Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130X
Rev Med Hered vol.26 no.1 Lima Jan. 2015
Diabetes tipo 2 en niños. Serie de casos
Type 2 diabetes in children. Case series
Helard Manrique-Hurtado1,2,a, Pedro Aro-Guardia2,b, Miguel Pinto-Valdivia3,a,4,b
1 Servicio de Endocrinología, Hospital Nacional Arzobispo Loayza. Lima, Perú.
2 Centro de Investigación en Diabetes, Obesidad y Nutrición. Lima, Perú.
3 Servicio de Endocrinología, Hospital Nacional Cayetano Heredia. Lima, Perú.
4 Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Médico endocrinólogo ; b Médico cirujano ; c Profesor contratado por asignatura
RESUMEN
Objetivos: Describir las características clínicas y bioquímicas de un grupo de niños y adolescentes con diagnóstico reciente de diabetes tipo 2. Material y métodos: Estudio descriptivo, retrospectivo, tipo de serie de casos. Se definió caso al niño o adolescente con glucosa plasmática en ayunas mayor a 126 mg/dl, ausencia de antiGAD y péptido C mayor a 1,5 ng/dl. Se excluyeron a los pacientes con diagnóstico previo de diabetes mellitus tipo 1, diabetes tipo MODY o diabetes secundaria a uso de fármacos. Resultados: La edad media fue 14,3 años, 59% fueron mujeres y 43% tenía por lo menos un padre con diabetes tipo 2. Al momento del diagnóstico, el índice de masa corporal fue 32,8 kg/m2, 85% tenía acantosis nigricans y 68% estaba en estadio Tanner IV y V. El tratamiento inicial incluyó el uso de hipoglicemiantes orales en 75% de los casos, siendo más frecuente el uso de metformina (64,3%). Solamente el 41% de los pacientes recibía algún tipo de insulina. Conclusiones: Los niños y adolescentes con diabetes tipo 2, tienen una frecuencia aumentada de obesidad/sobrepeso, acantosis nigricans y antecedente familiar de DM2. En general, tienen mal control metabólico y reciben metformina como tratamiento inicial.
PALABRAS CLAVE: Diabetes mellitus tipo 2, obesidad, resistencia a la insulina, niño, adolescente. (Fuente: DeCS BIREME).
SUMMARY
Objectives: To describe clinical and biochemical features of children and adolescents with recent onset type 2 diabetes mellitus. Methods: Retrospective study that included children or adolescents with fasting glucose above 126 mg/dl, absence of antiGAD and C peptide above 1.5 ng/dl. Patients with previous diagnosis of type 1 diabetes, diabetes type MODY or drug associated diabetes were excluded. Results: Mean age was 14.3 years; 59% were females, and 43% had at least one parent with type 2 diabetes. At the time of diagnosis, the body mass index was 32.8 kg/m2; 85% had acanthosis nigricans and 68% had Tanner stage IV or V. Initial treatment included oral hypoglycemic drugs in 75% , metformin was the most common drug used (64.3%). Only 41% of cases received insulin. Conclusions: Children and adolescents with type 2 diabetes in this setting have a high frequency of obesity, acanthosis nigricans and family history of type 2 diabetes. In general, these patients have poorly metabolic control and receive metformin as initial treatment.
KEYWORDS: Diabetes mellitus type 2, obesity, insulin resistance, child, adolescent. (Source: MeSH NLM).
INTRODUCCIÓN
Tradicionalmente, la diabetes mellitus tipo 2 (DM2) ha sido considerada una enfermedad de adultos; sin embargo, con el incremento de la obesidad infantil, su diagnóstico es más frecuente entre niños y adolescentes (1,2). Antes de 1990, era raro encontrar a niños con DM2. Para el año 1994, representaron el 16% de todos los casos de diabetes mellitus (DM) en niños; y para el año 1999, dependiendo de la localización geográfica, entre 8-45% de los casos incidentes de DM en niños fueron clasificados como DM2 (3,4).
De manera similar a los adultos, la DM2 se presenta en niños obesos con resistencia a la insulina (5). En este escenario, se produce un deterioro progresivo de la secreción de insulina, hiperglicemia crónica y diabetes. En los adolescentes este proceso es acelerado por la resistencia a la insulina fisiológica asociada a la pubertad (6).
En nuestro país, sólo hay reportes aislados de estos casos (7,8).
El objetivo del estudio fue describir las características clínicas y bioquímicas al momento del diagnóstico de 32 niños y adolescentes con DM2.
MATERIAL Y MÉTODOS
Estudio retrospectivo, descriptivo, tipo serie de casos, de niños y adolescentes con edades comprendidas entre los 8 y 19 años, con diagnóstico de DM2, desde enero de 2008 a diciembre de 2013. Los pacientes fueron identificados utilizando los registros de consulta externa de los hospitales Arzobispo Loayza y Cayetano Heredia.
Se revisaron las historias clínicas y se registraron en fichas los datos de edad, sexo, antecedente familiar de DM2, debut con cetoacidosis diabética (CAD), presencia de acantosis nigricans, estadio Tanner al diagnóstico e índice de masa corporal (IMC). Además, se consignaron los datos de glucosa plasmática, hemoglobina glicosilada (HbA1c), péptido C, presencia de anticuerpos contra la descarboxilasa del ácido glutámico (antiGAD) y tratamiento al momento del diagnóstico.
Se definió caso, al niño o adolescente con glucosa plasmática en ayunas mayor a 126 mg/dl (en dos oportunidades, después de un ayuno de 8 horas) o glucosa plasmática mayor a 200 mg/dl asociada a síntomas de hiperglicemia crónica (polidpsia, poliuria, baja de peso) ausencia de antiGAD y péptido c mayor a 1,5 ng/dl (9). La glucosa plasmática fue medida en el laboratorio central de cada hospital por el método enzimático de la glucosa-oxidasa. Se excluyeron a los pacientes con diagnóstico previo de diabetes mellitus tipo 1 (DM1), diabetes MODY o diabetes secundaria a uso de fármacos (por ejemplo, glucocorticoides).
Los resultados se presentan como medidas de tendencia central y sus respectivas medidas de dispersión. Se buscó asociación entre las variables demográficas y bioquímicas con la presencia de CAD al diagnóstico y uso de insulina, para lo cual se utilizó el programa STATA versión 8.0 (StataCorp LP, College Station, Texas). Las pruebas t de Student y U de Mann-Whitney se utilizaron para las variables continuas y el test exacto de Fisher para las variables categóricas. Un p<0,05 se consideró como significativo.
El protocolo del estudio fue aprobado por el Comité de Ética de la Universidad Peruana Cayetano Heredia.
RESULTADOS
Se encontraron 32 casos de DM2 en niños y adolescentes (19 mujeres, 13 hombres). La edad media fue 14,3 ± 2,4 años, la mediana del tiempo de enfermedad fue un año (RIQ 0-2), 43% tenía antecedente familiar de DM2 (padre, madre o ambos) y 17% debutó con CAD (Tabla 1). Al momento del diagnóstico, la media del IMC fue 32,8 ± 5,7 kg/m2, 85% tenía acantosis nigricans y 68% estaba en estadio Tanner IV y V.
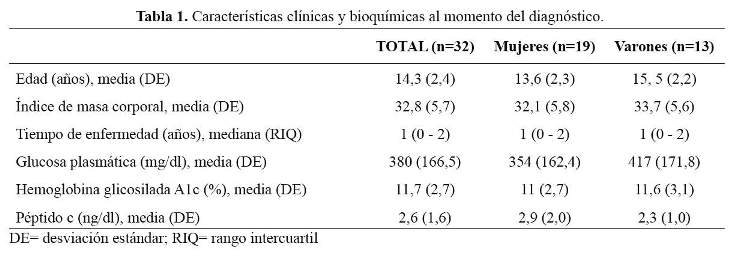
El 75% recibía hipoglicemiantes orales, siendo más frecuente metformina (64,3%). La metformina fue utilizada como monoterapia (32%), en combinación con insulina (25%) o sulfonilureas (7%). Por otro lado, 41% de los pacientes recibió algún tipo de insulina.
No hubo diferencia significativa en la edad, sexo, tiempo de enfermedad, IMC, valor de hemoglobina glicosilada y péptido C; entre los niños que debutaron con CAD y el resto. Tampoco hubo diferencia con respecto al uso de insulina.
DISCUSIÓN
Los primeros reportes de DM2 en niños y adolescentes datan de 1979 en los indios nativos de Estados Unidos y Canadá, poblaciones homogéneas con un riesgo elevado de DM2 (1-3). A partir de los años noventa, se empiezan a reconocer los primeros casos entre Hispanos y Afroamericanos en los Estados Unidos; y actualmente, los reportes provienen de todas las regiones del mundo (10). En nuestro país, una serie de casos del Instituto Nacional de Salud del Niño (INSN), encontró una frecuencia de 9,2% (11).
Estos niños generalmente son obesos y tienen asociados otros factores de riesgo cardiovascular; tales como, hipertensión, dislipidemia, hígado graso y síndrome metabólico. Por otro lado, tienden a desarrollar las complicaciones de la diabetes a edades más tempranas (12).
La obesidad es el factor crítico asociado a resistencia a la insulina y DM2 (2, 3). Tal como en los adultos, la DM2 se desarrolla generalmente en niños y adolescentes obesos, especialmente entre los grupos étnicos que tienen mayor resistencia a la insulina (12). La obesidad produce resistencia a la insulina, disfunción de la célula beta del páncreas, hiperglicemia y diabetes (13).
Nuestro estudio encontró una frecuencia de obesidad de 46,9% y sobrepeso de 31,3%; de manera similar al estudio del INSN (obesidad 41,2% y sobrepeso 35,3%) (11).
La resistencia a la insulina se incrementa de manera fisiológica a través de la pubertad. De esta manera, la sensibilidad a la insulina disminuye en 30% en los adolescentes en estadio Tanner II-IV, comparados con adolescentes en estadio I (14,15). En nuestro estudio, el 68% de los pacientes habían alcanzado la madurez sexual. Este incremento en la resistencia a la insulina estaría mediado por un aumento en la adiposidad, los esteroides sexuales o las concentraciones de IGF-1 (16).
La historia familiar de DM2 es otro factor de riesgo importante en niños y adolescentes. Entre 45-80% de los niños con DM2 tienen al menos un padre con la enfermedad (2-4). En nuestra serie, el 43% de los niños tenían un padre con diagnóstico de DM2 y en la serie del INSN 82,4% (11).
Estudios previos en los Indios Pima, han mostrado que la DM2 en niños tiene un componente genético sustancial; siendo la prevalencia más alta, entre aquellos niños con ambos padres diabéticos y que presentaron la enfermedad a edades más tempranas. En esta población no hay evidencia de diabetes tipo MODY (17). Por otro lado, la prevalencia también es mayor entre los descendientes de mujeres con antecedente de diabetes gestacional, sugiriendo que, además del riesgo genético, el ambiente intrauterino es un determinante importante en el desarrollo de obesidad y DM2 infantil (17,18).
Respecto a la presencia de CAD durante el debut, estudios previos han hallado que 42% de los niños Afroamericanos con DM2 pueden presentar cetonuria; y que de ellos, hasta 25% cumple criterios para CAD (12).
Tradicionalmente, la presencia de CAD ha estado asociada a DM1; sin embargo, los pacientes con DM2 también pueden debutar con CAD. En el estudio SEARCH for Diabetes in Youth (19), la frecuencia de CAD en DM1 fue 29,4%, mientras que en los niños con DM2 fue 9,7%. Los niños y adolescentes obesos que debutan con CAD, tienden a ser de mayor edad, de sexo masculino, con acantosis nigricans, sin presencia de autoanticuerpos, con secreción de péptido c normal y con remisión de la diabetes sin el uso de insulina (20,21). En nuestra serie, cinco pacientes debutaron con CAD. Todos estos pacientes tuvieron acantosis nigricans, obesidad, y el manejo inicial incluyó el uso de insulina y metformina. En la serie del INSN, 29% debutaron con CAD (11).
Otros factores de riesgo para DM2 en niños y adolescentes son la falta de actividad física, la presencia de acantosis nigricans, el sexo femenino, el diagnóstico de síndrome de ovario poliquístico y el status socio-económico bajo (15). En nuestro estudio, 85% tenía acantosis nigricans; mientras que en la serie de casos del INSN, el 65% (11).
Los objetivos del tratamiento de DM2 en niños y adolescentes son: bienestar físico y mental, control metabólico adecuado y prevención de complicaciones micro y macrovasculares (6).
En la población infantil, es difícil mantener la dieta y actividad física regular. En general, menos del 10% de los adolescentes alcanzan las metas del control metabólico adecuado solamente con dieta y ejercicio (2).
Respecto al uso de hipoglicemiantes orales, la metformina es el único agente oral aprobado para el tratamiento de DM2 en niños y adolescentes. La metformina reduce la producción hepática de glucosa e incrementa la sensibilidad a la insulina (15). Un estudio demostró que la metformina a dosis de 2000 mg por día, disminuyó la glicemia en ayunas en 42,9 mg/dl y la HbA1c desde 8,2% a 7,2%. En general, el 84% de los participantes en este estudio alcanzaron la meta de glicemia en ayunas menor a 126 mg/dl o HbA1c menor a 7% (7,22). De manera similar a la metformina, la glimepirida disminuyó los niveles de HbA1c; sin embargo, su uso estuvo asociado a mayor ganancia de peso y mayor frecuencia de hipoglicemia (22).
Por otro lado, de manera similar a los adultos con DM2, estos niños tienen mayor prevalencia de hipertensión y dislipidemia (12). Sin embargo, menos del 1% recibe drogas hipolipemiantes (22). Al momento del diagnóstico, 49% de los niños y adolescentes con DM2 tienen hipertensión sistólica; y la microalbuminuria, es más prevalente entre adolescentes con DM2 (22,2%) comparados con adolescentes con DM1 (9,2%) (22).
A pesar de las recomendaciones actuales acerca del manejo de la glucosa, presión arterial y lípidos en sangre; menos del 5% de adolescentes con DM2 reciben algún tipo de tratamiento (22).
Nuestro estudio tiene varias limitaciones. Al ser un estudio retrospectivo de revisión de historias clínicas, se ha perdido información clínica importante; como por ejemplo, la frecuencia de síntomas de diabetes al momento del diagnóstico y la evolución de los valores de péptido c en el tiempo. Por otro lado, sólo se consignó el valor de un anticuerpo, siendo lo ideal, la determinación de los cuatro anticuerpos asociados con diabetes autoinmune.
En conclusión, los niños y adolescentes con DM2 tuvieron sobrepeso u obesidad, con acantosis nigricans e historia familiar de diabetes. Además, tuvieron mal control metabólico y su tratamiento incluyó metformina sola o en combinación.
REFERENCIAS BIBLIOGRÁFICAS
1. Shaw J. Epidemiology of childhood type 2 diabetes and obesity. Pediatric Diabetes. 2007; 8 (S9): 7-15. [ Links ]
2. Kaufman FR. Type 2 diabetes in children and youth. Rev Endocr Metab Disord. 2003; 4: 33-42. [ Links ]
3. Kaufman FR. Obesity and type 2 diabetes in children and youth. Curr Opin Endocrinol Diabetes. 2006; 13: 332-37. [ Links ]
4. Singh R, Shaw J, Zimmet P. Epidemiology of childhood type 2 diabetes in the developing world. Pediatric Diabetes. 2004; 5: 154-68. [ Links ]
5. Weigensberg MJ, Goran MI. Type 2 diabetes in children and adolescents. Lancet 2009; 373: 1743-44. [ Links ]
6. Alberti G, Zimmet P, Shaw J, Bloomgarden Z, Kaufman F, Silink M. Type 2 diabetes in the young: The evolving epidemic. The International Diabetes Federation Consensus Workshop. Diabetes Care. 2004; 27: 1798-1811. [ Links ]
7. Pinto M, Seclén S, Cabello E. Diabetes tipo 2 en niños. Reporte de caso. Rev Med Hered. 2010; 21: 103-6. [ Links ]
8. Manrique H, Pinto M, Ramírez-Saba A, Zapana A, Aro-Guardia P. Diabetes tipo 2, obesidad y cetoacidosis diabética. Reporte de caso. Rev Med Hered. 2011; 22: 38-41. [ Links ]
9. Zeitler P. Approach to the obese adolescent with new- onset diabetes. J Clin Endocrinol Metab. 2010; 95: 5163-5170. [ Links ]
10. Pinhas-Hamiel O, Zeitler P. The global spread of type 2 diabetes mellitus in children and adolescents. J Pediatr. 2005; 146: 693-700. [ Links ]
11. Calagua-Quispe M, Falen-Boggio J, Del Águila-Villar C, Lu-de Lama R, Rojas-Gabulli MI. Características clínicas y bioquímicas de la diabetes mellitus tipo 2 (DMt2) en el Instituto Nacional de Salud del Niño. An Fac med. 2012; 73: 141-6. [ Links ]
12. Pinhas-Hamiel O, Zeitler P. Acute and chronic complications of type 2 diabetes mellitus in children and adolescents. Lancet. 2007; 369: 1823-31. [ Links ]
13. Weiss R, Caprio S. The metabolic consequences of childhood obesity. Best Pract Res Clin Endocrinol Metab. 2005; 19: 405-19. [ Links ]
14. Burt CM, McCartney CR. Obesity and the pubertal transition in girls and boys. Reproduction. 2010; 140: 399-410. [ Links ]
15. Guzzaloni G, Grugni G, Mazzilli G, Moro D, Morabito F. Comparison between beta-cell function and insulin resistance indexes in prepubertal and pubertal obese children. Metabolism. 2002; 51: 1011- 6. [ Links ]
16. Jeffery AN, Metcalf BS, Hosking J, Streeter AJ, Voss LD, Wilkin TJ. Age before stage: insulin resistance rises before the onset of puberty: a 9-year longitudinal study (EarlyBird 26). Diabetes Care. 2012; 35: 536- 41. [ Links ]
17. Dabelea D, Pettitt DJ, Jones KL, Arslanian SA. Type 2 diabetes mellitus in minority children and adolescents. An emerging problem. Endocrinol Metab Clin North Am. 1999; 28: 709-29. [ Links ]
18. Dabelea D, Crume T. Maternal environment and the transgenerational cycle of obesity and diabetes. Diabetes. 2011; 60: 1849-55. [ Links ]
19. Rewers A, Klingensmith G, Davis C, Petitti DB, Pihoker C, Rodriguez B, et al. Presence of diabetic ketoacidosis at diagnosis of diabetes mellitus in youth: the Search for Diabetes in Youth Study. Pediatrics. 2008; 121: 1258-66. [ Links ]
20. Low JC, Felner EI, Muir AB, Brown M, Peng L, et al. Do obese children with diabetic ketoacidosis have type 1 or type 2 diabetes? Prim Care Diabetes. 2012; 6: 61-5. [ Links ]
21. Sapru A, Gitelman SE, Bhatia S, Dubin RF, Newman TB, Flori H. Prevalence and characteristics of type 2 diabetes mellitus in 9-18 year-old children with diabetic ketoacidosis. J Pediatr Endocrinol Metab. 2005; 18: 865-72. [ Links ]
22. Flint A, Arslanian S. Treatment of type 2 diabetes in youth. Diabetes Care. 2011; 34 (S2): S177-83. [ Links ]
Declaración de financiamiento y de conflictos de intereses:
El estudio fue financiado por los investigadores. Los autores declaran no tener conflictos de intereses.
Contribución de autoría:
HM: Concepción y diseño del estudio, recolección y obtención de resultados, análisis e interpretación de los datos, redacción del manuscrito y aprobación de la versión final. PA: concepción y diseño del estudio, recolección y obtención de resultados, aporte de pacientes al estudio y aprobación de la versión final. MP: concepción y diseño del estudio, análisis e interpretación de los datos, redacción del manuscrito, asesoría estadística y aprobación de la versión final.
Correspondencia:
Miguel Pinto-Valdivia
Servicio de Endocrinología, Hospital Nacional Cayetano Heredia (Lima, Perú)
Avenida Honorio Delgado 262, Lima 31, Perú
Tele-Fax: +511 4814177
Correo electrónico: miguelpinto72@yahoo.com
Recibido: 25/08/2014
Aceptado: 26/12/2014














