Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered vol.26 no.1 Lima ene. 2015
Síndrome de abdomen en ciruela pasa y dextrocardia, asociación infrecuente
Prune belly syndrome and dextrocardia, an infrequent association
Hermann Silva1,2,a,b,c, Héctor Donayre2,c,d, Carlos Casavilca1,e, Rahy Padilla1,d
1 Servicio de Neonatología, Hospital Apoyo Iquitos. Iquitos, Perú.
2 Facultad de Medicina, Universidad Nacional de la Amazonía Peruana. Iquitos, Perú
a Médico pediatra; b Magister en Salud Pública;c Doctor en Medicina; d Interno de Medicina;e Médico Radiólogo
RESUMEN
Se describe un neonato con Síndrome de abdomen en ciruela pasa, de sexo masculino, nacido de 36 semanas de gestación y pesó 3 650 g al nacer. El examen clínico mostró un neonato con un abdomen globuloso, con redundancia de la piel que huelga a los costados rebosantes, la palpación del abdomen no descubre la tonalidad muscular. No se palpa visceromegalia y hay presencia normal de ruidos hidroaéreos. El examen físico del tórax y cardiovascular fueron aparentemente normales. Normocéfalo y facies no peculiar. La radiografía de tórax muestra dextrocardía. La ecografía renal mostró dilatación pielocalicial. Revela además criptorquidia bilateral.
PALABRAS CLAVE: Síndrome abdomen ciruela pasa, dextrocardia, criptorquídea. (Fuente: DeCS BIREME).
SUMMARY
We report the case of a male neonate born after 36 weeks of gestation with a body weight of 3 650 g with Prune belly Syndrome. The physical examination revealed a distended abdomen with redundant skin that wrinkle like a prune, no visceromegaly was found and normal abdominal sounds were heard. The examination of thorax and cardiovascular systems were apparently normal. The neurologic exam was normal. The chest x-ray revealed dextrocardia. A renal ultrasound revealed pyelocalyceal dilation. Bilateral cryptorchidism was also observed.
KEYWORDS: Prune belly syndrome, dextrocardia, cryptorchidism. (Source: MeSH NLM).
INTRODUCCIÓN
El Síndrome de abdomen en ciruela pasa, conocido también como síndrome de la triada de Eagle-Barret o Prune belly síndrome (OMIM #100100), es una anomalía congénita infrecuente, con una tasa de incidencia de 1/35 000 a 1/50 000 nacimientos (1,2). Es una condición mórbida que origina 20% de óbitos fetales, 30% de fallecimientos durante la hospitalización inicial, 50% de ellos cursan con grados variables de afectación renal, 67% de los cuales hacen insuficiencia renal. Además 43% nacen prematuros, 48% requieren intubación endotraqueal y ventilación mecánica al nacimiento y 25% son portadores de anomalías congénitas cardiovasculares (3,4).
La causa es desconocida y la mayoria de casos esporádicos. Sin embargo, casos de gemelos varones monocigóticos, y la alta incidencia en varones, sugirió una afectación congénita ligada al sexo. Leordean (5), menciona que los varones son afectados en un 95 a 97%. Generalmente, el cariotipo es normal. Recientemente, se describe a Prune Belly como una condición autosómica recesiva influenciada por el sexo, producto de mutaciones en el gen CHRM3 (6).
El síndrome se caracteriza por aplasia o hipoplasia de la musculatura abdominal, anomalías del tracto urinario y criptorquidea bilateral (2). El síndrome completo sólo se presenta en varones.
Se presenta el caso de un neonato de sexo masculino, que muestra las características clínicas del Síndrome de Prune belly, nacido de parto domiciliario y atendido por la madre de la gestante, y quien tuvo 6 controles prenatales en un centro de salud de la ciudad, sin practicarle ecografía a la gestante.
PRESENTACIÓN DEL CASO
Recién nacido varón, nacido de parto domiciliario atendido por la madre de la gestante, presentó llanto inmediato al nacer, siendo llevado inmediatamente al Hospital de Apoyo de Iquitos. Su peso fue 3 560 g (Pp: 50-90), talla 45,0 cm (Pt:<10) y PC 33,5 cm (Ppc: 10-50), la edad gestacional mediante el test de Capurro fue de 36 semanas.
La madre de 28 años en su cuarta gestación, con historia conyugal de un primer compromiso marital, con quien tiene una hija sana de 11 años. En su segundo compromiso marital tuvo dos hijos, una de 6 años y un niño de 5 años; ambos sanos. Con su tercera pareja concibe el niño propositus del estudio. No se pudo conocer los antecedentes personales y familiares de la pareja actual. No había antecedentes de consanguinidad entre los padres. El embarazo prosiguió sin mayores complicaciones, reportando infección urinaria en el primer trimestre de la gestación y tuvo seis controles prenatales en centro de salud de Iquitos, donde no se le practicaron ecografías.
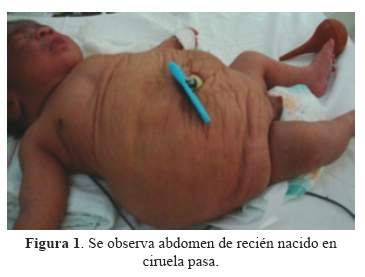
En el examen físico llama la atención el abdomen globuloso que muestra redundancia de la piel que se extiende a los costados rebosante (Figura 1); la palpación del abdomen no descubre la tonalidad muscular, presentando un abdomen muy blando, deprimible, que permite rodear las sinuosidades de las asa intestinales. No había visceromegalia y los ruidos hidroaéreos eran normales. El examen del tórax y cardiovascular fue aparentemente normal. La cabeza de aspecto normal. La fontanela anterior normal, el tono muscular de miembros inferiores y los reflejos osteotendinosos normales.
Desde el nacimiento mostró dificultad para deglutir y se alimenta por sonda orogástrica, también se observa sialorrea moderada (Figura 2).
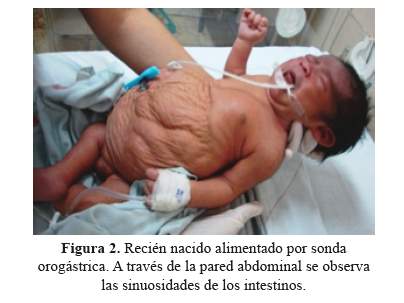
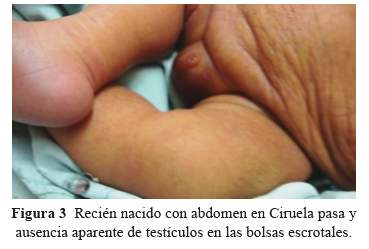
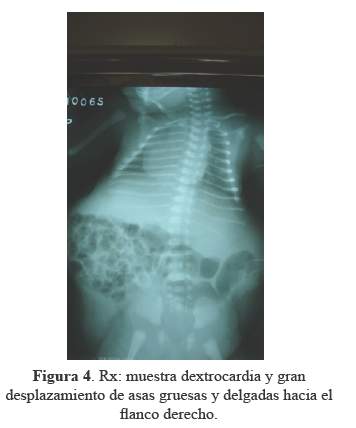
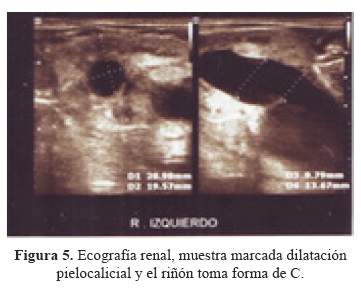
Recién a los 3 días mostró reflejo de succión y a los 11 días se alimentaba por succión directa. El neonato al nacimiento presentó saturación de oxígeno de 86% y Test de Silverman-Anderson de 4, requiriendo asistencia ventilatoria con CPAP. A los dos días se le retiró, presentando un patrón respiratorio normal. El paciente mostraba criptorquídea bilateral (Figura 3). La radiografía de tórax y abdomen reveló dextrocardia (Figura 4) y en la ecografía Doppler presentaba un abdomen redundante en ciruela pasa (Figura 1 y 2), con ausencia completa de la musculatura abdominal, los riñones con marcada dilatación pielocalicial bilateral, en el parénquima renal se visualiza las pirámides de Malpighi y una buena vascularización (Figura 5). El uréter izquierdo se une al uréter derecho a la altura del ombligo creando un uréter único el cual llega a la vejiga. El hígado, el páncreas y el bazo de aspectos ecográficos normales. La vasculatura a nivel intestinal estaba conservada. El estudio ecocardiográfico reveló dextrocardía y persistencia del ductus arterioso. La ecografía transfontanelar mostró ventrículos laterales simétricos.
El paciente cursó con taquipnea transitoria con una FR entre 60 y 95 por minuto, y a los 10 días de hospitalizado mejoró ostensiblemente. En los primeros 6 días presentó residuo gástrico entre 8 a 39 cc/día; luego la tolerancia oral mejora y a los 11 días se alimentaba por succión directa. El hábito defecatorio en los primeros 12 días de vida fueron heces entre 20 y 70 gramos al día, formadas, amarillentas y en número de dos cámaras al día. Se alimentó durante la hospitalización con leche materna exclusiva. Fue dado de alta para control ambulatorio.
DISCUSIÓN
Se han postulado dos teorías etiopatogénicas en el Síndrome de Prune Belly. La primera postula que en etapas tempranas de la gestación se produciría una severa obstrucción vesical que se alivia cuando se ha producido daños irreversibles. Esta teoría no explica la compleja variedad de anomalías morfológicas, y la segunda teoría plantea, defectos en el desarrollo del mesénquima por un contaminante desconocido entre las semanas 6ta a 10ma de la gestación (2,5).
Durán y col (7), afirman que las teorías que se plantean sobre la etiopatogenia del síndrome de Prune belly no son del todo claras, revisan una teoría embriológica donde se sostiene que la obstrucción de la uretra o del cuello vesical provocaría distensión vesical y uretral con sobre distención y atrofia de la musculatura abdominal. Okoeguale y col (8), plantean que defectos genéticos pueden ser la causa de las anomalías congénitas descritas, y que afectan fundamentalmente a hombres. Describen a dos hermanos portadores del síndrome de Prune belly, hijos de una madre y padre jóvenes. Younous y col (9), sostienen que un defecto en la diferenciación del mesodermo en el primer trimestre de la gestación puede ser la causa del síndrome. Leordean y col (10) explican el síndrome por causas genéticas y destacan la transmisión recesiva ligada a X (razón de sexo hombre:mujer 18/1), y su rara asociación a anomalías cromosómicas, como trisomía 13, trisomía 18, síndrome de Turner, síndrome ojo de gato y en trisomía 21. Murray y col (2), presentan un caso de síndrome de Prune belly completo con delección del gen HNF - 1ß, pero las mutaciones del gen no explican la hipoplasia muscular abdominal (2). Recientemente, se describe a Prune Belly como una condición autosómica recesiva influenciada por el sexo, producto de mutaciones en el gen CHRM3 (6).
Una interrupción en la diferenciación mesodérmica que ocurriría entre la 4ta y 5ta semanas de gestación sería la causa de la aplasia/hipoplasia muscular del abdomen. La displasia mesodérmica del desarrollo de la pared abdominal y del tracto urinario, se sugieren como responsables del síndrome de Prune belly. El momento en el que ocurriría esta agresión, pareciera ser la tercera semana de gestación. También se describe la presencia de una arteria umbilical única, lo que confirmaría que la agresión ocurriría en la cuarta semana de vida intrauterina (11). Comstock (12), reporta un caso de ruptura abdominal a las 20 semanas de gestación de un feto, portador de síndrome de Prune belly, quien además presentaba marcada dilatación vesical y de la uretra anterior, y con el intestino delgado y grueso fuera del abdomen. A las 23 semanas de gestación dieron fin a la gestación por decisión de la paciente.
Montemarano (13), describe dilatación de la uretra posterior en dos de 4 casos de síndrome de Prune belly, observadas con ecografías obstétricas a las 16 y 19 semanas de gestación respectivamente. Osborne y col (14), describen que la dilatación de las vías urinarias resulta de la obstrucción a diferentes niveles, pero se dan casos de dilatación sin evidencia de obstrucción. Afirman además que los lugares más frecuentes de obstrucción ocurren en la unión urétero pélvica, urétero-vesical y uretral, siendo la obstrucción parcial y otras veces completa; se ven unilateral o bilateral. La dilatación vesical sería secundaria a anomalías del músculo liso y del tejido conectivo y se asocian a oligohidramnios. Bonilla-Musoles y col (15), describen que la dilatación vesical se debería unas veces a estenosis uretral, otras veces a agenesia uretral, valvas uretrales o persistencia de la cloaca. Siempre se acompaña de oligohidramnios.
La criptorquidia es descrita en el 90% de los casos con testículos normales o atróficos (15). Zugor y col (16), reportaron 16 casos de síndrome de Pune belly, 68,8% de los cuales presentaron criptorquidia. Los portadores de criptorquidia deben ser sometidos a estudios nucleares para determinar la funcionabilidad de los testículos. Los testículos criptorquídicos tienen una histología favorable (17).
Se ha descrito también, anomalías congénitas asociadas a la triada del síndrome de Prune belly, como las anomalías gastrointestinales presentes en el 20 a 30% de los casos, anomalías como vólvulo del colon, atresia esofágica, estenosis del recto o del esófago, al igual que una variedad de mal rotaciones se debería a una insuficiente fijación del mesenterio a la pared posterior del abdomen. Por otro lado se observan 30 a 40% de anomalías ortopédicas (16).
El caso de Prune belly de diagnóstico más temprano sería el reportado por Hoshino en un feto de 12 semanas de gestación, tenía distención vesical, hidronefrosis bilateral y ausencia de musculaturas abdominal, hígado, bazo y diafragma (17).
Bonilla-Musoles y col (15), reportaron dos casos de síndrome de Prune belly diagnosticados durante la gestación, con el uso de ecografía de dos dimensiones. Osborne y col (14), estudiando anomalías congénitas tipo dilatación de las vías urinarias, mediante estudios ecográficos en 20 fetos y durante 10 años, en 8 se diagnosticó síndrome de Prune belly. La criptorquidia bilateral fue difícil de observar en los estudios durante el primer trimestre, por la presencia de oligohidramnios (14).
Hussain y col (18), estudiaron 250 casos de pacientes entre 0 y 14 años con criptorquidia, mediantes estudios de ecografía, historia clínica y examen físico. En un caso (0,4%), la criptorquidia se asoció a síndrome de Prune belly.
Nuestro paciente presentó dextrocardia, evidenciado por ecocardiografía y radiografía de tórax, asociado a persistencia del ductus arterioso. Zugor (16), encontró defectos de septum atrial y persistencia del ductus arterioso, en 5/16 casos de síndrome de Prune belly.
REFERENCIAS BIBLIOGRÁFICAS
1. Moreno J. Síndrome de abdomen en ciruela pasa, en el Hospital Daniel Alcides Carrión, Tacna. ET VITA. 2007; 2(2):27-32. [ Links ]
2. Murray P, Thomas K, Mulgrew C, Ellard S, Edghill E, Bingham C. Whole gene deletion of the hepatocyte nuclear factor-1β gene in a patient with the prune- belly syndrome. Nephrol Dial Transplant. 2008; 23: 2412-2415Links ]0pt;font-family:"Verdana","sans-serif";mso-bidi-font-family: "Times New Roman";color:#221E1F;mso-ansi-language:EN-US'>
3. Granberg C, Harrison S, Dajusta D, et al. Genetic basis of prune belly syndrome: Screening for HNF1ßGene. J Urol. 2012; 187(1): 272-278. [ Links ]
4. Byon M, Jun Kim G. Prune-belly syndrome detected by ultrasound in the first trimester and the usefulness of vesicocentesis as a modality of treatment. Obstet Gynecol Sci. 2013; 56(4):265-268. [ Links ]
5. Leordean V, Lazar D, Trofenciuc M. Morphological aspects in a urogenital malformation, complex and rare, in a child. Rom J Morphol Embryol. 2012; 53(2):421-425. [ Links ]
6. Online Mendelian Inheritance in Man, Johns Hopkins University. Abdominal muscles, absence of, with urinary tract abnormality and cryptorchidism. Baltimore: Online Mendelian Inheritance in Man, Johns Hopkins University;2011. [ Links ]
7. Durán M, Rivero de Jesús V, Macías B. La variante letal del síndrome Prune Belly: Informe de dos casos. Rev Med Hosp Gen Mex. 1999; 62 (3): 206-209. [ Links ]
8. Okoeguale M, Adeyekun Aa, Egberue G. Familial Prune Belly Syndrome in a Nigerian family. Saudi J Kidney Dis Transpl. 2012; 23(2):338-342. [ Links ]
9. Younous S, Zarrouki Y, Boutbaoucht M. Prune Belly Syndrome associated with full spectrum of VACTERL in a new born. J Clin Neonatol. 2012; 1(1): 49-51. [ Links ]
10. Leordean V, Lazar D, Trofenciuc M. Morphological aspects in a urogenital malformation: complex and rare in a child. Rom J Morphol Embryol. 2012; 53(2):421-425. [ Links ]
11. Dheeraj S, Shailesh S, Faridi MMA, Mishra K. VACTERL Association with Prune-Belly Syndrome. Indian Pediatrics. 2004; 41:845-847. [ Links ]
12. Comstock CH, Lee W, Bronsteen RA, Fennell T. Rupture of the fetal abdomen in prune belly syndrome. Ultrasound Obstet Gynecol. 2009; 33: 487-491. [ Links ]
13. Montemarano H, Bulas D, Rushton HG, Selby D. Bladder distention and pyelectasis in the male fetus: Causes, comparisons, and contrasts. J Ultrasound Med. 1998; 17: 743-749. [ Links ]
14. Osborne N, Bonilla-Musoles F, Machado LE, et al. Fetal megacystis differential diagnosis. J Ultrasound Med. 2011; 30:833-841. [ Links ]
15. Bonilla-Musoles F, Machado LE, Bailão LA, Osborne N, Raga F. Abdominal wall defects two- versus three-dimensional ultrasonographic diagnosis. J Ultrasound Med 2001; 20:379-389. [ Links ]
16. Zugor V, Schott G, Labanaris A. The Prune Belly syndrome: urological aspects and long-term outcomes of a rare disease. Pediatric Reports. 2012; 4:78-81. [ Links ]
17. Hoshino T, Ihara Y, Shirane H, Ota T. Prenatal diagnosis of prune belly syndrome at 12 weeks of pregnancy: case report and review of the literature. Ultrasound Obstet Gynecol. 1998;12: 362-366. [ Links ]
18. Hussain A, Ahsan A, Kumar S, Gupta G, Yusuf A. Undesended testis: How extensive should the work up be? African Journal of Paediatric Surgery. 2010; 7(2):92-95. [ Links ]
Declaración de financiamiento y de conflictos de intereses:
Financiado por los autores, quienes declaran no tener conflicto de interés.
Las fotografías del neonato se muestran con autorización de la madre.
Contribución de autoría:
HSD participó en la concepción del estudio, en la redacción y revisión crítica del artículo. HDL, CCG y RPC en revisión bibliográfica.
Correspondencia:
Hermann Federico Silva Delgado.
Calle Brasil No 343 Iquitos
Teléfonos: domicilio: 51(065) 507559; trabajo 51(065) 606666
Celular: 51965 -613367;
Correo electrónico: silvahermann@hotmail.com
Recibido: 25/09/2014
Aceptado: 19/12/2014














