Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered vol.27 no.1 Lima ene. 2016
INVESTIGACIÓN ORIGINAL
Caracterización fenotípica y molecular de Escherichia coli productoras de β-Lactamasas de espectro extendido en pacientes ambulatorios de Lima, Perú
Phenotypic and molecular characterization of extended spectrum beta-lactamase producing strains of Escherichia coli in ambulatory patients in Lima, Peru
Fiorela Galván1,a, Juan Agapito2,b, Nora Bravo3,a, José Lagos1,c, Jesús Tamariz2,d
1 Clínica Delgado-Auna. Lima, Perú.
2 Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Universidad Nacional Federico Villarreal. Lima, Perú.
a Licenciada en Biología;
b Magister en Ciencias con mención en Microbiología;
c Médico Patólogo Clínico;
d Doctor en Ciencias Biológicas
RESUMEN
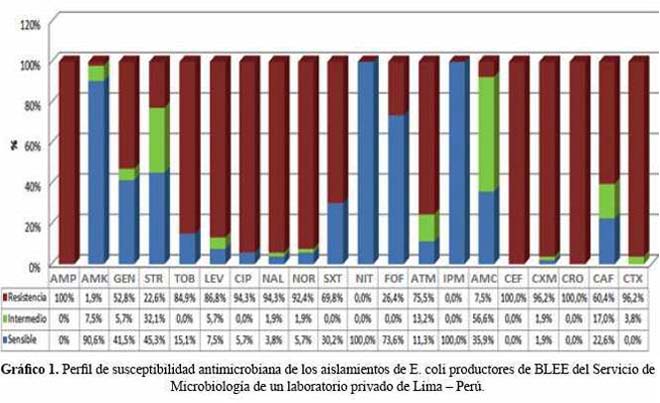
Objetivos: Determinar las características fenotípicas y genotípicas de las β-lactamasas de espectro extendido (BLEE) en E. coli aislados de cultivos de orina de pacientes de la comunidad en un laboratorio privado de la ciudad de Lima, Perú. Material y métodos: Se evaluaron 53 aislamientos de E. coli por dos métodos fenotípicos: Jarlier y CLSI, el perfil de susceptibilidad se realizó mediante disco difusión y la caracterización genotípica mediante PCR para los genes blaCTX-M, blaTEM y blaSHV. Resultados: Los 53 aislamientos productores de BLEE representaron el 16,30% del total de aislados de E. coli, afectando principalmente a mujeres mayores de 65 años. El perfil de susceptibilidad evidenció alta resistencia a AMP,CEF,CRO(100%), LEV(87%), NOR(92%), CIP y NAL(94%), CXM y CTX(96%),SXT(70%), ATM(75%) y TOB (85%); asimismo elevada sensibilidad a NIT e IPM(100%), AMK(91%) y FOF(73,6%). El tipo de gen bla más frecuente fue blaCTX-M (55%), seguido por la coexistencia blaCTX-M+TEM (24%), blaTEM (13%) y blaSHV (6%). Conclusiones: La frecuencia de E. coli productores de BLEE fue de 16,3%; siendo el gen tipo blaCTX-M el más frecuente, información valiosa para orientar la terapia antimicrobiana empírica.
PALABRAS CLAVE: Escherichia coli, beta-lactamasas, infección urinaria, comunidad. (Fuente: DeCS BIREME).
SUMMARY
Objective: To determine the phenotypic and genotypic features of extended spectrum beta-lactamase (ESBL) producing strains of Escherichia coli isolated from urine samples of patients attending outpatient services in a private laboratory in Lima, Peru. Methods: 53 E. coli isolates were evaluated using two phenotypic methods: Jarlier and CLSI, the susceptibility profile was performed using the disk diffusion method and the genotypic features were analyzed using PCR for detecting blaCTX-M, blaTEM y blaSHV genes. Results: The 53 ESBL producing strains of E. coli accounted for 16,30% of all E. coli isolates affecting mostly women older than 65 years. High resistant profile to AMP, CEF, CRO (100%), LEV (87%), NOR (92%), CIP, NAL (94%), CXM, CTX (96%), SXT (70%), ATM (75%) and TOB (85%) was observed. High susceptibility to NIT, IPM (100%), AMK (91%) and FOF (73.6%) was observed. The most frequent bla gen was blaCTX-M (55%), followed by blaCTX-M+TEM (24%), blaTEM (13%) and blaSHV (6%). Conclusions: The rate of ESBL producing strains of E. coli was 16.3% and the blaCTX-M gen was the most common gene type. These results provide valuable information for starting empiric antibiotic therapy in this setting.
KEYWORDS: Escherichia coli, beta-Lactamases, urinary tract infection, community. (Source: MeSH NLM).
INTRODUCCIÓN
La infección del tracto urinario (ITU) es la segunda patología infecciosa más frecuente luego de la infección de las vías respiratorias y la causa más común de consulta ambulatoria (1). Los principales organismos causales pertenecen a la familia Enterobacteriacea, y dentro de este grupo, Escherichia coli es el más frecuente, tanto en pacientes hospitalizados como de la comunidad (2).
En los últimos años se ha observado un aumento de las tasas de resistencia de estos uropatógenos frente a los antibióticos considerados de primera elección, jugando un papel importante la presión selectiva producida por el uso indiscriminado de estos antimicrobianos (3-5).
El principal mecanismo de resistencia de las enterobacterias es la producción de β-lactamasas de espectro extendido (BLEE), codificadas por los genes bla (TEM, SHV, CTX-M, entre otros), frecuentemente asociadas a plásmidos. Estos elementos extracromosómicos suelen ser portadores de genes que confieren resistencia a otros grupos de antibióticos, generando bacterias multirresistentes (6,7).
Hasta los años noventa, la mayoría de BLEE eran principalmente los tipos TEM y SHV, se aislaban en Klebsiella pneumoniae implicadas en brotes hospitalarios en unidades de cuidados intensivos; posteriormente fueron desplazadas por las CTX-M que en la actualidad son las BLEE más frecuentemente aisladas (8). E. coli está desplazando en forma paulatina, aunque con menor carácter epidémico a Klebsiella pneumoniae, siendo cada vez más frecuente el aislamiento de estas bacterias fuera del ámbito hospitalario (4). En el Perú, muy pocas investigaciones han evaluado e integrado estudios sobre el fenotipo BLEE con genotipo específico.
El objetivo de este estudio fue determinar las características fenotípicas y genotípicas de las β-lactamasas de espectro extendido (BLEE) en E. coli aisladas de urocultivos de pacientes de la comunidad en Lima, Perú.
MATERIAL Y MÉTODOS
Estudio de tipo descriptivo. La muestra de estudio estuvo constituida por aislamientos de E. coli productores de BLEE provenientes de cultivos de orina realizados entre setiembre y diciembre de 2012 en el servicio de microbiología de un laboratorio privado de la ciudad de Lima, Perú.
Las muestras de orina se procesaron utilizando agar tripticasa de soya-TSA (Oxoid®, UK), agar sangre de carnero al 5% y agar Mc Conkey (Oxoid®, UK), la identificación de los gérmenes aislados se realizó mediante pruebas bioquímicas convencionales: TSI (Oxoid®, UK), LIA (Oxoid®, UK), SIM (Oxoid®, UK), indol (Oxoid®, UK) y citrato (Oxoid®, UK). La detección fenotípica de BLEE fue realizada por el método de Jarlier que consistió en colocar un disco del inhibidor amoxicilina–ácido clavulánico (AMC) (20/10 μg) al centro, alrededor del cual se colocaron los discos de ceftazidima (CAF) (30 μg), cefalotina (CEF) (30 μg), cefuroxima (CXM) (30 μg) y ceftriaxona (CRO) (30 μg) a 25 mm de distancia. Los aislamientos de E. coli productores de BLEE fueron preservados en crioviales (Samplix®) con 2 ml de agar TSA (Oxoid®, UK) a una temperatura de 4°C.
Posteriormente los microorganismos aislados fueron reconstituidos en caldo nutritivo (Britania®, Argentina) y sembrados por agotamiento en placas de TSA (Oxoid®, UK) y agar Mc Conkey (Oxoid®, UK) para realizar pruebas bioquímicas convencionales para verificar que el aislamiento era E. coli. La presencia de BLEE fue confirmada por el método del Clinical and Laboratory Standards Institute (CLSI). Se utilizó la cepa K. pneumoniae ATCC 700603 (control positivo de BLEE) y E. coli ATCC 25922 como control negativo.
La susceptibilidad antimicrobiana se determinó por el método de disco difusión empleando agar Mueller Hinton (Oxoid®, UK) y los discos de antibióticos: norfloxacino (NOR) (10 μg) de la marca DDBBL®, USA; los discos amikacina (AMK) (30 μg), gentamicina (GEN) (10 μg), estreptomicina (STR) (10 μg), tobramicina (TOB) (10μg), levofloxacina (LEV) (5μg),ciprofloxacino (CIP) (5 μg), ácido nalidíxico (NAL) (30 μg), trimetoprim-sulfametoxazol (SXT) (25μg), nitrofurantoína (NIT) (300 μg), imipenem (IPM) (10 μg), aztreonam (ATM) (30 μg), ampicilina (AMP) (30 μg) y cefalotina (CEF) (30 μg) de la marca Oxoid®, UK y discos de fosfomicina (FOF) (200μg) de la marca Bioanalyse®,Turquía. El resultado se determinó de acuerdo al diámetro del halo de inhibición, según criterios del CLSI, catalogándose sensible (S), intermedio (I) y resistente(R).
Se realizó el tamizaje para β-lactamasastipo AmpC, empleando el método modificado de Martínez (9), utilizando discos de imipenem (IPM)(10 μg) como antibiótico inductor, suplementados con 20 µL de una solución de ácido fenilborónico (AFB) (Aldrich®, USA), considerado inhibidor competitivo reversible de las β-lactamasas AmpC; la medida del halo generado por este disco fue comparado con el halo de inhibición del disco de IPM sin el suplemento, una diferencia mayor o igual de3 mm entre los halos de inhibición, fue indicador de la presencia de una β-lactamasa tipo AmpC.
La presencia de genes bla se determinó a partir del ADN total mediante la reacción en cadena de la polimerasa (PCR), empleando cebadores específicos para los genes blaTEM, blaSHV y blaCTX-M, diseñados por Biosearch Technologies®, USA (Tabla 1). El ADN bacteriano total se extrajo mediante la técnica de choque térmico, la concentración de ADN se determinó midiendo la absorbancia a 260/280nm y 260/230nm en un espectrofotómetro Nanodrop-ND-1000 (ThermoScientific®, USA). Se uniformizó la concentración final de todos los extraídos a 20 ng/µl.

Los master mix para cada uno de los genes se prepararon de acuerdo a la metodología descrita por Castro et al, (6), tal como se detalla en la Tabla 2.
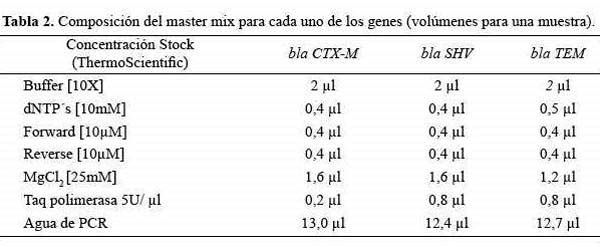
La PCR se realizó en un termociclador PIKO (Thermo Scientific®, USA), la mezcla de reacción se ajustó a un volumen final de 20µl (18 µl de master mix y 2 µl de ADN). Se incluyó un control positivo y negativo por cada reacción.
Los productos obtenidos tras la amplificación fueron coloreados con el reactivo fluorescente RunSafe (Cleaver Scientific®, UK) y se analizaron mediante electroforesis utilizando gel de agarosa al 1% en buffer TBE 1X (Tris-Borato-EDTA) (Thermo Scientific®, USA). La electroforesis se llevó a cabo a 110V y 110 A durante 40 minutos; para finalmente visualizar los geles con un transiluminador de Luz UV (Wealtec®, USA), se reportó la presencia o ausencia de los tipos de genes blaTEM, blaSHV y blaCTX-M.
Este proyecto fue revisado y aprobado, previo a su ejecución, por el Comité de investigación científica y académica del Grupo AUNA.
RESULTADOS
Se obtuvieron 325 aislamientos de E. coli, el 16,3% (53/325) fueron confirmados como productores de BLEE.
Respecto a los grupos etarios, 54,8 % de los pacientes (178/325) fueron mayores de 65 años; 25,8% (84/325) pertenecieron al rango de 45-64 años; 14,5% (47/325) tuvieron entre 20-44 años, y el 4,9 % (16/325) fueron menores de 20 años. El rango de edades de los pacientes confirmados con E. coli productor de BLEE estuvo comprendido entre los 22 y 100 años, con una media de 65,19 ± 20,2.
El 86,5% (281/325) de los urocultivos positivos a E. coli correspondieron al género femenino, mientras que de los aislamientos productores de BLEE, 88.7% (47/53) provenían de pacientes de sexo femenino. Asimismo, las pacientes mayores de 65 años fue el grupo etario más afectado por E. coli productor de BLEE 29/53 (54,7%).
Los métodos de Jarlier y CLSI utilizados como pruebas fenotípicas confirmatorias para la producción de BLEE, fueron positivos en 53/53 (100%) de los aislados estudiados (53/53), mientras que el método para la detección fenotípica de β-lactamasas tipo AmpC fue negativo en un 100%.
La distribución porcentual de los aislados catalogados como sensibles intermedios o resistentes frente a los antibióticos probados, se muestran en el gráfico 1.
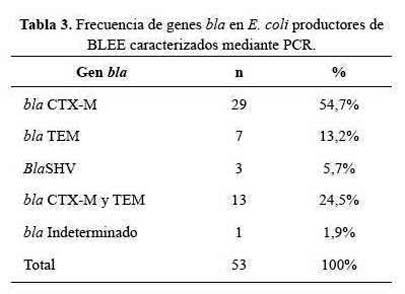
Se observó que del total de las E. coli productoras de BLEE, 42 (79,2%) presentaron el gen blaCTX-M, 20 (37,7%) el gen blaTEM y 3 (5,7%) el gen blaSHV; es importante mencionar que 13 (24%) aislamientos, presentaron una co-existencia de los genes blaCTX-M y TEM. Un aislado no amplificó para los genes bla en evaluación. La tabla 4 muestra la frecuencia relativa de los genes blaCTX-M, blaSHV, blaTEM y blaCTX-M+blaTEM.
DISCUSIÓN
En los últimos años se ha producido un aumento en las tasas de resistencia de los uropatógenos frente a los antibióticos considerados de primera elección, actualmente es más frecuente el reporte de aislamientos productores de BLEE en pacientes de la comunidad, siendo responsables de gran parte de los fracasos terapéuticos (10,13).
En nuestro estudio, la frecuencia de aislamientos de E. coli productores de BLEE en pacientes de la comunidad fue similar al 21% reportado por Castro et al., en México (14). Estas cifras son superiores a las reportadas en otros países de América; 6,2% en Chile (15) y 2,1% en Colombia (16), los primeros trabajaron con E. coli productor de BLEE en pacientes ambulatorios adultos, mientras que el segundo trabajó con muestras de origen comunitario en hospitales pertenecientes a la red GREBO.
En Europa, un estudio multicéntrico realizado en España, reportó que la frecuencia de E. coli productores de BLEE tuvo una media del 3,2% aumentando de 1,9% a 4,9% durante los años 2003 al 2007 (5); mientras que otro estudio en un hospital clínico de España reportó una frecuencia de 3,7% durante un periodo de un año, los aislamientos en este estudio fueron 67% de origen comunitario y 33% hospitalario (17).
Dhillon y Clark (18), explican que los niveles de resistencia a antimicrobianos varían de acuerdo a la región de estudio. Los países en vías de desarrollo presentan niveles de resistencia mayores debido a la situación socioeconómica, venta libre de antimicrobianos, carencia o incumplimiento de políticas de uso racional de antimicrobianos y la falta de recursos para implementar estrategias de contención adecuadas.
La metodología empleada en nuestro estudio para la detección fenotípica de BLEE no encontró discordancia entre los métodos de Jarlier y del CLSI, para ambos casos la confirmación de BLEE fue del 100%, estos resultados se relacionan estrictamente con los obtenidos en las pruebas moleculares, reafirmando la utilidad de estos métodos fenotípicos, simples y económicos para la confirmación de BLEE. Lezameta et al, (19), proponen que la detección de bacterias productoras de BLEE, debe ser una prueba de rutina en los laboratorios de microbiología a fin de conocer la verdadera dimensión del problema, adecuar las mejores opciones terapéuticas e implementar medidas pertinentes para limitar su diseminación.
Ningún aislamiento resultó positivo a la prueba fenotípica para detectar AmpC, sin embargo era necesaria la realización de esta prueba debido a que en la actualidad se hace referencia a la coexistencia de BLEE+AmpC a nivel mundial en aislamientos tanto a nivel hospitalario como en pacientes de la comunidad (20).
Se encontraron elevados niveles de resistencia a las fluoroquinolonas, estos antimicrobianos han sido usados con mucha frecuencia en tratamientos empíricos de infecciones del tracto urinario, ello debido a que ciprofloxacino y levofloxacino alcanzan altas concentraciones en el lugar de infección. Seral et al, (20) refirieren que las fluoroquinolonas podrían ser el tratamiento de elección en infecciones complicadas del tracto urinario, sólo en cepas sensibles, sin embargo, la coexistencia en elementos móviles de genes de resistencia a quinolonas (qnr, aac(6`)-Ib-cr, qepA) con genes productores de β-lactamasas vienen limitando su uso.
Un desenlace similar han tenido el clotrimoxazol y los aminoglucósidos, anteriormente antimicrobianos de gran eficacia para el tratamiento de las ITU pero en la actualidad se viene racionalizando su uso debido a su elevada resistencia (5,20,21). Se debe considerar la coexistencia de otros factores genéticos que confieren resistencia a estos antimicrobianos, esta resistencia se puede transferir conjuntamente con el gen responsable de la producción de BLEE; diversos autores coinciden que los plásmidos que codifican las BLEE portan genes de resistencia a estos antimicrobianos (21). La resistencia a aminoglucósidos por mecanismos enzimáticos, implican la presencia de genes que codifican enzimas modificadoras de aminoglusósidos (EMA), como las N-57acetiltransferasas (AAC-), entre las cuales las más frecuentes serían AAC(6´), AAC(3)-IV, ANT(2") y AAC(3)-II (22).
Un hallazgo importante de nuestro estudio fue el 100% de sensibilidad a nitrofurantoína, esto puede explicarse debido a que en nuestro medio, el uso de este antimicrobiano ha sido desplazado por otros grupos de antibióticos. Es necesario considerar que la nitrofurantoina tiene la ventaja de su baja toxicidad, posibilidad de empleo para tratamientos prolongados y bajo costo, por lo que en diversos países está siendo empleado para tratar las infecciones por gérmenes productores de BLEE en ITU no complicada (23).
El elevado porcentaje de sensibilidad frente a fofosmicina, estaría influenciado por el limitado uso que se le da al antimicrobiano en nuestro país, en otros países es muy empleado debido a que no presentan resistencias cruzadas, convirtiéndose en una alternativa terapéutica para infecciones causadas por E. coli resistentes a fluoroquinolonas y β-lactámicos (24).
Respecto al tipo de gen bla, el más frecuente fue blaCTX-M (55%), esto coincide con lo reportado por Hernández quien describió una distribución de los tipos de BLEE según procedencia: a nivel hospitalario fueron de 54,1%, 34,7% y 11,1% para blaCTX-M, blaTEM y blaSHV, respectivamente (17), mientras que a nivel comunitario los porcentajes fueron de 54,7%, 27,7% y 17,5%, para blaCTX-M, blaTEM y blaSHV; como se evidencia para ambos niveles la frecuencia del gen blaCTX-M, supera a los otros tipos de genes bla.
Por otro lado difieren de lo reportado por Castro et al., quienes en un estudio realizado con E. coli productores de BLEE aislados de urocultivos de pacientes de la comunidad de Chilpancingo, México; describieron que los genes blaTEM (94,4%) fueron los más frecuentes, seguidos por blaCTX-M (50%) y blaSHV (5,5%) (14).
Numerosos estudios refieren que la mayoría de aislados de E. coli recuperados a partir de pacientes de la comunidad, expresaron BLEE de tipo CTX-M; así mismo estudios realizados en Europa han identificado epidemias en la comunidad producidas por estos aislados, siendo la variable CTX-M-15 la más frecuente en ITU (11).
El hecho de tener un aislado con genotipo indeterminado sugiere que los cebadores utilizados no fueron capaces de amplificar las regiones concordantes con sus genes, en este estudio se utilizó la metodología modificada de Castro et al., quien a su vez utilizó cebadores empleados por otros autores, éstos fueron específicos amplificando los genes: bla CTX-M (-1 al -17 y del -19 al -22), bla SHV (-1, -2, -5 y del -19 al -22) y bla TEM (-1 al -7 y -20). Es probable que la BLEE detectada en este germen, sea diferente a los mencionados.
El presente constituye la primera publicación sobre la presencia de E. coli productora de BLEE y su caracterización molecular en pacientes de la comunidad de nuestro medio. La difusión de esta información contribuirá a orientar el tratamiento de las ITU en esta población en particular.
Lugar de estudio:
Instalaciones del servicio de microbiología del Laboratorio Clínico Inmunológico Cantella S.A de la ciudad de Lima y Laboratorio de Resistencia bacteriana del LID - UPCH.
Agradecimientos:
Al grupo de trabajo de la Dirección Científica y Académica de Oncosalud-AUNA, el Dr. Alfredo Aguilar, Mg. Claudio Flores, Mg. Joseph Pinto y Blga. Priscila Valdiviezo. Al equipo de Microbiología del Laboratorio Clínico Inmunológico Cantella, Blga. Juli Rafaile, a los técnicos Martín López y Agustina Álvarez.
REFERENCIAS BIBLIOGRÁFICAS
1.Echevarría J, Sarmiento E, Osores F. Infección del tracto urinario y manejo antibiótico. Acta Méd Peru. 2006; 23(S1):26-31. [ Links ]
2.Martín S, Martín T, Liso PJ. Tratamiento de las infecciones producidas por β-lactamasas de espectro extendido (BLEE): Formación continuada para farmacéuticos de hospital V. Badajoz, España: Fundación PROMEDIC; 2010. p. 95-127. [ Links ]
3. Gómez CP, Plata M, Sejnaui JE, Rico CL, Vanegas BS. Resistencia de la E.coli en urocultivos de pacientes con sospecha de infección urinaria intra y extra-hospitalaria en la Fundación Santa Fe de Bogotá. Urol Colomb. 2009; 18(S1): 53-8. [ Links ]
4.García C, Astocondor L, Banda C. Enterobacterias productoras de β-lactamasas de espectro extendido:Situación en América Latina y en el Perú. Acta Méd Peru. 2012; 29(S3):163–9. [ Links ]
5. Tena D, Praetorius AG, González JC, et al. Evolución del patrón de sensibilidad de Escherichia coli en infecciones del tracto urinario diagnosticadas en la comunidad durante el periodo 2003-2007:Estudio multicéntrico en Castilla la Mancha. Rev Esp Quimioter. 2010; 23(S1):36-42. [ Links ]
6.Castro-Alarcón N, Carreón-Valle ED, Moreno-Godínez ME, Alarcón-Romero L. Caracterización molecular de β-lactamasas de espectro extendido en aislamientos clínicos de Escherichia coli. Enf inf Microbiol 2008; 28:114-120. [ Links ]
7. Sánchez M, Bello H, Domínguez M, Mella S, Zemelman R, González G. Transferencia de ß-lactamasas de espectro extendido desde cepas hospitalarias de Klebsiella pneumoniae a otras especies de enterobacterias. Rev Méd Chile. 2006; 134(S4):415-420. [ Links ]
8. Paterson DL, Bonomo RA. Extended-Spectrum ß-Lactamases: a clinical update. Clin Microbiol Review. 2005; 18(4): 657-686. [ Links ]
9. Martínez DDV. Betalactamasas tipo AmpC: Generalidades y métodos para detección fenotípica. Rev Soc Venez Microbiol. 2009; 29(S2):78-83. [ Links ]
10. Gaitán SL, Espinal PA. Caracterización molecular de Escherichia coli y Klebsiella pneumoniae productores de ß-lactamasas de espectro extendido en hospitales de la Región Caribe, Colombia. Rev Chil Infectol. 2009; 26(S3):239-246. [ Links ]
11. Hernández E, Araque M, Millán Y, Millán B, Vielma S. Prevalence of beta-lactamase CTX-M-15 in phylogenetic groups of uropathogenic Escherichia coli isolated from patients in the community of Merida, Venezuela. Investig Clínica. 2014; 55(S1):32-43. [ Links ]
12. Horcajada JP, Fariñas M. Implicaciones de las resistencias bacterianas en las infecciones urinarias adquiridas en la comunidad. Enferm Infecc Microbiol Clin. 2005; 23(S1):1-3. [ Links ]
13. Rodríguez-Baño J, Navarro MD, Romero L, et al. Epidemiology and clinical features of infections caused by extended-spectrum beta-lactamase-producing Escherichia coli in nonhospitalized patients. J Clin Microbiol. 2004; 42(S3):1089–94. [ Links ]
14. Castro N, Salgado JFS, Ocampo RLO, Silva J, Ruiz MR. Caracterización de β-lactamasas de espectro extendido producidas por Escherichia coli de infecciones del tracto urinario adquiridas en la comunidad de Chilpancingo, Guerrero, México. Tlamati. 2014; 5(1): 14-23. [ Links ]
15. Wirth H, García P, Zacher D. Castillo C, Pérez C. Patrones actuales de resistencia a uropatógenos en pacientes adultos. Viña del Mar: XXI Congreso Chileno de Infectología; 2004. [ Links ]
16. Arias G. Características clínicas y frecuencia de betalactamasas de espectro extendido en aislamientos de enterobacterias causantes de IVU de origen comunitario en pacientes adultos de siete hospitales pertenecientes a la red GREBO 2009-2010. Tesis de postgrado. Bogotá: Universidad Nacional de Colombia; 2011. 37p. [ Links ]
17. Hernández E. Escherichia coli productores de blee aislados de urocultivo: implicaciones en el diagnóstico y tratamiento de la infección urinaria, Tesis de doctorado. Madrid: Universidad Complutence de Madrid; 2010. 172 p. [ Links ]
18. Dhillon RHP, Clark J. ESBLs: A Clear and Present Danger? Crit Care Res Pract. 2012; 2012: 625170. [ Links ]
19. Lezameta L, Gonzáles-Escalante E, Tamariz JH. Comparación de cuatro métodos fenotípicos para la detección de β-lactamasas de espectro extendido. Rev Perú Med Exp Salud Publica. 2010; 27(3):345–51. [ Links ]
20. Seral C, Gude MJ, Castillo FJ. Emergencia de β-lactamasas AmpC plasmídicas (pAmpC ó cefamicinasas): origen, importancia, detección y alternativas terapéuticas. Rev Esp Quimioter. 2012; 25(2):89-99. [ Links ]
21. Miranda MC. Escherichia coli portador de betalactamasas de espectro extendido: resistencia. Sanid Mil. 2013; 69(S4):244–248. [ Links ]
22. Martínez-Martínez L. Asociación de BLEE con otros mecanismos de resistencia. Enferm Infecc Microbiol Clin. 2007; 25(2): 38-47. [ Links ]
23.Mancuso C, Bagilet DH. Eficacia y seguridad de la nitrofurantoína en el tratamiento de las infecciones urinarias no complicadas. Rosario, Santa Fe, Argentina: Clínica Médica y Terapéutica, Facultad de Ciencias Médicas, Universidad Nacional del Rosario; 2012. [ Links ]
24. Hassan SA, Jamal SA, Kamal M. Occurrence of multidrug resistant and ESBL producing E coli causing urinary tract infections. J Basic Appl Sci. 2011; 7(S1):39-43. [ Links ]
Declaración de financiamiento y de conflictos de intereses:
El trabajo contó con el financiamiento del Grupo AUNA y el Laboratorio de Resistencia bacteriana del LID - UPCH. Los autores declaran no tener conflictos de intereses.
Contribución de autoría:
FG: Concepción y diseño del estudio, la recolección, análisis e interpretación de datos; redacción y aprobación de la versión final del artículo. JT: Concepción y diseño del estudio, la recolección, análisis e interpretación de datos; y aprobación de la versión final del artículo. NB y JL: Revisión y aprobación de la versión final del artículo. JA: Estandarización y validación de las pruebas moleculares.
Correspondencia:
Jesús Humberto Tamariz Ortiz
Av. Honorio Delgado 430, Urb. Ingeniería, SMP. Lima-Perú
Teléfono: 511 319-0000
Correo electrónico:
jesus.tamariz@upch.pe
Recibido: 19/10/2015
Aceptado: 28/12/2015













