Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130X
Rev Med Hered vol.27 no.3 Lima July 2016
INVESTIGACIÓN ORIGINAL
Estudio exploratorio de marcadores plasmáticos del estado redox y perfil lipídico en gestantes adolescentes atendidas en una consulta prenatal pública de la ciudad de San Felipe, Venezuela.
Exploratory study of the plasmatic markers of redox status and lipidic profile in pregnant adolescents attending public antenatal care service in the city of San Felipe, Venezuela
Nelina Alejandra Ruiz-Fernández1,2,a, Kisaira Osuna1,b, Ericksson Mora1,b, Katherine Terán1,b, Naymar Ojeda1,b
1 Departamento de Morfofisiopatología de la Escuela de Bioanálisis Sede Carabobo, Facultad de Ciencias de la Salud, Universidad de Carabobo. Valencia, Venezuela.
2 Instituto de Investigaciones en Nutrición, Facultad de Ciencias de la Salud, Universidad de Carabobo. Valencia, Venezuela.
a Doctor en Ciencias Fisiológicas; b Licenciado en Bioanálisis
RESUMEN
Las adolescentes embarazadas constituyen un grupo de alta vulnerabilidad biológica y social. Objetivos: Evaluar el comportamiento de marcadores plasmáticos del estado redox y perfil lipídico en gestantes adolescentes en el segundo y tercer trimestre de embarazo atendidas en una consulta prenatal pública y compararlo con el que muestran gestantes adultas y mujeres no embarazadas. Material y métodos: Estudio descriptivo transversal, que incluyó 29 gestantes adolescentes (14-20 años), 26 gestantes adultas (20-44 años) y 25 mujeres no embarazadas (17-44 años). Se determinó en suero malondialdehído (MDA), ácido ascórbico (AA), ácido úrico (AU), colesterol total (CT), LDLc, HDLc, triglicéridos (TGL) y se calculó el índice de estrés oxidativo (MDA/AA), relaciones CT/ HDLc, LDLc/HDLc, TGL/HDLc y colesterol NoHDL. Resultados: En ambos trimestres, las gestantes adolescentes mostraron valores más elevados de MDA, índice MDA/AA, TGL y relación TGL/HDLc así como concentraciones menores de AA, en comparación con adolescente no embarazadas. Solo en el tercer trimestre, los niveles de CT y LDLc de las gestantes adolescentes superaron significativamente los encontrados en adolescentes no embarazadas. Los marcadores evaluados no variaron significativamente entre el segundo y tercer trimestre en las gestantes adolescentes. En el tercer trimestre, las concentraciones de MDA, LDLc y colesterol NoHDL de las gestantes adolescentes fueron significativamente menores respecto de las gestantes adultas. Conclusiones: El embarazo adolescente normal se asoció a modificaciones del estado redox y del metabolismo lipídico, especialmente en el tercer trimestre, pero no se confirmó que dihos cambios gestacionales fuesen de mayor magnitud respecto de las gestantes adultas.
PALABRAS CLAVE: adolescente, embarazo, oxidación, ácido ascórbico, lípidos, ácido úrico. (Fuente: DeCS BIREME).
SUMMARY
Pregnant adolescents are a group of high biological and social vulnerability. Objective: To evaluate the behavior of plasma markers of redox status and lipid profile in pregnant adolescents in the second and third trimester of pregnancy attending public antenatal care service and compare it with adult pregnant women and non-pregnant women. Methods: Cross-sectional study involving 29 pregnant adolescents (aged 14-20 years), 26 adult pregnant women (aged 20-44 years) and 25 non-pregnant women (aged 17-44 years). Malondialdehyde (MDA), ascorbic acid (AA), uric acid (UA), total cholesterol (TC), LDL cholesterol (LDLc), HDL cholesterol (HDLc), triglycerides (TGL) were determined. Oxidative stress index (MDA/AA), TC/HDLc ratio, LDLc/HDLc ratio, TGL/HDLc ratio and nonHDL-cholesterol were calculated. Results: In both trimesters, pregnant adolescents showed higher levels of MDA, MDA/AA index, TGL, TGL/HDLc ratio and lower concentrations of AA, compared to non-pregnant adolescents. Only in the third trimester, the levls of TC and LDLc of pregnant adolescents significantly exceeded those found in non-pregnant adolescents. The markers did not differ significantly between the second and third trimesters in pregnant adolescents. In the third trimester, the concentrations of MDA, LDLc and nonHDL-cholesterol of pregnant adolescents were significantly lower compared to the adult pregnant women. Conclusions: Normal adolescent pregnancy is associated with changes in the redox state and lipid metabolism, especially in the third trimester, but it was not confirmed that these gestational changes were of greater magnitude relative to the adult pregnant women.
KEYWORDS: adolescent, pregnancy, oxidative stress, ascorbic acid, lipids, uric acid. (Source: MeSH NLM).
INTRODUCCIÓN
El embarazo se considera una etapa de gran susceptibilidad al estrés oxidativo (EOx), un estado en el que el balance redox se inclina a favor del componente oxidativo frente al antioxidante. Tal susceptibilidad resulta del aumento del consumo de oxígeno para hacer frente a los requerimientos energéticos gestacionales y por el incremento de la biosíntesis de sustratos oxidables como los lípidos (1). También puede existir consumo y depleción de las defensas antioxidantes, las cuales dependen en buena medida del aporte dietario balanceado de micronutrientes que funcionan como antioxidantes por si mismos o como cofactores de enzimas antioxidantes.
Las especies reactivas de oxígeno oxidan los ácidos grasos poli-insaturados, produciéndose hidroperóxidos que se transforman en una variedad de productos cuantificables en sangre, uno de ellos es el malodialdehído, éste constituye un indicador directo del daño celular y de la peroxidación lipídica (2), por ende, refleja el componente oxidativo del balance redox. En cuanto al componente antioxidante del plasma éste suele ser evaluado a través de la valoración individual de diversas moléculas que tienen tal acción. Aunque la contribución de diversos antioxidantes a la capacidad antioxidante no enzimática del plasma varía de acuerdo al método empleado para determinarla, moléculas de origen “endógeno” como el ácido úrico y los grupos tiol de las proteínas plasmáticas confieren el mayor porcentaje de dicha capacidad. Por su parte, el ácido ascórbico o vitamina C es el agente reductor de origen “exógeno” que contribuye más a la capacidad antioxidante no enzimática del plasma y se encuentra en mayor concentración en sangre humana (3).
En gestantes adultas se ha informado aumento de los niveles plasmáticos de lípidos y de peroxidación lipídica, así como también disminución de ciertos antioxidantes (4-6). Sin embargo, existe poca información en gestantes adolescentes aun cuando su vulnerabilidad biológica es acentuada por la doble carga que impone el crecimiento fetal y el propio, existiendo evidencias de competencia entre madre y feto por los nutrientes (7). Un reciente análisis de datos de 29 países incluyendo latinoamericanos demostró en las gestantes adolescentes mayor riesgo de eclampsia, bajo peso al nacer y parto prematuro (8), condiciones asociadas a EOx (9).
Más del 90% de los embarazos adolescentes ocurren en países de bajo y mediano ingreso (10). En el Perú, el porcentaje de adolescentes embarazadas se ha situado alrededor del 13% en las últimas dos décadas (11), mientras que en Venezuela 22,2% de los nacimientos en el año 2012 procedieron de madres adolescentes (12). La ciudad de San Felipe es la capital del Estado Yaracuy, una entidad federal venezolana que se incluye entre aquellas en las que el porcentaje de madres adolescentes (12 a 19 años) osciló entre 11,32 y 13,06% en 2011 según el Censo Nacional de población y vivienda (13); adicionalmente su porcentaje de hogares pobres fue de 27%, casi tres puntos por encima del que se informó para el país (14). En conjunto estos datos indicaron la necesidad de un estudio exploratorio sobre gestantes provenientes de la ciudad de San Felipe, Estado Yaracuy, cuyo objetivo fue evaluar el comportamiento de marcadores plasmáticos del estado redox y el perfil lipídico en gestantes adolescentes atendidas en una consulta prenatal pública en el segundo y tercer trimestre de embarazo, contrastándolo con el obtenido en gestantes adultas y en un grupo control de mujeres adolescentes y adultas no embarazadas.
MATERIAL Y MÉTODOS
Estudio descriptivo de tipo transversal, de diseño no experimental. La población estuvo formada por todas las gestantes que asistieron a la consulta prenatal de un hospital público ubicado en el municipio San Felipe, Estado Yaracuy, Venezuela, entre Febrero-Marzo 2014. Por muestreo no probabilístico e intencional se seleccionó:
Grupo Gestantes adolescentes: 29 gestantes incluidas en el estudio según los siguientes criterios: edad entre 14 y 19 años, edad gestacional mayor o igual a 13 semanas por fecha de ultima regla (FUR), embarazo único, evolución del embarazo dentro de lo normal, presión arterial normal al momento de la evaluación y participación voluntaria.
Grupo Gestantes adultas: 26 gestantes con edad entre 20 y 45 años, incluidas según los criterios antes señalados.
Para ambos grupos los criterios de exclusión fueron: diagnóstico de enfermedades crónicas preexistentes o complicaciones obstétricas, antecedentes de complicaciones obstétricas en embarazos previos, hábito tabáquico, consumo de drogas de abuso o alcohol, niveles de proteína C-reactiva en suero = 20,3 ó = 8,1 mg/l, para el segundo y tercer trimestre (15), respectivamente.
Se incluyó un tercer grupo de mujeres que acudieron por análisis de rutina para chequeo general de salud. Grupo control (mujeres no embarazadas-NE): 25 mujeres no embarazadas incluidas según los siguientes criterios de inclusión: aparentemente sana, edad cronológica entre 14 y 45 años, fecha de ultima regla dentro de los 30 días previos a la evaluación, presión arterial normal y participación voluntaria.
Los criterios de exclusión fueron: manifestaciones clínicas de infecciones o inflamación al momento de la evaluación, antecedentes personales de enfermedad cardiovascular, cáncer o diabetes, hipertensión arterial no controlada, hábito tabáquico, consumo de drogas de abuso y alcohol, tratamiento con hipolipemiantes o corticoides, presencia de proteína C-reactiva en suero.
El tamaño de la muestra estudiada fue condicionado por el periodo de recolección de la muestra así como por los criterios de inclusión/exclusión antes señalados.
Mediante encuesta y revisión de historia clínica (en el caso de las gestantes) se obtuvieron los datos relevantes al estudio y se confirmaron los criterios de inclusión/exclusión. Previo ayuno de 12 horas y cena ligera, se extrajeron 12 ml de sangre por venopunción en el pliegue del codo. En el suero se determinaron los siguientes marcadores:
a) Estado redox
Se midió la concentración de malodialdehído (MDA) como indicador de lipoperoxidación empleando el kit comercial de Cayman Chemical Company para MDA. Ácido ascórbico (AA) fue determinado mediante método colorimétrico (16). Ácido úrico (AU) se valoró mediante método enzimático por el kit Uricostat Wiener Lab. Como índice de estrés oxidativo se calculó la relación MDA/AA.
b) Perfil Lipídico
Colesterol total (CT) y triglicéridos (TGL) fueron determinados por métodos enzimáticos colorimétricos, mediante kits comerciales de Wiener Lab. Colesterol unido a lipoproteínas de alta densidad (HDLc) se midió previa precipitación con ácido fosfotúngstico. Colesterol unido a lipoproteínas de baja densidad (LDLc) se midió previa separación mediante ensayo homogéneo sin precipitación en dos pasos. El colesterol de ambas fracciones lipoproteicas se determinó utilizado el mismo kit comercial para CT.
Se calcularon los índices CT/HDLc, LDLc/HDLc, TGL/HDLc y colesterol NoHDL (CT-HDLc).
Los análisis estadísticos se realizaron considerando el trimestre de embarazo en el cual se encontró cada gestante. Se calcularon mediana, media, desviación estándar, frecuencias absolutas y relativas. La prueba U de Mann-Whitney para dos muestras independientes permitió comparar la variación de los indicadores evaluados entre un trimestre y otro en cada grupo de gestante así como establecer diferencias entre los grupos estudiados. Fue considerado como nivel de significancia p<0,05 y se empleó el programa PASW Statistics versión 18.0 para Windows.
Se cumplieron todos los acuerdos de la Declaración de Helsinki actualizada en 2013. Los objetivos y protocolo del estudio se explicaron adecuadamente a las participantes solicitándose consentimiento informado firmado. La dirección de la institución donde se realizó el estudio conoció y aprobó el mismo.
RESULTADOS
Como se esperaba la edad materna difirió entre los grupos estudiados y la paridad fue mayor entre las gestantes adultas (p<0,01). La distribución por trimestre de embarazo no fue significativamente diferente entre los grupos de gestantes estudiadas (Tabla 1).
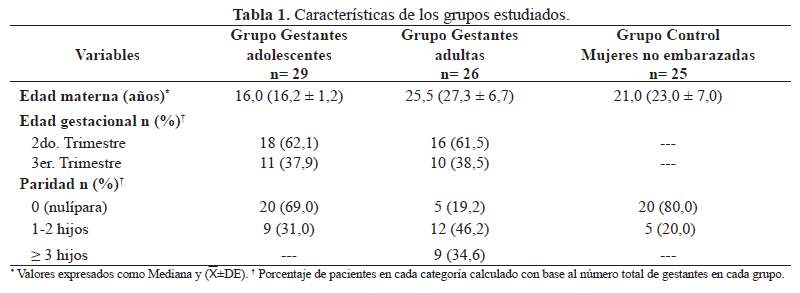
No se observaron variaciones significativas de los marcadores evaluados entre el segundo y tercer trimestre entre las gestantes adolescentes. En comparación con el grupo control de adolescentes no embarazadas, las gestantes adolescentes en ambos trimestres mostraron valores más elevados de MDA, índice MDA/AA, TGL y relación TGL/HDLc así como concentraciones menores de AA. Solo en el tercer trimestre, sus niveles de CT y LDLc superaron significativamente los encontrados en las adolescentes no embarazadas. Cuando se compararon con el grupo control de adultas no embarazadas, las gestantes adolescentes en el segundo trimestre mostraron concentraciones más elevadas de CT, HDLc y colesterol NoHDL; en el tercer trimestre, presentaron valores significativamente superiores de MDA, índice MDA/AA, CT, LDLc, HDLc, TGL y colesterol NoHDL respecto de las adultas no embarazadas (Tabla 2).
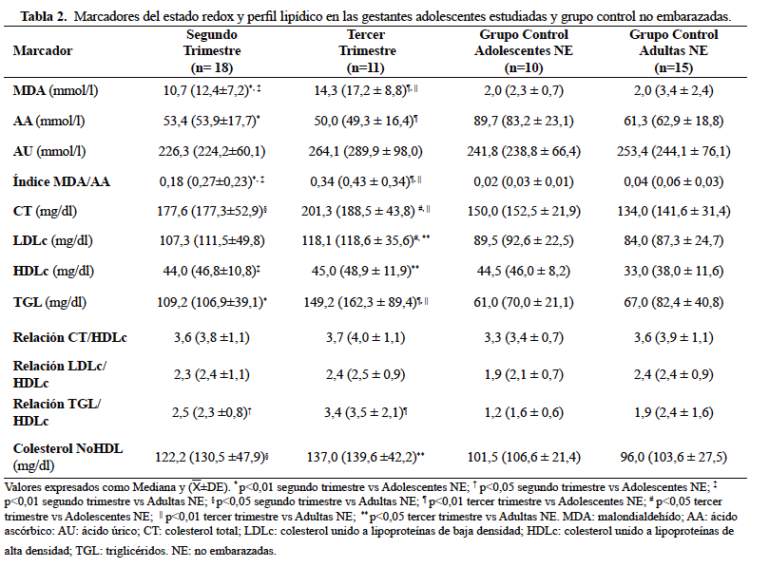
Al comparar con el grupo control de adultas no embarazadas, las gestantes adultas en ambos trimestres mostraron valores de MDA, índice MDA/AA, CT y colesterol NoHDL significativamente superiores mientras que LDLc, HDLc, TGL, relación CT/HDLc, relación LDLc/HDLc, relación TGL/HDLc solo fueron mayores en el tercer trimestre. En las gestantes adultas los niveles de MDA, AU, índice MDA/AA, CT, LDLc, TGL, colesterol NoHDL y relación TGL/HDLc se encontraron más elevados en el tercer trimestre respecto del segundo (Tabla 3).
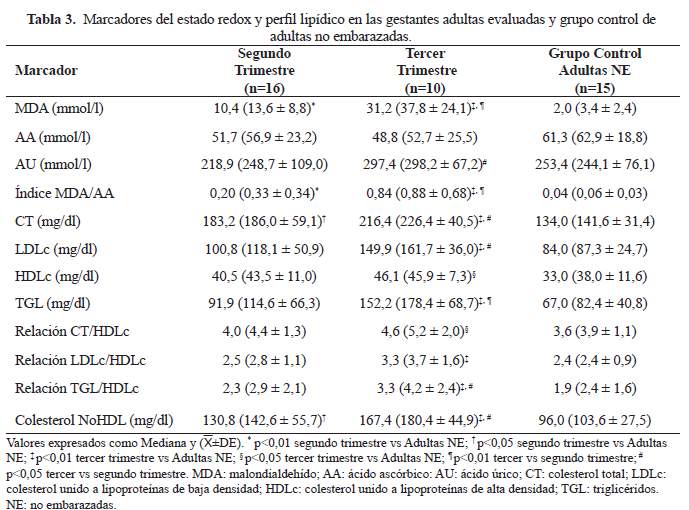
En el tercer trimestre las concentraciones de MDA, LDLc y colesterol NoHDL difirieron significativamente entre las gestantes adolescentes y las gestantes adultas, siendo menores en las primeras (p=0,029; p=0,036; p=0,036, respectivamente). El resto de las variables evaluadas no difirieron entre los grupos de gestantes estudiadas en ambos trimestres.
DISCUSIÓN
Diversos eventos morfofuncionales que ocurren antes de la concepción, durante el desarrollo embrionario-fetal y el alumbramiento son dirigidos por procesos oxidativos (9). En línea con lo anterior, ambos grupos de gestantes mostraron concentraciones más elevadas de MDA y un índice de EOx (MDA/AA) mayor respecto del grupo control de no embarazadas (adolescentes y adultas). Al igual que otros autores (5,17,18), también se evidenciaron niveles menores de AA en las gestantes adolescentes de ambos trimestres solo en relación al grupo control de no embarazadas adolescentes; la ausencia de tal diferencia respecto de las no embarazadas adultas y entre las gestantes adultas con respecto a su grupo control pudiera evidenciar el efecto de la suplementación de hierro y vitamina C prescrita en la consulta prenatal.
Idonije et al (4) y Patil et al (19) demostraron un aumento del MDA durante el tercer trimestre de gestación respecto del segundo, resultado que solo fue confirmado entre las gestantes adultas. La literatura no es totalmente coincidente pues Ñuñez-González et al (20) y Patrick et al (21) no evidenciaron variaciones significativas de dicho indicador entre un trimestre y otro, tal como se observó en las gestantes adolescentes evaluadas en este estudio. A lo anterior se suma que los valores de MDA y del índice MDA/AA de las gestantes adolescentes en el tercer trimestre fueron significativamente menores en comparación con las gestantes adultas. Tales hallazgos fueron inesperados, indicando que los mecanismos compensadores defensivos en las gestantes adolescentes fueron suficientes para limitar la lipoperoxidación y contraviniendo la condición de vulnerabilidad que se les adjudica a la madre adolescente, no solo por la competencia por nutrientes con el feto sino por la inseguridad social en la cual frecuentemente se encuentran y que puede condicionar una dieta de baja calidad que coadyuve el desplazamiento del estado redox hacia su componente oxidativo.
Hasta el momento no se conoce el estado redox o nivel de EOx “deseable” en el embarazo normal. En tal sentido, por mucho tiempo, se han enfatizado los efectos deletéreos del EOx perdiéndose la noción de la importancia de la magnitud del EOx, pues si bien el EOx severo genera daño y muerte celular, un EOx moderado, es decir, un EOx positivo inducido por un nivel moderado de especies reactivas puede ser parte de una respuesta adaptativa que protege a la células contra eventos subsecuentes que de otra manera pueden causar daño oxidativo extenso (22). De este modo, es inaplazable confirmar las observaciones obtenidas en el pequeño grupo de adolescentes que se evaluaron en el presente trabajo y realizar esfuerzos por definir ese nivel de EOx “deseable” en el embarazo normal, lo cual indudablemente redundaría en la optimización de estrategias antioxidantes aplicadas en el tratamiento de patologías obstétricas.
En los últimos años ha resurgido el interés por el AU al sugerirse su participación en complicaciones obstétricas como la preeclampsia-eclampsia (23). Paradójicamente, el AU ejerce acciones tanto antioxidantes como pro-oxidantes, aunque se desconoce el interruptor molecular que gobierna ese rol dual (24). Al inicio del embarazo normal existe una disminución del AU respecto de mujeres no embarazadas debido al efecto uricosúrico de los estrógenos y el aumento de la filtración glomerular, pero al final de la gestación se eleva alcanzando los niveles observados en mujeres no embarazadas (25). En línea con lo anterior, en ambos grupos de gestantes, las concentraciones de AU en el tercer trimestre no difirieron de las encontradas en el grupo control, y en las adultas del tercer trimestre se registraron cifras de AU significativamente mayores que en el segundo trimestre. El AU no se relacionó con el MDA o el índice MDA/AA en las gestantes estudiadas (datos no demostrados), por lo que queda abierto su papel en el embarazo normal.
El perfil lipídico de las embarazadas estudiadas demostró la hiperlipidemia fisiológica gestacional referida en la literatura. Los niveles de CT, TGL, LDLc, colesterol NoHDL y relación TGL/HDLc en el tercer trimestre fueron significativamente mayores en comparación con el segundo trimestre entre las gestantes adultas, siendo los TGL la fracción lipídica que más notablemente se elevó. En el caso de las gestantes adolescentes también se observaron los mismos cambios, aunque sin alcanzar significancia estadística.
Tal comportamiento se correspondió con lo descrito previamente (6,20,26,27) y refleja la etapa catabólica que tiene lugar en el último tercio del embarazo, cuando la grasa acumulada en el primer semestre se metaboliza, dando lugar a una hipertrigliceridemia materna que resulta del efecto lipolítico promovido por el incremento de hormonas como el estrógeno y también por la pérdida de sensibilidad a la insulina que ocurre en el embarazo avanzado (28). La única modificación en el perfil lipídico que no se confirmó en ambos grupos de gestantes estudiados fue el aumento de las concentraciones de HDLc entre un trimestre y otro, como ya se ha informado previamente en venezolanas (20,29) y chilenas (6), aunque si se observó elevación de dicha fracción respecto del grupo control de no embarazadas.
Los índices TGL/HDLc y colesterol NoHDL no variaron con la edad gestacional entre las gestantes adolescentes, mostrando valores en promedio superiores respecto del grupo control no embarazadas (adolescentes y adultas) pero nuevamente sin alcanzar significancia estadística. En general, las relaciones lipídicas se mantuvieron en valores dentro de lo que se considera aceptable para la población adulta, con excepción del cociente TGL/HDLc y del colesterol NoHDL en las adultas en el tercer trimestre, probablemente reflejando el aumento de partículas particularmente aterogénicas como son las LDL pequeñas y densas que se generan cuando las LDL se enriquecen con TGL, como ocurre en el embarazo avanzado (28).
Gunterson et al (30), concluyeron que el embarazo durante la adolescencia puede ejercer efectos proaterogénicos a largo plazo, independientemente de la ganancia de peso. En el presente trabajo no se encontraron evidencias que apunten a un perfil lipídico de mayor riesgo cardiovascular durante el embarazo adolescente respecto del embarazo adulto. En el segundo trimestre no se hallaron diferencias según edad materna, más aun, en el tercer trimestre las gestantes adolescentes mostraron valores menores de LDLc y colesterol NoHDL respecto de las gestantes adultas. Es necesario profundizar sobre este aspecto puesto que los cambios gestacionales del perfil lipídico no solo pueden afectar a la mujer sino también al feto, en tal sentido, tanto la atenuación como la intensificación de dichas modificaciones se han asociado a alteraciones del crecimiento fetal (28).
Es preciso señalar que este estudio presenta ciertas limitaciones. Su diseño transversal no permite establecer relaciones causales. Muy probablemente su tamaño muestral reducido limitó su poder para detectar diferencias estadísticas ni permitió evaluar el impacto de la paridad. Asimismo no se evaluaron variables intervinientes como estado nutricional antropométrico y balance redox pre-gestacional, ganancia de peso e ingesta dietética, factores que podrían tener influencia sobre el metabolismo lipídico y el estado redox de la gestante.
En conclusión, el embarazo normal en las adolescentes estudiadas se asoció a modificaciones del estado redox y del metabolismo lipídico, especialmente en el tercer trimestre, observándose elevación de la lipoperoxidación, disminución del AA y EOx. Se confirmó la hiperlipidemia gestacional entre las gestantes adolescentes, siendo los triglicéridos la fracción que sufrió mayor aumento respecto del grupo control y entre los trimestres estudiados. Los cambios gestacionales observados no fueron de mayor magnitud respecto de las gestantes adultas. Se sugiere desarrollar investigaciones de tipo longitudinal para corroborar resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Rangel H. Cambios metabólicos durante la gestación. En: Cabero L, Saldivar D, Cabrillo E. Obstetricia y Medicina Materno-Fetal. Madrid: Editorial Panamericana; 2007.p. 215-217. [ Links ]
2. Ayala A, Muñoz MF, Argüelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid Med Cell Longev. 2014; 2014:360438. [ Links ]
3. Bartosz G. Non-enzymatic antioxidant capacity assays: Limitations of use in biomedicine. Free Radic Res. 2010; 44(7):711-20. [ Links ]
4. Idonije OB, Festus O, Okhiai O, Akpamu U. A comparative study of the status of oxidative stress in pregnant nigerian women. Res J Obstet Gynecol. 2011; 4(1):28-36. [ Links ]
5. Kalaiselvi V, Birundha S, Manjula S, Mythili S, Shanthi B. Estimation of Ascorbic Acid Status in Normal Pregnancy. World J Med Sci. 2014:10(2):150-52. [ Links ]
6. Ywaskewycz LR, Bonneau GA, Castillo MS, López L, Pedrozo WR. Perfil lipídico por trimestre de gestación en una población de mujeres adultas. Rev Chil Obstet Ginecol. 2010; 75(4):227-33. [ Links ]
7. Mistry P, Williams J. The importance of Antioxidant Micronutrients in pregnancy. Oxid Med Cell Longev. 2011; 1(16):8-16. [ Links ]
8. Ganchimeg T, Ota E, Morisaki N, et al. Pregnancy and childbirth outcomes among adolescent mothers: a World Health Organization multicountry study. BJOG. 2014; 121(S1):40-8. [ Links ]
9. Biondi C, Pavan B, Lunghi L, Fiorini S, Vesce F. The role and modulation of the oxidative balance in pregnancy. Curr Pharm Des. 2005; 11(16):2075-89. [ Links ]
10. World Health Organization. WHO Guidelines on preventing early pregnancy and poor reproductive outcome among adolescents in developing countries. Geneva: WHO; 2011. [ Links ]
11. Mendoza W, Subira G. El embarazo adolescente en el Perú: Situación actual e implicancias para las políticas públicas. Rev Perú Med Exp Salud Pública. 2013; 30(3): 471-9. [ Links ]
12. Instituto Nacional de Estadística. I Boletín del Subcomité de Embarazo en Adolescentes. Lima: Instituto Nacional de Estadística; 2015p.p; 8. [ Links ]
13. Instituto Nacional de Estadística. Maternidad Adolescente: una mirada sociodemográfica. Boletín Demográfico. 2014; 4(4):0-0. [ Links ]
14. Instituto Nacional de Estadística. Pobres y Pobres Extremos por Entidad Federal y Municipios. Caracas: Instituto Nacional de Estadística; 2011. [ Links ]
15. Abbassi-Ghanavati M, Greer LG, Cunningham FG. Pregnancy and laboratory studies: a reference table for clinicians. Obstet Gynecol. 2009; 114(6):1326-31. [ Links ]
16. Gunter W, Turner E, Neese W, Bayse D. Laboratory procedures used by the clinical chemistry division, Center for Disease Control, for the second health and nutrition examination survey (HANES II). 1976-80. Atlanta: Centers for Disease Control; 1981. [ Links ]
17. Ghate J, Choudhari AR, Ghuagare B, Singh R. Antioxidant Role of Vitamin C in normal pregnancy. Biomed Res. 2001; 22(1):49-51. [ Links ]
18. Hassan GI, Onu AB. Total serum vitamin C concentration in pregnant women: implications for a healthy pregnancy. Rev Bras Saúde Matern Infant. 2006; 6(3):293-6. [ Links ]
19. Patil SB, Kodliwadmath MV, Kodliwadmath SM. Study of oxidative stress and enzymatic antioxidants in normal pregnancy. Indian J Clin Biochem. 2007;22(1):135-7. [ Links ]
20. Núñez-González J, Sanabria-Vera C, Romero-Adrián T, et al. Óxido nítrico, malondialdehído, perfil lipídico, factor de necrosis tumoral alfa y sus receptores solubles en mujeres no embarazadas, gestantes normales y preeclámpticas. Gac Med Caracas. 2001; 109(3):352-60. [ Links ]
21. Patrick TE, Hubel CA, Roberts JM. Evidence of increased oxidative stress, unexplained by lipid changes, is present in nulliparous black women from early gestation. Hypertens Pregnancy. 2004; 23(1):91-100. [ Links ]
22. Yan LJ. Positive oxidative stress in aging and aging related disease tolerance. Redox Biol. 2014; 2:165-9. [ Links ]
23. Vázquez JG, Rico EI. Papel del ácido úrico en la preeclampsia-eclampsia. Ginecol Obstet Méx. 2011;79(5):292-7. [ Links ]
24. Kang DH, Ha SK. Uric acid puzzle: Dual role as antioxidantand pro-oxidant. Electrolyte Blood Press. 2014; 12(1):1-6. [ Links ]
25. Bainbridge SA, Roberts JM. Uric acid as a pathogenic factor in preeclampsia. Placenta. 2008; 29: S67-72. [ Links ]
26. Lippi G, Albiero A, Montagnana M, et al. Lipid and lipoprotein profile in physiological pregnancy. Clin Lab. 2007;53(3-4):173-7. [ Links ]
27. Diareme M, Karkalousos P, Theodoropoulos G, Strouzas S, Lazanas N. Lipid profile of healthy women during normal pregnancy. JMB. 2009; 28(3):152-60. [ Links ]
28. Herrera E, Ortega-Senovilla H. Lipid metabolism during pregnancy and its implications for fetal growth. Curr Pharm Biotechnol. 2014; 15(1):24-31. [ Links ]
29. Becerra AV, Salas A, Buela L, et al. Indice triglicéridos/cHDL en el embarazo. Interrelación con índices de resistencia a la insulina y antropometría fetal. Rev Venez Endocrinol Metab. 2013; 11(3):141-6. [ Links ]
30. Gunderson EP, Schreiber G, Striegel-Moore R, et al. Pregnancy during adolescence has lasting adverse effects on blood lipids: A 10-year longitudinal study of black and white females. J Clin Lipidol. 2012; 6(2):139-49. [ Links ]
Declaración de Financiamiento y de conflictos de intereses:
La investigación fue financiada con fondos propios de los autores. No declaran conflictos de intereses.
Contribución de Autoría:
NRF: Concepción y diseño de la investigación, procesamiento y análisis de muestras de laboratorio,análisis estadístico y redacción, revisión y aprobación final del manuscrito; KO, EM, KT: Concepción y diseño de la investigación, obtención de datos y toma de muestra, procesamiento y análisis de muestras de laboratorio, redacción, revisión y aprobación final del manuscrito; NO: procesamiento y análisis de muestras de laboratorio, redacción, revisión y aprobación final del manuscrito.
Correspondencia:
Nelina Ruíz-Fernández,
Calle acuario No. 88-20, Urb. Trigal Norte, Valencia,Estado Carabobo, Venezuela.
Correo electrónico: nelinaruiz@yahoo.com ; nruiz@uc.edu.ve
Recibido: 19/12/2015
Aceptado: 28/06/2016













