Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130X
Rev Med Hered vol.28 no.1 Lima ene. 2017
http://dx.doi.org/10.20453/rmh.v28i1.3072
REPORTE DE CASO
Endocarditis infecciosa secundaria a Streptococcus gordonii, complicada con aneurisma y fístula en válvula mitral. Reporte de caso.
Infective endocarditis due to Streptococcus gordonii complicated with an aneurism and mitral valve fistula. Case report
Katia Baca 1,a, Hebert Puente 1,a, Franco González 1,a, Katherine Leyva 1,a, Bruno Rodriguez 1,a, Félix Medina 1,b; 2,c.
1 Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Servicio de Cardiología, Hospital Cayetano Heredia. Ministerio de Salud. Lima, Perú.
a Estudiante de Medicina; b Docente; c Médico Cardiólogo
RESUMEN
Entre las bacterias poco comunes que causan Endocarditis infecciosa (EI), se encuentran el Streptococcus gordonii, conocido por su habilidad de colonizar y dañar las válvulas cardiacas. Asimismo, se conoce que el hallazgo de aneurisma complicado con fístula intracardiaca es infrecuente en EI, sólo se presenta en el 1,6% de pacientes. Se reporta el caso de un varón de 58 años con EI por Streptococcus gordonii complicada con aneurisma y fístula en la válvula mitral.
PALABRAS CLAVE: Endocarditis bacteriana, aneurisma, fístula. (Fuente: DeCS BIREME).
SUMMARY
Streptococcus gordonii is a rare cause of infective endocarditis (IE) known for its ability to colonize and damage cardiac valves. Moreover, it is known that complicated aneurism with intracardiac fistula is an infrequent finding in IE, reported in1.6% of patients. We report the case of a 58 year old male patient with IE infected with Streptococcus gordonii and complicated with an aneurism and mitral valve fistula.
KEYWORDS: Bacterial endocarditis, aneurysm, fistula. (Source: MeSH NLM).
INTRODUCCIÓN
La Endocarditis Infecciosa (EI) es una infección que comúnmente afecta las válvulas cardiacas cuya esión característica es la vegetación. La incidencia es de 3 a 7 por cada 100,000 habitantes al año. Es considerada como el cuarto síndrome infeccioso que pone en riesgo la vida de la persona (1,2).
Existe una amplia gama de bacterias que pueden causar EI (3); entre ellas se encuentran los estreptococos del grupo viridans (SGV) que generalmente es la causa principal de infecciones en válvulas nativas y son adquiridas en el entorno comunitario en pacientes que no son usuarios de drogas intravenosas (1,2).
Entre los SGV tenemos al Streptococcus gordonii, un miembro del grupo Mitis que pertenece a la flora normal de la cavidad oral, predominantemente en la superficie de los dientes; no obstante, puede salir de su habitat y causar EI y artritis séptica (4,5).
S. gordonii, es conocido por su habilidad de colonizar y dañar las válvulas cardiacas, además son identificados como agentes etiológicos primarios de endocarditis bacteriana subaguda (5); sin embargo, en la literatura no se ha descrito a esta especie como un agente productor de abscesos, fístulas y focos de infección metastásicos tanto en el corazón como en regiones extracardiacas en los pacientes con EI (1,2).
Se presenta el caso de un paciente con EI debido a S. gordonii, que se complicó con un aneurisma perforado en la válvula mitral; así como focos sépticos extra cardiacos. Se discuten las indicaciones del tratamiento quirúrgico para estos casos.
PRESENTACIÓN DEL CASO
Varón de 58 años, admitido al Hospital Cayetano Heredia con historia de 2 meses, caracterizado por vómitos alimenticios, fiebre de 38°C y lumbalgia severa incapacitante. El examen clínico reveló soplo holosistólico, multifocal a predominio de foco mitral de intensidad III/VI, irradiado a la axila y cuello. Signo de Lasegue y Psoas positivo, así como signo de Dandy positivo en L3, L4 y L5.
Los datos de laboratorio obtenidos a la admisión fueron: Hemoglobina: 12,2 g/dl, hematocrito: 38%, recuento de leucocitos: 14,01/µl (Neutrófilos: 64,5%), velocidad de sedimentación globular (VSG): 116 mm/h y proteína C reactiva (PCR): 1/16 mg/l. La radiografía de tórax no mostró signos de condensación. Del mismo modo, el trazado electrocardiográfico en reposo no evidenció alteraciones relevantes.
La ecocardiografía transesofágica reveló compromiso valvular mitral y aórtico caracterizado por vegetaciones en la valva anterior de la válvula mitral (superficie auricular y ventricular del segmento A2) y aneurisma de 1,6 x 1,3 cm perforado (0,7 cm) que condicionaba insuficiencia severa. Asimismo, en la válvula aórtica se encontraron múltiples vegetaciones en las tres valvas; la más grande de 0,9 cm, regurgitación severa y flujo compatible con perforación de la valva semilunar posterior (figura 1 y figura 2).
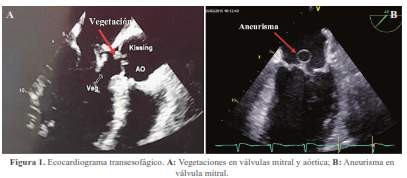
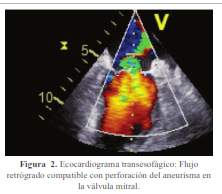
En los hemocultivos se aisló Streptococcus gordonnii. Adicionalmente la resonancia magnética lumbosacra mostró osteomielitis vertebral de L4-L5 (figura 3).
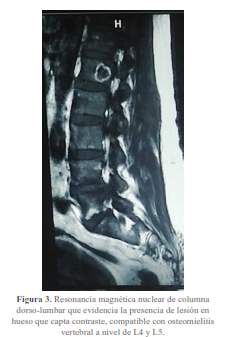
Durante el acto quirúrgico se confirmaron los hallazgos antes señalados y se procedió con el reemplazo bivalvular aórtico y mitral con el implante de prótesis mecánicas.
DISCUSIÓN
Se han identificado más de 30 subespecies de estreptococos del grupo viridans (SGV), siendo uno de ellos el grupo Mitis (6). Dentro del grupo Mitis tenemos al Streptococcus gordonii, el cual contiene genes que contribuyen a desarrollar factores importantes para la patogénesis de la EI (2,3). Estos factores favorecen la adherencia bacteriana a la superficie de las válvulas cardiacas, con la subsecuente formación de vegetaciones macroscópicas y daño endotelial (7).
A diferencia del grupo de Streptococcus anginosus o S. milleri, el S. gordonii del grupo Mitis, no tiene la tendencia a formar abscesos, fístulas y focos de infección metastásicos dentro del corazón o en regiones extra cardiacas en los pacientes con EI (5). Por lo tanto, se reporta uno de los primeros casos, en el cual un paciente con vegetaciones de S. gordonii en la válvula mitral y aórtica se complicó con perforación de la válvula mitral y formación de focos sépticos extra cardiacos.
La EI se asocia con una amplia variedad de complicaciones. Dentro de las principales, tenemos las complicaciones cardiacas como insuficiencia cardiaca, abscesos perivalvulares, fístulas intracardiacas, aneurismas, infartos o perforación. Además, se puede presentar la embolia séptica, accidente cerebrovascular embolico, infarto o absceso renal, osteomielitis vertebral, artritis séptica, entre otros (8,9).
Los abscesos perivalvulares pueden llegar a duplicar el riesgo de embolización y aumentar la mortalidad de 14% a 23% (10,11). La incidencia de fistula intracardiaca se encontró en 1,6% en un estudio descriptivo realizado en España (12). La insuficiencia cardiaca es la indicación de cirugía más común en pacientes con EI, además es la causa más común de muerte por EI en nuestra era (13). La embolia séptica con secuela clínica se observa entre 13 y 44% de pacientes con EI (13), y es más común en los que tienen una vegetación mitral, una vegetación mayor a 15 mm, EI por un agente fúngico o S.aereus y alguna otra patología que predisponga a hipercoagulabilidad (13,14). Dentro de todas las complicaciones, en el caso reportado se presenta un aneurisma complicado con una fístula en la válvula mitral.
La cirugía está indicada en 40 a 50% de pacientes con EI y si el paciente presenta complicaciones propias de la endocarditis (6). Las complicaciones en la EI se presentan en 10 a 30% en la válvula nativa (15). Entre las principales complicaciones de la EI que tienen indicación quirúrgica están: insuficiencia cardiaca (IC), infección no controlada y embolia sistémica, y además en pacientes con bloqueo cardiaco, absceso anular o aórtico, o lesiones destructivas penetrantes (se considera la dehiscencia valvular, rotura y fístula) (13,16). Asimismo, el tiempo de la intervención quirúrgica es esencial para prevenir las complicaciones embolicas, con un mayor beneficio durante las dos primeras semanas de tratamiento antibiótico cuando el riesgo embolico alcanza su máximo nivel (13). Debe realizarse cirugía urgente a los pacientes con insuficiencia aórtica o mitral grave y grandes vegetaciones, incluso en ausencia de IC (13), por ello se justificaba la cirugía de nuestro paciente por presentar insuficiencia severa en válvulas aórtica y mitral.
Diferentes estudios demuestran que la cirugía temprana en endocarditis de válvula nativa se asocia con una ventaja significativa de la mortalidad hospitalaria en comparación con el tratamiento médico (17).
Un estudio retrospectivo, descriptivo, mostró el beneficio de la cirugía en pacientes con diagnóstico definitivo de EI y fístula aorto-cavitaria documentada (18). Se apoya el concepto que la formación de una fístula intracardiaca debe ser una fuerte indicación para tratamiento quirúrgico. Se ha informado que la intervención quirúrgica temprana antes del desarrollo de IC mejora los resultados del paciente, aunque no existen datos respecto al momento exacto de la cirugía. En algunos casos los beneficios relativos de la reparación quirúrgica deben considerarse frente al riesgo de las técnicas quirúrgicas reconstructivas complejas. Pequeñas fístulas que pueden tener poco efecto sobre la hemodinámica y, en casos seleccionados con muy alto riesgo quirúrgico, el tratamiento conservador puede ser contemplado (18).
REFERENCIAS BIBLIOGRÁFICAS
1. Baddour L, Wilson W, Bayer A, Fowler V, Tleyjeh I, Rybak M. Infective endocarditis in adults: Diagnosis, antimicrobial therapy, and management of complications. Rev Circulation. 2015; 132(15):1435-1486. [ Links ]
2. Mann D, Zipes D, Libby P, Bonow R. Braunwald, Tratado de Medicina, Texto de medicina cardiovascular. Philadelphia: Elsevier; 2015. [ Links ]
3. Murdoch DR, Corey GR, Hoen B. Clinical presentation, etiology and outcome of infective endocarditis in the 21st century: The International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med. 2009; 169(5):463-473. [ Links ]
4. Rasmussen L, Dargis R, Christensen J, Skovgaard O, Nielsen X. Draft genome sequence of type strain Streptococcus gordonii ATCC 10558. Genome Announcements. 2016; 4(1):e01745-15. [ Links ]
5. Yombi J, Belkhir L, Jonckheere S, et al. Streptococcus gordonii septic arthritis: two cases and review of literature. BMC Infectious Diseases. 2012; 12(1):215. [ Links ]
6. Montes M, García J. Género Streptococcus: una revisión práctica para el laboratorio de microbiología. Enferm Infecc Microbiol Clin. 2007; 24(3):14-20. [ Links ]
7. Xiong Y, Bensing B, Bayer A, Chambers H, Sullam P. Role of the serine-rich surface glycoprotein GspB of Streptococcus gordonii in the pathogenesis of infective endocarditis. PLoS ONE. 2008; 45(4):297-301. [ Links ]
8. Hoen B, Duval X. Infective endocarditis. N Engl J Med. 2013; 369(8):764-785. [ Links ]
9. Baddour LM, Wilson WR, Bayer AS. Endocarditis infecciosa en pacientes adultos: Diagnóstico, Tratamiento antimicrobiano, y Gestión de las complicaciones; Una Declaración Científica para Profesionales de la Salud de la Asociación Americana del Corazón. Circulation. 2015; 132(15):1435. [ Links ]
10. Daniel WG, Mügge A, Martin RP, et al. Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography. N Engl J Med. 1991; 324(12):795. [ Links ]
11. Omari B, Shapiro S, Ginzton L, Robertson JM, Ward J, Nelson RJ, Bayer AS. Predictive risk factors for periannular extension of native valve endocarditis: Clinical and echocardiographic analyses. Chest. 1989; 96(6):1273. [ Links ]
12. Anguera I, Miro J, Vilacosta I. Aorto-cavitary fistulous tract formation in infective endocarditis: clinical and echocardiographic features of 76 cases and risk factors for mortality.European Heart Journal. 2005; 26: 288–97. [ Links ]
13. Habib G, Lancellotti P, Antunes MJ et al. 2015 ESC Guidelines for the management of infective endocarditis. European Heart Journal. 2015; 36 3075-3128. [ Links ]
14. Snygg-Martin U, Gustafsson L, Rosengren L, et al. Cerebrovascular complications in patients with left-sided infective endocarditis are common: a prospective study using magnetic resonance imaging and neurochemical brain damage markers. Clin Infect Dis. 2008; 47(1):23. [ Links ]
15. Lopez J, Revilla A, Villacosta I, et al. Age-dependent profile of left-sided infective endocarditis: A three center experience. Circulation. 2010; 121(7):892-7. [ Links ]
16. Habib G, Lancellotti P, Antunes M, et al. Comentarios a la guía ESC 2015 sobre el tratamiento de la endocarditis infecciosa. Rev Esp Cardiol. 2016;69(69):1-49. [ Links ]
17. Lalani T, Cabell C, Benjamin D, et al. Analysis of the impact of early surgery on in-hospital mortality of native valve endocarditis: Use of Propensity Score and instrumental variable methods to adjust for treatment selection bias. Circulation.2010; 121(8):1005–1013. [ Links ]
18. Anguera I, Miro JM, Vilacosta I, et al. Aorto-cavitary fistulous tract formation in infective endocarditis: clinical and echocardiographic features of 76 cases and risk factors for mortality. Eur Heart J. 2005; 26:288–97. [ Links ]
Declaración de financiamiento y de conflicto de intereses: Los autores declaran no tener conflicto de intereses. El estudio ha sido financiado por los autores.
Contribución de autoría: KB, HP, FG, KL, BR y FM: Descripción y discusión del caso; redacción del artículo.
Correspondencia:
Katia del Pilar Baca Mendo
Av. Brasil 2377 ap 301.Lima, Perú.
E-mail: katia.baca.m@upch.pe
Recibido: 04/05/2016
Aceptado: 26/12/2016













