Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130X
Rev Med Hered vol.28 no.2 Lima Apr./Jun. 2017
http://dx.doi.org/https://doi.org/10.20453/rmh.v28i2.3112
REPORTE DE CASO
Fiebre amarilla y disfunción multiorgánica. Reporte de tres casos
Yellow fever and multi organ dysfunction. Report of three cases
Jaime Zegarra 1,a, Mónica Meza 1,a, Carla Cornejo 1,a, Willy Porras 1,a, Alfredo Díaz 1,a, Omar Heredia 1,a, Wilson Rojas 1,a, Luis Granados 1,a,b, Eva Campos 1,a, Samuel Cosme 1,a, Pedro Mayma 1,a, Marco Delgado 1,a, Ivan Canchos 1,a, José Castillo 1,a, Denny Matzunaga1,a, Luis Umezawa1,a, Greta Chiquinta 1,a, Diana Fernández1,a, Diana Callo 1,a, Erika Rojas 1,c, Yesenia Beramendi 1,c, María Isabel Sotelo 1,c, Vanessa Saavedra 1,c, Gabriela Bejarano1,c, Víctor Ramírez 1,c, Antonio Hernández 2,d
1 Unidad de Cuidados Intensivos, Hospital Nacional Cayetano Heredia. Lima, Perú.
2 Departamento de Medicina, Hospital Nacional Cayetano Heredia. Lima, Perú.
a Médico Asistente; b Jefe de la Unidad; c Médico Residente; d Jefe del Departamento.
RESUMEN
Fiebre amarilla es una enfermedad viral aguda causada por un virus de la familia Flaviviridae transmitida por vectores, caracterizada por síndrome ictérico febril hemorrágica y que puede cursar con disfunción multiorgánica, con alta mortalidad. Se reportan tres casos de pacientes que viajaron a La Merced, Chanchamayo, que cursaron con síndrome ictérico febril hemorrágico con disfunción multiorgánica, con diagnóstico serológico de fiebre amarilla; uno sobrevivió y dos fallecieron.
PALABRAS CLAVE: Fiebre amarilla, síndrome, ictericia, fiebre, hemorragia. (Fuente: DeCS BIREME).
SUMMARY
Yellow fever is a vector-borne disease caused by a virus of the Flaviviridae family that is characterized by fever and jaundice that may progressed to multi organ failure with high associated mortality. We report three cases of patients who had travelled to La Merced, Chanchamayo who presented with multi organ failure with confirmed serology for yellow fever, one survived and the other two died.
KEYWORDS: Yellow fever, hemorrhagic fever, syndrome, jaundice. (Source: MesH NLM).
INTRODUCCIÓN
Fiebre amarilla es una enfermedad viral aguda causada por un virus de la familia Flaviviridae, trasmitida por vectores, la urbana por Aedes aegypti y la selvática por Haemagoggus sp y Sabethes sp; es endémica en áreas tropicales de África y Sudamérica; en nuestro país existen sitios endémicos de donde se reportan casos (1,2).
La enfermedad luego de un periodo de incubación de 3 a 6 días pasa por un periodo de infección, remisión y el 15% pueden desarrollar la fase de intoxicación la cual se caracteriza por disfunción hepática, renal, sangrado y choque con una tasa de mortalidad de 20 a 50% (2).
Se reportan tres casos de pacientes que luego de viajar a la ciudad de La Merced, Chanchamayo, cursaron con síndrome ictérico febril hemorrágico, con disfunción multiorgánica e hipertensión intracraneal; el diagnóstico de fiebre amarilla fue por serología, uno sobrevivió y dos fallecieron.
Debido al impacto epidemiológico, clínico y a la alta mortalidad de los pacientes con fiebre amarilla en disfunción multiorgánica se decidió reportar los casos para resaltar la gravedad de la misma y las estrategias de manejo intensivo realizadas.
PRESENTACIÓN DE LOS CASOS
Caso 1
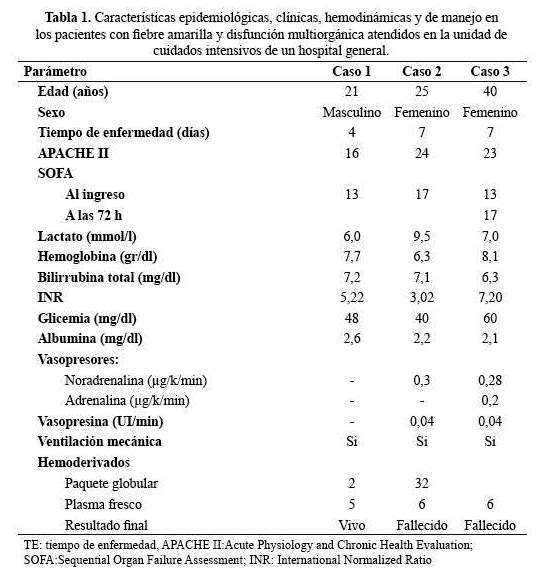
Varón de 21 años viajó a La Merced, Chanchamayo por una semana, ingresó al servicio de emergencia del Hospital Cayetano Heredia (HNCH) con tiempo de enfermedad (TE) de 4 días caracterizado por cefalea, fiebre, mialgias; seguida de vómitos, hematemesis, dolor abdominal, coluria, oliguria. Al examen físico tuvo PA: 100/70mmHg, FC: 80 x min., FR: 22 x min., SatO2: 96%, T 38°C; palidez, ictericia, petequias, hepatomegalia, dolor abdominal en cuadrante superior derecho, Glasgow 14.
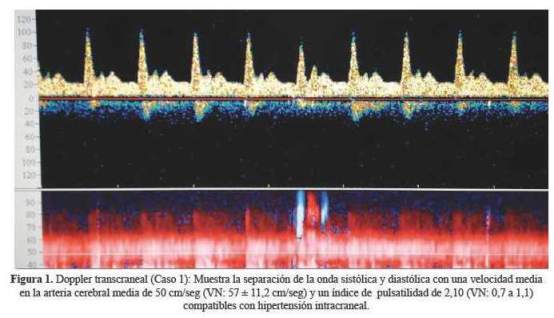
A las 10 horas cursó con alteración del sensorio y disnea, la glicemia capilar fue 48 mg/dl, gases arteriales: pH: 7,2 PCO2: 18 PO2: 63 HCO3: 9, SatO2 86%; PaO2/FiO2: 126; lactato 6 mmol/l; urea 139 mg/dl, creatinina 9 mg/dl, INR 5,22; bilirrubina total 7,2 mg/dl, TGP 8989. Al ingreso a la unidad de cuidados intensivos (UCI) tuvo score APACHE II 16, SOFA 13 (tabla 1), recibió soporte ventilatorio, dextrosa 33% 5 ampollas en bolo seguido de dextrosa 10% en infusión, N-acetil cisteína en infusión, bicarbonato de sodio; vitamina K; hemodiálisis; plasma fresco congelado, paquete globular. Evolucionó con sangrado activo múltiple, anuria y mayor alteración del sensorio; la tomografía (TEM) mostró edema cerebral y el Doppler mostró hipertensión intracraneal con índice de pulsatilidad (IP) 2,1 – 2,9 y velocidad media (VM) 30 – 50 cm/s en la arteria cerebral media (figura 2), recibiendo osmoterapia y neuroprotección total. Cursó con traqueo bronquitis nosocomial por Acinetobacter sp., recibiendo tratamiento con colistina: El sangrado activo cesó progresivamente, mejoró el sensorio, fue extubado y salió de alta de UCI y del hospital.
En los exámenes de laboratorio, la gota gruesa (x3), BK en secreción bronquial (x3), hemocultivo (x5) y urocultivo fueron negativos. La serología ELISA IgM para Fiebre amarilla fue positiva y la serología para Dengue, leptospirosis, riketsia, negativos.
Caso 2
Mujer de 25 años viajó a La Merced, Chanchamayo por 2 semanas, ingresó por emergencia del HNCH con TE de 7 días caracterizado por fiebre, cefalea, mialgias; con serología (-) para dengue; en la evolución cursó con dolor abdominal, ictericia, oliguria, alteración del sensorio. Al examen clínico PA: 120/60 mm Hg, FC: 80 x min., SatO2: 96%, T 38°C; Glasgow 14; ictericia, palidez, hepato-esplenomegalia; los exámenes de laboratorio mostraron: INR 3,02, urea 138 mg/dl, creatinina 8,8 mg/dl, TGP 6301, bilirrubina total 7,1 mg/dl, análisis de gases arteriales: pH: 7,3, P02: 93, PaCO2: 13, HCO3: 8,5; satO2: 96%, lactato 9,5 mmol/l, glicemia capilar 40 mg/dl; evolucionó con mayor alteración del sensorio, insuficiencia respiratoria y choque.
Al ingreso a UCI tuvo APACHE II 24, SOFA 17 (Tabla 1), recibiendo soporte ventilatorio, noradrenalina 0,3 ug/kg/min más vasopresina 0,04 U/min; hemodiafiltración; dextrosa al 33% en bolo, N-acetilcisteina en infusión; cursó con sangrado activo múltiple; con deterioro severo del sensorio, gran edema cerebral y hematoma subdural izquierdo espontaneo según la TEM, hipertensión intracraneal por Doppler con IP: 4,4 y VM 18 – 25 cm/seg en la arteria cerebral media, recibiendo osmoterapia, coma barbitúrico y neuroprotección total, sin mejoría. Falleció al cuarto día del ingreso a UCI en falla multiorgánica, choque vasodilatado e hipoxemia refractaria. La serología (IgM) para fiebre amarilla fue positiva.
Caso 3
Mujer de 40 años procedente de La Merced, Chanchamayo ingresó por emergencia con TE de 7 días caracterizado por cefalea, mialgias, fiebre, vómitos, dolor abdominal, ictericia, coluria, oliguria y alteración del sensorio. Al examen PA: 90/70 mm Hg, FC: 78 x min, FR: 22 x min, SatO2: 96%, T: 37,2°C; ictericia marcada, palidez, abdomen distendido doloroso, con hepatomegalia, Glasgow 14; glicemia 60 mg/dl, urea 59 mg/dl, creatinina 2,3 mg/dl, INR 7,2, TGP 1334, bilirrubina total 6,3 mg/dl, lactato 7 mmol/l.
Al ingreso a UCI tuvo APACHE II 23, SOFA 13 (Tabla 1); cursó con mayor deterioro del sensorio, acidosis metabólica, oliguria e hipertensión intracraneal por Doppler transcraneal, recibiendo osmoterapia, neuroprotección total, soporte ventilatorio; asimismo, presentó crisis hipertensiva reactiva transitoria con presión arterial media (PAM) > 130 mm Hg, con deterioro subsecuente, mayor alteración del sensorio, convulsiones tónico clónicas generalizadas, paro cardio-respiratorio por dos minutos, choque vasodilatado que requirió el uso de noradrenalina, adrenalina y vasopresina a dosis máximas. Además, sangrado activo múltiple, hipoxemia refractaria, y falla multiorgánica, falleciendo al quinto día de su ingreso a UCI. En los exámenes de laboratorio la serología (IgM) para fiebre amarilla fue positiva.
DISCUSIÓN
Fiebre amarilla es una enfermedad viral aguda causada por un virus de la familia Flaviviridae, un RNA virus de 40-60 nm; transmitida por vectores Aedes aegypti para la forma urbana, Haemagogus sp y Sabethes sp para la selvática (3-5).
Según la Organización Mundial de la Salud (OMS) en un reporte del 2014, cada año se producen 200 000 casos nuevos de fiebre amarilla y 30 000 muertes; en las Américas entre 1985 y 2012 el 95% de casos reportados fueron en el Perú 54%, Bolivia 18%, Brasil 16%, Colombia 7%; y del 2000 – 2013 se tuvo 1100 casos confirmados entre Brasil y Perú (4).
En el Perú los casos se relacionan a la migración de la población sin vacunación a zonas endémicas. Desde 1938 a la actualidad se han identificado cuencas hidrográficas de notificación de la enfermedad (2). En febrero del 2016 la Oficina General de Epidemiologia (OGE) reportó 2 casos de fiebre amarilla en La Merced, Chanchamayo. En este artículo se reportan tres casos de pacientes con síndrome ictérico febril hemorrágico y disfunción multiorgánica, que viajaron a La Merced, Chanchamayo, de los cuales uno sobrevivió y dos fallecieron. El paciente del caso 1 no requirió uso de vasopresores, tuvo score APACHE y SOFA menor, y menor compromiso neurológico que las pacientes de los casos 2 y 3. El mayor compromiso multiorgánico y mayor severidad del compromiso neurológico probablemente fueron factores asociados con la mortalidad en los casos 2 y 3.
El paciente del caso 1 cursó con traqueo bronquitis nosocomial por Acinetobacter, tal como se describe en los estudios estos pacientes están predispuestos a infecciones bacterianas (6,7).
Según los hallazgos en nuestros pacientes y los reportes de casos, luego de un periodo de incubación de 3 a 6 días, se desarrolla la infección viral aguda por 3 a 4 días, seguida de un periodo de remisión, y el 15% cursa con el estadio de intoxicación caracterizado por disfunción multiorgánica con mortalidad de 20 a 50% (1,2); este estadio se caracteriza por la liberación de citoquinas inflamatorias y síndrome de respuesta inflamatoria sistémica (SIRS) (6,7). El compromiso hepático es medio zonal por degeneración eosinofilica y cromatina nuclear condensada (cuerpos de councilman), y necrosis coagulada en el 80% de los casos fatales. El daño renal es por efecto viral directo y el estado de choque; la hemorragia está relacionada a trombocitopenia, coagulación intravascular diseminada (CID), y falla de factores vitamina K dependientes. La alteración del sensorio es de grado variable desde delirio hasta coma, relacionada a hemorragias perivasculares microscópicas, con edema cerebral e hipertensión intracraneal tal como presentaron nuestros tres pacientes (7).
El diagnóstico en los casos presentados fue epidemiológico, clínico y serológico con Elisa IgM positivo; los estudios sugieren adicionalmente reacción de cadena de la polimerasa (PCR), aislamiento viral en los tejidos e inmunohistoquimica.
El tratamiento es de soporte y manejo intensivo, no existe tratamiento antiviral específico. La ribavirina puede usarse en fiebre amarilla; sin embargo, se requiere concentraciones muy altas que usualmente no se alcanzan (8).
La vacunación para fiebre amarilla es muy importante, la misma se realiza con virus vivos atenuados, en dosis única intramuscular, y está dirigida a personas inmunocompetentes mayores de 9 meses y menores de 60 años, que viven en zonas endémicas de la enfermedad, a quienes viajan a dichas zonas y para prevenir la propagación internacional (9).
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Panamericana de la Salud, Organización Mundial de la Salud. Pequeñas picaduras grandes amenazas. Washington: Organización Panamericana de la Salud; 2014. [ Links ]
2. Espinoza M, Cabezas C, Ruiz J. Un acercamiento al conocimiento de la fiebre amarilla en el Perú. Rev Peru Med Exp salud publica. 2005; 22(4):308-315. [ Links ]
3. Robertson SE, Hull BP, Tomori O, Bele O, LeDuc JW, Esteves K. Yellow fever: a decade of reemergence. JAMA. 1996; 276(14):1157. [ Links ]
4. Vasconcelos PF, Bryant JE, da Rosa TP, Tesh RB, Rodrigues SG, Barrett AD. Genetic divergence and dispersal of yellow fever virus, Brazil. Emerg Infect Dis. 2004; 10(9):1578. [ Links ]
5. Monath TP, Barrett AD. Pathogenesis and pathophysiology of yellow fever. Adv Virus Res. 2003; 60:343. [ Links ]
6. terMeulen J, Sakho M, Koulemou K, et al. Activation of the cytokine network and unfavorable outcome in patients with yellow fever. J Infect Dis. 2004; 190(10):1821. [ Links ]
7. Centers for Disease Control and Prevention. Fatal yellow fever in a traveler returning from Amazonas, Brazil, 2002. MMWR Morb Mortal Wkly Rep. 2002; 51(15):324. [ Links ]
8. Monath TP. Treatment of yellow fever. Antiviral Res. 2008; 78(1):116. [ Links ]
9. Organización Mundial de la Salud . Documento de posición de la OMS junio 2013: Vacunas y vacunación contra fiebre amarilla. Ginebra: Organización Mundial de la Salud; 2013. [ Links ]
Declaración de financiamiento y de conflictos de intereses: El trabajo fue financiado por los autores, quienes declaran que no existen conflictos de interés.
Contribución de autoría: ER, YB, MIS, VS, GB, VR: Obtención de la información de cada caso; JZ, MM, CC, WP, AD,OH, WR, LG, EC, SC, PM, MD, IC, DM, LU, GCh, DF, DC: Resumen de los casos y discusión; LG, AH:Revisión y sugerencia de la presentación.
Correspondencia:
Jaime Zegarra Piérola
Recibido: 08/09/2016
Aceptado: 28/03/2017













