Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered vol.28 no.3 Lima jul./set. 2017
http://dx.doi.org/https://doi.org/10.20453/rmh.v28i3.3186
https://doi.org/10.20453/rmh.v28i3.3186
REPORTE DE CASO
Síndrome hemofagocítico secundario a infección por Citomegalovirus post trasplante renal. Reporte del primer caso en Perú
Hemophagocytic syndrome due to cytomegalovirus infection after renal transplantation. First report in Peru
Liliana Gonzales-Hamada 1, Liliana Fernández Anticona 2, Carlos Molina Bellido 1, Wilmer Bacilio Calderón 1
1 Servicio de trasplante renal, Hospital Nacional Guillermo Almenara. Lima, Perú.
2 Servicio Nefrología, Complejo Hospitalario Alberto Barton. Callao, Perú.
RESUMEN
Se presenta el caso de una paciente trasplantada renal de 60 años, quien presentó síndrome hemofagocítico secundario a infección por Citomegalovirus (CMV). La presentación clínica fue inespecífica con fiebre, bicitopenia, niveles altos de ferritina, hepatoesplenomegalia y hemofagocitósis confirmada por aspirado de médula ósea; evoluciono a shock séptico, siendo trasladada grave a la Unidad de cuidados intensivos, respondiendo favorablemente luego de 3 semanas de tratamiento antibiótico con meropenen, vancomicina, retiro de inmunosupresores, ganciclovir, caspofungina, y metilprednisolona. Cursó durante toda su complicación con función renal normal. En Perú no se ha descrito algún caso de síndrome hemofagocítico secundario a infección por Citomegalovirus en un paciente trasplantado renal, por lo que consideramos importante su difusión. Es importante la sospecha precoz de esta patología, ya que la mortalidad es alta llegando al 50% y la evolución depende de un tratamiento adecuado y temprano, tal como sucedió con nuestra paciente.
PALABRAS CLAVE: Linfohistiocitosis hemofagocítica, citomegalovirus, trasplante de riñón. (Fuente: DeCS BIREME).
SUMMARY
We report the case of a 60-year-old female renal transplant patient who presented with an hemophagocytic syndrome due to cytomegalovirus infection. Clinical presentation was non-specific with fever, bicytopenia, high ferritin levels, visceromegaly and hemophagocytosis documented in a bone marrow aspiration. The patient progressed to septic shock for which was transferred to the ICU where she recovered uneventfully after 3 weeks of treatment that included meropenem, vancomycin, suspension of immunosuppressive drugs, ganciclovir, casponfungin and methylprednisolone. Renal function was not altered throughout. This is the first report of this condition in Peru. Early suspicion is paramount as mortality is high and prognosis depends on early initiation of treatment as in this patient.
KEYWORDS: Lymphohistiocytosis hemophagocytic, cytomegalovirus, kidney transplantation. (Source: MeSH NLM).
INTRODUCCIÓN
El síndrome hemofagocítico, también conocido como linfohistiocitosis hemofagocítica es una entidad clínico patológica multicausal, poco frecuente caracterizada por una excesiva activación de los macrófagos y liberación descontrolada de citoquinas por los linfocitos T (1). Se ha descrito una forma primaria familiar y varias secundarias, relacionadas con procesos infecciosos, neoplásicos y autoinmunitarios. El cuadro clínico se caracteriza por una inflamación desproporcionada que produce fiebre, esplenomegalia, bicitopenia, hipertrigliceridemia o hipofibrinogenemia, hiperferritinemia, actividad Natural Killer disminuida o ausente, CD25 soluble elevada y hemofagocitósis en médula ósea, bazo o ganglio linfático (2).
Es importante la sospecha precoz de esta patología, ya que la mortalidad es alta y la evolución depende de un manejo adecuado y a tiempo. En el Perú no se ha descrito otro caso de síndrome hemofagocítico secundario a virus, en un paciente trasplantado renal, por lo que consideramos importante su difusión; para tener esta entidad siempre presente en un paciente trasplantado renal con fiebre y anormalidades hematológicas.
PRESENTACIÓN DEL CASO
Mujer de 60 años, religiosa de claustro, con enfermedad renal crónica secundaria a Poliquistosis renal del adulto, en hemodiálisis por dos años, trasplantada renal de donante cadavérico, HLA compatible, PRA clase I: 11% y clase II: 17%. PPD reactivo 14 mm; IgG CMV Donante D (+) / Receptor R (+), IgG Epstein Barr Virus: Donante (+) / Receptor (+) y marcadores de hepatitis viral negativos; inmunosupresión de mantenimiento con tacrolimus, micofenolato mofetilo y prednisona, según protocolo del Servicio de trasplante renal del Hospital Nacional Guillermo Almenara Irigoyen (HNGAI), saliendo de alta al 7º día post trasplante con función renal normal. Al mes post trasplante presentó fiebre de 38,5ºC, dolor abdominal tipo retortijón, diarrea (4 deposiciones/día, durante 7 días), deshidratación severa y compromiso hemodinámico.
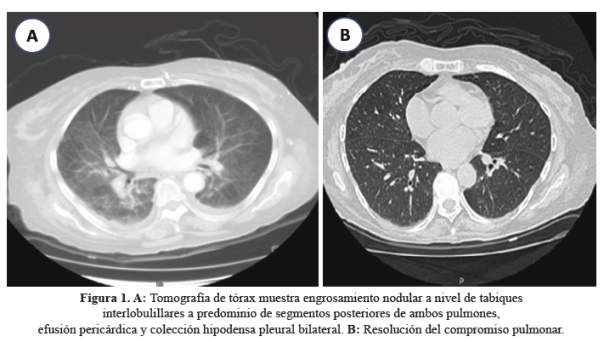
Al examen físico se encontró hepatoesplenomegalia y adenopatías. Los exámenes auxiliares mostraron: leucocitos 1930 x mm3, hemoglobina 8,7g/dl; LDH 547 IU/l; ferritina 1412 ng/ml; triglicéridos 54 mg/dl; albumina 2,7 g/dl; fosforo 1,3 mg/dl, GGTP 31 U/l; TGO y TGP < 20 U/l; fosfatasa alcalina 55 U/l; creatinina 1,1 mg/dl, GFR en 74 ml/min/1,73 m2; urea 20 mg/dl, sodio sérico 123,9 mEq/l; dosaje de hormonas tiroideas normales; hemocultivos, urocultivos, mielocultivo negativos, parasitológicos seriados, estudio LCR: cultivo y tinta china; negativos. La carga viral CMV fue 105,909 copias/ml. La tomografía de cerebro fue normal y la tomografía de tórax mostró engrosamiento nodular a nivel de tabiques interlobulillares a predominio de segmentos posteriores de ambos pulmones (Tabla 1).
El tratamiento inicial fue con metronidazol y reto de fluidos, presentó hiponatremia persistente (< 125 mEq/l) a pesar tratamiento EV y manejo intensivo del medio interno; y además, presentó síndrome convulsivo, evolucionando tórpidamente a shock séptico siendo transferida a la unidad de cuidados intensivos. Se indicó retiro de inmunosupresores y se amplió cobertura antibiótica con meropenem 1 g c/8 h por 10 días, vancomicina 750 mg c/12h por 10 días; metilprednisolona, caspofungina 50 mg/día y ganciclovir 250 mg c/12h hasta el alta, continuando con valganciclovir 900 mg/d por 3 meses.
En el estudio del aspirado de médula ósea se observó celularidad incrementada 70%; relación M/E: 3/1; serie eritroide con maduración megaloblástica; serie mieloide y megacariocítica adecuada, sin patología; no se observaron células ajenas a médula ósea; incremento de células plasmáticas en 5%, e incremento de histiocitos y hemofagocitosis. El estudio de sangre periférica mostró granulaciones tóxicas y acantosis.
La evolución fue favorable, a las tres semanas de iniciado el tratamiento mencionado había desaparecido la fiebre y diarrea, con recuperación de la encefalopatía sin secuelas, y resolución del compromiso pulmonar, evidenciado por las imágenes (figura 1). El sodio sérico se corrigió progresivamente, así como el conteo de leucocitos, buena función del injerto renal, sin proteinuria. Salió de alta luego de 40 días de hospitalización. Actualmente su condición permanece estable con función renal normal.
DISCUSIÓN
Descrito inicialmente por Chandra et al., (3) en 1975, en una población adulta, no fue hasta 1979 cuando Risdall et al (4), informaron sobre 19 pacientes con síndrome hemofagocítico reactivo; de ellos, 13 eran receptores de trasplante renal. Desde entonces, se han descrito varios casos en trasplante de órganos y receptores de médula ósea.
La serie más grande fue reportada por Karras et al., (5), presentando 17 casos entre 4 230 receptores de trasplante renal, resultando una prevalencia estimada del 0,4%; su patogénesis es poco entendida.
El síndrome hemofagocítico se presenta más a menudo en las primeras semanas después del trasplante, pero en algunos pacientes ocurrió años después del trasplante, particularmente cuando fue causado por infección o neoplasia.
La mayoría de los casos se asociaron con infección viral causada por citomegalovirus, adenovirus, virus de Epstein-Barr, virus del herpes humano 8, HHV-6, parvovirus B19 o incluso por BK polioma virus (6).
El desarrollo de este síndrome es probablemente debido a un trastorno inmunológico que resulta en activación incontrolada de los linfocitos T siendo la anormalidad inmunológica más frecuente la alteración global de la función citotóxica. Por otro lado, la función de las células NK está marcadamente disminuida o ausente y la actividad citotóxica de los CD8+ también es defectuosa (7).
Una de las hipótesis es que existiría un defecto en la regulación de la respuesta inflamatoria e inmune, más específicamente, que las células NK y los linfocitos T citotóxicos no destruyen las células infectadas y, por tanto, no eliminan la fuente de estimulación antigénica. Dicha estimulación persistente del antígeno, conduciría a su vez, a la activación y proliferación persistentes de células T asociadas con la producción escalonada de citoquinas que estimulan a los macrófagos (8,9).
La presentación clínica es pleomorfa, aunque siempre dominada por los síntomas y signos de infección, en muchos casos se asocia con infecciones virales, bacterianas y neoplasias; sin embargo, en el 20% de los casos, su etiología no se logra identificar (10). En la literatura disponible, se encontró que 40 de 76 (53%) receptores de trasplante renal con síndrome hemofagocítico, fallecieron (4).
El caso reportado cumplió con 5 de los 8 criterios diagnósticos necesarios para síndrome hemofagocítico: Fiebre, bicitopenia, hiperferrinemia, hepatoesplenomegalia, hemofagocitosis confirmada por aspirado de médula ósea (Tabla 1). Además, cursó con disfunción neurológica, síntomas gastrointestinales, adenopatías, hiponatremia, LDH incrementada con alteración de enzimas hepáticas (11). El diagnostico se realizó en base a criterios clínicos y de laboratorio, aspirado de medula ósea, PCR CMV.
Una vez establecido el diagnostico, se recomienda reducir o suspender los anticalcineurinicos, inhibidores mTOR y micofenolato mofetilo a fin de controlar la infección por citomegalovirus (12,13). La metilprednisolona EV puede reducir la activación de macrófagos y citoquinas.
En nuestra paciente, el agente que modificó y alteró la respuesta inmune fue el citomegalovirus que como sabemos es un virus inmunomodulador. Se ha encontrado también que la infección activa por CMV es un factor de riesgo independiente para el desarrollo de otras complicaciones infecciosas, tales como bacteriemia, enfermedad fúngica invasiva y enfermedad linfoproliferativa post trasplante (PTLD) relacionada con EBV. CMV también ha sido implicado como causa de lesión aguda y crónica del aloinjerto. Existen pruebas que el CMV puede desempeñar un papel crucial en la vasculopatía crónica del injerto, lo que resulta en lesiones, como la nefropatía crónica del aloinjerto, la bronquiolitis obliterante (trasplante de pulmón) y la coronariopatía acelerada (trasplante de corazón) (14).
Los efectos indirectos de la infección por CMV son debidos a la interacción entre el CMV y la respuesta inmune del paciente; aunque se ha discutido mucho sobre ello, se considera que pueden aparecer en pacientes con un nivel persistente de replicación viral de baja intensidad. En estos casos se produce disfunción de los mecanismos inmunomoduladores que producen una alteración del funcionamiento celular normal, sin llegar a tener un efecto citopático directo aumentando la vulnerabilidad frente a otras infecciones (15-17). En la paciente no se consideró profilaxis para CMV, por ser una paciente de riesgo intermedio, por lo que fue monitorizada con cargas PCR-CMV mensuales, siendo estas negativas hasta antes del evento; sin embargo, este virus se reactivó rápidamente, iniciándose todas las complicaciones mencionadas.
En la serie de Karras et al (5), 8/17 (47%) pacientes fallecieron, teniendo que realizar nefrectomía del injerto en 4 de los 9 sobrevivientes (44,4%).
El caso presentado tuvo una buena evolución con recuperación completa de las alteraciones producidas por el síndrome hemofagocítico y el CMV, debido a su diagnóstico temprano. Por lo que se recomienda siempre tener presente esta entidad clínicaa fin de iniciar tempranamente un adecuado tratamiento y mejorar su pronóstico.
REFERENCIAS BIBLIOGRÁFICAS
1.Dapena JL, Díaz de Heredia C, Bastida P, et al. Síndrome hemofagocítico: expresión de diversas entidades nosológicas. An Pediatr. 2009; 71(2):110-6. [ Links ]
2.Espinosa KA, Garcia P, Fossas D, León E. Síndrome hemofagocítico. Conceptos actuales Gaceta Médica de México. 2013;149:431-7. [ Links ]
3.Chandra P, Chaudery SA, Rosner F, et al. Transient histiocytosis with striking phagocytosis of platelets, leukocytes and erythrocytes. Arch Intern Med. 1975; 135:989-91. [ Links ]
4.Risdall RJ, McKenna RW, Nesbit ME, et al. Virus- associated hemophagocytic syndrome: a benign histiocytic proliferation distinct from malignant histiocytosis. Cancer. 1979; 44:993-7. [ Links ]
5.Karras A, Thervet E, Legendre C, et al. Hemophagocytic syndrome in renal transplant recipients: report of 17 cases and review of literature. Transplantation. 2004; 77:238–243. [ Links ]
6.Ponticelli C, Ornella A. Haemophagocytic syndrome–a life-threatening complication of renal transplantation. Nephrology Dial Transplant. 2009; 24:2623-2627. [ Links ]
7.Groma A, Mellins E. Macrophage activation syndrome: advances towards understanding pathogenesis. Curr Opin Rheumatol. 2010; 22:561-6. [ Links ]
8.Kagi D, Odermatt B, Mak TW. Homeostatic regulation of CD8+ T cells by perforin. Eur J Immunol. 1999; 29:3262-3272. [ Links ]
9.Verbsky JW, Grossman WJ. Hemophagocytic lymphohistiocytosis: diagnosis, pathophysiology, treatment, and future perspectives. Ann Med. 2006; 38:20-31. [ Links ]
10.Bea S, Beneyto I, Ramos D, et al. Cytomegalovirus- associated haemophagocytic syndrome in a kidney transplant patient. Nephrology. 2011; 31(2):236- 2383. [ Links ]
11.Henter J, Horne A, Aricó M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatric Blood and Cancer. 2007; 48(2):124-131. [ Links ]
12.de la Torre-Cisneros J, Fariñas MC, Castón JJ, et al. GESITRA-SEIMC/REIPI recommendations for the management of cytomegalovirus infection in solid-organ transplant patients. Enferm Infecc Microbiol Clin. 2011;29(10):735-58. [ Links ]
13.Aguado JM, Lumbreras C, Fortun J, et al. Impact of current transplantation management on the development of cytomegalovirus disease after renal transplantation. Clin Infect Dis. 2008; 47(7):875-82. [ Links ]
14.Humar A, Snydman D. Cytomegalovirus in Solid Organ Transplant Recipients. American Journal of Transplantation. 2009; 9(4):S78-S86. [ Links ]
15.Eid A, Brown R, Hogan W, et al. Kinetics of interferon-gamma producing cytomegalovirus (CMV)-specific CD4+ and CD8+ T lymphocytes and the risk of subsequent CMV viremia after allogeneic hematopoietic stem cell transplantation. Transplant Infectious Disease. 2009; 11(6):519-528. [ Links ]
16.Cummins NW, Deziel PJ, Abraham RS, Razonable RR. Deficiency of cytomegalovirus (CMV)-specific CD8 T cells in patients presenting with late-onset CMV disease several years after transplantation. Transpl Infect Dis. 2009; 11:20-7. [ Links ]
17.Tavera M, Petroni J, Leon L, et al. Reactive haemophagocytic syndrome associated with parvovirus B19 in a kidney-pancreas transplant patient. Nefrologia. 2012; 32(1):125-6. [ Links ]
Declaración de financiamiento y de conflictos de intereses:La publicación fue financiada por los autores, quienes declaran no tener conflictos de interés.
Contribución de autoría:LGH Redacción de la publicación; LFA recolección e interpretación de datos; CMB versión final de la publicación; WBC diseño de la publicación
Correspondencia:
Liliana Gonzales-Hamada
Calle Las Petunias 164 Urb. El Palmar Lima 33, Perú
Correo electrónico: lilianagonzales2000@gmail.com
Recibido: 07/03/2017
Aceptado: 12/06/2017













