Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered vol.28 no.3 Lima jul./set. 2017
http://dx.doi.org/https://doi.org/10.20453/rmh.v28i3.3187
https://doi.org/10.20453/rmh.v28i3.3187
REPORTE DE CASO
Tratamiento exitoso con los nuevos antivirales de acción directa en paciente infectado con el virus de la hepatitis C con fibrosis avanzada y dos recaídas previas. Reporte de caso
Successful treatment with new direct acting antiviral in an infected patient with hepatitis C virus with advanced liver fibrosis in a treatment experienced patient. Case report
Álvaro Bellido-Caparó 1, Mavel Rosado1, Jorge Espinoza-Ríos 1,2,a, Martin Tagle Arróspide 2,a;3.
1 Servicio de Gastroenterología, Hospital Cayetano Heredia. Lima, Perú.
2 Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Servicio de Gastroenterología, Clínica Anglo Americana. Lima, Perú.
a Profesor.
RESUMEN
El tratamiento del virus de la hepatitis C ha presentado grandes cambios en los últimos años. El esquema base utilizado era Interferón Pegylado y Ribavirina, con el que se lograba respuesta viral sostenida (RVS) de alrededor del 50%. Con la adición de los inhibidores de proteasa Telaprevir y Boceprevir al esquema “esqueleto” de Interferon Pegylado y Ribavirina, la tasa de RVS mejoró hasta valores cercanos a 70%; sin embargo, ocurren efectos colaterales importantes y difícil adherencia. Los nuevos antivirales de acción directa (AAD) (inhibidores de la polimerasa NS5A y NS5B), tienen altas tasas de RVS alcanzando valores mayores de 95% en los diferentes genotipos, en pacientes que recibieron tratamiento previo o no, incluyendo cirróticos. Se presenta el caso de un paciente que recibió dos esquemas terapéuticos previos y con fibrosis hepática avanzada que presentó RVS al ser tratado con los nuevos AAD (Sofosbuvir y Ledipasvir).
PALABRAS CLAVE: Hepatitis C, interferon pegylado, sofosbuvir, ledipasvir. (Fuente: DeCS BIREME).
SUMMARY
The treatment of hepatitis C virus utilized was Pegylated Interferon and Ribavirin, achieving a sustained virological response (SVR) of about 50 %. With the addition of the first-generation protease inhibitors Telaprevir and Boceprevir to the Pegylated Interferon/Ribavirin backbone the SVR rates rose up to approximately 70%, but with important side effects and a difficult adherence. The new direct acting antivirals (NS5A and NS5B polymerase inhibitors) improved SVR rates to 95 % or greater in the different genotypes, in the treatment-naive and treatment experienced patients including patients with cirrhosis. We report the case of a patient with advanced fibrotic stage, who failed to respond to 2 regimens and was subsequently treated with Ledipasvir/Sofosbuvir and achieved virogical cure.
KEYWORDS: Hepatitis C, Pegylated interferon, sofosbuvir, ledipasvir. (Source: MeSH NLM).
INTRODUCCIÓN
En el mundo, la infección por el virus de Hepatitis C (VHC) afecta a 170 millones de personas (1), seis millones de ellas están en Latinoamérica (2), y se calcula que en Perú existen alrededor de 300 000 pacientes infectados (3,4). Estas cifras pueden subvalorar el número real debido a la poca sintomatología y a la naturaleza crónica de la infección (5). Existen 7 genotipos conocidos del VHC, el genotipo más frecuente en Perú es el genotipo 1(3).
La importancia de la detección del VHC se relaciona con las complicaciones de este: la cirrosis hepática y el hepatocarcinoma (5), siendo el VHC en Perú la tercera causa de cirrosis hepática (3).
La eficacia del tratamiento del virus de la hepatitis C se monitoriza con la respuesta viral sostenida (RVS) definida como una carga indetectable de ARN del VHC a las 12 semanas de finalizado el tratamiento (6). En el caso de los pacientes cirróticos con RVS es importante indicar que se observa una regresión de la cirrosis y disminución de la fibrosis (7).
El tratamiento del VHC ha sido por muchos años el esquema con Interferón Pegylado Alpha 2-a y Ribavirina con RVS de 40-50 % en el genotipo 1; este esquema presenta múltiples efectos colaterales, alteraciones de laboratorio, además de ser un tratamiento de larga duración (5). En el 2011 en EEUU y en Perú en el 2013, al tratamiento con interferón Pegylado Alpha 2a y Ribavirina se añadió la terapia con los antivirales de acción directa (AAD) conocido así a los inhibidores de la proteasa NS3B/4A (Boceprevir y Telaprevir) los que mejoraron el porcentaje de RVS hasta en 70% aproximadamente (2); sin embargo, presentaron múltiples interacciones medicamentosas y aparición de nuevos efectos colaterales como anemia, rash, disgeusia entre otros (5).
A partir del 2014 con el uso de los nuevos antivirales de acción directa (AAD), los inhibidores de NS5A (Daclatasvir, Ledipasvir, Ombitasvir) y NS5B (Sofosbuvir), la tasa de RVS alcanza valores de 95-100% tanto en pacientes nuevos como en pacientes que recibieron terapia previa, en pacientes cirróticos y no cirróticos, razón por la cual se han convertido en el tratamiento de elección en las diferentes guías (6,8).
Se presenta el caso de un varón quien tuvo RVS después de 24 semanas de tratamiento con Sofosbuvir - Ledipasvir, luego de presentar dos recaídas después de recibir un tratamiento con Interferon Pegylado Alpha 2a + Ribavirina y un tratamiento con interferón Pegylado Alpha 2 a + Ribavirina y Boceprevir.
PRESENTACIÓN DEL CASO
Varón de 62 años, con antecedente de esplenectomía a los 17 años por un accidente de tránsito. El paciente recibió transfusiones sanguíneas en ese entonces, presumiéndose como fuente de adquisición del virus de la hepatitis C, la cual fue diagnosticada a los 46 años durante la evaluación de transaminasemia asintomática. En el examen físico tenía IMC 28 kg/m2 y lo demás no fue contributorio. En ese momento su evaluación incluyó una carga viral (HVC RNA) de 169 000 UI/ml copias, genotipo 1b y se le realizó biopsia hepática que mostró leve inflamación y no fibrosis (Metavir F0). Se inició tratamiento con interferón Pegylado Alpha 2a 180 mcg/semana + Ribavirina 1200 mg/día por 48 semanas con lo cual negativizó la carga viral (tabla 1).

A la edad de 51 años se le encontró una carga viral de 230 000 UI/ml y se realizó biopsia hepática encontrándose fibrosis (Metavir F1), decidiéndose observación. Cinco años después, tenía carga viral de HVC RNA 4 010 000 UI/ml copias y biopsia hepática con un grado mayor de fibrosis (Metavir F3), a pesar que el examen físico y auxiliares eran no contributorios (tabla 2), por lo que se decidió iniciar tratamiento con interferón Pegylado Alpha 2a 180 mcg/semana + Ribavirina 1200 mg/día como dosis de inducción durante 4 semanas, añadiéndose Boceprevir 800 mg cada 8 horas. Se administró el tratamiento durante 36 semanas, negativizando la carga viral a la semana 10 (tabla 1). Sin embargo, presentó efectos adversos como disgeusia, astenia, disminución de la libido y una anemia leve macrocítica normocrómica.
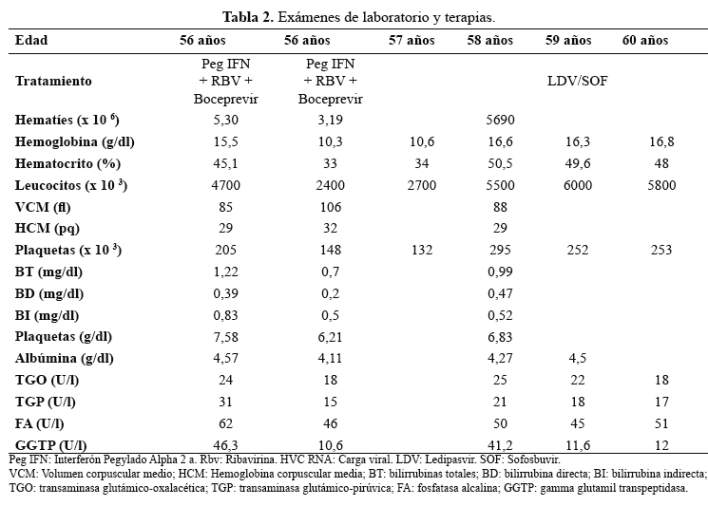
En su control a los 59 años, se evidenció carga viral HVC RNA en 5 870 000 UI/ml copias, por lo que se le realizó elastografía hepática (Fibroscan) con hallazgos (7,7 kpa), a pesar de su última biopsia hepática que mostraba fibrosis avanzada (Metavir F3). Por ello se le consideró como paciente con infección por virus de hepatitis C con falla de tratamiento en dos oportunidades, la segunda con inhibidor de proteasa (Boceprevir) y con fibrosis avanzada por lo cual se decidió iniciar terapia con Ledipasvir 90 mg + Sofosbuvir 400 mg por 24 semanas. Se le considera curado virológicamente con HVC RNA indetectable desde la semana 8 de tratamiento hasta el momento del reporte (24 meses aproximadamente). Durante los controles tanto el examen físico como los exámenes auxiliares no presentaron alteraciones (tabla 1 y tabla 2).
DISCUSIÓN
En el caso que presentamos podemos observar que la posible fuente de transmisión del virus de la hepatitis C fue la transfusión de hemoderivados, la que junto a la hemodiálisis y las intervenciones médicas ha sido identificada como uno de los principales factores de riesgo de transmisión en Perú, antes de que se implemente el tamizaje universal a los hemoderivados, el cual se implementó en EEUU a partir de 1999 (1,9,10). Como en la mayoría de casos de VHC el diagnóstico se realizó por presentar exámenes de rutina anormales (5), en nuestro caso la razón fue la evaluación de una transaminasemia asintomática. El tipo de genotipo que tenía nuestro paciente fue el 1b que es uno de los más frecuentes en nuestro país (3).
El tratamiento de la hepatitis C está indicado en pacientes con infección crónica por VHC, excepto en los que este condicionado el pronóstico a corto plazo y que no pueda ser remediado por trasplante hepático o alguna terapia (8). La terapia de erradicación del VHC tiene como objetivo disminuir la mortalidad y las complicaciones asociadas como el hepatocarcinoma y la cirrosis hepática (8).
La evaluación del estado de fibrosis de forma directa (biopsia) o indirecta (biomarcadores, o pruebas de elastografía) es importante para determinar el tipo de tratamiento más adecuado para el paciente (8). En ese sentido, el paciente inició tres años después de realizado el diagnóstico el esquema de Interferón Pegylado Alpha 2-a y Ribavirina durante 48 semanas, tratamiento estandarizado en ese momento para el tratamiento del VHC en paciente no cirrótico (5). Sin embargo, dos años después presentó su primera recaída y siete años después del primer tratamiento se utiliza el esquema con inhibidores de proteasa, recién aprobado por la FDA (5): Interferón Pegylado Alpha 2a más Ribavirina y Boceprevir, durante el cual presentó disgeusia, astenia, y anemia, como efectos colaterales.
Tres años después del segundo esquema de tratamiento, el paciente presentó nueva recaída (luego de haber recibido dos terapias previas una de ellas con inhibidor de proteasa), con una fibrosis avanzada (Metavir F3). Las mejores alternativas para este tipo de pacientes según lo publicado en la literatura son los nuevos antivirales de acción directa: Sofosbuvir 400 mg y Ledipasvir 90 mg, los que de acuerdo a lo encontrado en el estudio ION 2 en el cual se evaluaron pacientes con fibrosis avanzada o cirrosis compensada y con falla previa a interferón Pegyado Alpha 2-a más Ribavirina, se observó que el tratamiento por 24 semanas de Ledipasvir + Sofosbuvir sin Ribavirina tenía valores más altos de RVS que los tratamientos de 12 semanas de Ledipasvir + Sofosbuvir con o sin Ribavirina (11). Son precisamente los hallazgos de este estudio los que nos llevaron a escoger la terapia mencionada para el paciente.
Otro estudio que evaluó Sofosbuvir 400 mg y Ledipasvir 90 mg en pacientes cirróticos compensados que no respondieron al tratamiento de interferón Pegylado Alpha 2a con Ribavirina + Boceprevir es el estudio SIRIUS (12), donde la RVS fue similar en el tratamiento con Sofosbuvir + Ledipasvir con Ribavirina a 12 semanas (RVS 96%) y el tratamiento con Sofosbuvir + Ledipasvir 24 semanas. (RVS 97%). Otras alternativas son el uso de Elbasvir 50 mg/ Grazoprevir 100 mg por 12 semanas, o Sofosbuvir 400 mg/Velpatasvir 100 mg por 12 semanas recomendadas en la última versión de la guía de la Asociación Americana para el Estudio del Hígado y la Sociedad Americana de Enfermedades Infecciosas (8).
En el consenso nacional para el manejo de hepatitis C del 2016 se recomienda para pacientes con terapia previa y cirrosis compensada de genotipo 1b los siguientes esquemas: Ledipasvir 90 mg/Sofosbuvir 400 mg por 24 semanas (esquema que utilizó el paciente); Ledipasvir 90 mg/Sofosbuvir 400 mg más Ribavirina por 12 semanas; Paritaprevir 150 mg/Ritonavir 100 mg y Ombitasvir 25 mg más Dasabuvir 2 veces al día por 12 semanas; Simeprevir 150 mg/Sofosbuvir 400 mg por 24 semanas (9).
En Perú contamos actualmente con Simeprevir (inhibidor de proteasa NS3B/4A de segunda generación) que también puede ser utilizado con Interferón Pegylado Alpha 2a y Ribavirina pero cuyo uso está más orientado a la combinación con Sofosbuvir, además se cuenta con Daclatasvir y Asunaprevir. A nivel privado se cuenta con la combinación Ombitasvir + Paritaprevir/Ritonavir + Dasabuvir y probablemente al momento de la publicación de este reporte se contará ya con Sofosbuvir.
Existen pocos estudios de prevalencia en Perú, y se considera que hay un importante subdiagnóstico por lo que se debe instaurar un tamizaje en los pacientes en riesgo. Estamos en una nueva era del tratamiento de la hepatitis C en la cual existen altas tasas de RVS de hasta 95 a 100% tanto en pacientes nuevos como en pacientes con terapia previa, en cirróticos como en no cirróticos y en los diferentes genotipos. La RVS se relaciona con una disminución de la fibrosis y de la cirrosis.Con el Consenso Nacional de Hepatitis C y la aprobación de los nuevos fármacos antivirales de acción directa, se podrá brindar un adecuado tratamiento a la población afectada.
REFERENCIAS BIBLIOGRÁFICAS
1.Webster DP, Klenerman P, Dusheiko GM. World Health Organization, Hepatitis C. Lancet. 2015; 385:1124-35. [ Links ]
2.Botero RC, Tagle M. New therapies for hepatitis C: Latin American Perspectives. Clinical Liver Dis. 2015; 5:8-10. [ Links ]
3.Dávalos M. Epidemiology of hepatitis C virus in Perú and Latin America. Rev Gastroenterol Peru. 2009; 29(4):347-54. [ Links ]
4.Instituto Nacional de Estadística e Informática. Población y vivienda: Población estimada y proyectada por sexo y tasa de crecimiento según años calendarios. Lima: Instituto Nacional de Estadística e Informática; 2016. [ Links ]
5.Deming P, Martin MT, Chan J, et al. Therapeutic Advances in HCV Genotype 1 Infection: Insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2015; 36 (2):203-217. [ Links ]
6.The Korean Association for the Study of the Liver. KASL clinical practice guidelines: management of hepatitis C. Clin Mol Hepatol. 2016; 22 (1):76-139. [ Links ]
7.DAmbrosio R, Aghemo A, Rumi MG, Ronchi G, Donato MF. A morphometric and inmunohistochemical study to assess the benefit of a sustained virological response in hepatitis C virus patients with cirrosis. Hepatology. 2012; 56 (2):532 -543. [ Links ]
8.Infectious Diseases Society of America. HCV Guidance: Recommendations for testing, managing, and treating hepatitis C. Virginia: Infectious Diseases Society of America; 2011. [ Links ]
9.Asociación peruana para el estudio del hígado. Consenso Nacional para el manejo de la Hepatitis C. Lima: Asociación peruana para el estudio del hígado; 2016. [ Links ]
10.Zou S, Dorsey K, Notari EP, et al. Prevalence, incidence, and residual risk of human immunodeficiency virus and Hepatitis C virus infections among Unites States blood donors since the introduction of nucleica acid testing. Transfusion. 2010; 50:1494-1504. [ Links ]
11.Afdhal N, Reddy KR, Nelson DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med. 2014;370(16):1483-93. doi: 10.1056/NEJMoa1316366
12.Bourliere M, Bronowicki JP, de-Ledinghen V, et al. Ledipasvir-sofosbuvir with or without ribavirin to treat patients with HCV genotype 1 infection and cirrosis non-responsive to previous protease-inhibitor therapy: a randomized, double blind, phase 2 trial. (SIRUS) Lancet Infect Dis. 2015; 15 (4):397-404. [ Links ]
Conflictos de intereses: Los autores declaran no tener conflictos de interés.
Contribución de autoría: ABC, MR: redacción del informe de caso. ABC, JER, MTA: revisión crítica del artículo. Todos los autores revisaron y aprobaron la versión final del reporte de caso.
Correspondencia:
Álvaro Bellido Caparó
Teléfono:51 984284899
Dirección: Av Honorio Delgado 401
E-mail: abellido86@gmail.com /alvaro.bellido.c@upch.pe
Recibido: 15/05/2017
Aceptado: 28/06/2017













