Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered vol.28 no.4 Lima oct./dic. 2017
http://dx.doi.org/https://doi.org/10.20453/rmh.v28i4.3230
CONVERSATORIO CLÍNICO
Gran Ronda de Medicina Interna y Especialidades del Hospital Nacional Cayetano Heredia / Grand Round of Internal Medicine and Specialties at the Cayetano Heredia Hospital.
Editor de sección: Dr. Sergio Vásquez Kunze.
Editores asociados: Dr. Héctor Sosa Valle, Dr. Leslie Soto Arquiñigo, Dra. Elena Zelaya Arteaga
Caso clínico 04-2017. Mujer de 70 años con dolor óseo, alteración del sensorio e hipercalcemia
Clinical case 04-2017. A 70 year old woman with bone pain, altered mental state and hypercalcemia
Sergio Vasquez 1,a, Evelyn Mejia 2,a, Ricardo Cipra 1,b
1 Servicio de Medicina Interna. Dpto. de Medicina, Hospital Cayetano Heredia. Lima, Perú.
2 Servicio de Hemato-Oncología. Dpto. de Medicina. Hospital Cayetano Heredia. Lima, Perú.
a Médico asistente;b Médico residente
Ricardo Cipra (Médico residente 3er año Medicina Interna):
Mujer de 70 años, natural de Huancavelica y procedente de Lima, quien acudió con un tiempo de enfermedad de 2 años, caracterizado por dolor en ambas rodillas que aumentaba con la actividad y no calmaba con la ingesta de analgésicos. Desde hace un año y medio se agregó dolor de cadera bilateral, que limitaba parcialmente la deambulación.
Un año antes del ingreso se agregó dolor en región lumbar, no irradiado, que se exacerbaba con la actividad física, y no calmaba con la ingesta de analgésicos. Un mes antes de su ingreso presentó caída a nivel, golpeándose la región sacro-coxígea, por lo que fue llevada al servicio de emergencia, dónde le realizaron radiografía de cadera, no evidenciándose trazos de fractura, siendo dada de alta con analgésicos. Sin embargo, los dolores aumentaron de intensidad, llevando a la paciente a la postración.
Dos semanas antes de su ingreso acudió a un médico particular, quién le solicitó densitometría ósea, examen de orina, glicemia basal y hemograma, refiriéndole que presentaba osteopenia, infección urinaria y diabetes mellitus, prescribiéndole gentamicina intramuscular, glibenclamida y metformina sin mejoría de los síntomas.
Al día del ingreso al hospital, la paciente fue encontrada por su familiar, sudorosa, sin responder al llamado, siendo trasladada al servicio de emergencia de nuestro hospital, decidiéndose su admisión.
En sus funciones biológicas, el apetito había disminuido desde hacía dos semanas antes a la admisión, refería perdida ponderal de aproximadamente 5 k en los últimos tres meses, y estreñimiento por el que se medicaba con lactulosa vía oral.
Negaba historia de enfermedades previas al inicio de la enfermedad actual, tomaba paracetamol condicional a dolor. Negaba además alergias o cirugía previa. Respecto a la valoración funcional geriátrica era dependiente para bañarse, vestirse, levantarse e ir al baño. No se mencionaron antecedentes familiares de importancia.
En la revisión anamnésica por aparatos y sistemas, refería parestesias en miembros inferiores de forma intermitente.
En el examen físico a la admisión se encontró presión arterial 150/70 mm Hg; frecuencia cardiaca 96 latidos/min, frecuencia respiratoria 20/min y saturación de oxígeno arterial en 98%. Lucía en mal estado general y mal estado de hidratación, con palidez de piel y mucosas, llenado capilar menor de dos segundos; el tejido celular subcutáneo estaba disminuido, y no había edema. En cuello no había acantosis nigricans ni acrocordones, y no se palpaba la tiroides. El examen de tórax y pulmones era normal. Los ruidos cardiacos eran rítmicos, no había soplos y los pulsos periféricos eran de amplitud conservada. En el abdomen no había dolor a la palpación, ni visceromegalias, ni masas palpables.
En el aparato osteomuscular se evidenció dolor a la movilización activa y pasiva de articulación de cadera y de ambas rodillas, sin flogosis local, había atrofia de músculos interóseos con onicodistrofia en pies.
El examen neurológico mostró una paciente soporosa, que no respondía al llamado, con score de Glasgow 6/15 (apertura ocular: 1, respuesta verbal: 1 y respuesta motora: 4), pupilas isocóricas, fotorreactivas, con reflejos troncales presentes, reflejos osteotendinosos normales, signo de Babinski y sucedáneos negativos, tono conservado, no presentaba
rigidez de nuca, la sensibilidad no era evaluable por la condición de la paciente. Resto del examen fue no contributorio.
Los exámenes de laboratorio a la admisión mostraron: glucosa capilar 14 mg/dl, Hb 8,9 g/dl, con parámetros corpusculares dentro de rangos normales; recuento de leucocitos 8 400/ul, con neutrófilos 6636/ ul y linfocitos 1 033/ul, el resto de la fórmula se encontraba en rangos normales; plaquetas 185000/ ul; urea 71 mg/d, creatinina 1,8 mg/dl, calcio iónico sérico 1,74 mmol/l (VN: 1.1-1.3), resto de electrolitos séricos dentro de rangos normales; proteínas totales 6,3 g/dl, albúmina sérica 3,9 g/dl (relación albúmina/ globulina de 1,3), bilirrubinas, transaminasas y fosfatasa alcalina sérica dentro de rangos normales. La proteína C reactiva (PCR) cualitativa fue negativa, LDH 568 U/l (VN: 313-618 U/l).
A la admisión en el servicio de emergencia, se le administró inmediatamente cinco ampollas IV de dextrosa al 33%, obteniéndose luego de 20 minutos una glicemia capilar en 131 mg/dl. Se evidenció mejoría del nivel de conciencia (Glasgow de 6 a 14), manteniéndose con infusión de dextrosa al 10%, la cual fue suspendida cuatro días después al no volver a repetir evento de hipoglicemia.
Además, se solicitó perfil de coagulación, que mostró INR 1,05; tiempo de protrombina de 14,6 seg y tiempo de tromboplastina parcial activada 26,6 seg. El perfil tiroideo reveló TSH 5,23 mUI/ml, y T4 libre1,24 ng/dl; la hemoglobina glicosilada fue 7,1% yparatohormona (PTH) intacta en 20,48 pg/ml (VN 10-65 pg/ml).
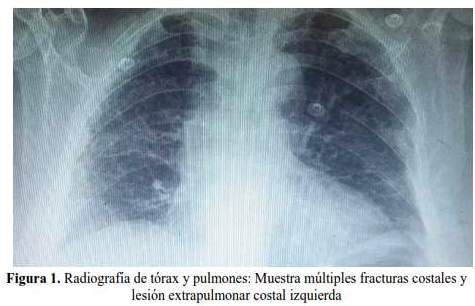
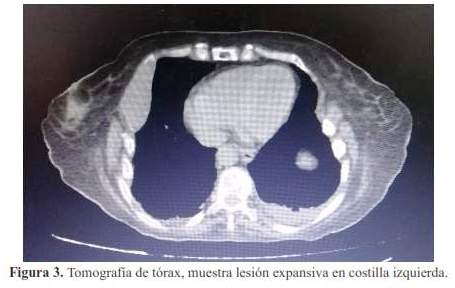
Posteriormente, se solicitó una radiografía de tórax ( figura 1), la que mostró campos pulmonares hipoventilados, con trazo de fractura en cuarta y quinta costillas del lado izquierdo; en la tomografía de tórax se evidenció tumoración costal derecha (figura 2) de aproximadamente 87 x 40 mm, así como, múltiples imágenes osteolíticas en cuerpo vertebral, arcos costales y pelvis.
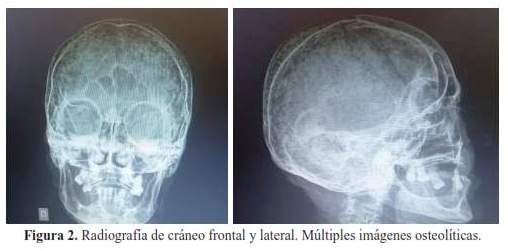
En la radiografía de cráneo ( figura 3) se evidenció múltiples imágenes radiolúcidas circulares confluentes y dispersas en toda la calota craneal.
El proteinograma electroforético en suero mostró leve incremento de la región alfa 2 sin picos monoclonales. El estudio de inmunofijación en suero y en orina no mostró presencia de bandas monoclonales. El estudio del aspirado de médula ósea mostró celularidad incrementada para la edad, presencia de las tres series hematopoyéticas con displasia multilineal y células plasmáticas en 3%. En la biopsia de hueso se evidenció celularidad de 90% con respecto al tejido adiposo, presencia de las tres series hematopoyéticas con arresto leve de la maduración mieloide y eritroide.
DISCUSIÓN
Sergio Vásquez Kunze (Medicina Interna)
La presentación clínica de esta paciente es básicamente dolor óseo generalizado progresivo, principalmente axial, que limita la deambulación y conduce a la postración. El dolor está asociado a lesiones oseas líticas y expansivas e hipercalcemia. Se estima que una hipercalcemia con valores de calcio iónico menores a 2 mmol/l es leve a moderada. La pérdida de peso significativa es inespecífica, pero pone a alguna neoplasia a la cabeza de los diagnósticos. Tiene algunas otras pistas diagnósticas como: el estreñimiento, que debe ser causado por la elevación del calcio y es improbable que apunte a alguna neoplasia colónica pues la forma de presentación de ésta es primero metástasis hepática antes de lesiones oseas e hipercalcemia. También la injuria renal aguda puede ser explicada por la hipercalcemia, esta produce disminución de la habilidad de concentración del túbulo distal del riñón con subsecuente poliuria y deshidratación, además vasoconstricción renal directa. Sin embargo, en general la injuria renal aguda suele verse con niveles de calcio mayores. Otros contribuyentes al daño renal pudieron ser el uso de analgésicos.
La alteración del sensorio fue debida principalmente a la hipoglicemia inducida por sulfonilureas que de hecho no estaba indicada en esta paciente pues no tiene diagnóstico sólido de diabetes y además de haberse diagnosticado diabetes es una medicación muy insegura en un paciente adulto mayor debido al alto riesgo de hipoglicemia. La hipercalcemia puede también causar depresión del sensorio, directamente proporcional a la severidad del aumento del calcio. Las parestesias en miembros inferiores nos llevan a buscar si existe alguna compresión radicular secundaria a lesión ósea metastásica en la columna lumbar. En los exámenes auxiliares son resaltables la anemia normocítica como única serie hematopoyética comprometida, pudiendo ser secundaria a enfermedad crónica o infiltración ósea. Dado las lesiones oseas, la hipercalcemia, la anemia y la injuria renal aguda los esfuerzos diagnósticos iniciales apuntaron a una neoplasia hematológica principalmente mieloma múltiple. Sin embargo, no se concluyó esta posibilidad diagnóstica debido a la ausencia de identificación por inmunofijación de inmunoglobulinas monoclonales tanto en sangre como en orina hechos en el paciente y los estudios de médula ósea y biopsia de hueso sin un diagnóstico concluyente descritos.
Para aproximarme al diagnóstico voy a discutir las principales posibilidades que pueden presentarse en este paciente cuyos hallazgos cardinales son hipercalcemia y lesiones óseas.
Hiperparatiroidismo primario
Es una causa común de hipercalcemia y lesiones óseas. Típicamente es un diagnóstico que ha incrementado su detección por
las pruebas rutinarias a pacientes ambulatorios que muchas vecen incluyen niveles de calcio, aunque no están recomendadas como tamizaje. Cuando se detectan de esta manera los pacientes frecuentemente están asintomáticos. El otro escenario clínico es un paciente que ya tiene síntomas progresivos o graves y se detecta hipercalcemia. Los síntomas o hallazgos más frecuentes son dolor óseo, litiasis renal, dolor abdominal y alteraciones psiquiátricas (bones, stones, abdominal moans and psychic groans). Es de interés para el análisis de nuestro paciente como es el compromiso óseo del hiperparatiroidismo. La lesión mas frecuente es la osteítis fibrosa quística que se va representar como resorción subperióstica típicamente en el lado radial de las falanges medias y clavículas. También se presenta en el cráneo con aspecto de sal y pimienta, y por último puede ocasionar lesiones expansivas óseas (frecuentemente combinadas con deposito de hemosiderina), estos últimos son los llamados tumores pardos de localización más frecuente en mandíbula, pero reportados también en múltiples ubicaciones óseas incluyendo costillas (1). El diagnóstico de hiperparatiroidismo primario se hace de manera sólida con los niveles de PTH intacta (PTHi). Se puede ver niveles francamente altos de PTHi o inapropiadamente normales para el nivel de hipercalcemia (2). Los niveles bajos o en los rangos normal bajo de PTHi sugieren fuertemente hipercalcemia de la malignidad. Para este último aspecto es útil los normogramas que comparan los niveles de calcio y su relación con la PTHi.
Las lesiones óseas de nuestra paciente, por ejemplo, en el cráneo son radiolúcidas, de apariencia osteolítica, no son tan finas como la descripción de sal y pimienta. La lesión expansiva en la costilla si podría ser indistinguible de un tumor pardo. Sin embargo, los niveles de PTH intacta del paciente están en el rango normal bajo, hallazgo más sugerente de hipercalcemia por otro mecanismo, más frecuentemente malignidad. Esto, asociado a la apariencia de las lesiones óseas hace que el diagnóstico de hiperparatiroidismo primario en nuestra paciente sea muy improbable.
Enfermedades granulomatosas
Las enfermedades granulomatosas producen hipercalcemia por activación ectópica de la vitamina D en los macrófagos de los granulomas, aumentando los niveles de 1,25 (OH)2D y consecuentemente el calcio sérico (3,4). Entre las más comunes están sarcoidosis y tuberculosis. Entre otras causas más infrecuentes están las micosis sistémicas, enfermedad de Crohn, poliangiitis y granulomatosis (antes Wegener) e histiocitosis de células de Langerhans, entre otras (5).
Con referencia a las mas frecuentes, tuberculosis y sarcoidosis, nuestra paciente tiene una radiografía de tórax sin adenopatía hiliar, tampoco lesiones parenquimales sugerentes de tuberculosis y además, las lesiones óseas serían completamente inusuales en estas enfermedades. Así, estas posibilidades en nuestra paciente son de poca probabilidad.
Hipercalcemia asociada a malignidad
Estas básicamente se dividen en 3 grupos: tumores sólidos con metástasis (por ejemplo, cáncer de mama), tumores sólidos con mediación humoral sistémica (p ej. cáncer de pulmón o riñón) y las neoplasias hematológicas como leucemia, linfoma y el mieloma múltiple.
Los tumores sólidos que producen metástasis ósea causan hipercalcemia por osteólisis. Esta se produce no por destrucción del hueso por las células tumorales en sí, si no que éstas producen factores como la PTH rp localmente (no detectable en sangre periférica) que van a activar a los osteoclastos, con aumento de la resorción ósea e hipercalcemia (6). El tumor sólido más común con metástasis ósea e hipercalcemia por este mecanismo es el cáncer de mama (7). Este puede producir lesiones muy parecidas a las osteolíticas del mieloma múltiple. Sin embargo, la hipercalcemia y las lesiones osteolíticas se presentan cuando ya hay un compromiso evidente de la mama y ganglios regionales axilares. Nuestra paciente tenía un examen físico normal de mama y sin adenopatías regionales axilares, lo que aleja fuertemente esta posibilidad.
En los tumores sólidos que no presentan metástasis ósea al momento del diagnóstico, la hipercalcemia es debida a la PTH rp (related peptide) (8,9). Esta se encuentra elevada en sangre periférica. Típicamente está asociada a cáncer de pulmón, renal y de cabeza y cuello. Las imágenes de nuestra paciente van en contra de estas posibilidades. También se puede ver este mecanismo humoral de hipercalcemia en los linfomas no Hodgkin especialmente los de células T, el cual discutiremos a continuación.
Linfoma de células T
El linfoma de células T es una causa importante de hipercalcemia. Por ejemplo, entre los pacientes con leucemia/linfoma de células T del adulto la frecuencia es de 50-70%. En cambio, en los linfomas de Hodgkin es alrededor de 5% y en los no-Hodgkin células B entre 0,8 y 13% (10,11).
Aunque se creía que los linfomas de células T causarían hipercalcemia por mecanismos mediados por IL-1, factor de necrosis tumoral beta y PTH rp, actualmente se considera que una mayor expresión del ligando del receptor activador para el factor nuclear kB (RANKL) en los linfocitos T es una causa frecuente de la hipercalcemia. El RANKL induce la diferenciación de los precursores hematopoyéticos a osteoclastos y la mayor actividad de estos estarían asociada a la hipercalcemia (12).
Las lesiones óseas líticas en cráneo y otros huesos debido a linfoma de células T pueden ser indistinguibles de las del mieloma o de otras neoplasias con metástasis óseas (13). Así las lesiones de nuestra paciente pueden corresponder a un linfoma especialmente de células T. Si bien se puede alejar leucemia/linfoma de células T del adulto por la ausencia de flower cells en la lámina periférica, adenopatía y HTLV 1 negativo, otros tipos de linfoma de células T no se pueden descartar (p. ej linfoma anaplásico de células T), aunque la ausencia de adenopatía hace este diagnóstico menos probable. Una citometría de flujo del aspirado de médula ósea ayudaría a identificar esta neoplasia.
Mieloma múltiple
Cuando se me presentó este caso mi primera impresión fue que tenía mieloma múltiple. El dolor óseo, particularmente el dolor lumbar, la anemia, la hipercalcemia, la injuria renal, las imágenes osteolíticas típicas en una paciente adulta mayor, así como la ausencia de otra neoplasia en el examen físico y exámenes auxiliares e imágenes preliminares, sugerían fuertemente este diagnóstico. Otra clave que orienta al diagnóstico es la lesión expansiva costal en las imágenes, típica de plasmocitoma, el cual puede ser secundario, o primario que se ha diseminado al momento de la presentación del paciente.
El diagnóstico de mieloma múltiple se puede hacer con seguridad, según el Grupo de Trabajo Internacional para Mieloma, encontrando en el aspirado de médula ósea más de 10% de células plasmáticas clonales, además de tener daño en órgano blanco relacionado al mieloma (principalmente hipercalcemia, falla renal, lesiones óseas líticas y anemia). La paraproteína monoclonal en sangre u orina ya no es necesaria para el diagnóstico porque, aunque se encuentra en la gran mayoría de pacientes cuando es buscada por métodos de inmunofijación, en algunos pacientes puede ser difícil su demostración y retrasar el diagnóstico y tratamiento precoz (14).
En nuestra paciente existen dos dificultades con el diagnóstico de mieloma múltiple. La primera sería el escaso porcentaje de células plasmáticas en la médula ósea (tanto en el aspirado como en la biopsia de hueso) y la segunda la falta de demostración de una paraproteína monoclonal.
Con respecto a la demostración de más de 10% de células plasmáticas clonales en médula ósea, esto es fácilmente demostrable en la mayoría de pacientes, pero al ser la infiltración de la médula ósea en parches se ha observado que hasta 4% de pacientes tienen menos de 10% de plasmocitos clonales (15). De existir este problema se recomienda obtener otro aspirado de médula ósea y biopsia de hueso de un lugar diferente que puede ser guiado también por imágenes (RMN o PET/CT). La clonalidad puede ser demostrada en la médula ósea por la restricción de las cadenas ligeras kappa/lambda en citometría de flujo, inmunohistoquímica o inmunofluorescencia.
El segundo problema es la falta de demostración de la paraproteína monoclonal. Es interesante revisar la data contemporánea de la demostración de las paraproteínas en el mieloma múltiple. En la serie de la Clínica Mayo se encontró que el proteinograma electroforético sérico la identificó en el 82% de pacientes y cuando además se realizó inmunofijación sérica se identificó en el 93%. Cuando además se complementó el estudio con la medición de cadenas ligeras libres (free light chain, FLC) en sangre e inmunofijación en orina se demostró hasta en 97% de pacientes la proteína monoclonal. De importancia es que en el restante 3% de pacientes no se identificó alguna paraproteína monoclonal por ningún análisis y fue diagnosticado como verdadero mieloma no secretor. Otros datos importantes es que en el 78% de pacientes se encontró una cadena ligera monoclonal en la orina. El 20% de pacientes fue diagnosticado de un mieloma de cadenas ligeras solamente. El 40% de pacientes con mieloma sintomático tiene una proteína m noclonal menor a 3g/dl (15).
Como muchos de los pacientes, la nuestra tiene estudios de proteinograma electroforético e inmunofijación en sangre y en orina y estamos familiarizados con la técnica y la interpretación de estos, en que básicamente se demuestra un pico en la región gamma (inmunoelectroforesis), o una banda discreta en los territorios de las cadenas pesadas de IgG, IgA o IgD, y en los de las cadenas ligeras kappa o lambda (inmunofijación).
Cuando no se demuestra la paraproteína por estas dos técnicas (inmunoelectroforesis e inmunofijación), se puede hacer el estudio de cadenas ligeras libres mencionado. Este estudio va a medir ambas cadenas ligeras (kappa y lambda) en su forma libre en sangre. Normalmente se encuentran en sangre en una razón entre 0,26 a 1,65 (kappa/lambda) (16). En mieloma multiple esta razón se altera, lo cual indica monoclonalidad. El hallazgo de un nivel sérico de una cadena ligera mayor de 100 mg/l conjuntamente con una ratio de FLC de 100 a 1 (o de 1 a 100 dependiendo cual cadena ligera es monoclonal) establecen firmemente el diagnóstico de mieloma múltiple. También estos valores son de importancia pronóstica de daño a órgano blanco.
Cuando sólo por esta técnica se demuestra la paraproteína se ha denominado “mieloma de solo cadenas ligeras libres no medibles” (17). Se reconoce el diagnóstico de mieloma oligosecretor por esta técnica cuando la paraproteína es menor de 1 g/dl (1000 mg/l) en sangre.
En conclusión, dado la presentación clínica, la anemia, hipercalcemia, las lesiones osteolíticas y la lesión costal sugerente de plasmocitoma, el mejor diagnóstico sigue siendo mieloma múltiple probablemente de cadenas ligeras solamente y oligosecretor. Se debería complementar el estudio con el dosaje y razón de cadenas libres en sangre y un nuevo aspirado de médula ósea de localización diferente al primero con estudios de clonalidad por citometría de flujo. Un segundo diagnóstico mas improbable por lo descrito previamente es linfoma de células T. La citometría de flujo en medula ósea sería útil también para este propósito.
Evolución inicial
Debido a que no se demostró una paraproteína monoclonal, y por la alta sospecha de mieloma múltiple se realizó dosaje de cadenas ligeras, con cadena kappa libre en 947 mg/l (VN: 3,3-19,4), cadena lambda libre en 6,47 mg/l (VN: 5,7 a 26,3), obteniéndose un índice kappa/lambda de 146,3 (RN 0,26- 1,66).
El estudio de inmunohistoquímica de la biopsia de hueso fue positivo para CD138, con relación kappa/ lambda no contributorio y en el estudio de citometría de flujo del aspirado medular se evidenció células plasmáticas neoplásicas en 8,29% (positivas para CD138, CD38, CD56 y negativas para CD45 y CD19), con la relación de células plasmáticas normales con respecto al total de plasmocitos de 0,12% (VN < 5%), siendo esto compatible con el diagnóstico de mieloma múltiple.
COMENTARIOS
Sergio Vásquez Kunze
El nivel de sérico de cadenas libres kappa (mayor de 100 mg/l) y la razón kappa/lambda mayor de 100 son diagnósticos de mieloma múltiple de cadenas ligeras. El porcentaje anormalmente alto de células plasmáticas clonales si bien no alcanza el 10% en el contexto clínico discutido y habiéndose demostrado monoclonalidad de cadenas ligeras confirman el diagnóstico de mieloma múltiple, haciendo la necesidad de otra biopsia innecesaria.
Evelyn Mejía (Hematología)
Luego de establecido el diagnóstico de mieloma múltiple, se procedió a determinar la mejor terapia para nuestra paciente. La existencia de criterios diagnósticos para mieloma múltiple determina el inicio de tratamiento, no existiendo diferencias en el manejo de la variedad oligosecretora. La principal diferencia en el tratamiento se da entre los mielomas con criterios CRAB (como este caso, Calcium, Renal, Anemia and Bone disease) y los no sintomáticos (MGUS y Smoldering), aunque estudios recientes han demostrado en beneficio potencial de tratar determinados pacientes asintomáticos (18).
A pesar de que la quimioterapia seguida de trasplante de progenitores hematopoyéticos actualmente constituye el tratamiento de elección para casos nuevos de mieloma, nos encontramos ante una paciente frágil (Score de Palumbo para fragilidad en pacientes con mieloma = 3), por lo que no es elegible para trasplante ni para quimioterapia en dosis intensas (19).
En el servicio de Hemato-Oncología utilizamos el esquema talidomida más prednisona como terapia de elección para estos casos. Por limitación en recursos económicos, los esquemas que contienen lenalidomida y bortezomib son usados como terapia de segunda línea en recaídas y pacientes refractarios (20). La paciente ha evolucionado de forma satisfactoria, con buena tolerancia al tratamiento, control adecuado de la sintomatología y mínima toxicidad farmacológica.
Sergio Vásquez Kunze
Como comentario final debo decir que hace 5 años en esta misma revista y en la misma sección comente y defendí un diagnóstico de síndrome de POEMS a pesar que no se pudo encontrar la paraproteína en inmunofijación en sangre y orina (21). Al igual que en esta discusión comente la importancia del dosaje de cadenas ligeras libres y la citometría de flujo en médula ósea para el diagnóstico. Sin embargo, en aquel paciente no se realizó porque los laboratorios locales aun no contaban con esas pruebas y por limitaciones económicas. De haberse hecho esas pruebas como en el caso actual seguramente se hubiera diagnosticado sólidamente la neoplasia de células plasmáticas.
EVOLUCIÓN FINAL
Durante su hospitalización, para el tratamiento de la hipercalcemia se le administró hidratación, así como diuréticos y además una dosis de bifosfonato (pamidronato), obteniéndose niveles séricos de calcio dentro de valores normales y mejoría completa del sensorio.
Posterior al diagnóstico de mieloma múltiple se decidió la administración de talidomida conjuntamente con corticoterapia (dexametasona), debido a buena evolución de la paciente, se decidió su alta para continuar manejo de forma ambulatoria.
DIAGNÓSTICO FINAL
Mieloma múltiple de cadenas ligeras oligosecretor.
DIAGNÓSTICO FINAL
Mieloma múltiple de cadenas ligeras oligosecretor.
REFERENCIAS BIBLIOGRÁFICAS
1. Bilezikian JP, Brandi ML, Rubin M, Silverberg SJ. Primary hyperparathyroidism: new concepts in clinical, densitometric and biochemical features. J Intern Med. 2005; 257:6. [ Links ]
2. Hollenberg AN, Arnold A. Hypercalcemia with low-normal serum intact PTH: a novel presentation of primary hyperparathyroidism. Am J Med. 1991;91:547. [ Links ]
3. Adams JS. Vitamin D metabolite-mediated hypercalcemia. Endocrinol Metab Clin North Am. 1989; 18:765. [ Links ]
4. Tebben PJ, Singh RJ, Kumar R. Vitamin D-mediated hypercalcemia: Mechanisms, diagnosis, and treatment. Endocr Rev. 2016; 37:521. [ Links ]
5. Jacobs TP, Bilezikian JP. Clinical review: Rare causes of hypercalcemia. J Clin Endocrinol Metab. 2005; 90:6316. [ Links ]
6. Quinn JM, Matsumura Y, Tarin D, et al. Cellular and hormonal mechanisms associated with malignant bone resorption. Lab Invest. 1994; 71:465. [ Links ]
7. Grill V, Ho P, Body JJ, et al. Parathyroid hormone- related protein: elevated levels in both humoral hypercalcemia of malignancy and hypercalcemia complicating metastatic breast cancer. J Clin Endocrinol Metab. 1991; 73:1309. [ Links ]
8. Mirrakhimov AE. Hypercalcemia of malignancy: An Update on Pathogenesis and Management. N Am J Med Sci. 2015; 7:483. [ Links ]
9. Ratcliffe WA, Hutchesson AC, Bundred NJ, Ratcliffe JG. Role of assays for parathyroid-hormone-related protein in investigation of hypercalcaemia. Lancet. 1992; 339:164. [ Links ]
10. Sargent JT, Smith OP. Haematological emergencies managing hypercalcaemia in adults and children with haematological disorders. Br J Haematol. 2010;149: 465–477. [ Links ]
11. Vassilopoulou-Sellin R, Newman BM, Taylor SH, Guinee VF. Incidence of hypercalcemia in patients with malignancy referred to a comprehensive cancer center. Cancer. 1993;71:1309–1312. [ Links ]
12. Nosaka K, Miyamoto T, Sakai T, Mitsuya H, Suda T, Matsuoka M. Mechanism of hypercalcemia in adult T-cell leukemia: overexpression of receptor activator of nuclear factor κB ligand on adult T-cell leukemia cells. Blood. 2002; 99:634-640. [ Links ]
13. Zahra M. Bone lesion in Adult T Cell Lymphoma Leukemia. Pan African Medical Journal. 2013; 16:76. [ Links ]
14. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014; 15:538. [ Links ]
15. Kyle RA, Gertz MA, Witzig TE, et al. A Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003; 78(1):21. [ Links ]
16. Katzmann JA, Abraham RS, Dispenzieri A, et al. Diagnostic performance of quantitative kappa and lambda free light chain assays in clinical practice. Clin Chem. 2005; 51:878. [ Links ]
17. Dimopoulos MA, Kastritis E, Terpos E. Non-secretory myeloma: one, two, or more entities? Oncology (Williston Park). 2013; 27(9):930-2. [ Links ]
18. Rajkumar V. Multiple mieloma: 2016 update on diagnosis, risk-stratification, and management. American Journal of Hematology. 2016; 91(7):720-734. [ Links ]
19. Palumbo A, Bringhen S, Mateos MV, et al. Geriatric assessment predicts survival and toxicities in elderly myeloma patients: an International Myeloma Working Group report. Blood. 2015; 125(13):2068-7. [ Links ]
20. Larocca A, Palumbo A. How I treat fragile myeloma patients. Blood. 2015; 126(19):2179-85. [ Links ]
21. Vasquez S. Caso clínico 02-2012 Varón de 38 años con neuropatía periférica, edemas y lesiones dérmicas. Rev Med Hered. 2012; 23(3):204-214. [ Links ]













