Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Medica Herediana
Print version ISSN 1018-130XOn-line version ISSN 1729-214X
Rev Med Hered vol.29 no.4 Lima Oct./Dec. 2018
http://dx.doi.org/https://doi.org/10.20453/rmh.v29i4.3453
CONVERSATORIO CLÍNICO
Gran Ronda de Medicina Interna y Especialidades del Hospital Cayetano Heredia / Grand Round of Internal Medicine and Specialties at the Hospital Cayetano Heredia
Editor de sección: Dr. Sergio Vásquez Kunze
Caso clínico 03-2018. Mujer de 62 años con tos, parestesias y orinas espumosas
Clinical case 03-2018. A 62-year-old woman with cough, paresthesia and foamy urine
Enrique Oshiro Romero 1,a, Milthon Blanco Mamani 1,b
1 Servicio de Medicina Interna, Departamento de Medicina, Hospital Cayetano Heredia, Ministerio de Salud. Lima, Perú.
a Médico Asistente; b Médico Residente de 3er año.
Dr. Milthon Blanco Mamani (Médico residente de 3er año de Medicina Interna):
Mujer de 62 años, natural de Cajamarca y procedente de Lima, con historia de un año de evolución, de inicio insidioso y curso progresivo, caracterizado por orinas espumosas, parestesias en miembros inferiores y tos.
Un año antes del ingreso notó orina espumosa, por ello acudió a consulta médica. Un estudio de sedimento urinario reveló presencia de hematíes 20 por campo, sin presencia de dismórficos y la proteinuria en 24 horas de 842 mg. Además, le realizaron estudios de autoinmunidad encontrándose ANCA P positivo 1/640 por inmunofluorescencia, diagnosticándosele vasculitis. Cuatro meses antes del ingreso presentó parestesias de miembros inferiores, simétricas y bilateral; se le realizó un estudio de electromiografía que fue informada como polineuropatía distal, sensitivo motora tipo axonal que afectaba extremidades inferiores. Se le indicó tres pulsos de metilprednisolona y ciclofosfamida, sin presentar mejoría de la proteinuria ni de las parestesias. Un mes antes de su ingreso, refirió tos productiva, se le realizó radiografía de tórax y se le diagnosticó bronquiectasias. Le indicaron tratamiento con claritromicina, presentando mejoría parcial. Un cultivo de esputo mostró crecimiento de Aspergillus sp; se le inició tratamiento con itraconazol, pero no mostró mejoría.
Debido a que tenía programado otro pulso de ciclofosfamida se debía desfocalizar y descartar tuberculosis pulmonar programándose una fibrobroncoscopía para obtención de muestras. Durante la broncoscopia presentó bradicardia severa con compromiso del sensorio siendo trasladado a choque trauma en paro cardiorrespiratorio; se procedió a RCP avanzado por 7 minutos recobrando funciones vitales e ingresando a la unidad cuidados intensivos de nuestra institución.
En las funciones biológicas, el apetito estaba conservado, la sed aumentada, refería insomnio, así como pérdida de 7 kg de peso en un año, sudor disminuido, orinas espumosas, deposiciones conservadas y estado de ánimo triste.
Tenía antecedente de tuberculosis pulmonar en la niñez y recibió tratamiento por seis meses. Se le diagnosticó bronquiectasias secuelares y aspergilosis pulmonar recibiendo tratamiento con itraconazol por 14 días. En la revisión anamnésica de aparatos y sistemas refirió caída de cabello desde hace cuatro meses y tos crónica desde hace cinco meses.
El tratamiento que recibía por su enfermedad actual era enalapril 10 mg, prednisona 50 mg e hidroclorotiazida 25 mg, por día.
El examen físico post RCP mostró presión arterial de 110/70, frecuencia cardiaca 113, frecuencia respiratoria 36, saturación de 96% a FiO : 50%; estaba en mal estado general, regular estado de hidratación, mal estado nutricional, en decúbito dorsal pasivo, la piel tibia, frialdad distal, llenado capilar menor a 2 segundos, no cianosis; enfisema subcutáneo en región anterior supraclavicular, en pulmones, el murmullo vesicular estaba disminuido en ambas bases con presencia de roncantes difusos; los ruidos cardíacos eran rítmicos, taquicárdicos, con pulsos periféricos débiles; el abdomen era blando con ruidos hidroaéreos presentes. Al examen neurológico, estaba despierta, con escala de Glasgow de 10/15, tenía hemiparesia izquierda y hemianestesia ipsilateral, reflejos osteotendinosos conservados, signos de Hoffman y Babinski presentes en el lado izquierdo, pupilas isocóricas y fotoreactivas.
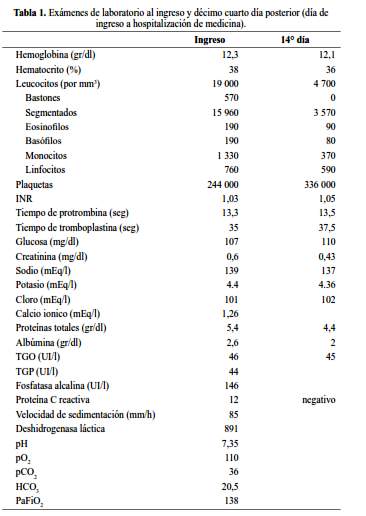
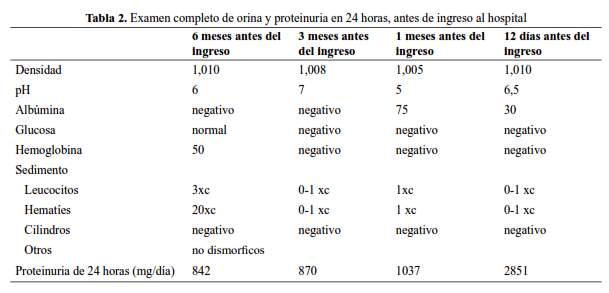
Los exámenes de laboratorio al ingreso se muestran en la tabla 1; la serología para VIH, HBsAg y Anti Hepatitis C fueron negativos; ANCA, Anti MPO, ANA, perfil ENA, factor reumatoide, negativos y C y C , normales. Los resultados del examen de orina y proteinuria en 24 horas previos, se muestran en la tabla 2.
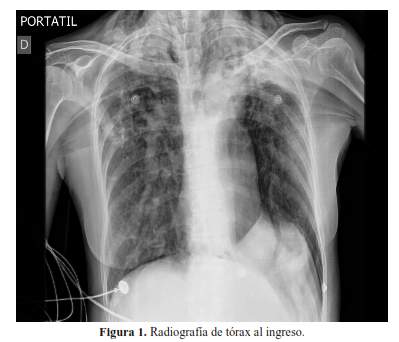
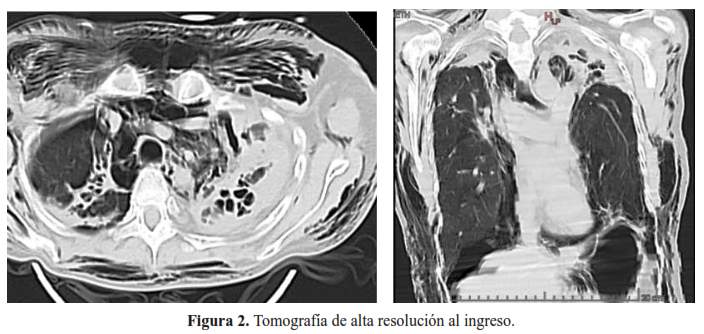
La radiografía de tórax mostró enfisema subcutáneo, neumomediastino, neumotórax bilateral, presencia de bronquiectasias en ápices pulmonares, y atelectasia en base hemitórax izquierdo (figura 1) y la tomografía de tórax de alta resolución en ventana parenquimal mostró extensa lesión secuelar con bronquiectasias y tractos fibróticos biapicales (figura 2).
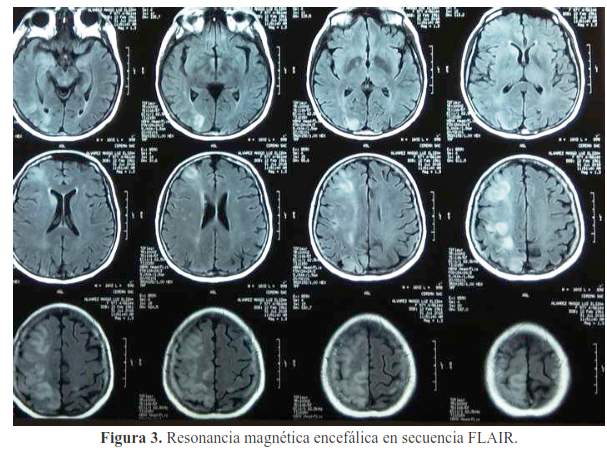
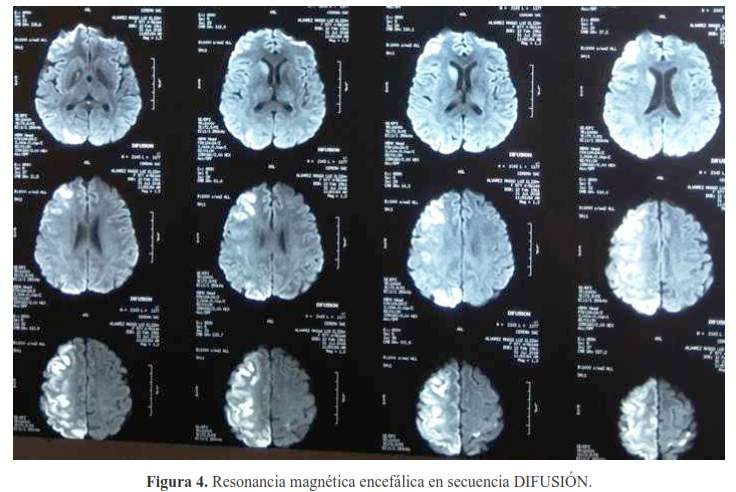
Además, se realizó resonancia magnética encefálica (figura 3 y figura 4), que mostró en secuencia flair y difusión un infarto subagudo tardío de localización subcortical de distribución difusa en hemisferio cerebral derecho y fronto-parietal izquierdo presentando áreas de hiperemia. La angioresonancia de los sistemas carotídeos y vertebro basilar a nivel intracraneal fue normal.
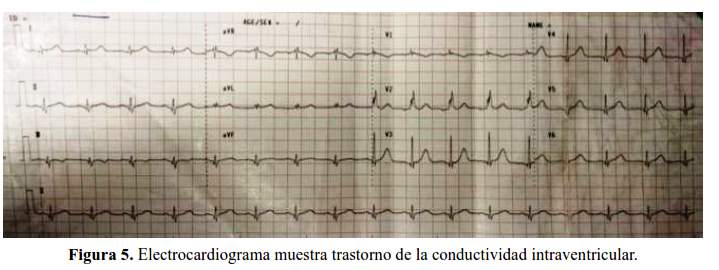
El electrocardiograma al ingreso mostró taquicardia sinusal, eje en 0°, complejos de bajo voltaje en derivadas precordiales, trastorno de la conductibilidad intraventricular (patrón de fragmentación) (figura 5).
Se indicó a su ingreso oxigenoterapia, tratamiento antibiótico con ceftazidima y clindamicina, hidrocortisona, inhaladores, siendo su evolución favorable mejorando el Glasgow a 15/15, pero persistiendo hemiplejia izquierda.
Pasa a piso de medicina 14 días posteriores al ingreso, para completar estudios.
Se realiza un ecocardiograma transtorácico que muestra función sistólica del ventrículo izquierdo deprimida en grado leve con fracción de eyección de 47% y disfunción diastólica grado I con remodelación concéntrica de ventrículo izquierdo, regurgitación mitral leve, efusión pericárdica leve sin trombos.
Se realizó también una ecografía renal con riñones de tamaño normal, aumento de la ecogenicidad y pérdida de la diferenciación cortico medular, informándose como signos de nefropatía crónica bilateral.
Se llevó el caso a discusión de especialidades.
DISCUSIÓN CLÍNICA
Dr. Enrique Oshiro Romero (Medicina Interna):
Se trata de una paciente de 62 años con tiempo de enfermedad de un año caracterizado por orina espumosa, parestesias en miembros inferiores y tos crónica. Como antecedente de importancia, tuberculosis pulmonar y diagnóstico presuntivo de vasculitis ANCA P en evaluación previa.
Para el enfoque diagnóstico consideramos como punto de partida la presencia de parestesias y orina espumosa. Estos hallazgos son enfocados en el contexto de una paciente con lesiones pulmonares previas relacionados con tuberculosis.
En relación a la presencia de orina espumosa, este hallazgo obliga a descartar proteinuria, para esto se solicitó estudios de orina los cuales mediante tira reactiva mostró positividad para proteínas. Este tipo de pruebas es bastante específico, pero poco sensible para proteinuria de tipo no albumina (1); por lo tanto, la positividad nos traduce una causa glomerular del problema. En relación a la cantidad, clasificamos a la proteinuria en rango nefrótico y no nefrótico. La presencia de una orina en rango nefrótico nos orientaría en los diagnósticos a considerar. Los estudios realizados reportan valores por debajo de 3,5 gramos en 24 horas lo cual la encasilla fuera de rango nefrótico. Dentro de las causas más frecuentes tenemos glomerulopatías, vasculitis, ortostatismo, amiloidosis entre otras (2).
Si bien la asociación de proteinuria y parestesias se puede relacionar con la diabetes de larga data, la paciente no presentó hallazgos clínicos ni de laboratorio de diabetes mellitus por lo que esta posibilidad bastante frecuente queda descartada.
Mencionado esto, pasamos a discutir nuestras principales probabilidades diagnósticas: amiloidosis secundaria vs vasculitis sistémica.
Vasculitis ANCA C
Esta paciente ingresó con historia de uso de ciclofosfamida por marcador ANCA positivo asociado a manifestaciones renales. Dentro de este tipo de vasculitis, tenemos las de tipo P (MPO) y C (PR3). Nuestra paciente presentó dentro de estudios previos al ingreso un resultado positivo para ANCA P. Dentro de estas encontramos a la poliangeitis microscópica, vasculitis limitada al riñón y vasculitis de tipo Churg Strauss. En menor proporción también se describe vasculitis de Wegener; sin embargo, la ausencia de compromiso de vías aéreas, eosinofilia, asma y compromiso cardiaco aleja estas posibilidades por lo que discutiremos como causas probables, poliangeitis microscópica y vasculitis limitada al riñón.
La poliangeitis microscópica puede comprometer diversos sistemas; sin embargo, tiene como característica principal el compromiso renal. Se reporta nefropatía entre 80-90% de los pacientes (3-4). Esta se manifiesta en forma de glomerulonefritis y proteinuria. Esta última habitualmente en rango no nefrótico, tal como en el caso de nuestra paciente. La característica principal de la glomerulonefritis es la presencia de hematuria, hipertensión, edema y proteinuria. En la paciente los niveles de presión arterial se mantuvieron en límite inferior, si bien presentaba edema no se describe la presencia de cilindros ni hematíes dismórficos, lo cual es típico de glomerulonefritis. Si bien existe la posibilidad de presentar una vasculitis con estos hallazgos, su ausencia hace discutible la presencia de este diagnóstico.
Con respecto a la proteinuria, los estudios son categóricos y muestran desde el inicio rangos de proteinuria no nefrótica. Si bien este hallazgo junto con la presencia de marcador ANCA positivo sugieren posibilidad de vasculitis debemos evaluar otros hallazgos clínicos, ya que la sola presencia de proteinuria no es específica; asimismo, llama la atención que el marcador ANCA P no fue positivo en estudios realizado durante su hospitalización, por lo que el diagnóstico fue reevaluado (5).
El síntoma acompañante al cuadro fue parestesias. La presencia de esta nos habla de compromiso de nervio periférico. En el caso de la vasculitis ANCA P, se pueden presentar en el 70% de los casos (6). Habitualmente son de tipo axonal y dan compromiso sensorio-motor tal como en nuestra paciente. Para confirmar la presencia de vasculitis como causa de cuadro, la biopsia es una posibilidad a considerar. Este procedimiento no se llegó a realizar debido a la confirmación de diagnóstico mediante otro medio.
Finalmente, con respecto a este diagnóstico planteado, es necesario mencionar que la especificidad de un ANCA P por IFI (realizado antes del ingreso) es del 50%, por lo que se sugiere complementar con método de ELISA (7). Este método no fue corroborado en nuestra paciente por lo que la sola presencia de este resultado no es contundente para plantear el diagnóstico de vasculitis ANCA P. Asimismo, se reporta la presencia de ANCA P en casos de bacteriemia, infecciones por micobacterias y aspergillus tal como el caso de nuestra paciente (8).
Amiloidosis
La amiloidosis es una enfermedad en la que hay depósito de proteínas de bajo peso molecular en diferentes órganos. Hay varios tipos siendo las más importantes la primaria (AL) y secundaria (AA). Existen otros tipos de menor frecuencia como la relacionada a diálisis, hereditaria y senil. En nuestro caso, la sospecha va hacia la forma AA. Esta forma se describe en pacientes con enfermedades inflamatorias crónicas como artritis reumatoidea, bronquiectasias, artritis psoriásica, ulceras de presión, enfermedades intestinales crónicas, osteomielitis, fiebre mediterránea familiar y tuberculosis pulmonar (9). En la paciente se presenta de forma clara el antecedente de tuberculosis pulmonar y se constata claramente la presencia de bronquiectasias. Estos hallazgos junto al cuadro clínico orientan a esta patología.
La amiloidosis puede comprometer diversos sistemas. A nivel renal las manifestaciones dependen del lugar de depósito de amiloide, la más frecuente es la presencia de proteinuria. Esta puede estar dentro de rango nefrótico o no, tal como en el caso de la paciente. Este hallazgo puede estar acompañado de sedimento urinario activo cuando se asocia a patología reumatológica con daño renal. Ejemplos claros son poliangeitis microscópica, artritis reumatoidea entre otros (10).
La presencia de parestesias en miembros inferiores se presenta también en amiloidosis, de forma característica de compromiso axonal y de fibras pequeñas, ocasionando síntomas sensitivos con preservación de sensibilidad profunda. La electromiografía de la paciente era compatible con amiloidosis, a pesar de no ser específico clínicamente orientaba hacia el diagnóstico junto con las otras manifestaciones clínicas. Otras manifestaciones neurológicas halladas en amiloidosis son disautonomías, demencia, sangrados y stroke (11).
La paciente presentó luego de la reanimación cardiaca, hallazgos clínicos y radiológicos compatibles con evento vascular en hemisferio derecho. ¿Puede ser esto causado por amiloidosis? De hecho sí. La presencia de stroke puede ser una manifestación relacionada con amiloidosis y en algunos casos es la manifestación inicial. Esto es ocasionado por infiltración amiloide a nivel auricular lo cual aumenta considerablemente el riesgo de fibrilación auricular, cardioembolismo y stroke. Analizado esto podríamos mencionar que si hay compromiso cardiaco por amiloide, tendríamos relación del stroke con esta patología; sin embargo, hay que mencionar que la presencia de amiloidosis cardiaca se presenta sobre todo en amiloidosis primaria, siendo rara en las formas secundarias. De ser el caso, y teniendo la sospecha de amiloidosis secundaria por lo antecedentes de la paciente, deberíamos buscar otras explicaciones al compromiso hallado (11).
¿Tiene alguna relación el paro cardiorrespiratorio y los hallazgos neurológicos? Si, la evidencia describe la presencia de compromiso neurológico a nivel de corteza, hipocampo, cerebelo, ganglios basales y en ocasiones en medula espinal (12). Estas alteraciones pueden presentarse como stroke y dependiendo de la severidad ocasionar un daño permanente en el paciente. En nuestro caso, la paciente presentó mejora parcial en funciones cerebrales superiores; sin embargo, persistió la focalización a nivel de hemicuerpo izquierdo hasta el alta médica.
En conclusión, podemos mencionar que, si bien un cuadro de amiloidosis podría generar los hallazgos neurológicos presentados, el antecedente de paro cardiorrespiratorio también puede explicar las manifestaciones evidenciadas.
En el sistema cardiovascular, la amiloidosis AA se debe sospechar en pacientes con compromiso renal más presencia de EKG con complejos QRS de bajo voltaje (13). Este hallazgo se relaciona con la presencia de amiloide en músculo cardiaco; sin embargo, no podemos ser contundentes ya que neumotórax y neumomediastino, presentes en esta paciente son patologías en la cuales también se da este hallazgo. Asimismo, no es habitual el compromiso cardíaco en amiloidosis secundaria por lo que sospecha se aleja. Para confirmar esta posibilidad una alternativa diagnóstica sería realizar biopsia cardiaca o RM. Sin embargo, existen otros medios menos invasivos y accesibles los cuales son discutidos más adelante.
La incidencia de tuberculosis en nuestro país es alta en comparación con países del primer mundo, debido a esto la presencia de compromiso renal de tipo glomerular en ausencia de otras causas claras, amiloidosis es un diagnóstico importante a considerar. Estudios de pacientes con enfermedad renal crónica terminal en el Perú con etiología no conocida, reportan como principal causa de esta a la amiloidosis de tipo AA. Las patologías frecuentemente asociadas a amiloidosis secundaria según este reporte fueron tuberculosis pulmonar, bronquiectasias y osteomielitis (14).
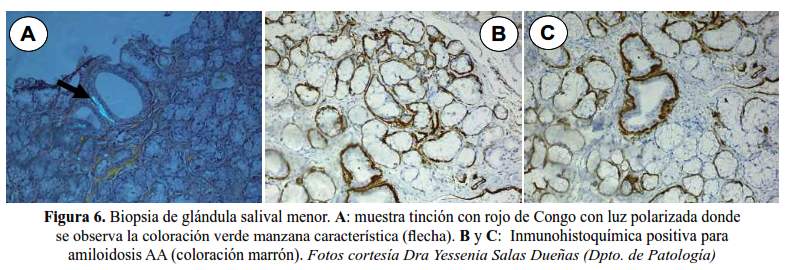
De acuerdo a esta discusión debemos plantear amiloidosis secundaria a bronquiectasias como principal sospecha diagnóstica. El plan a realizar debe incluir toma de biopsia de glándulas salivares menores para tinción con rojo de Congo y microscopia de luz polarizada (figura 6).
EVOLUCIÓN
Por presentar proteinuria significativa, compromiso cardiaco con insuficiencia cardiaca diastólica y polineuropatía sensitivo motora se realizó biopsia de glándula salival menor y tinción con rojo de Congo, resultando positivo.
Se realizó inmunohistoquímica para amiloidosis AA resultando positivo.
Dr. Enrique Oshiro Romero
El manejo de este cuadro está enfocado en el control de la causa que desencadena la formación de esta sustancia. Si bien dentro de las guías y publicaciones podemos encontrar fármacos como colchicina, dimetilsulfóxido, inmunosupresores, citostáticos y anticitoquinas, su efectividad no es clara. Sin embargo, se vienen ensayando nuevas moléculas con resultados esperanzadores por el momento en casos de amiloidosis primaria (15). En el caso de amiloidosis secundaria, aún no se cuenta con resultados positivos.
En el caso de nuestra paciente se indicó vigilar aparición de síntomas respiratorios e instauración de manejo antibiótico temprano.
DIAGNÓSTICO FINAL
Amiloidosis secundaria
REFERENCIAS BIBLIOGRÁFICAS
1.Constantiner M, Sehgal AR, Humbert L, Constantiner D, Arce L, Sedor JR, Schelling J. A dipstick protein and specific gravity algorithm accurately predicts pathological proteinuria. Am J Kidney Dis. 2005; 45(5):833-841. [ Links ]
2.Ellis EN, Mauer SM, Sutherland DE, Steffes MW. Glomerular capillary morphology in normal humans. Lab Invest. 1989; 60:231-236. [ Links ]
3.Seo P, Stone JH. The antineutrophil cytoplasmic antibody-associated vasculitides. Am J Med. 2004;117:39-50. [ Links ]
4.Falk RJ, Hogan S, Carey TS, Jennette JC. Clinical course of anti-neutrophil cytoplasmic autoantibody-associated glomerulonephritis and systemic vasculitis: The Glomerular Disease Collaborative Network. Ann Intern Med. 1990; 113:656-663. [ Links ]
5.Savage CO, Winearls CG, Evans DJ, et al. Microscopic polyarteritis: presentation, pathology and prognosis. Q J Med. 1985; 56:467-483. [ Links ]
6.Pagnoux C, Guillevin L. Peripheral neuropathy in systemic vasculitides. Curr Opin Rheumatol. 2005; 17:41-48. [ Links ]
7.Stone JH, Talor M, Stebbing J, et al. Test characteristics of immunofluorescence and ELISA tests in 856 consecutive patients with possible ANCA-associated conditions. Arthritis Care Res. 2000; 13:424-434. [ Links ]
8.Vahid B, Wildemore B, Nguyen C, Marik P. Positive C-ANCA and cavitary lung lesion: recurrence of Wegener granulomatosis or aspergillosis? South Med J. 2006; 99:753-756. [ Links ]
9.Pinney JH, Lachmann HJ. Systemic AA amyloidosis. Subcell Biochem. 2012; 65:541-564. [ Links ]
10. Kurita N, Kotera N, Ishimoto Y, et al. AA amyloid nephropathy with predominant vascular deposition in Crohn’s disease. Clin Nephrol. 2013; 79:229-232. [ Links ]
11.Shin SC, Robinson-Papp J. Amyloid neuropathies. Mt Sinai J Med. 2012; 79:733-748. [ Links ]
12.Brierley JB. Pathology of cerebral ischemia. In: McDowell FH, Brennan RW. Cerebral Vascular Disease. New York: Eighth Princeton Conference on Cerebrovascular Diseases Grune & Stratton; 1973. pp. 59-75. [ Links ]
13.Dubrey SW, Hawkins PN, Falk RH. Amyloid diseases of the heart: assessment, diagnosis, and referral. Heart. 2011; 97:75-84. [ Links ]
14. Lopez F, Valdez G, Hernández J, Delgado W, et al. Amiloidosis secundaria: Características clínicas. Rev Med Hered. 1999; 10:45-48. [ Links ]
15. Richards DB, Cookson LM, Berges AC, et al. Therapeutic Clearance of Amyloid by Antibodies to Serum Amyloid P Component. N Engl J Med. 2015;373:1106-1114. [ Links ]













