Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Medica Herediana
versión impresa ISSN 1018-130Xversión On-line ISSN 1729-214X
Rev Med Hered vol.30 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.20453/rmh.v30i1.3470
INVESTIGACIÓN ORIGINAL
Patrones de tinción de anticuerposantinucleares identificados por Inmunofluorescencia indirecta en pacientes con enfermedad del tejido conectivo
Antinuclear antibody staining patterns identified by indirect immunofluorescence in patients with connective tissue disease
José Enrique Oliva-Menacho 1,2,3, Jorge Luis Arroyo- Acevedo 4,5, José Arturo Oliva-Candela 3, Marco Antonio García-Hjarles 1
1 Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Unidad de Posgrado, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Hospital Nacional Arzobispo Loayza. Lima, Perú.
4 Instituto de Investigaciones Clínicas, Universidad Nacional Mayor de San Marcos. Lima, Perú.
5 Laboratorio de Farmacología Experimental, Facultad de Medicina Humana, Universidad Nacional Mayor de San Marcos. Lima, Perú.
RESUMEN
Objetivos: Determinar la frecuencia de patrones de tinción de anticuerpos antinucleares identificados por inmunofluorescencia indirecta en pacientes con enfermedad del tejido conectivo en un hospital de nivel III de Lima, Perú. Material y métodos: Estudio de tipo cuantitativo, observacional y transversal, realizado en el Servicio de Inmunología del Hospital Nacional Arzobispo Loayza entre enero 2017 y junio 2017. Se revisaron 291 historias clínicas de pacientes con enfermedad del tejido conectivo y con detección de los patrones de tinción de anticuerpos antinucleares en suero, usando la técnica de Inmunofluorescencia Indirecta. Resultados: La frecuencia de estudios de anticuerpos antinucleares fue 322 (100 %), los patrones de anticuerpos antinucleares fueron PCNA6 (1,86%), patrón homogéneo 109(33,85%), patrón centromérico 34(10,56%), patrón moteado 135(41,93%), patrón citoplasmático 25(7,76%), patrón nucleolar 9(2,80%), patrón NUMA 1- Huso Acromático 3(0,93%) y patrón lisosoma 1(0,31%). La positividad de anticuerpos antinucleares se determinó mayormente en pacientes con lupus eritematoso sistémico 85(29.21%), esclerosis sistémica progresiva limitada (CREST) 34(11,68%), síndrome de Sjögren 77(26,46%), esclerodermia 15(5,15%), enfermedades mixtas del tejido conectivo72 (24,74%) y polimiositis 8 (2,75%). Conclusiones: Se encontró elevada frecuencia del patrón homogéneo y del patrón moteado en pacientes con enfermedad del tejido conectivo. El patrón homogéneo se asoció fuertemente al lupus eritematoso sistémico y el patrón moteado se asoció al síndrome de Sjögren. Por lo tanto, el método ANA-IFI puede reducir el gasto de un trabajo inmunológico detallado con una pérdida mínima en la exactitud diagnóstica de la enfermedad.
PALABRAS CLAVE: Anticuerpos antinucleares, técnica del anticuerpo fluorescente indirecta, enfermedades indiferenciadas del tejido conectivo. (Fuente: DeCS BIREME).
SUMMARY
Objectives: To determine the antinuclear antibody staining patterns identified by indirect immunofluorescence in patients with connective tissue disease in hospital level III in Lima, Peru. Methods: Cross-sectional study performed at the Servicio de Inmunología of the Hospital Nacional Arzobispo Loayza between January and June 2017. We reviewed 291 clinical charts of patients with connective tissue disease who had determination of antinuclear antibodies by indirect immunofluorescence. Results: 322 determinations were analyzed; patterns detected were PCNA 6 (1.86%); homogeneous pattern 109(33.85%), centromeric pattern 34(10.56%), speckled pattern 135(41.93%), cytoplasmic pattern 25(7.76%), nucleolar pattern 9(2.80%), NUMA 1- Huso achromatic pattern 3(0.93%) and lysosomal pattern 1(0.31%). The spectrum of diseases in which antinuclear antibodies were looked for were systemic lupus 85(29.21%), limited progressive systemic sclerosis CREST) 34(11.68%), Sjögren´s syndrome 77(26.46%), scleroderma 15(5.15%), mixed connective tissue disorders 72 (24.74%) and polymyositis 8 (2.75%). Conclusions: A high frequency of homogeneous and speckled patterns were observed, the former associated with systemic lupus and the latter with Sjögren´s syndrome. Detection of antinuclear antibodies by indirect immunofluorescence is an accurate diagnostic method.
KEYWORDS: Antibodies, antinuclear, fluorescent antibody technique, indirect, undifferentiated connective tissue diseases. (Source: MeSH NLM).
INTRODUCCIÓN
Las enfermedades autoinmunes son causadas por daño intrínseco del sistema inmunológico, que produce la pérdida de la auto tolerancia, con respuestas anormales frente a estructuras propias, causando daño tisular que se mantiene en el tiempo (1); las causas son poco conocidas, aunque se han podido reconocer múltiples factores etiológicos y varios de los genes involucrados están relacionados con el reconocimiento proteico entre las superficies de las membranas celulares del sistema inmunológico y las que forman el resto del organismo. La mayor contribución se debe a los genes del sistema de histocompatibilidad (SPH) y hay múltiples ejemplos de asociación entre las enfermedades autoinmunes y determinados antígenos del SPH, ya que estos genes pueden influir en la selección de los linfocitos autorreactivos y en el desarrollo de la autotolerancia (1,2).
La frecuencia de anticuerpos antinucleares (ANA) es alta en el lupus eritematoso sistémico, síndrome de Sjögren, esclerodermia, enfermedad mixta del tejido conectivo, hepatopatías autoinmunes, entre otras. Se ha estudiado el valor diagnóstico de la determinación de ANA en diferentes enfermedades, mostrando el significado de ANA en el lupus sistémico y la esclerodermia, y asimismo se evidencia aun sobre la interpretación de los altos títulos de ANA en otros trastornos autoinmunes como en enfermedades sin patogénesis autoinmune y sanas (3).
El estudio de los anticuerpos antinucleares (ANA) se inició con la identificación en pacientes con lupus eritematoso generalizado de las células LE, descrito por Hargraves en 1948 (4).
La detección de las células LE fue durante mucho tiempo una prueba utilizada para confirmar el diagnóstico de lupus eritematoso sistémico. Sin embargo, años después se demostró su baja especificidad, ya que pueden estar presentes en pacientes con artritis reumatoide (25%), síndrome de Sjögren (15–20%), cirrosis pancreática (33%), hepatitis crónica activa (50–70%) y en otras enfermedades (1–2% miastenia gravis y púrpura trombocitopenia idiopática). En 1959, Holman mostró que el fenómeno de las células LE se debía a la presencia de anticuerpos que reconocen antígenos nucleares (5).
El lupus eritematoso es definido como una enfermedad multisistémica de origen autoinmune, caracterizada por un conjunto de auto-anticuerpos, particularmente los anticuerpos antinucleares citoplasmáticos (6); por lo general tiene un comienzo agudo o insidioso y es considerada una enfermedad crónica que tiene episodios de remisión y de recidivas. Clínicamente es caracterizada por lesiones en la piel, las articulaciones, los riñones y principalmente las membranas serosas, aunque es conocido que puede afectar cualquier órgano del cuerpo (7-10).
Actualmente, la técnica más utilizada para la detección de los anticuerpos antinucleares es la Inmunofluorescencia Indirecta, la cual fue desarrollada en 1950 por Coons et al (11).
La técnica de Inmunofluorescencia Indirecta (IFI), emplea cortes de varios tejidos o la línea celular tumoral (HEp-2) de epitelioma laríngeo humano como fuente antigénica, se utiliza ampliamente para el diagnóstico de enfermedades autoinmunes de muchos laboratorios (12,13). En la Inmunofluorescencia Indirecta (IFI), los antígenos no definidos son reconocidos por los anticuerpos en el suero del paciente y ofrecen determinados patrones que son interpretados en relación con su asociación a enfermedades (14).
Existen tres tipos de clasificación de los anticuerpos antinucleares; las cuales son ANA natural, ANA infeccioso y ANA autoinmunes (15), estos últimos reflejan la pérdida de la tolerancia inmunológica y su origen es multifactorial, su producción depende de la carga genética, del medio ambiente y de cambios hormonales (16).
El sustrato utilizado para la detección de los anticuerpos antinucleares es importante, ya que existen antígenos cuya concentración en las células de los tejidos es baja en contraste con lo que sucede en las células HEp-2, que por ser una línea celular epitelial su concentración está aumentada; otra característica de estas células es que tienen de 46 cromosomas, más de dos nucléolos y, por ser células muy activas metabólicamente, tienen una gran cantidad de mitocondrias (17).
El estudio de los ANA por IFI sobre células HEp-2 debe incluir los patrones nucleares de células en interface y en mitosis, también en el citoplasma celular, debido a que existen antígenos que solo se expresan en determinadas fases del ciclo celular o en el citoplasma (15,18).
Los anticuerpos antinucleares mediante inmunofluorescencia indirecta en líneas celulares se considera la prueba inicial de laboratorio que apoya al diagnóstico de las enfermedades autoinmunes debido a su alta sensibilidad.
El objetivo del trabajo fue determinar la frecuencia de patrones de tinción de anticuerpos antinucleares identificados por Inmunofluorescencia Indirecta en pacientes con enfermedad del tejido conectivo en un hospital de nivel III de Lima, Perú.
MATERIAL Y MÉTODOS
Estudio de tipo cuantitativo, observacional, descriptivo y transversal realizado en el Servicio de Inmunología del Hospital Nacional Arzobispo Loayza entre enero y junio del 2017. Se revisaron 291 historias clínicas de los pacientes para confirmar el diagnóstico de la enfermedad y se procesaron muestras de sangre de los pacientes.
Para la detección de los patrones de tinción de anticuerpos antinucleares en suero de los pacientes con enfermedad del tejido conectivo se empleó el kit inmunológico, y se realizó la dilución 1/160 para confirmar la positividad de anticuerpos antinucleares y observación con microscopio de Inmunofluorescencia a 40X.
Metodología de Inmunofluorescencia Indirecta (IFI -ANA)
Preparación del buffer: Se diluye un sobre de PBS en un litro de agua destilada y se agrega un frasco de tween 20, se agita suavemente.
Preparación de la muestra (suero): Se diluye 990 ul de buffer con 10 ul de muestra (1:100). Se homogeniza los tubos en el vortex por aproximadamente 5 segundos. Se coloca 30 ul de suero diluido inmediatamente, asegurándose que coincida la ranura de la placa; se incuba durante 30 minutos. Se lava con el buffer, enjuagando la lámina previamente y luego dejándola por 5 minutos en el frasco Coplin. Se carga 30 ul de conjugado correspondiente al kit Hep 20-10 Euroimmun AG en cada cuadrante de placa Tray. Se coloca inmediatamente la impronta correspondiente asegurándose que coincida la ranura de la placa. Se incuba durante 40 minutos, protegiendo de la exposición a la luz. Luego se lava usando el buffer, enjuagando la lámina previamente, dejándola por 5 minutos en el frasco de Coplin. Se agregar una gota de glicerol y se coloca la lámina cubreobjetos. Se observa al microscopio de fluorescencia con el objetivo de 40X.
Importante, se colocó control positivo estandarizado en cada impronta, suero humano con anticuerpos antinucleares (ANA) patrón homogéneo grado IV, azida de sodio 0,95 g/l. La especificidad del control positivo ANA está verificada frente al suero de referencia AF/CDC1 del Center for Disease Control y se colocó control negativo estandarizado en cada impronta, suero humano negativo a tamizaje infeccioso y AAN negativo. Se numeran las improntas en caso de correr más de 10 muestras y rápidamente para evitar desecación de la impronta.
Análisis estadístico
Todos los análisis estadísticos se realizaron con el paquete estadístico SPSS versión 20 para Windows y el programa Microsoft Excel 2016. Se utilizó la prueba de Chi cuadrado de Pearson para las variables categóricas, considerando significativo un valor de p <0,05.
Este estudio fue conducido de acuerdo con los principios éticos que tienen su origen en la Declaración de Helsinki, el estudio fue evaluado y aprobado por el comité de ética del Instituto de Ética en Salud de la Universidad Nacional Mayor de San Marcos y por el del Hospital Nacional Arzobispo Loayza.
RESULTADOS
Se estudiaron 291 pacientes con enfermedad del tejido conectivo, 217 de sexo femenino (74,57%) y 74 de sexo masculino (25,43%). La frecuencia de anticuerpos antinucleares positivo fue 322, la distribución según patrones se muestra en la tabla 1 y según enfermedad en la tabla 2.
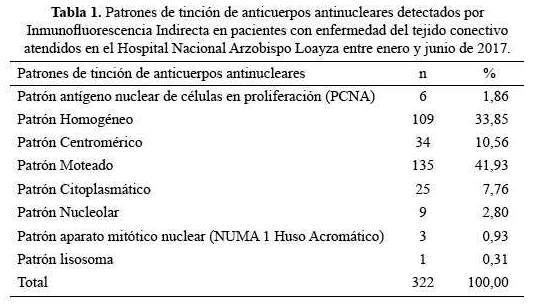

Cincuenta y ocho (68,2%) de los pacientes con Lupus eritematoso sistémico (LES) tenían patrón de tinción homogéneo (p<0,001), mientras que el patrón moteado fue menos frecuente en LES (p<0,001) (tabla 3).
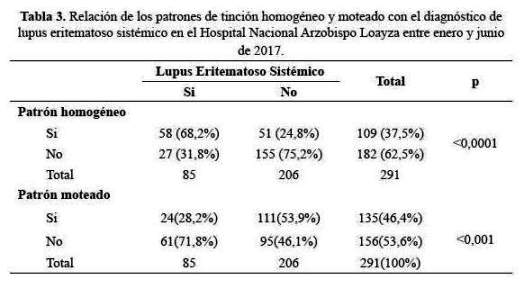
Se encontró asociación entre el patrón de tinción centromérico y CREST (p<0,0001 Prueba exacta de Fisher) (tabla 4).
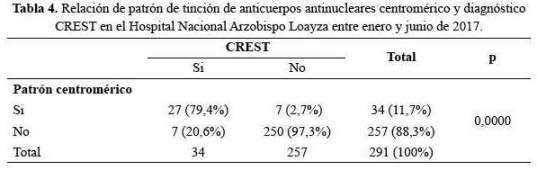
En Síndrome de Sjögren fue más frecuente el patrón moteado (p<0,0001) y menos frecuente el patrón homogéneo (p<0,001) (tabla 5).
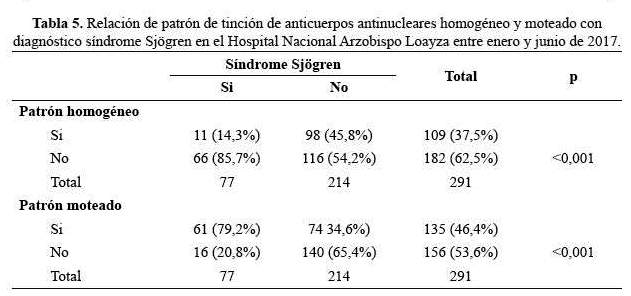
Cuarenta (55,6%) de los pacientes con enfermedad mixta del tejido conectivo tenían patrón de tinción moteado (p=0,078), mientras que treinta (41,7%) de los pacientes tenían el patrón de tinción homogéneo (p=0,403).
Siete (87,5%) de los pacientes con polimiositis tenían patrón de tinción citoplasmático (p<0,0001 Prueba exacta de Fisher).
DISCUSIÓN
En el estudio se encontraron 85 casos con diagnóstico de lupus eritematoso sistémico, 58 casos presentaron patrón homogéneo, 24 casos patrón moteado y 3 casos patrón mixto, hallazgo similar al de los estudios de Sontheimer et al. (19) y Carpinelli et al. (20), los que muestran que el patrón moteado se relaciona con anticuerpos frente a varias fibronucleoproteínas y se observa en lupus eritematoso sistémico, enfermedades mixtas del tejido conectivo y esclerodermia.
Sometheimer et al. (19) y Bernstein et al. (21), muestran que el modelo centromérico es característico del síndrome CREST (calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias), de manera similar a Smolen y Billings (22,23), lo que concuerda con nuestro estudio.
A nivel latinoamericano se han realizado algunos trabajos en enfermedades del tejido conectivo relacionados con la presencia de anticuerpos antinucleares; en Argentina Bovone et al. (24), hallaron relación significativa de los patrones de tinción homogéneo, moteado con el lupus eritematoso sistémico y con el síndrome de Sjögren, similar a nuestro estudio.
En nuestro estudio utilizamos el kit de células Hep 20-10, la cual a diferencia de la Hep 2, contiene 10 veces más células mitóticas, lo que permite identificar más fácilmente las reacciones contra estructuras específicas (centrómeros, fibras del huso, zona de la separación, centriolos), que con las preparaciones convencionales.
Usando las células Hep 20-10 muchos anticuerpos contra los núcleos celulares pueden ser analizados, los anticuerpos contra ADN, histonas, ARN, RNPn, SM, SS-A, SS-B, puntos nucleares, centrómeros, membrana nuclear, nucléolos (PM-SCL, fibrilación, ARN polimerasa I, NOR), SCL-70, ciclina I y II, fibras del huso, cuerpo de los centriolos. Además, los autoanticuerpos citoplásmicos se identifican con las células Hep 20-10: anticuerpos contra ribosomas, Jo-1, mitocondrias, aparato de Golgi y actinia.
En conclusión, se determinó elevada frecuencia del patrón homogéneo y del patrón moteado en pacientes con enfermedad del tejido conectivo. El patrón homogéneo se asoció fuertemente al lupus eritematoso sistémico y el patrón moteado se asoció al síndrome de Sjögren. Por lo tanto, el método ANA-IFI puede reducir el gasto de un trabajo inmunológico detallado con una pérdida mínima en la exactitud diagnóstica de la enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1.Abbas AK, Lichtman AH, Pillai S. Inmunología celular y molecular. Madrid: Elsevier Saunders; 2008. pp. 432-439. [ Links ]
2.Salamuniae I. Laboratory diagnosis of autoimmune diseases new technologies, old dilemmas. Biochemia Medica. 2010; 20(1):45-56. [ Links ]
3.Baleva M, Lesichkova S, Gesheva N, et al. Diagnostic significance of the titer of antinuclear antibodies. Inmunologia clínica; 2017; 1:83-99
4.Hargraves M, Richmond H, Morton R. Presentation of two bone marrow elements; the tart cell and L.E cell. Proceedings of the staff meetings Mayo Clinic. 1948; 23(2):25-28. [ Links ]
5. Holman H, Deicher H. The reaction of the lupus erythematosus (LE) cell factor with deoxyribonucleoprotein of the cell nucleus. J Clin Invest. 1959; 38: 2059-2072. [ Links ]
6. Carballo O, Ingénito F, Ginaca A, Carabajal P, Costa M, Balbaryski J. Primer Consenso Argentino para la Estandarización de la Determinación de Anticuerpos Anti-Nucleares por Inmunofluorescencia Indirecta– HEp-2. Acta Bioquímica Clínica Latinoamericana. 2012; 46 (1):3-13. [ Links ]
7. Rahman A, Isenberg D. Systemic Lupus Erythematous. Mechanisms of Disease. New England Journal of Medicine. 2008; 358(9):929-939. [ Links ]
8.Fauci AS, Kasper DL, Braunwald E, et al., editors. Harrisons principles of internal medicine. New York: McGraw Hill; 2008. [ Links ]
9. Grigor R, Admones. J, Lewkonia R, et al. Systemic Lupus Erythematous: A prospective Analysis. Annals of the Rheumatic Diseases. 1978; 37(2):121-128. [ Links ]
10. Sánchez S, Barajas G, Ramírez E, Moreno A, Barbosa O. Lupus Eritematoso: Enfermedad autoinmune sistémica y órgano específico. Revista Biomédica. 2004; 15(1):173-180. [ Links ]
11. Coons A, Kaplan M. Localization of antigen in tissue cells; improvements in a method for the detection of antigen by means of fluorescent antibody. Journal of Experimental Medicine. 1950; 91(1):1-13. [ Links ]
12. Copple SS, Giles SR, Jaskowski TD, et al. Screening for IgG antinuclear autoantibodies by HEp-2 indirect fluorescent antibody assays and the need for standardization. American Journal of Clinical Pathology. 2012; 137(5):825-830. [ Links ]
13. Hoffman IE, Peene I, Veys EM, De Keyser F. Detection of specific antinuclear reactivities in patients with negative anti-nuclear antibody immunofluorescence screening tests. Clinical Chemistry. 2002; 48(12):2171-2176. [ Links ]
14. Stinton LM, Fritzler MJ. A clinical approach to autoantibody testing in systemic autoimmune rheumatic disorders. Autoimmunity Reviews. 2007; 7(1): 77-84. [ Links ]
15. Cabiedes J, Nuñez C. Anticuerpos antinucleares. Reumatología Clínica. 2010; 6(4):224-230. [ Links ]
16. Oertelt S, Invernizzi P, Podda M, Gershwin ME.What is an autoantibody? In: Shoenfeld Y, Meroni PL, Gershwin M, editors. Autoantibodies. Campania: Elsevier; 2007. p. 3-6.15. [ Links ]
17. Damoiseaux JG, Tervaert JW. From ANA to ENA: How to proceed? Autoimmunity Reviews. 2006;5(1):10-17. [ Links ]
18. Mariz HA, Sato EI, Barbosa SH, Rodrigues SH, Dellavance A, Andrade LE. Pattern on the antinuclear antibody Hep-2 test is a critical parameter for discriminating antinuclear antibody –positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis & Rheumatology. 2011; 63(1):191-200. [ Links ]
19. Sontheimer R, McCauliffe D, Zappi E, Targoff I. Antinuclear antibodies: clinical correlations and biologic significance. Advances in dermatology. 1992; 7(1):3-52. [ Links ]
20. Carpinelli M, Giménez V, Ferreira L, Rovira C, Picaguá E, Granados E. Frecuencia de los patrones de anticuerpos anti-nucleares en pacientes con sospecha clínica de LES. Mem Inst Investig Cienc Salud. 2010; 8(2):27-33. [ Links ]
21. Bernstein RM, Steigerwald JC, Tan EM. Association of antinuclear and antinuclear antibodies in progressive systemic sclerosis. Clinical & Experimental Immunology. 1982; 48(1):43-51. [ Links ]
22. Smolen JS, Steiner G. Mixed connective tissue disease. To be or not to be? Arthritis & Rheumatism. 1998; 41(5): 768-777. [ Links ]
23. Billings PB, Allen RW, Jensen FC, Hoch SO. Anti-RNP monoclonal antibodies derived from a mouse strain with lupus-like autoimmunity. Journal of Immunology. 1982; 128(3):1176-1180. [ Links ]
24. Bovone N, Fuente M, Eposto E. Detección de anticuerpos anti-núcleo con inmunoensayo lineal: Correlación con inmunofluorescencia indirecta. Acta Bioquímica Clínica Latinoamericana. 2005; 39 (4):423-428. [ Links ]
Declaración de financiamiento y de conflictos de interés: El estudio fue financiado por los autores. Los autores declaran no tener conflicto de interés.
Contribuciones de autoría: JOM, participo en la concepción del estudio, la recolección de datos, interpretación de los datos y redacción del artículo. JOM, JAA, JOC, MAGH aprobaron la versión final del manuscrito.
Correspondencia
José Enrique Oliva-Menacho.
Correo electrónico: jose.oliva.m@upch.pe
Celular: 51990009733 / 51997286770
Recibido: 21/08/2018
Aceptado: 28/12/2018













