INTRODUCCIÓN
La Tomografía de coherencia óptica (OCT) se ha convertido en el estándar de oro para el diagnóstico de muchas enfermedades maculares de la retina. Desde que se inició su uso en la práctica clínica, su desarrollo tecnológico ha evolucionado aportando pautas diagnósticas cada vez más precisas, muchas de las cuales se están estudiando actualmente para predecir respuestas a los tratamientos de estas enfermedades maculares.
Estas pautas diagnósticas han sido denominadas biomarcadores tomográficos que se han ido descubriendo en el análisis retrospectivo de los exámenes tomográficos realizados a los participantes de los ensayos clínicos pivotales probando la eficacia y seguridad de drogas para enfermedades maculares de diverso tipo. Las asociaciones encontradas entre los resultados visuales de los tratamientos empleados y las características tomográficas previas y posteriores de las retinas sometidas a tratamiento, vienen explicando porque algunos pacientes responden mejor que otros.
Es el caso del edema macular diabético (EMD), que actualmente es la causa más frecuente de disminución de la visión en pacientes diabéticos y con la que en las últimas dos décadas, se ha realizado una intensa investigación, tanto para mejorar su diagnóstico como para hacer más efectivo su tratamiento 1.
El impacto de estas investigaciones que se está teniendo sobre la decisión de tratar esta enfermedad macular justifica extender este conocimiento a médicos no oftalmólogos que tratan pacientes en su especialidad con padecimientos oculares concurrentes y deben recomendar la mejor manera de proceder con esta parte de su afección de salud, especialmente médicos internistas, geriatras, endocrinólogos, reumatólogos, cardiologos y otros.
Se realizó una búsqueda bibliográfica en PubMed, Lilacs y EBSCO para artículos de revisión, ensayos clínicos y meta-análisis en inglés, español y portugués publicados en los últimos 5 años, usando los términos “Biomarker” OR “ocular coherence tomografy” OR “OCT” AND “Diabetic macular edema” AND “diagnosis” OR “Outcomes”, encontrándose 16 artículos para sustentar esta revisión.
Se realizó esta revisión para compartir con la comunidad médica en general que trata pacientes diabéticos, las alternativas de diagnóstico que tiene el EMD y el potencial valor pronóstico que tiene la OCT en el estudio de estos pacientes.
Tomografía de Coherencia Óptica (OCT)
La OCT es un examen no invasivo que, haciendo uso de una luz de láser que barre el tejido retiniano permite obtener imágenes de la mácula de alta resolución y estudiar morfológicamente la retina y la coroides, pudiendo cuantificar volumétricamente su espesor en tiempo real 2.
La OCT permite detectar el edema macular antes de que el engrosamiento retiniano sea visible al examen oftalmoscópico. Por la rapidez para la obtención de las imágenes y el carácter no invasivo del procedimiento, se ha convertido en el examen preferencial para el diagnóstico del EMD, y determinar, con mucha precisión, la alteración de la anatomía retiniana por efecto de la acumulación de fluido, identificando características en la retina afectada que se vinculan con su pronóstico funcional después del tratamiento o con su evolución natural 3,4.
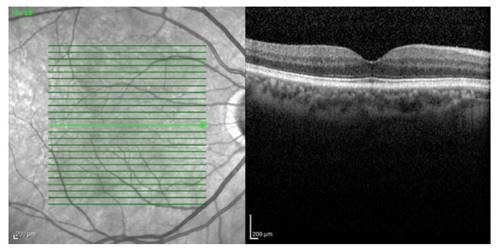
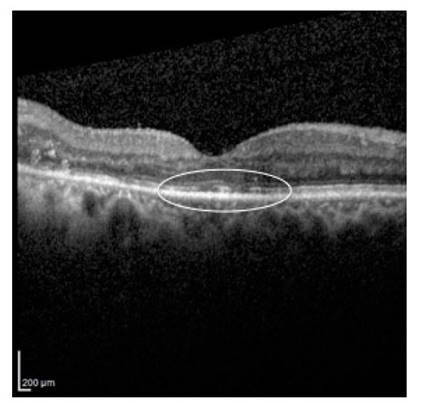
El corte tomográfico de la mácula es determinado por una línea que pasa por el centro foveal y se extiende como mínimo 250µ a cada lado del punto central. Este corte permite identificar con claridad la depresión foveal y la distribución segmentaria de las capas de la retina, incluyendo estructuras tisulares como la membrana limitante externa y la zona elipsoide, con una resolución aproximada de 5µ 2. La imagen tomográfica de la mácula correlaciona con las imágenes histológicas de la retina macular normal de una manera muy precisa y las herramientas del programa informático del tomógrafo permite además realizar mediciones lineales, de superficie y volumétricas de la imagen obtenida, estimando dimensiones muy cercanas a las reales y también reproducibles, que las hace muy útiles para el seguimiento de cualquier alteración macular por esta vía (Figura 1).
Edema macular diabético
El edema macular diabético (EMD) es una complicación de la diabetes mellitus que consiste en la acumulación de fluido intrarretiniano que produce engrosamiento de la retina a nivel macular afectando la visión central del ojo comprometido. Esta acumulación resulta del escape de fluido desde el intravascular de los capilares retinianos, por falla de la barrera hematorretiniana interna, que pierde su función de barrera por las alteraciones estructurales que sufre el endotelio capilar por efecto de la microangiopatía generada por la hiperglicemia 5.
En el proceso de daño del endotelio capilar (microangiopatía) están involucrados el factor de crecimiento vascular endotelial (VEGF) y un grupo de factores pro inflamatorios activados por el desequilibrio metabólico de la glucosa en la retina, que afectan las uniones fuertes de las células endoteliales de los capilares dejando escapar componentes del intravascular, generando acumulación de fluido en la retina, tanto por la alteración de las gradientes de difusión hidrostática, como de la gradiente osmótica, que ya existen 6.
Se estima que 10% de todos los diabéticos harían EMD alguna vez durante su vida, 4% con afectación importante de su visión central. En Latinoamérica se estima que afecta la visión del 5,5% de los diabéticos 7,8. La prevalencia se incrementa con la edad y con la necesidad de usar insulina. Puede presentarse de manera aislada como única afección retiniana o acompañar a la retinopatía diabética concurrente, siendo más prevalente mientras más severa es la retinopatía, razón por la cual en las clasificaciones modernas su presencia o ausencia se añade al estado de la retinopatía 7.
Diagnóstico del edema macular diabético con OCT
El EMD se diagnostica por oftalmoscopía, mejor cuando la retina se examina estereoscópicamente. Esta evaluación permite observar un engrosamiento de la retina donde hay edema, con pérdida del brillo retiniano y eventualmente manchas puntiformes con tendencia a aglomerarse de color amarillento a las que denominamos exudados duros.
Esta evaluación, que se realiza observando las lesiones en el plano superficial de la retina, generalmente es cualitativa. Algunas veces se puede dimensionar el daño retiniano en áreas o distancias lineales relativas, que se usan para la antigua clasificación del EMD que lo caracteriza en clínicamente significativo, cuando los hallazgos están cerca de la fovea y afectan la agudeza visual o en clínicamente no significativo cuando los cambios retinianos se encuentran alejados de la fovea y no afectan la agudeza visual.
Desde que se inició el uso de la OCT para el estudio de la retina en 1991, comenzó el diagnóstico del EMD en una nueva dimensión, que implicaba observar la acumulación del fluido ocupando el espesor de la retina, determinando con mucha precisión, cuál o cuáles de las 10 capas retinianas estaban afectadas. Esta tecnología permite ver la retina como en un corte histológico con 5µ de resolución, identificando todas las capas de la retina y algunas estructuras más que solo pueden apreciarse gracias al examen en vivo.
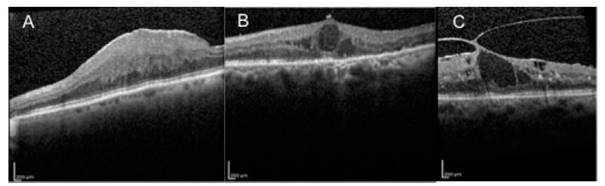
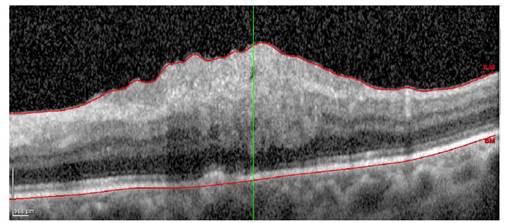
De esta manera, la principal característica tomográfica del EMD es el engrosamiento retiniano por el efecto de masa que ejerce el fluido anormal dentro de las células retinianas y a su alrededor. Este engrosamiento puede adoptar hasta 5 formas, dependiendo del lugar que ocupa el fluido anormal o de las circunstancias que se asocian a su producción: engrosamiento retiniano difuso, edema macular cistoideo, desprendimiento seroso de retina, edema macular por tracción de la hialoides posterior con desprendimiento de retina traccional y edema macular por tracción de la hialoides posterior sin desprendimiento de retina traccional 9 (Figura 2).
La EMD puede adoptar cinco formas tomográficas, que pasamos a describir:
1. Engrosamiento retiniano difuso (edema esponjoso)
Tiene una prevalencia del 97% de los EMD. Representa probablemente el efecto inicial del edema en la retina. Aparece primero como una reducción en la reflectividad del tejido intrarretiniano, asociado al aumento del grosor de la retina. Más tarde, la retina adopta un aspecto esponjoso.
2. EMD cistoide
Tiene una prevalencia del 55% y se caracteriza por la acumulación de líquido intrarretiniano en grandes espacios ovoideos bien definidos de baja reflectividad. Los espacios cistoides se forman en las proximidades de la capa plexiforme externa y la apariencia de roseta que se ve en las fases finales de la angiografía con fluoresceína es causada por la estructura anatómica de la capa plexiforme. La separación de los espacios cistoides la determina septos de alta reflectividad constituidos por fibras de las células de Müller, que son verticales. La anatomía está claramente delineada en OCT y se vuelve muy evidente en las fases finales de la AFG cuando se observa el típico escape petaloide. Este tipo de edema se relaciona con mayor pérdida de la agudeza visual.
3. EMD con desprendimiento de retina seroso
Tiene una prevalencia del 7% y se relaciona generalmente con un edema crónico. En estos pacientes la retina sensorial se eleva y los espacios quísticos confluyen. En la OCT se aprecia una acumulación oscura de fluido subretiniano que eleva la retina en forma de cúpula destacando su alta reflectividad, que representa la superficie externa de la retina desprendida y que permite diferenciar este fluido subretiniano del fluido intrarretiniano.
4. Edema por tracción de la hialoides posterior con desprendimiento de retina traccional
Tiene una prevalencia del 2,9%. En este caso es un engrosamiento macular acompañado de un desprendimiento traccional subclínico de la retina, detectable solamente por OCT y que particularmente debe tratarse con cirugía porque no responden bien al tratamiento médico. La OCT permite apreciar una banda de alta reflectividad frecuentemente de aspecto empinado, diferente del aspecto de cúpula que se aprecia en el desprendimiento seroso.
5.Edema por tracción de la hialoides posterior sin desprendimiento de retina traccional
Tiene una prevalencia de 12,7% y en el examen revela edema, pero no se detecta desprendimiento de retina.
Biomarcadores de OCT
Un biomarcador o marcador biológico de OCT para EMD es una característica morfológica identificable que aparece en las imágenes de la retina que se obtienen con la OCT asociada al estado patológico (presencia de edema) o de respuesta al tratamiento farmacológico (antiangiogénicos, antinflamatorios) 9. La presencia o no de biomarcadores podrían mejorar el asesoramiento del paciente, la estratificación del riesgo y el manejo clínico de la enfermedad ocular.
El estudio CHARTRES 10 demostró que el daño de la zona elipsoide (ZE), valores altos de desorganización de las capas la retina interna (DRIL) y la disminución del grosor central de la retina (GCR), todos ellos biomarcadores tomográficos de la retina, son buenos predictores de la respuesta a la terapia con antiangiogénicos de la AVMC de ojos con EMD 2,11. A la luz de nuevas investigaciones se siguen descubriendo más biomarcadores tomográficos de la retina y su asociación con el pronóstico funcional del tratamiento sigue en estudio.
Biomarcadores tomográficos del EMD
Los biomarcadores asociados a la evolución funcional de los ojos con EMD son los siguientes:
a) Grosor central retiniano
Es la medida estándar del grosor macular obtenida con el OCT que se puede utilizar objetivamente para diagnosticar y monitorizar el EMD. Se ha descrito que el cambio del grosor central retiniano medido antes y después del tratamiento recibido es un biomarcador de respuesta positiva al tratamiento intravítreo del EMD 11. Aunque la mayoría de pacientes tratados reducen significativamente el grosor macular, no se ha podido establecer una mejoría visual correspondiente 12, lo que ha permitido inferir que no es un buen predictor entre visitas de la agudeza visual mejor corregida.
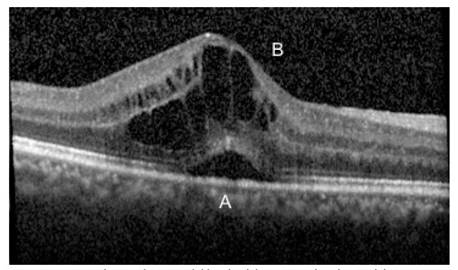
b) Quistes intrarretinianos
Son espacios ovalados hiporreflectivos que ocupan las capas plexiformes de la retina al acumularse en los espacios intercelulares el fluido que escapa de los capilares incompetentes afectados por la diabetes (fluido intrarretiniano) (11). Estos quistes tienden a aglomerarse y eventualmente fusionarse con los colindantes configurando el edema macular cistoideo. Luego de un tratamiento efectivo, primero se reducen de tamaño y luego pueden desaparecer. La persistencia de estos quistes a pesar del tratamiento se relaciona con cronicidad del edema y alteraciones estructurales de la retina circundante (Figura 3).
c) Fluido subrretiniano
Determina espacios hiporreflectivos inmediatamente por debajo de una línea hiperreflectiva que representa el plano de la retina desprendida 11. Su presencia configura el diagnóstico de uno de los tipos de EMD ya descritos (ver EMD con desprendimiento de retina seroso). Sin embargo, a pesar de poder permanecer en pequeñas cantidades (menos de 20µ de altura medido con el OCT) luego del tratamiento intravítreo del EMD, se ha asociado con buena recuperación visual del ojo tratado, ya no siendo necesario eliminar por completo el fluido subretiniano para detener el tratamiento.
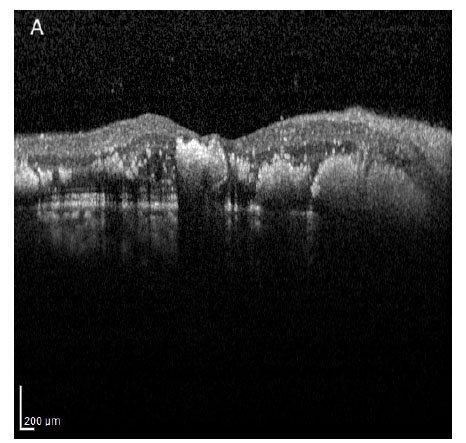
d) Puntos hiperreflectivos (PI)
Son manchas bien delimitadas de 20 a 40µ de diámetro de igual o mayor reflectividad que la banda del epitelio pigmentario de la retina y que se pueden ubicar en cualquier capa de la retina y por dentro de las paredes de los microaneurismas intra retinianos 13. Cuando estos puntos hiperreflectivos confluyen en la capa plexiforme externa de la retina coinciden con la ubicación en la que clínicamente se encuentran los exudados duros intra-retinianos. Los PI representan lipoproteínas que se extravasan después de la ruptura de la barrera hemato-retiniana interna. Cuando se ubican en la fóvea pueden asociarse a una función visual disminuida 13. Se sospecha también que conglomerados de pequeños PI en la retina interna podrían representar infiltrados inflamatorios asociados a microglía, cuya desaparición generalmente correlaciona con el tratamiento exitoso del EMD con dexametasona intravítrea 13 (Figura 4).
e) Interrupción de la línea elipsoide
La línea elipsoide es la segunda banda hiperreflectiva en la retina externa, inmediatamente después de la banda hiperreflectiva más gruesa de la retina que corresponde al complejo epitelio pigmentario retiniano y membrana de Bruch 14. Histológicamente corresponde a la zona elipsoide (ZE) que representa la unión de los segmentos externos con los segmentos internos de los fotorreceptores. Su interrupción está asociada con un pronóstico visual más pobre en los pacientes tratados para EMD 14.
f) Interrupción de la membrana limitante externa
La membrana limitante externa (MLE) representa la unión del cuerpo citoplasmático con el cilio modificado (constituido por los segmentos externo e interno) de los foto-receptores. Estas uniones alineadas en un mismo plano en toda la retina le otorgan un aspecto de membrana al corte histológico derivando de allí su nombre 15. Se ha observado que aquellos pacientes con alteraciones de la MLE al inicio de su tratamiento son más propensos a continuar con esta alteración en los controles posteriores. En un estudio de cohortes de 154 ojos tratados para EMD, se asoció una disminución de la agudeza visual mejor corregida con el incremento de las alteraciones tanto de la MLE como de la ZE 15 (Figura 5).
g) Desorganización de las capas de la retina interna (DRIL)
Se define como la extensión horizontal en micras dentro de las cuales no se puede identificar los límites entre la banda de células ganglionares, el complejo de la capa plexiforme interna, la capa nuclear interna y la capa plexiforme externa 16. Las capas internas de la retina consisten en axones, células bipolares y núcleos de células amacrinas, todos los cuales son importantes para la transmisión de señales visuales desde los fotorreceptores a la capa de células ganglionares. La DRIL implica daño a estas estructuras que conduce a un procesamiento visual anormal. Esta DRIL puede ocurrir tanto en el EMD con compromiso foveal como con el extrafoveal y en la actualidad es un parámetro no invasivo que correlaciona muy bien con la agudeza visual durante el EMD o después de su tratamiento 16,17 (Figura 6).
CONCLUSIONES
Los pacientes con EMD tienen problemas multiorgánicos que requieren de una atención multidisciplinaria que da lugar a la intervención de diversos especialistas en su manejo. Muchos de estos especialistas reciben a pacientes diabéticos antes de su evaluación oftalmológica.
Reconocer que un paciente puede estar haciendo un EMD puede ayudar a que estos pacientes lleguen pronto al oftalmólogo y conocer que existen medios diagnósticos no invasivos que pueden ayudar a confirmarlo y a permitir anticipar posibles resultados del tratamiento que puedan recibir puede reforzar la recomendación al paciente de llegar más pronto aún.
Sin embargo, también existe la posibilidad que, en el mediano plazo, especialistas no oftalmólogos puedan estar solicitanto OCTs para el diagnóstico del EMD y reconocer biomarcadores que puedan permitirle explicar a su paciente por qué debe consultar pronto a su oftalmólogo.