INTRODUCCIÓN
La leucemia mieloide crónica es una enfermedad mieloproliferativa maligna caracterizada por una proliferación desregulada de precursores mieloides que comprometen la formación de leucocitos (exceptuando linfocitos), eritrocitos y plaquetas, en la cual se ha identificado la presencia del cromosoma Philadelphia (Ph+) que codifica la tirosina cinasa BCR-ABL constitutivamente activa, como condición característica de la enfermedad 1.
Desde la introducción de los inhibidores de tirosina cinasa (ITK) a principios del presente siglo, la progresión desde la fase crónica hacia fases más avanzadas ha tenido una notable disminución en su incidencia 2, lo cual ha significado un cambio de paradigma en el tratamiento al lograr niveles de respuesta clínica (hematológica, citogenética y molecular) sustancialmente profundas que se corresponden con la mejora tanto en la sobrevida libre de progresión como la sobrevida general de los pacientes, que resulta ser en la actualidad comparable a la de la población general 3,4. Sin embargo, al pasar de considerarse una enfermedad con alto potencial letal a una enfermedad crónica, la prevalencia de la enfermedad ha crecido de manera progresiva y se estima que alrededor del 25% de los pacientes requerirán cambios en su tratamiento con ITK por intolerancia 5) , o resistencia, frente a lo cual se ha documentado que alrededor del 40% de los pacientes no responderán adecuadamente a imatinib 6, debido a múltiples mecanismos de resistencia (amplificación genética, mutaciones en ABL y bombas de eflujo de fármacos) 7, dando lugar al desarrollo de nuevas moléculas de ITK con efecto en BCR-ABL.
En Perú, de acuerdo a la información del Instituto Nacional de Enfermedades Neoplásicas (INEN) se reporta la leucemia mieloide crónica entre las cinco neoplasias malignas más frecuentes 8, con mayor incidencia en población masculina (relación hombre/mujer 1,6/1) 9 siendo responsable del 4,5% de las defunciones totales, ubicándose como la sexta causa de muerte por cáncer. El 79,4% de los pacientes se diagnostica en fase crónica y la incidencia para el período 2000-2009 se calcula en 1,2 casos por 100000 habitantes 9, ligeramente por debajo de lo reportado en Estados Unidos con 1,5-1,8 casos por 100 000 habitantes 10.
En este reporte se muestra el resultado del uso de ponatinib, en el tratamiento de una paciente con diagnóstico de leucemia mieloide crónica en fase crónica quien no tuvo respuesta óptima al tratamiento con imatinib y posteriormente a dasatinib.
PRESENTACIÓN DEL CASO
Mujer de 54 años, con diagnóstico de leucemia mieloide crónica, en fase crónica, quien inició tratamiento de primera línea con imatinib a dosis de 400 mg/día, inicialmente con adecuada respuesta clínica. En su primer control a los 6 meses de tratamiento tuvo respuesta citogenética completa; en el segundo control a los 2 años y 2 meses de tratamiento se evidenció elevación del recuento leucocitario y plaquetario, ajustándose la dosis de imatinib a 500 mg/día, y en el tercer control hubo pérdida de la respuesta hematológica con aparición de síntomas como náuseas, intolerancia a la vía oral y fatiga, por ello, se aumentó la dosis a 600 mg/día de imatinib.
Valoración diagnóstica
Se remitió al Hospital Nacional Guillermo Almenara Yrigoyen para estudio de resistencia y tratamiento de segunda línea. En la evaluación de respuesta molecular se reportó BCR-ABLIS 25% y respuesta citogenética completa, solicitándose estudio mutacional para evaluar la presencia de T315I.
Dos meses después, estando aún pendiente el resultado del estudio mutacional, se inició tratamiento en segunda línea con dasatinib a 100 mg/día.
Al mes de tratamiento se encontró BCR-ABLIS 34% y el estudio citogenético reportó la presencia de cromosoma Philadelphia en 20 metafases, compatible con pérdida de respuesta citogenética respecto a control anterior, no obstante, sin hallazgos en el aspirado de médula ósea compatibles con progresión de la enfermedad. El reporte de panel mutacional indicó mutación T315I en dominio ABL positivo. Dado lo anterior, se suspendió dasatinib y se inició hidroxicarbamida 500 mg c/8 horas por 6 meses con seguimiento hematológico, renal y hepático. Finalmente, en el mismo mes se solicitó valoración por la unidad de trasplante de médula ósea, que emitió opinión desfavorable para la realización del procedimiento, a pesar de contar con estudio de HLA reportando histocompatibilidad haploidéntica con 4 hermanos.
Tres meses después, se solicitó inicio de ponatinib al Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de EsSalud, con respuesta negativa.
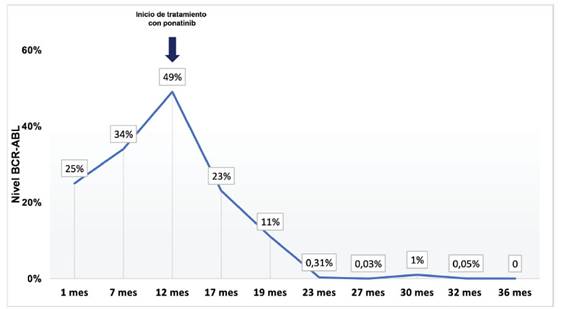
Para el control un año después, se reportó progresión en la pérdida de respuesta molecular con BCR-ABLIS 49%, continuó con hidroxicarbamida 500 mg c/12 horas (disminución de la dosis debido a anemia).
Intervención terapéutica
A los 21 meses de tratamiento con hidroxicarbamida, se inició tratamiento con ponatinib a dosis de 45 mg/día manteniéndose por 5 meses, con posterior disminución a 15 mg/día -debido a la presentación de reacción psoriasiforme grado 1- por espacio de 18 días con posterior reajuste a 30 mg/día por 6 meses. A los 11 meses de tratamiento se ajusta nuevamente a 15 mg por presentar hipertrigliceridemia moderada, manteniéndose la dosis por 5 meses.
Resultados y seguimiento
En el control a los 5 meses, se evidenció una pérdida de respuesta dado BCR-ABLIS de 1% con previo de 0,03%, por lo cual y ante mejor control en niveles de triglicéridos, se incrementó la dosis a 30 mg/día, la que se mantiene en la actualidad. El último reporte de BCR-ABLIS fue de 0,053 %. En los controles posteriores al inicio de ponatinib, se evidenciaron respuesta hematológica y citogenética completas, sin ocurrencia de reacciones adversas hematológicas o no hematológicas en grado 3-4 de severidad, ni reporte de hallazgos clínicos o paraclínicos de seguridad compatibles con eventos oclusivos arteriales o venosos. En la tabla 1 se muestra el seguimiento paraclínico.
Tabla 1 Reportes seriados de control paraclínico (hemograma y química sanguínea).
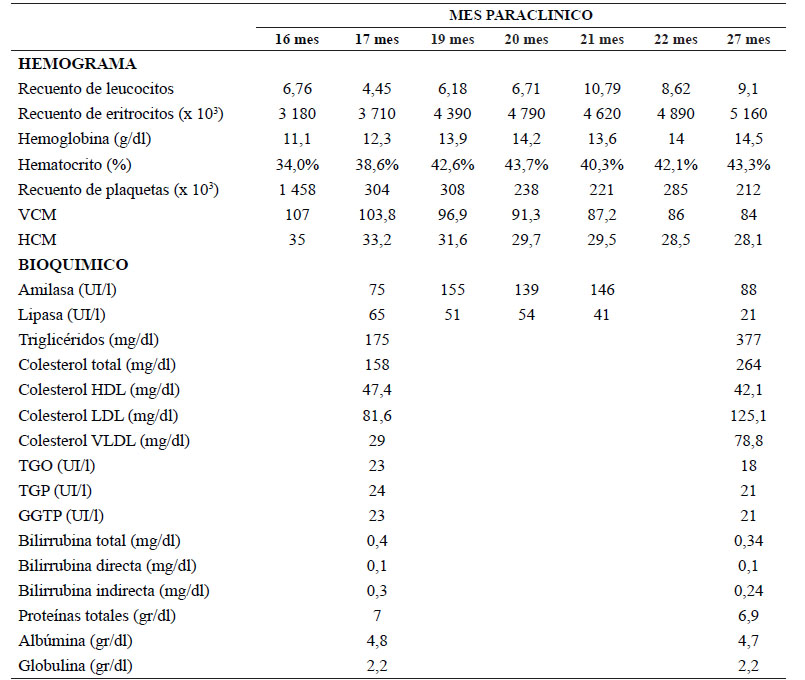
VCM: Volumen corpuscular medio; HCM: Hemoglobina corpuscular media
TGO: Transaminasa glutámico oxalacética; TGP: Transaminasa glutâmico pirúvia; GGTP: Gama glutamil transpeptidasa.
DISCUSIÓN
En el tratamiento de la leucemia mieloide crónica se ha documentado pérdida de la respuesta a los ITK en al menos uno de cada tres pacientes que se encuentran en fase crónica; sin embargo, la frecuencia puede ser mayor en fases avanzadas de la enfermedad 11. Dentro de los diferentes mecanismos de resistencia descritos, se considera que las mutaciones del dominio cinasa de BCR-ABL o sitio de unión del ATP (se han documentado más de 70 mutaciones entre simples y compuestas) son las principales responsables de la pérdida/falta de respuesta. Alrededor de 50% de dichas mutaciones responsables de resistencia al tratamiento, pueden ser tratadas con ITK de segunda generación (dasatinib, nilotinib o bosutinib) 12,13, no obstante la respuesta no siempre es completa, máxime si se tiene en cuenta que ninguno de los ITK de primera y segunda generación, inhiben la mutación T315I del BCR-ABL en la que se incorpora un voluminoso residuo de isoleucina donde en principio (BCR-ABL no mutado) debería haber una treonina en la posición 315 (mutación guardián o gatekeeper), llevando a que la isoleucina bloquee el acceso al sitio activo por parte de todos los ITK exceptuando ponatinib 14; esta molécula diseñada con técnicas de química computacional, con la facultad de evadir el bloqueo estérico de la isoleucina que impide el acople de los demás ITK al sitio activo gracias a un novedoso enlace triple entre dos carbonos extendido desde la base de la purina 14,15, demostrando en modelos preclínicos una completa inhibición de la actividad de BCR-ABL con o sin mutaciones simples y la mayoría de las mutaciones compuestas a concentraciones IC50 de 40nM 16). Tal nivel de efecto inhibitorio no sólo permite alcanzar respuestas citogenéticas y moleculares de manera más rápida y profunda, sino que además reduce el riesgo de aparición de nuevas mutaciones y por ende la posibilidad de recaída y progresión en la enfermedad 17,18.
En cuanto a eficacia clínica, ponatinib ha demostrado resultados robustos en pacientes con falla a por lo menos dos esquemas previos de ITK sin importar la presencia o no de la mutación T315I, razón principal de su aprobación por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) en diciembre de 2012 y la Agencia Europea de Medicamentos (EMA) en julio de 2013 para el tratamiento de la leucemia mieloide crónica con resistencia/intolerancia a dasatinib o nilotinib así como para el manejo de la leucemia linfoblástica aguda cromosoma Philadelphia positivo (LLA Ph+)19,20, luego de publicarse el ensayo clínico pivotal (PACE), donde en referencia a pacientes con mutación T315I en fase crónica a 12 meses se evidenció: (i) respuesta citogenética mayor 70%, (ii) respuesta citogenética completa 66% y (iii) respuesta molecular mayor de 56%, con un porcentaje de (iv) permanencia en remisión citogenética mayor por 2 años de 87% (99 % para pacientes T315I positivos), (v) sobrevida libre de progresión de 67% (75% para pacientes T315I positivos) y (vi) sobrevida global de 86 %15. Al evaluar la seguridad, los eventos adversos no hematológicos más frecuentes fueron eritema cutáneo (34%), sequedad de piel (32%) y dolor abdominal (22%), en referencia a los hematológicos más frecuentes grados 3-4 se documentó trombocitopenia (37%), neutropenia (19%) y anemia (13%). Adicionalmente se reportaron eventos trombóticos arteriales en 9% de los pacientes (cardiovasculares 5,1%, cerebrovasculares 2,4% y vasculares periféricos en el 2%), los cuales se presentaron con mayor frecuencia en quienes tenían factores de riesgo cardiovascular no controlados 21.
Con base en tales resultados y la subsecuente inquietud respecto a seguridad, se diseñó el ensayo OPTIC para evaluar la respuesta a ponatinib con diferentes regímenes de dosificación en pacientes con leucemia mieloide crónica en fase crónica y establecer el perfil óptimo de eficacia/seguridad para la molécula. El análisis interino del estudio 22 reportó un mayor beneficio clínico al iniciar con 45 mg/día y una reducción a 15 mg/día una vez logrado BCR-ABLIS <1 %, evidenciando además una baja incidencia de eventos arterio-oclusivos a dicha dosis y por tanto un perfil de seguridad favorable; dando lugar a una nueva indicación suplementaria aprobada por FDA para el uso de este medicamento 23).
Por tanto y teniendo en cuenta la conducta terapéutica descrita en nuestra paciente con muy buenos resultados en cuanto al control de la enfermedad (logrando respuestas moleculares profundas en un tiempo menor a 7 meses), sin evidencia de eventos adversos graves de tipo arterio-oclusivo, se recomienda valorar el uso de ponatinib para pacientes con leucemia mieloide crónica en fase crónica que muestren respuesta inadecuada o pérdida de respuesta, así mismo, la pronta realización de estudios mutacionales de acuerdo a las recomendaciones de las guías NCCN 24 y ELN 25 con el objetivo de ajustar oportunamente el tratamiento, evitando la progresión hacia fases avanzadas donde se compromete notablemente la eficacia de los ITK, ensombreciéndose significativamente el pronóstico.
En conclusión, Ponatinib es un inhibidor de tirosina cinasa que se ha constituido en una alternativa terapéutica de probada eficacia, el cual ha permitido alcanzar adecuados niveles de respuesta citogenética y molecular en nuestra paciente, mostrando de momento un óptimo control de la enfermedad y el logro de una elevada calidad de vida, con un perfil de seguridad favorable.