INTRODUCCIÓN
Streptococcus agalactiae también llamado estreptococo del grupo B de Lancefield (EGB), es considerado un comensal de la microbiota intestinal, suele colonizar el tracto genitourinario y en la actualidad es causa importante de infecciones graves en recién nacidos (RN), embarazadas y adultos mayores. 1,2
El esquema de tratamiento de primera línea frente a EGB o para la profilaxis antibiótica intraparto es ampicilina (AMP) y penicilina (PE) (3,4). Sin embargo, en el caso de pacientes alérgicos a PE o ante la falta de respuesta clínica, se administra antimicrobianos alternativos como clindamicina (CLI) y eritromicina (ERI) en infecciones leves y vancomicina (VA), antibiótico de último recurso, usado en caso de pacientes alérgicos a PE y en cepas resistentes a CLI 1,3. Además, se ha observado que las tasas de resistencia a ERI y CLI de EGB causantes de infección invasiva en RN y adultos ha aumentado gradualmente 2,4,5. Otro antibiótico de uso menos común frente a EGB es levofloxacino (LEV), una fluoroquinolona (FQ) que no es utilizada en el tratamiento de infecciones por EGB en pediatría, pero es usado en pacientes adultos alérgicos a PE o con aislamientos resistentes a ERI. 4,5
En 2019, se informó del incremento de los aislamientos de EGB en muestras de orina, colocándolo como el tercer patógeno urinario más frecuentemente reportado en un hospital materno-infantil 6. Es por el aumento de casos y la resistencia a los antimicrobianos que se realizó este estudio con el objetivo de determinar la susceptibilidad antimicrobiana de EGB aislados en un hospital materno-infantil entre 2015-2020.
MATERIAL Y MÉTODOS
Estudio descriptivo, realizado en el laboratorio de microbiología del Hospital Nacional Docente Madre- Niño “San Bartolomé”, entre el 1 de enero de 2015 y 31 de diciembre de 2020.
Se siguieron los protocolos de cultivo estandarizados del laboratorio. Se incluyeron todos los cultivos positivos para EGB únicos y consecutivos, recuperados de 477 muestras de orina, 12 de secreción vaginal, 8 de herida, cuatro de sangre, cuatro de absceso y uno de líquido cefalorraquídeo. La identificación y susceptibilidad antimicrobiana se realizó con el sistema automatizado Vitek® 2 (BioMérieux, Francia). Los datos obtenidos se ingresaron en el programa WHONET 7 versión 5.6, a partir del cual fueron filtrados y unificados los datos para su posterior análisis.
Para evaluar los perfiles de susceptibilidad se determinó la concentración inhibitoria mínima (CIM) para los antibióticos AMP, PE, CLI, ERI, LEV y VA. Se interpretaron siguiendo los lineamientos del Clinical and Laboratory Standards Institute (CLSI).(8
Con la información obtenida se realizó el análisis a través del programa WHONET, el cual fue resumido en un formato de datos de Microsoft Excel. Así se determinaron porcentajes de resistencia y sensibilidad antimicrobiana.
Los microorganismos estudiados fueron recuperados e identificados como parte del diagnóstico microbiológico y analizados a partir de la base de datos de laboratorio de microbiología. Se analizaron las cepas bacterianas, los datos de los pacientes se manejaron de manera anónima, desconociéndose la identidad del paciente del cual fueran recuperados, garantizando de esta forma la confidencialidad. La obtención de datos fue autorizada por el departamento de Patología clínica del hospital “San Bartolomé” y, por las razones expuestas, exonerando de revisión por el comité de ética.
RESULTADOS
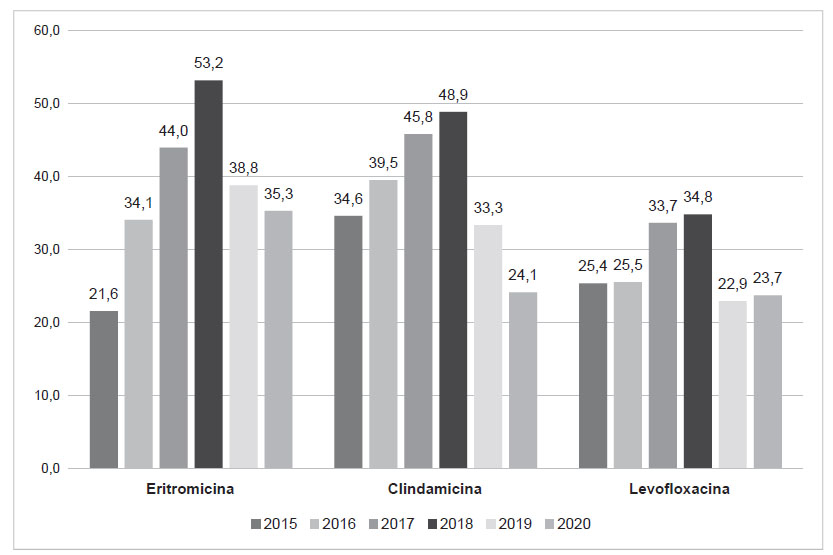
Se incluyeron en el estudio en total 506 aislamientos de EGB únicos y consecutivos (uno por paciente), de los cuales 500 (98,8%) fueron de mujeres. La edad media de los pacientes fue 31,9 ± 11,8 años. La distribución de los aislamientos por año y según el tipo de muestra se observa en la tabla 1. El perfil de susceptibilidad a los antimicrobianos de los aislamientos de EGB mostró que todos fueron sensibles a PE, AMP y VA; la tasa general de resistencia a ERI, CLI y LEV fue de 38,5%, 37,4% y 28%, respectivamente, mostrando un pico de resistencia en 2018 (gráfico 1).
Tabla 1 Distribución de los aislamientos de Streptococcus agalactiae por año y tipo de muestra.
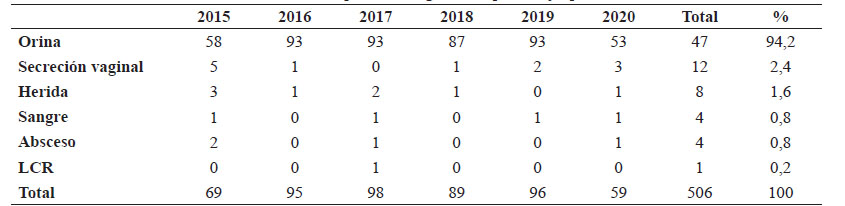
LCR: Líquido cefalorraquídeo
DISCUSIÓN
En este estudio encontramos que todos los aislamientos fueron sensibles a PE, AMP y VA. Además, se observó resistencia a ERI, CLI y LEV, con 38,5%, 37,4% y 28%, respectivamente; con un pico de resistencia en el año 2018.
Las infecciones por EGB son causas importantes de morbilidad y mortalidad en RN, gestantes y adultos mayores; además, se ha observado el incremento de las tasas de resistencia frente a ERI y CLI, lo que genera preocupación para el tratamiento de infecciones por este microorganismo. 2,3,4
Todos los aislamientos fueron sensibles a PE y AMP como es común encontrar en EGB 2,3. Si bien la resistencia a betalactámicos sigue siendo relativamente rara, un estudio destacó el aumento de la incidencia de EGB con susceptibilidad reducida a la PE en Japón, que aumentó de 2,3% en 2005-2006 a 14,7% en 2012-2013 y el 68,9% de estos aislamientos eran multi resistentes, mostrando resistencia adicional a macrólidos y FQ 9. Además, se ha reportado susceptibilidad reducida a la penicilina en los EE. UU., Canadá y Corea 9. En Colombia, en 2019 reportaron que el 12,5% de aislamientos de EGB colonizando mujeres embarazadas no eran sensibles a PE 10. También, en China en 2020 se reportó un aislamiento clínico con una CIM de PE y cefotaxima de 2,0 mg/l y el análisis de las proteínas fijadora de penicilina (PBP) mostró que la reducción de la sensibilidad se debía a la sustitución de aminoácidos en las PBP. (11)
La resistencia a la ERI y CLI en EBG ha aumentado en los últimos años y varía según cada región, así como del tipo de muestra y la población 9. En nuestro estudio se evidenció aumento de la resistencia a la eritromicina entre 2015 y 2018 de 38,5%, a 53,2%. También se han observado altas tasas en aislamientos de EGB en los EE. UU., con valores de 54,8% y 44,8% 9. Se han reportado tasas más bajas en otros países de Latinoamérica como Chile (17%) 12, Colombia (12,5%) 10, Brasil (variable de acuerdo al tiempo y la región geográfica, de 4% a 14%) 13 y Argentina donde se vio un aumento entre los años 2013 y 2019 de 11,6% a 25%) 14,15. En Perú, un estudio de 2004 encontró una resistencia a ERI de 11,5% 16 lo que muestra el aumento de la resistencia a este fármaco a través de los años.
La resistencia a la CLI también está aumentando de manera constante. En nuestro estudio se encontró aumento de la tasa de resistencia a CLI entre 2015 y 2018 de 37,4% a 48,8%. Se han visto altas tasas en Taiwán (65,9%) y Portugal (34%) 9, mientras que en Latinoamérica es más baja, Chile (13%) 12, Colombia (7,5%) 10, Brasil (entre 2% y 16%) 13 y Argentina donde, al igual que con ERI, se vio un aumento entre los años 2013 y 2019 de 1,8% a 13,2%). 14,15
En al caso de LEV, la resistencia está aumentando en todo el mundo 9. Aquí encontramos una tasa de resistencia general de 28%, y en 2018 esta se elevó hasta 34,8%. Los primeros aislamientos resistentes a FQ documentadas se encontraron en Japón en 2003, y han aumentado desde entonces, con tasas de 43,6% en 2012 17,18. Un estudio de EE. UU. en 2019, informó una tasa de resistencia del 2,3% 19. En Argentina, en aislamientos de 2014-2015, se observó una resistencia de 14,8% 20. La falta de datos de otros países probablemente se deba a la ausencia de pruebas de sensibilidad frente a este fármaco, más que a una baja incidencia de resistencia a FQ.
Una de las limitaciones de este estudio es que los aislamientos incluidos en el estudio se obtuvieron de un solo establecimiento de salud, por lo tanto, nuestros resultados no pueden extrapolarse a todos los establecimientos de salud. Además, durante el año 2020 disminuyó el número de aislamientos, esto debido seguramente a que los esfuerzos del laboratorio estaban centrados en la pandemia de la Covid-19.
En conclusión, se observó un incremento en la resistencia de EGB a los antimicrobianos, marcando el 2018 como el punto más alto.