INTRODUCCIÓN
La leishmaniasis tegumentaria (LT), que incluye a las formas cutánea (LC) y mucosa (LM), es un problema de salud pública en América, donde se reporta 31% de la carga mundial (principalmente Brasil, Colombia, Perú y Bolivia) 1. Pese a que la región ha logrado mejoras significativas en los indicadores de pobreza y acceso a sistemas de salud 2, la LT sigue afectando a personas de bajos ingresos. Explican esta problemática la falta de medidas de prevención y control eficaces o sostenibles a largo plazo, el acceso reducido a servicios de salud por barreras geográficas y culturales, así como la falta de tratamientos adecuados.
En Perú, las estrategias sanitarias están orientadas al tratamiento de LC y LM, siendo esta última en la que se prefiere tratamiento médico por ser crónica, desfigurante y debilitante 3,4. Así, los antimoniales pentavalentes sistémicos (Sb5+) son el tratamiento de primera línea en la mayoría de casos de LC así como aquellos de LM que no afecten extensamente la vía aérea.
En 2011, la OMS actualizó las recomendaciones terapéuticas debido a las diferencias en las tasas de curación según especie de Leishmania, incluyendo a diversas terapias tópicas como alternativas de tratamiento de LC del Nuevo Mundo 5. Siendo L.(V.) braziliensis, L.(V.) guyanensis y L.(V.) peruviana los principales agentes etiológicos de LC en Perú y debido al potencial de progresión a LM reportado por ambas especies, la terapia de primera línea para ambas formas clínicas en Perú son aún los Sb5+.
La mayoría de los países endémicos de LC en América Latina utilizan antimoniato de meglumina (AM). El Perú es uno de los pocos países que ha utilizado diversas formulaciones genéricas de estibogluconato sódico (EGS) en los últimos 20 años, aunque hasta 1990 el único medicamento antimonial pentavalente utilizado fue AM. Aun cuando la OMS y OPS recomiendan ambos fármacos por su similar eficacia y seguridad5, la evidencia existente que compare la eficacia y seguridad de AM y EGS es escasa y proviene de países con considerables diferencias epidemiológicas y parasitológicas 6,7. Este estudio tuvo como objetivo comparar la eficacia y toxicidad de AM y EGS durante el tratamiento de LC.
MATERIAL Y MÉTODOS
Diseño del estudio
Serie de casos comparativa que utilizó los registros clínicos de pacientes con confirmación parasitológica de LC del Programa de Leishmaniasis del Hospital Cayetano Heredia (HCH) y de tres ensayos clínicos ( ) que fueron tratados con AM o EGS entre enero de 2001 y diciembre de 2010. En todos los casos se utilizó el esquema de tratamiento de 20 mg de Sb5+/kg/día, una vez al día, por vía endovenosa por 20 días consecutivos, según la Norma Nacional de Tratamiento de Leishmaniasis y la OMS. En todos los casos se utilizó la misma metodología de administración para AM y EGS, la cual fue supervisada por personal de enfermería entrenado, con un seguimiento diario de los eventos adversos y la supervisión permanente de médicos especialistas con amplia experiencia en el manejo de Sb5+. Los pacientes tuvieron evaluaciones electrocardiográficas y de laboratorio incluyendo hemograma completo, ALT (alanina aminotransferasa) y AST (aspartato aminotransferasa), creatinina y examen de orina completo previo al tratamiento y a los 10 y 20 días de tratamiento. Además, se condujo evaluaciones clínicas luego de 1, 2, 3 y 6 meses de finalizado el tratamiento. Los 3 estudios clínicos tuvieron monitoreo externo. Por estas razones, este es un grupo muy homogéneo desde el punto de vista clínico y laboratorial.
Población de estudio
Los pacientes en este estudio fueron hombres y mujeres de 11-71 años de edad que tuvieron LC confirmada (por microscopía o cultivo in vitro o reacción en cadena de polimerasa) y que recibieron terapia antimonial supervisada.
Medicación utilizada y seguimiento de los eventos adversos
Tanto EGS (Albert David, India, lotes Nº AD2002, AD2005, AD2007, AD2008 y AD2018; Marfan, lotes Nº020509 y 2000764) como AM (Rhône-Poulenc Rorer, Francia, y Aventis, Francia, lotes Nº SA581, SA811, SA9005) fueron administrados diariamente a los pacientes en dosis de 20 mg Sb5+/kg/día intravenoso durante 20 días consecutivos, considerando como dosis máxima 1500 mg Sb5+. Ambos fármacos se prepararon de forma semejante. Se calculó el volumen del medicamento según el peso corporal del paciente. La ampolla de AM de 5 ml tiene 405 mg de Sb5+ y la ampolla de EGS contiene 500 mg de Sb5+. El volumen calculado se diluye en un volumen similar con solución salina al 9‰. La dilución fue administrada lentamente en un periodo de 4-5 minutos con aguja No. 23 o 25 para evitar una rápida infusión.
Los síntomas y eventos adversos fueron evaluados diariamente por un médico que utilizó una lista de chequeo que recoge los efectos adversos más frecuentes descritos durante el tratamiento con antimoniales 8,9,11-13. Se incluyeron síntomas inusuales, así como su duración, gravedad y relación potencial con el fármaco de tratamiento o la vía de administración.
Los criterios de eficacia primarios fueron la tasa de curación por protocolo (PP) y por intención de tratar (ITT) en la visita de seguimiento al tercer mes (contado desde el final del tratamiento). Los parámetros secundarios que se evaluaron fueron: proporción de pacientes en los que el tratamiento se interrumpió debido a toxicidad hepática relacionada con los medicamentos al final del tratamiento, proporción de pacientes con una toxicidad hematológica al final del tratamiento, proporción de pacientes con toxicidad cardíaca al final del tratamiento.
La cura se definió como remisión clínica completa de la lesión cutánea en la que todas las siguientes condiciones fueran reconocibles: re-epitelización completa, desaparición del edema, induración u otros signos inflamatorios (cicatrización completa). La recaída se definió como recurrencia de una lesión o aparición de una nueva lesión después de la documentación de mejoría clínica o cura antes de o en la visita de seguimiento al tercer mes.
Un evento adverso laboratorial fue calificado y normalizado de acuerdo con los Criterios Terminológicos Comunes para Eventos Adversos v4,0 (CTCAE) 14. La AST y ALT fueron calificadas de la siguiente manera: anomalía leve hasta 3 veces el límite superior normal (LSN), moderada entre 3 a 5 veces y grave hasta 5 veces el LSN. La creatinina se calificó de la siguiente manera: leve (≤1,5 veces sobre el LSN), moderada (1,5-3,0 veces) y anomalías graves (>3,0 veces el LSN). La leucopenia fue calificada como leve (entre 3 000 células/mm3 y el nivel inferior normal), moderada (2 000-3 000 células/mm3) y grave (<2 000 células/mm3). La plaquetopenia fue calificada como leve (valor entre 75 000 células/mm3 y el nivel inferior), moderada (50 000-75 000 células/mm3) o grave (<50000 células/mm3). Para el electrocardiograma, QTc se midió según la fórmula de Fridericia y se consideró anormal si QTc >480 ms ( ). Se definió un efecto adverso leve (EAL) inicial como la presencia de cualquier queja registrada en historia clínica (HC) incluyendo artralgias, mialgias, cefalea, mareos, cansancio, náuseas, diarrea, dolor abdominal u otros. La HC sólo registró la presencia o ausencia de quejas, pero no la severidad. También se obtuvo la duración del EAL, ya que se registró en fichas de seguimiento por día de tratamiento.
Análisis estadístico
Se empleó el software STATA, v. 10 con licencia institucional. La prueba t Student a 2 colas se utilizó para comparar las medias de variables continuas (edad, duración de enfermedad y número de lesiones). Los valores de las medianas se compararon usando Wilcoxon Rank-Sum. Las diferencias en las características clínicas y epidemiológicas basales, así como el estado clínico y los efectos secundarios se compararon utilizando prueba exacta de Fisher o Chi2 según el caso. Las diferencias se consideraron significativas cuando los valores p fueron <0,05.
RESULTADOS
Características clínicas
Se incluyeron en el análisis 124 pacientes tratados con EGS (grupo EGS) y 69 con AM (grupo AM). Las características demográficas basales según antimonial administrado se muestran en la Tabla 1. Los pacientes fueron predominantemente hombres (85%), con una mediana de 29 años (rango: 11-71). El 72,0% adquirió la infección en un lugar distinto a su residencia habitual y el 78,8% lo hizo en regiones selváticas. Todos recibieron Sb5+ por primera vez y el tiempo de enfermedad promedio de la lesión fue 9 semanas (rango: 1-94 semanas). Las lesiones se localizaron principalmente en áreas expuestas como cara (25,4%), miembros superiores (31,6%), miembros inferiores (33%) y hubo afectación linfática en el 31,0%. El frotis fue positivo en el 85%, mientras que 29/193 (15,0%) tuvo diagnóstico definitivo por PCR o cultivo in vitro. Las características clínicas fueron comparables entre ambos grupos. Por otro lado, los pacientes del grupo AM tuvieron un peso más bajo (60 vs 67 kg, p=0,011) y lesiones más grandes (4,3 vs 3,1 cm2, p=0,003) que el grupo EGS. Ningún paciente tuvo evidencia clínica de afectación mucosa.
Tabla 1 Características demográficas y clínicas basales.
| Características | AM (n=69) | EGS (n=124) | Total (n=193) | p |
|---|---|---|---|---|
| Mediana de edad en años (rango) | 30 (11-57) | 29 (14-71) | 29 (11-71) | 0,436 |
| Sexo masculino (%) | 58 (86,1) | 107 (86,3) | 165 (85,5) | 0,673 |
| Región donde LC fue adquirida | 0,9 | |||
| Selva (%) | 54 (78,3) | 98 (79,0) | 152 (78,8) | |
| Andes (%) | 15 (21,7) | 26 (21,0) | 41 (21,2) | |
| Caso importado (%) | 46 (66,7) | 94 (75,8) | 140 (72,5) | 0,173 |
| Mediana de duración de la lesión en semanas (rango) | 9 (1-91) | 9 (1-94) | 9 (1-94) | 0,566 |
| Presión arterial normal (%) | 60 (86,9) | 117 (94,4) | 177 (91,7) | 0,074 |
| Peso en kilogramos (rango) | 60 (42-105) | 67 (42-94) | 64,5 (42-105) | 0,002 |
| Índice de masa corporal >27 (%) | 6 (8,7) | 12 (12,1) | 21 (10,9) | 0,467 |
| Lesión única (%) | 41 (59,4) | 90 (72,6) | 131 (67,9) | 0,061 |
| Localización | 0,172 | |||
| Cara (%) | 15 (21,7) | 34 (27,4) | 49 (25,4) | |
| Miembro superior (%) | 20 (29,0) | 41 (33,1) | 61 (31,6) | |
| Miembro inferior (%) | 23 (33,3) | 41 (33,1) | 64 (33,2) | |
| Tronco (%) | 11 (15,9) | 7 (5,6) | 18 (9,3) | |
| Pelvis (%) | - | 1 (0,8) | 1 (0,5) | |
| Linfadenopatía asociada (%) | 19 (27,5) | 40 (32,3) | 59 (30,6) | 0,495 |
| Tamaño medio de la lesión cm (rango) | 4,3 (0,61-87,6) | 3,1 (0,07-19,1) | 3,2 (0,07-87,6) | 0,003 |
AM: antimoniato de meglumina; EGS: estibogluconato de sodio.
Respuesta al tratamiento
El cumplimiento del tratamiento fue de 98,9%; sólo 5 pacientes no completaron el régimen. Tres pacientes dejaron el tratamiento por eventos adversos clínicos o laboratoriales, mientras que otros dos pacientes no completaron el tratamiento con EGS por asuntos personales. La evolución clínica en 1, 3 y 6 meses de seguimiento se muestra en la Tabla 2. Al tercer mes de seguimiento 38/69 (55,1%) de los pacientes del grupo MA alcanzaron los criterios de cura clínica versus 63/124 (50,1%) del grupo EGS usando el criterio ITT. El análisis PP no encontró diferencia significativa en la eficacia de ambas drogas (76% en MA y 67,7% en EGS, p=0,300). Las visitas perdidas al seguimiento en los meses 3 y 6 fueron del 25% (AM) y del 27,5% (EGS). Durante el estudio, 14/69 (20,3%) de pacientes de AM fueron catalogados como falla terapéutica según la definición clínica vs 31/124 (25,0%) de EGS.
Tabla 2 Evolución clínica durante el seguimiento.
| Evolución clínica | AM (n=69) | EGS (n=124) | Total (n=193) | p |
|---|---|---|---|---|
| n (%) | n (%) | n (%) | ||
| 15-30 días después de tratamiento | ||||
| Falla | 6 (8,7) | 11 (8,9) | 17 (8,8) | |
| Cura o mejoría | 5 (7,2) | 75 (60,4) | 80 (41,5) | |
| No evaluado | 58 (84,1) | 38 (30,7) | 96 (49,7) | |
| 90 días después de tratamiento | ||||
| Falla | 12 (17,4) | 30 (24,2) | 42 (21,8) | |
| Cura | 38 (55,1) | 63 (50,8) | 101 (52,3) | |
| No evaluado | 19 (27,5) | 31 (25,0) | 50 (25,9) | |
| 180 días después de tratamiento | ||||
| Falla | 14 (20,3) | 31 (25,0) | 45 (23,3) | |
| Cura | 36 (52,2) | 62 (50,0) | 98 (50,8) | |
| No evaluado | 19 (27,5) | 31 (25,0) | 50 (25,9) | |
| Tasa de curación por protocolo en la visita de seguimiento de 3 meses | 38/50 (76,0) | 63/93 (67,7) | 101/143 (71,1) | 0,301 |
| Tasa de curación de intención a tratar en la visita de seguimiento de 3 meses | 38/69 (55,1) | 63/124 (50,8) | 101/193 (52,3) | 0,57 |
AM: antimoniato de meglumina; EGS: estibogluconato de sodio
Eventos adversos
No se observaron efectos adversos inmediatos. La Tabla 3 muestra las anomalías de laboratorio observadas al final del tratamiento. En 3 pacientes mayores de 50 años se suspendió definitivamente el tratamiento, todos fueron del grupo EGS versus ninguno del grupo AM (p=0,262, Fisher exacto 1 cola). La razón de suspensión en un paciente fue por emesis refractaria (sin enzimas pancreáticas elevadas) en el día 11. En otro paciente, se suspendió al día 14 por emesis refractaria, deshidratación y enzimas pancreáticas anormales. En un tercer paciente, la suspensión fue el día 2 por extrasístoles ventriculares prematuras (>4/minuto) y QTc >480 ms.
Tabla 3 Alteraciones laboratoriales durante el tratamiento con Sb5+.
| Control del tratamiento final | |||
|---|---|---|---|
| EGS (n = 124) | AM (n = 69) | p | |
| Interrupción del tratamiento debido a EA relacionado con drogas | 3 | 0 | 0,554 |
| Recuento medio de leucocitos (células/mm3) | 5400 | 6200 | <0,001 |
| Nivel normal, (%) | 109 (87,9) | 66 (95,7) | |
| Cualquier toxicidad, (%) | 12 (9,7) | 3 (4,3) | 0,263 |
| Toxicidad leve | 10 | 2 | |
| Toxicidad moderada | 1 | 1 | |
| Toxicidad grave | 1 | - | |
| No probado (%) | 3 (2,4) | ||
| Recuento medio de plaquetas (células/mm3) | 266 | 306 | 0,001 |
| Nivel normal, (%) | 121 (97,6) | 68 (98,6) | |
| Cualquier toxicidad, (%) | - | 1 (1,4) | 0,263 |
| Toxicidad leve | - | 1 | |
| Toxicidad moderada | - | - | |
| No probado (%) | 3 (2,4) | - | |
| Creatinina media (mg/dl) | 0,94 ± 0,21 | 0,79 ± 0,17 | <0,001 |
| Nivel normal, (%) | 118 (95,2) | 68 (98,6) | |
| Cualquier toxicidad, (%) | 3 (2,4) | 1 (1,4) | 1 |
| Toxicidad leve | - | - | |
| Toxicidad moderada | - | - | |
| No probado, (%) | 3 (2,4) | - | |
| Nivel normal de ALT (UI/l), n (%) | 52 (43,0) | 37 (53,6) | |
| Cualquier toxicidad, (%) | 69 (57,0) | 32 (46,4) | 0,157 |
| Toxicidad leve | 48 | 19 | |
| Toxicidad moderada | 20 | 13 | |
| Toxicidad grave | 1 | - | |
| No probado, (%) | - | - | |
| Nivel normal de AST (UI/l), n (%) | 59 (47,6) | 44 (63,8) | |
| Cualquier toxicidad, (%) | 51 (41,1) | 25 (36,2) | 0,182 |
| Toxicidad leve | 51 | 25 | |
| Toxicidad moderada | - | - | |
| Toxicidad grave | - | - | |
| No probado, (%) | 14 (11,3) | - | |
| QTc (ms) | 407 | 408 | 0,32 |
| QTc normal, (%) | 119 (96,0) | 67 (97,1) | |
| Cualquier toxicidad, (%) | 2 (1,6) | 2 (2,9) | 0,565 |
| No probado, (%) | 3 (2,4) | - | |
AM: antimoniato de meglumina; EGS: estibogluconato de sodio. EA: Evento adverso.
Los recuentos leucocitarios tendieron a disminuir durante el tratamiento, particularmente en el grupo EGS (p<0,001, (Gráfico 1). Sin embargo, esta disminución, aunque estadísticamente significativa, no fue clínicamente relevante al final del tratamiento entre ambos grupos (p=0,263). El recuento plaquetario fue normal en todos los pacientes en la evaluación basal y, similar al leucocitario, tiende a disminuir durante el tratamiento (p=0,001, (Gráfico 2)), aunque esta disminución no fue clínicamente relevante al final del tratamiento entre ambos grupos (p=0,263). Los niveles de ALT al inicio fueron normales en 81,0% de participantes. La ocurrencia de transaminasemia fue únicamente de tipo leve. Al final del tratamiento, una mayor proporción de individuos tratados con EGS tuvo niveles anormales de ALT, aunque la diferencia no fue estadísticamente significativa entre grupos (AM 46,6% versus EGS 57%, p=0,157). Se identificaron hallazgos similares al evaluar AST. La creatinina fue anormal en un solo paciente en la evaluación basal y la tasa de elevaciones de creatinina clínicamente significativas fue similar en ambos grupos al final del tratamiento (p=1,000).
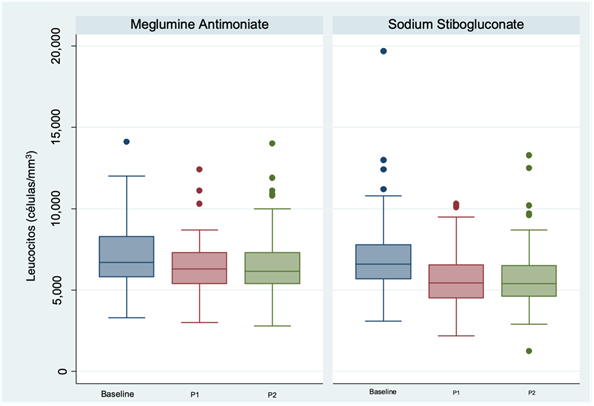
Gráfico de cajas del número de leucocitos en las evaluaciones basales, la mitad del tratamiento (P1) y final del tratamiento (P2), según el tipo de antimonial pentavalente.
Gráfico 1 Evaluación de los eventos adversos durante la administración de EGS y AM
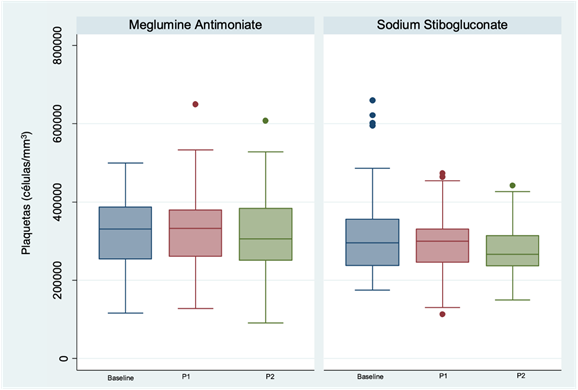
Gráfico 2 Gráfico de cajas de recuentos plaquetarios al inicio, mitad del tratamiento (P1) y final del tratamiento (P2), según el tipo de tratamiento con Sb5+.
Los valores de QTc fueron normales en todos los participantes en la evaluación basal y no hubo diferencia en los valores medios de QTc por grupo de tratamiento al final (p=0,565, (Gráfico 3). Ocho individuos desarrollaron valores QTc anormales durante el tratamiento. A un paciente sintomático se le suspendió el tratamiento después de 2 días con EGS (interrupción temprana del tratamiento). También se suspendió transitoriamente el tratamiento a 3 individuos debido a valores anormales de QTc a mitad del tratamiento (QTc=490 ms) pero que normalizaron al final de la terapia. En 4 individuos se evidenció prolongación de QTc al fin de la evaluación del tratamiento, pero sin sobrepasar 500 ms. A excepción del paciente referido previamente, todos fueron asintomáticos durante el tratamiento. Los pacientes con QTc anormal fueron principalmente hombres (6/8) y mayores de 50 años (5/8).
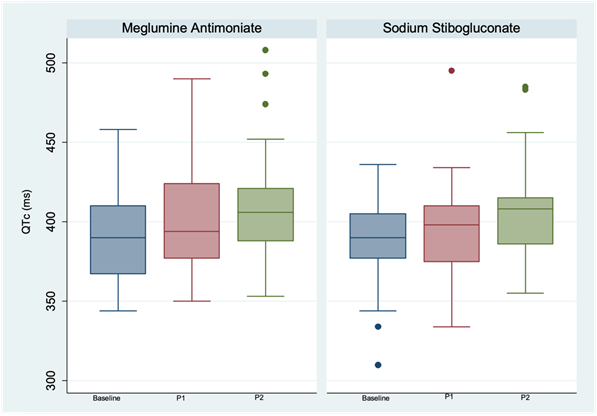
Gráfico 3 Gráfico de cajas de QTc al inicio, mitad del tratamiento (P1) y final del tratamiento final (P2) según el tipo de Sb5+.
En relación con los síntomas generales subjetivos referidos por los pacientes, solo el 23,0% permanecieron asintomáticos durante el tratamiento, sin diferencias entre grupos (Tabla 4, p=0,911). Los pacientes del grupo AM tuvieron un período asintomático más largo en comparación al grupo EGS, pero la diferencia no fue significativa (15 días vs 12 días, p=0,068).
Tabla 4 Síntomas subjetivos referidos durante el tratamiento con Sb5+.
| AM (n= 69) | EGS (n=124) | Total (n=193) | p | |
|---|---|---|---|---|
| Sin síntomas durante el tratamiento (%) | 14 (20,3) | 26 (21,0) | 40 (23,7) | 0,911 |
| Período sin síntomas en días | 15 (0-20) | 12 (0-20) | 12 (0-20) | 0,068 |
| Disgeusia durante la perfusión (%) | 16 (23,2) | 57 (46,0) | 73 (37,8) | 0,002 |
| Duración media | 2,4 ±1,55 | 3,5 ±1,78 | 3,2 ±1,77 | 0,017 |
| Cefalea (%) | 38 (55,1) | 34 (27,4) | 72 (37,3) | >0,001 |
| Mediana de duración | 3 (1-11) | 4 (1-14) | 3,5 (1-14) | 0,12 |
| Náuseas y vómitos (%) | 6 (8,7) | 56 (45,2) | 62 (32,1) | >0,001 |
| Mediana de duración | 20 (7-20) | 12 (2-20) | 13,5 (2-20) | 0,197 |
| Dolor articular (%) | 25 (36,2) | 36 (29,0) | 61 (31,6) | 0,29 |
| Mediana de duración | 4,5 (2-15) | 4 (1-10) | 4 (1-15) | 0,356 |
| Dolor en los ganglios linfáticos (%) | 13 (18,8) | 27 (21,8) | 40 (20,7) | 0,536 |
| Duración media | 6,3 ±3,47 | 7,1 ±2,46 | 6,9 ±2,81 | 0,363 |
| Dolor muscular, (%) | 9 (13,0) | 15 (12,1) | 24 (12,4) | 0,849 |
| Duración media | 3,3 ±2,58 | 5,6 ±2,66 | 4,7 ±2,83 | 0,019 |
| Dolor abdominal, (%) | 17 (24,6) | 7 (5,7) | 24 (12,4) | >0,001 |
| Mediana de duración | 3 (1-16) | 6 (2-10) | 4.5 (1-16) | 0,404 |
| Anorexia (%) | 4 (5,8) | 9 (7,3) | 13 (6,7) | 0,774 |
| Duración media | 2 ± 1,1 | 5,7 ± 4,4 | 4,6 ± 4,1 | 0,064 |
AM: antimoniato de meglumina; EGS: estibogluconato de sodio.
La disgeusia fue el síntoma más frecuente y esta fue particularmente frecuente (46,0% versus 23,0%, p=0,002) y prolongado (2,4 versus 3,5 días, p=0,017) en el grupo EGS. Se notificó cefalea con mayor frecuencia en pacientes del grupo AM (p<0,001), aunque no hubo ninguna diferencia en la duración de este síntoma entre los grupos de tratamiento. Con frecuencia se notificaban náuseas y vómitos en el grupo EGS (45,0% versus 8,0% en AM, p>0,001), pero no se identificó diferencias en la duración de estos síntomas.
Se notificó artralgias de manera similar en ambos grupos, así como su duración. Como anécdota se detectó signos escintigráficos de artritis reactiva, en un paciente con dolor articular prolongado en el cual se realizó una gammagrafía ósea.
El dolor e hinchazón de ganglios linfáticos se observó de manera similar en ambos grupos. En algunos pacientes, el dolor articular intenso y de ganglios linfáticos se controló con un corto curso de esteroides orales (prednisona) en caso estos no fueran aliviados con analgésicos convencionales 16 y para mantener la adherencia. Se reportó dolor muscular de manera parecida en ambos grupos, así como sudoración. Se notificó dolor abdominal con mayor frecuencia en el grupo AM (p>0.001), pero no hubo diferencias con respecto a su duración.
DISCUSIÓN
Este estudio muestra que tanto AM como EGS son comparables en términos de eficacia y seguridad. La tasa de cura PP fue 76,0% con AM versus 67,7% con EGS; mientras que por ITT fue 55,0% con AM y 50,0% con EGS. No obstante, estas diferencias no alcanzaron diferencias significativas. La eficacia reportada para el tratamiento de LC con AM varía entre el 40,0-91,0% y con EGS entre 55,0-91,0% 7,17-20 la eficacia encontrada en este estudio está entre los rangos reportados. La evidencia práctica muestra que no existe diferencias significativas entre las eficacias de ambos antimoniales, conclusión que también fue reportada por el Comité de Expertos de la OMS 5. El uso intravenoso de ambas medicaciones fue seguro y no se reportaron casos de hipersensibilidad o reacción adversa inmediata durante o luego de su administración, hecho que confirma la evidencia acumulada desde 1984 en el Programa de Leishmaniasis del Hospital Cayetano Heredia/Instituto de Medicina Tropical Alexander von Humboldt-UPCH.
AM y EGS tienden a causar disminución de los recuentos leucocitario y plaquetario, elevación de ALT, AST, creatinina y QTc después de 10 días de tratamiento, pero no se identificaron diferencias relevantes entre grupos al finalizar tratamiento. La disminución leucocitaria y plaquetaria fue significativamente mayor con EGS; sin embargo, estas alteraciones alcanzaron niveles clínicamente no significativos. Globalmente, los eventos adversos clínicos y su duración fueron similares entre tratamientos. No obstante, náuseas, vómitos y disgeusia fueron notificados más comúnmente con EGS, mientras que cefalea y dolor abdominal más frecuentemente reportados en el grupo AM. Nuestro estudio reporta hallazgos similares a los previos relacionados con la tolerabilidad y frecuencia de efectos secundarios laboratoriales reportados en la literatura internacional y confirma que ambos fármacos pueden ser utilizados con seguridad en niños y adultos sanos en un entorno ambulatorio y cuando son administrados por vía endovenosa. Hubo pocos adultos mayores de 60 años en esta revisión, grupo en que los Sb5+ suelen tener una toxicidad incrementada. 21
Nuestros resultados sobre alteraciones comunes de laboratorio durante la terapia antimonial ( Los eventos adversos más comunes fueron elevación de ALT y AST (29-46%), leucopenia (2,9-9,7%), recuentos plaquetarios bajos (1,4-1,6%), niveles elevados de creatinina (1,4-3,2%) y QTc prolongado (0,8-4,4%). El QTc estuvo prolongado más frecuentemente en adultos mayores (>60 años). Este grupo etario tiene mayor riesgo de desarrollar eventos adversos según reportes recientes ( ) y probablemente esto se asocia a la menor aclaración renal de Sb5+ en adultos mayores ( Esta hipótesis ha sido propuesta como una posible explicación de las diferentes tasas de curación reportadas en adultos y niños (75% versus 25-50%) en diferentes escenarios ( pero puede ser útil para entender por qué las personas mayores suelen tener toxicidad más alta y grave que los jóvenes 21. En nuestra experiencia tratando a niños, identificamos una tasa de curación más baja que en los adultos ( ) y eventos adversos menos frecuentes y graves que en adultos.
Los síntomas notificados en nuestro estudio como eventos adversos se han descrito de manera comparable con otros estudios. Disgeusia, dolor de cabeza, náuseas y vómitos y dolor articular se notificaron entre 30-40% de los individuos, mientras que el resto de los eventos adversos tuvo una frecuencia entre 6,0-20,0%. La disgeusia, náuseas y vómitos fueron más frecuentes en individuos tratados con EGS, en tanto, el dolor de cabeza y el dolor abdominal en aquellos tratados con AM. No tenemos una explicación para estas diferencias entre AM y EGS, pero una hipótesis a considerar son los metales contaminantes de los antimoniales, que pueden diferir y que frecuentemente no tienen control de calidad en caso de EGS.
Existen limitaciones debido a la naturaleza retrospectiva del estudio, principalmente relacionadas con la cuantificación e identificación de síntomas y su gravedad. Los síntomas subjetivos como artralgias o cefalea podrían ser reportados de manera diferente ya que los individuos de zonas andinas generalmente tienen una mayor tolerabilidad y están culturalmente predispuestos a no expresar sus quejas. Los datos relacionados a la eficacia también podrían tener algunas limitaciones teniendo en cuenta que casi el 30% de los pacientes no continuaron con el seguimiento; sin embargo, las tasas de curación por ITT fueron comparables. Por otro lado, la cicatrización de lesiones y las anomalías de laboratorio se evaluaron adecuadamente de acuerdo con la valoración clínica utilizada en el estudio y tuvimos un laboratorio estandarizado con adecuado registro de la información.
En conclusión, AM y EGS tuvieron similar eficacia y seguridad. La tasa de cura PP fue 76,0% con AM versus 67,7% con EGS. Según análisis ITT, fue 55,0% con AM y 50,0% con EGS; sin embargo, esta diferencia no es estadísticamente significativa. No hubo diferencias significativas en efectos adversos clínicos ni laboratoriales. No se observó complicaciones asociadas a la aplicación endovenosa de Sb5+.















