Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Estomatológica Herediana
versión impresa ISSN 1019-4355
Rev. Estomatol. Herediana vol.26 no.4 Lima oct. 2016
REPORTE DE CASO
Blanqueamiento interno: Reporte de caso.
Non-vital bleaching: Case report.
Yessica Cahuantico Carhuapoma 1,a, Lizbeth Cheng Abusabal 1,a, Andres Kenichi Noborikawa Kohatsu 1,a,b,c, Lidia Yileng Tay 1,b,c,d.
1 Área de Odontología Restauradora y Estética, Facultad de Estomatología, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Especialista de Odontología Restauradora y Estética; b Docente; c Magíster en Estomatología;d Doctor en Odontología.
RESUMEN
La discromia de un diente es una alteración que varía en etiología, localización y severidad. Esta puede estar relacionada a causas extrínsecas, intrínsecas o una combinación de ambos. Una manera de tratar estas piezas no vitales, es el blanqueamiento interno, el cual se presenta como una alternativa conservadora frente a otros procedimientos como restauraciones con resina, carillas o coronas cerámicas, ya que preserva al máximo la estructura dentaria. El objetivo de este trabajo es presentar un reporte de caso de una paciente con discromia de la pieza 21 y cómo fue tratada con blanqueamiento interno, además hacer una revisión de la literatura actual presentando la etiología de las alteraciones de color en dientes no vitales, las alternativas de tratamiento, así como los agentes disponibles para este fin. Las técnicas para realizar el blanqueamiento de una pieza no vital son: la técnica en consultorio o In-office bleaching, las técnicas ambulatorias (Walking bleach e inside/outside bleaching) y por último la técnica mixta. Asimismo existen agentes blanqueadores disponibles en diferentes concentraciones para realizar dichas técnicas, cuya efectividad será revisada en este trabajo. Existen diversos factores que afectarán la eficacia del blanqueamiento interno, como la edad del paciente, tiempo de oscurecimiento, el grado y origen de la discromia, que podrían afectar el resultado final y la longevidad del tratamiento.
PALABRAS CLAVE: Blanqueamiento dental, peróxido de hidrógeno, discromia.
SUMMARY
Tooth discoloration varies in etiology, location and severity. It may be extrinsic, intrinsic or a combination of both. A treatment option in such cases is non-vital bleaching, which presents itself as a conservative alternative to other procedures like composite restorations, veneers or ceramic crowns, as it preserves the most of tooth structure. The aim of this paper is to report a clinical case of a patient with non vital tooth discoloration and how it was successfully treated with internal bleaching procedures; also to review the current literature discussing the etiology of discoloration in non-vital teeth, treatment options and agents available. Non-vital bleaching techniques include: In-office bleaching, walking bleach, inside/outside bleaching and finally, the combined technique. Bleaching agents are available in different concentrations for these techniques, whose effectiveness is discussed in this paper. There are several factors that could affect the effectiveness of non-vital bleaching, such as patient age, time, degree and etiology of discoloration. All of these can influence the final result and treatment longevity.
KEYWORDS: Internal bleaching, non-vital bleaching, discoloration, walking bleach.
INTRODUCCIÓN
La discromia de un diente es una alteración que varía en etiología, localización y severidad. Los orígenes de dichas discromias pueden estar relacionadas a causas extrínsecas, intrínsecas o una combinación de ambos (1,2). Esta alteración afecta siempre la estética del paciente, lo cual impacta negativamente en su autoestima y calidad de vida (3-5).
Por otro lado, debido a la creciente demanda de la población por tener una sonrisa cada vez más blanca, los tratamientos para piezas con discromia han ido en aumento considerable en los últimos años (6-9). Una manera de tratar estas piezas no vitales, es el blanqueamiento interno, mencionado por primera vez en la literatura por Truman en 1864 (2). Este se presenta como una alternativa conservadora frente a otros procedimientos como restauraciones con resina, carillas o coronas cerámicas, ya que preserva al máximo la estructura dentaria, y por lo tanto su resistencia a la fractura. (10-13). Sin embargo si no se conocen los procedimientos, agentes y técnicas (14-16), podríamos tener complicaciones (17-20).
El objetivo de este trabajo es mostrar un reporte de caso de una paciente con discromia dental de la pieza 21, cómo fue tratada con blanqueamiento interno y su control a los 30 meses, además hacer una revisión de la literatura actual presentando la etiología de las alteraciones de color en dientes no vitales, las alternativas de tratamiento y los agentes disponibles para este fin, así como el pronóstico y las posibles complicaciones.
Reporte de caso
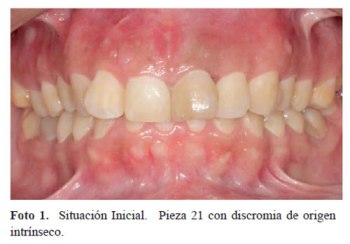
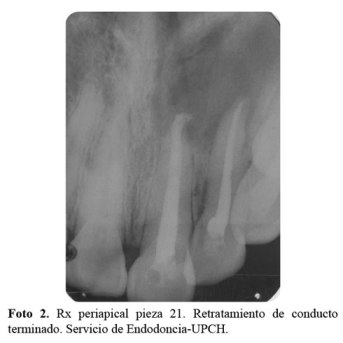
Paciente de sexo femenino de 31 años de edad acude al Servicio de Postgrado en Odontología Restauradora y Estética (ORE) de la Clínica Dental de la Universidad Peruana Cayetano Heredia en Mayo del 2014, presentando la pieza 21 con discromia por trauma de aproximadamente 23 años de antigüedad según la paciente (foto1). Al examen radiográfico presentaba en dicha pieza un tratamiento de conductos en mal estado, por lo cual fue referida al Sevicio de Endodoncia donde se le realizó un retratamiento de conductos y apicectomía (foto 2).
Luego se programó el blanqueamiento interno utilizando la técnica combinada (In-office bleaching+ walking bleach).
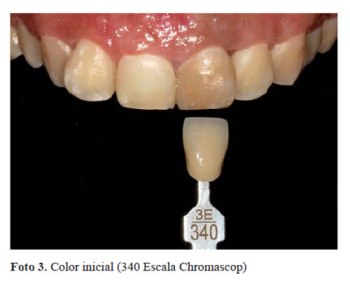
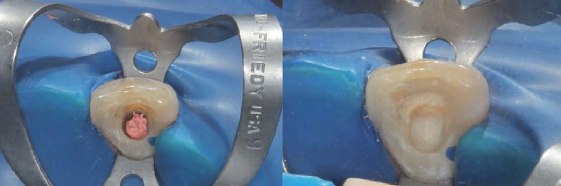
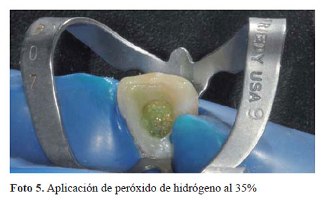
El color se registró por medio de la escala Chromascop, (foto 3) siendo el color inicial 340. Durante la primera sesión se realizó la barrera biológica, midiendo la corona clínica de la pieza con una sonda periodontal hasta el límite amelo-cementario y desobturando el material endodóntico 2 mm por debajo de esta medida. Luego se colocó ionómero de vidrio modificado con resina (Vitrebond, 3M ESPE) (foto 4) hasta alcanzar la medida inicial. Se realizó 1 aplicación de peróxido de hidrógeno al 35% (Whiteness HP Maxx, FGM) por 15 minutos (foto 5). Posteriormente la cámara pulpar fue lavada profusamente con suero fisiológico y sellada con material temporal hasta la siguiente cita.
Después de 7 días se citó a la paciente para hacer una aplicación de peróxido de carbamida al 16% (Nite White, Discus Dental) con una torunda de algodón, la cual fue dejada hasta la siguiente cita mediante un sellado de la apertura cameral con material temporal. Luego de 7 días se repitió el procedimiento.
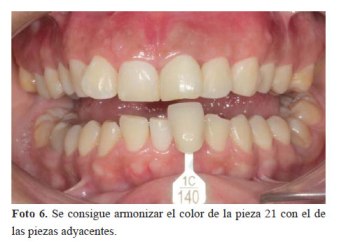
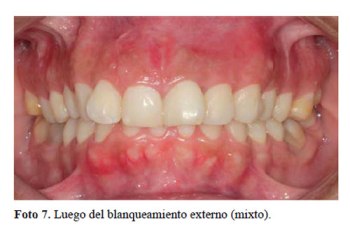
Una vez obtenido el color deseado por la paciente, y cuando se vio que el color la pieza 21 se encontraba en armonía con los dientes adyacentes (foto 6), se procedió, a solicitud de la paciente a realizar un blanqueamiento externo de todos los dientes con técnica mixta (foto 7).
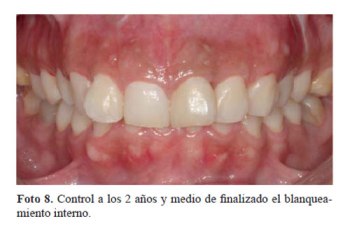
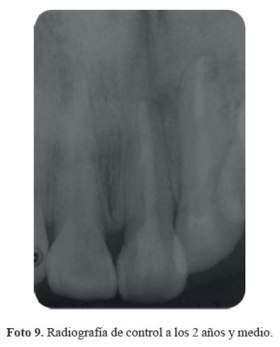
Luego de 15 días de terminado el blanqueamiento externo, la pieza 21 fue restaurada con un poste de fibra de vidrio anatomizado y la apertura restaurada con resina compuesta. La paciente fue dada de alta del servicio y se programaron controles periódicos cada 6 meses. Sin embargo, sólo se pudo realizar el control en noviembre del 2016, cuando la paciente acudió, a los 2 años y medio. Al realizar la toma de color se pudo observar que se había producido una leve regresión (Color: 310 Escala Chromascop) con respecto al resultado final del tratamiento (foto 8), sin embargo la paciente aún se encontraba satisfecha con el color. No se encontraron signos clínicos ni radiográficos de reabsorción radicular externa (foto 9). Se programó un blanqueamiento externo en dicha pieza.
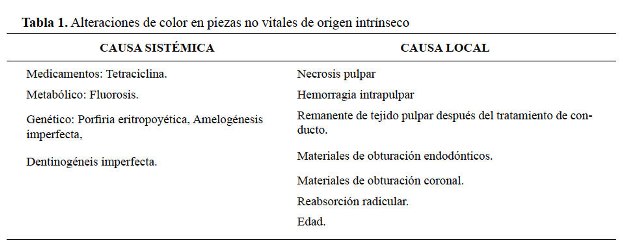
Etiología de las alteraciones de color en piezas no vitales
El primer paso para realizar el blanqueamiento interno será determinar el origen de la discromia. La discromia dentaria varía en etiología, apariencia, localización, severidad y afinidad a la estructura dentaria. Su origen puede clasificarse en extrínseco o intrínseco, pudiendo ser este último por causa sistémica o local (2) (tabla 1).
Una de las causas locales es la necrosis pulpar, en la cual tiempo de permanencia de la pulpa necrótica está directamente relacionado con el grado de discromía (1). En el caso de hemorragia intrapulpar, los componentes sanguíneos fluyen dentro de los túbulos dentinarios, produciendo una discromia de la dentina circundante. El hierro obtenido de la combinación del cofactor sanguíneo hemo con el tejido pulpar, puede ser convertido por el sulfato de hidrógeno (producido por bacterias) en sulfato de hierro, pigmentando el diente de gris. Estudios in vitro han demostrado que la principal causa de la discromía en dientes traumatizados no infectados es la acumulación de la molécula de hemoglobina u otras moléculas de hematina (1,21).
Por otro lado, un inadecuado acceso cameral, puede generar la presencia de tejido pulpar remanente en la cámara, especialmente en los cuernos pulpares, cuyos componentes sanguíneos pueden fluir dentro de los túbulos dentinarios, causando discromia (1). En cuanto a los materiales de obturación endodóntico, la remoción incompleta de estos o de medicamentos que contengan tetraciclina pueden conducir a una discromia dentaria (1,21, 22). El efecto de la luz solar en estos medicamentos, ha sido reportado como un factor contribuyente importante en la discromia dentaria a través de una reacción de fotoiniciación (11). En un estudio in vitro de Partovi y col en el 2006, la discromía fue encontrada en todos los selladores del conducto radicular, después de tres, seis y nueve meses. De estos productos, el Endofill® demostró la mayor tendencia de discromía, seguido por el Óxido de zinc eugenol, Tubiseal®, AH 26®, gutapercha, Apatite root sealer III y Cavizol® (23). El MTA (mineral trióxido agregado) presenta un color grisáceo, lo que conduce a una discromia dentaria indeseada en el área estética. Jacobowitz y De Lima en el 2008 (24), en un reporte de caso muestran discromia dentaria después de la aplicación del MTA blanco. Con respecto a este punto, se asume que en el caso MTA blanco la discromia ocurre debido al proceso de oxidación del hierro (1).
Sobre los materiales de obturación coronal, la amalgama puede pigmentar a la dentina de gris oscuro, a causa de los componentes metálicos. Este tipo de pigmento es difícil de aclarar y tiende a reaparecer con el tiempo debido a la tenacidad de los productos oxidantes hacia el tejido dentario (1,25).
La reabsorción radicular, aunque es clínicamente asintomática, puede exhibir una apariencia inicial rosada en el límite amelocementario, que sirve en el diagnóstico diferencial del origen de la discromia (17).
La deposición fisiológica de la dentina secundaria producto del envejecimiento y obliteración de los túbulos dentinarios afecta las propiedades de transmisión de luz de los dientes, resultando en un oscurecimiento gradual por el estrechamiento del espacio pulpar (21).
Técnicas y agentes blanqueadores
Antes de iniciar cualquier técnica es necesario comprobar que el tratamiento de conducto se encuentre en óptimas condiciones a través de una radiografía (1). Además el caso deberá ser documentado con fotografías que incluyan la toma del color inicial (26).
Se le debe comunicar al paciente los posibles riesgos del blanqueamiento interno así como las otras alternativas de tratamiento existentes. El paciente debe ser informado que los resultados de este tratamiento no son predecibles y que no se puede garantizar llegar al color ideal o que para lograrlo se requerirá repetir la aplicación del agente blanqueador. Por último, es necesario informar al paciente de que al realizar el acceso cavitario para el blanqueamiento interno existirá un mayor riesgo de fractura en dicha pieza por lo que deberá tomar los cuidados del caso (26).
De existir lesiones cariosas o restauraciones en mal estado, éstas deberán ser reemplazadas por restauraciones provisorias (1).
1. Sellado cervical
En todos los casos, se deberá realizar previamente la confección de una barrera biológica o tapón, que impedirá la difusión del agente blanqueador a través de los túbulos dentinarios hacia el periodonto, ya que el material de obturación endodóntico no puede prevenir la difusión de dicho agente (1). Rotstein y col en 1992 recomendaron el uso de un material de base como protección a este nivel que tuviese un grosor de 2mm (27).
Diversos estudios de laboratorio han demostrado la difusión del peróxido de hidrógeno intracoronal hacia la raíz y que esta difusión es mayor si se presentan defectos radiculares a nivel del cemento (14,15,27,28). Se especula que el pasaje de los iones de hidrógeno de los agentes blanqueadores intracoronales puede generar un ambiente ácido óptimo para la actividad osteoclástica y la reabsorción ósea; resultando con el tiempo en reabsorción cervical externa (15,28).
Sharma y col evaluaron in vitro la penetración radicular del peróxido de hidrógeno de diversos agentes blanqueadores durante el blanqueamiento interno de 51 piezas uniradiculares humanas, encontrando que casi todos los dientes mostraron filtración de peróxido de hidrógeno, lo cual fue mayor en las piezas con defectos radiculares cervicales cuando se usó peróxido de hidrógeno al 30% (14). El perborato de sodio mezclado con agua fue considerado el agente blanqueador más seguro. Asimismo, Rokaya y col estudiaron la difusión extraradicular del peróxido de hidrógeno durante el blanqueamiento interno en 108 molares mandibulares con 4 agentes blanqueadores, encontrando que el peróxido de hidrógeno al 35% generó la mayor difusión, seguido de la mezcla de perborato de sodio con peróxido de hidrógeno al 30% y de peróxido de carbamida al 35% (15). Los dientes aclarados con mezcla de perborato de sodio y agua fueron los que tuvieron menor difusión.
Para conformar la barrera biológica, la obturación endodóntica se debe reducir entre 1 y 2mm por debajo del límite amelo-cementario. Esta medida puede determinarse con el uso de una sonda periodontal. La cámara pulpar debe estar libre de material de obturación endodóntico (26). La remoción puede realizarse con fresas de carburo de baja velocidad (1).
El material utilizado para realizar la barrera debe alcanzar el nivel de la unión epitelial, por ello la forma de este sellado cervical debe asemejar las referencias anatómicas externas, reproduciendo la posición del LAC y del hueso interproximal (1). Una barrera de forma plana dejará los túbulos dentinarios en la zona interproximal desprotegidos: esta área crítica es el sitio donde la reabsorción radicular externa se inicia. La forma resultante de una adecuada barrera biológica es una silueta en forma de túnel desde una vista frontal. Desde una vista lateral, esta adopta la forma de una rampa de ski (figura 1 y figura 2). La verificación radiográfica posterior permitirá confirmar la correcta posición de la barrera (18).

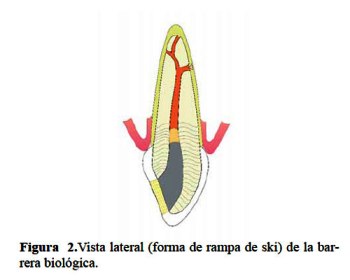
Para este fin se han propuesto diversos materiales como óxido de zinc-eugenol, ionómero de vidrio, ionómero de vidrio modificado con resina, resina compuesta y MTA (29); aunque es el ionómero de vidrio el que tradicionalmente se utiliza como barrera protectora en blanqueamiento interno (27).
Por otro lado, Canoglu y col evaluaron el efecto de diferentes agentes blanqueadores en las propiedades de sellado de los materiales de barrera y los materiales de obturación endodónticos, encontrando que el uso de ionómero de vidrio (Fuji Triage) mostró valores de filtración mucho mayores al compararse con resina compuesta y MTA ProRoot (30).
También se ha recomendado el uso del hidróxido del calcio como barrera suplementaria durante el blanqueamiento interno. Sin embargo, en el 2002 Lambrianidis y col demostraron que la colocación de hidróxido de calcio por debajo del ionómero de vidrio a manera de barrera suplementaria durante el blanqueamiento interno, no tiene un efecto significativo para revertir el pH ácido creado in vitro en las superficies radiculares externas (31).
2. Técnicas
Existen diversas técnicas y agentes para realizar el blanqueamiento de una pieza no vital. Durante el blanqueamiento, los radicales libres de peróxido de hidrógeno quiebran las cadenas largas de moléculas orgánicas de los pigmentos, dividiéndolas en moléculas más pequeñas y difusibles, logrando así que el diente se vea más claro. Las cadenas son transformadas en carbón y agua, y probablemente liberadas junto con el oxígeno formado (2, 26).
Las técnicas para el blanqueamiento interno son: la técnica de consultorio o In-office Bleaching, las técnicas ambulatorias (Walking Bleach, Inside/Outside Bleaching) y la técnica mixta o combinada. La técnica utilizada en este caso clínico fue la técnica combinada.
In-office Bleaching:
Esta técnica es ampliamente utilizada en piezas vitales pero también se puede utilizar en dientes no vitales. Es necesaria la utilización de aislamiento absoluto y además la protección ocular con anteojos. Se realiza la aplicación de gel de peróxido de hidrógeno al 30-35% por 15 a 20 minutos y es posible repetir la aplicación si es necesario (26).
Walking Bleach:
Fue descrita por primera vez por Spasser en 1961 y actualmente los resultados son altamente aceptados por los pacientes (32). Consiste en la aplicación del agente blanqueador sobre la dentina de la cámara pulpar, la cual es sellada, dejando así el producto entre cita y cita. El producto es cambiado es las citas posteriores hasta conseguir un resultado de aclaramiento aceptable (2). La mezcla de Perborato de sodio y agua ha sido ampliamente utilizada como un agente blanqueador intracoronal efectivo. Con el objetivo de mejorar la eficacia del blanqueamiento, se ha sugerido la utilización de peróxido de hidrógeno al 30%-35 en vez de agua (2,15).
Inside/Outside Bleaching:
Esta técnica fue descrita por primera vez por Settembrini y col en 1997 y posteriormente modificada por Liebenberg (26). Como su nombre lo indica el objetivo es aplicar el agente blanqueador tanto en la superficie interna como en la externa de la pieza a tratar, con el objetivo de reducir el número de citas (2). El acceso cavitario se mantiene abierto durante todo el tratamiento y se utilizan agentes blanqueadores de baja concentración (generalmente peróxido de carbamida al 10%) y una cubeta al vacío. El acceso cavitario se realiza de la misma forma que para la técnica Walking bleach, se realiza el sellado cervical y se instruye al paciente sobre la aplicación del gel y uso de la cubeta. Se realizan los controles al paciente cada dos o tres días para evaluar los cambios en el color de la pieza (26). Una de las desventajas de esta técnica es que la cámara pulpar permanece abierta durante todo el blanqueamiento, lo que puede generar que el sellado cervical filtre y se contaminen los tejidos periapicales, conllevando al fracaso del tratamiento endodontico (2).
3. Agentes blanqueadores
Los agentes blanqueadores usados para aclarar piezas no vitales son el peróxido de hidrógeno, peróxido de carbamida y perborato de sodio (26 ,33).
Peróxido de hidrógeno: (H2O2)
Es el agente activo en todos los materiales para blanqueamiento. Puede ser usado de forma directa o producirse a través de una reacción química del peróxido de carbamida o el perborato de sodio. Debido a su bajo peso molecular, éste puede penetrar la dentina y liberar oxígeno, el cual rompe los dobles enlaces de los compuestos orgánicos e inorgánicos al interior de los túbulos dentinarios (1). Concentraciones altas de éste producto (>30%) deben ser utilizadas con cuidado para evitar incrementar el riesgo de reabsorción radicular (26).
Peróxido de carbamida: (CH4N2O·H2O2)
Es un compuesto orgánico usado en distintas concentraciones, que contiene peróxido de hidrógeno y úrea (1). Los productos que contienen peróxido de carbamida al 10% liberan 3.5% de peróxido de hidrógeno (26). Fue introducido en 1989 por Haywood y Heymann para blanqueamiento en piezas vitales (34). El peróxido de carbamida ha sido recomendado también para el blanqueamiento intracoronal. Considerando su bajo nivel de difusión extra-radicular y su eficacia como agente blanqueador, el peróxido de carbamida al 35% podría ser considerado como un buen agente blanqueador intracoronal.
Perborato de sodio: (NaBO2·H2O2·3H2O)
agente oxidante disponible en forma de polvo (1). Al agregársele agua se libera peróxido de hidrogeno (26). Existe en las formas de mono, tri, y tetrahidratado los cuales difieren en su contenido de oxígeno. Weiger y col en 1994 compararon los efectos de estos tres tipos de perborato de sodio para blanqueamiento interno y verificaron que la combinación de perborato de sodio tetrahidratado con agua o con peróxido de hidrógeno al 30% produjo resultados estéticos similares (34).
Complicaciones
Entre los efectos adversos que se presentan en la técnica de blanqueamiento interno son la reabsorción cervical radicular externa y la disminución de la resistencia adhesiva a la estructura dental:
Reabsorción cervical radicular externa
La reabsorción cervical radicular es una reabsorción externa de la raíz de origen inflamatorio, causado por un trauma o por blanqueamiento intracoronal (1). Sin embargo, la combinación de ambos es el factor predisponente más importante para la reabsorción cervical (35). Los primeros cuatro casos fueron publicados por Harrington y Natkin en 1979 (1).
El mecanismo para este efecto es poco claro, pero se ha sugerido que el agente blanqueador llega al tejido periodontal a través de los túbulos dentinarios, iniciando un proceso inflamatorio (2).
Price y col en el 2000 investigaron el pH de algunos agentes y encontraron que algunos productos de blanqueamiento en consultorio fueron ácidos (36). El bajo valor del pH del peróxido de hidrógeno de alta concentración puede ser considerado un factor inductor de daño tisular, porque un ambiente ácido es óptimo para una actividad osteoclástica resultando en una reabsorción ósea (37,38). La incidencia mencionada en la literatura varía entre 1% y 13% (26).
Pacientes quienes tuvieron un blanqueamiento a una menor edad frecuentemente tuvieron una reabsorción externa. Esto se podría explicar, debido a que el peróxido de hidrógeno puede penetrar con mayor facilidad en el periodonto por el ancho de los túbulos en los dientes jóvenes. El incremento de la permeabilidad en la dentina está asociado con la disminución del espesor dentinario y una alta temperatura del entorno (1).
La recomendación actual es no calentar el agente blanqueador en el acceso cavitario, porque el calor puede dañar el tejido periodontal y conducir a un incremento en la taza de reabsorción en la superficie radicular (26,39,40).
Defectos en el límite amelodentinario incrementan la penetración del agente blanqueador en el espacio periodontal (26), no indicándose el uso de agentes blanqueadores con alto porcentaje de componentes oxidativos activos (14,27).
La reabsorción cervical es principalmente asintomática y usualmente es detectada sólo a través de radiografías de rutina, a veces se observa una hinchazón en la papila o el diente presenta sensibilidad a la percusión (1,17).
Se recomienda un seguimiento radiográfico de los dientes tratados dentro del primer año después del tratamiento para diagnosticar una posible reabsorción cervical lo más pronto posible (1).
El pronóstico del tratamiento depende principalmente de la extensión del proceso de reabsorción, y esta servirá como guía para el clínico en la selección del tratamiento (figura 3).
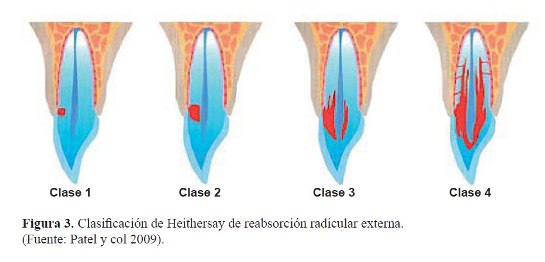
Reducción de la resistencia adhesiva
La reducción de la resistencia adhesiva de las restauraciones con resina a la estructura dentaria después del blanqueamiento dental ha sido muy estudiado (21). Varias teorías han sido propuestas para explicar las razones de la disminución de la resistencia adhesiva (1). Puede deberse a la presencia de peróxido residual sobre la estructura dentaria el cual interfiere con la adhesión de la resina y previene su completa polimerización (21). También depende del agente utilizado (19, 41,42).
Varios estudios han demostrado que una resistencia adhesiva óptima puede ser obtenida postergando el procedimiento adhesivo después del blanqueamiento (43). Dependiendo del agente utilizado se debe esperar entre 1 a 21 días para eliminar el oxígeno residual (total o parcial) del sustrato (41,44).
En el caso clínico descrito, para hacer la restauración final de la pieza se esperaron 15 días para la realizar la restauración final con poste de fibra de vidrio. Después de 2 años y medio no se observaron signos clínicos ni radiográficos de reabsorción radicular externa.
Longevidad
El blanqueamiento interno es un tratamiento altamente efectivo, sin embargo en algunos casos el resultado puede no ser perenne. En el presente reporte de caso la paciente tuvo una regresión ligera del color a los 30 meses, la cual no era percibida por la paciente.
Abbott P y Heah SYS en el 2009 (45) realizaron un análisis retrospectivo de 255 piezas de 203 pacientes que habían recibido blanqueamiento interno con la técnica Walking Bleach (mezcla de peróxido de hidrógeno al 35% y perborato de sodio) y observaron que las piezas con tinciones amarillo oscuro y negro requirieron de más aplicaciones y fueron más difíciles de aclarar que las tinciones amarillas claras o grises. Durante los controles se pudo evidenciar que hubo un 3.9% de piezas que habían sufrido una nueva discromia, tanto a un nivel aceptable (2-4 años) como e inaceptable (1-5 años). Una de las causas de la regresión del color fue el deterioro o pérdida de la restauración coronal definitiva.
Algunas recidivas de color pueden ocurrir en aproximadamente 50% de los dientes blanqueados después del primer año y aún más después de un periodo largo. Algunos selladores endodónticos específicos resultan en un mayor riesgo de recidiva de color (25).
Amato y col en el 2006 (46) realizaron un seguimiento a largo plazo de 35 pacientes, de los cuales 22 casos (62.9%) presentaron resultados satisfactorios después de 16 años del tratamiento de blanqueamiento (método combinado: In-office Bleaching seguido de Walking Bleach). En 13 pacientes (37.1%) el resultado ya no fue satisfactorio, presentando un marcado oscurecimiento. No hubo presencia de reabsorción radicular externa.
CONCLUSIONES
El blanqueamiento interno es una alternativa conservadora para el tratamiento de dientes con discromia de etiología intrínseca por causa local.
El origen o causa de la discromia puede influir en el resultado final del blanqueamiento interno.
Los dientes con blanqueamiento interno deberán controlarse periódicamente, clínica y radiográficamente ya que puede existir una recidiva en el color y para un diagnóstico precoz en el caso de una posible reabsorción radicular externa.
REFERENCIAS BIBLIOGRÁFICAS
1. Plotino G, Buono L, Grande MN, Paneijer CH, Somma F. Nonvital tooth bleaching: A review of the literature and clinical procedures. J Endod. 2008; 34:394- 407. [ Links ]
2. Dahl JE, Pallesen U. Tooth bleaching-a critical review of the biological aspects. Crit Rev Oral Biol Med. 2003;14(4): 292-304. [ Links ]
3. Patzer GL. Improving self-esteem by improving physical attractiveness. J Esthet Dent. 1997; 9(1): 44-6. [ Links ]
4. Van-Der-Geld P, Oosterveld P, Van Heck G, Kuijpers-Jagtman AM. Smile attractiveness: Self-perception and influence on personality. Angle Orthod. 2007; 77(5):759-65. [ Links ]
5. Lukez A, Pavlic A, Trinajstic Zrinski M, Spalj S. The unique contribution of elements of smile aesthetics to psychosocial well-being. J Oral Rehabil. 2015; 42(4): 275-81. [ Links ]
6. Mon-Mon T, Norkhafizah S, Nurhidayati H. Factors influencing patient satisfaction with dental appearance and treatments they desire to improve aesthetics. BMC Oral Health. 2011; 23;11:6.
7. Al-Zarea BK. Satisfaction with appearance and the desired treatment to improve aesthetics. Int J Dent. 2013; 20:912368. [ Links ]
8. Joiner A. Tooth colour: A review of literature. Journal of Dentistry. 2004; 32(S1): 3-12. [ Links ]
9. Samorodnitzky-Naveh GR, Geiger SB, Levin L. Patients satisfaction with dental esthetics. JADA. 2007; 138:805-808. [ Links ]
10. Carrasco-Guerisoli LD, Schiavoni RJ, Barroso JM, Guerisoli DM, Pécora JD, Fröner IC. Effect of different bleaching systems on the ultrastructure of bovine dentin. Dent Traumatol. 2009; 25(2):176-80. [ Links ]
11. Leonardo Rde T, Kuga MC, Guiotti FA, et al. Fracture resistance of teeth submitted to several internal bleaching protocols. J Contemp Dent Pract. 2014; 15(2):186-9. [ Links ]
12. Tam LE, Cho W, Wang BY, De Souza G. Effect of bleaching treatment on fatigue resistance and flexural strength of bovine dentin. J Esthet Restor Dent. 2015; 27(6):374-82. [ Links ]
13. Ge C, Green CC, Sederstrom D, McLaren EA, White SN. Effect of porcelain and enamel thickness on porcelain veneer failure loads in vitro. J Prosthet Dent. 2014;111(5):380-7. [ Links ]
14. Sharma DS, Sharma S, Natu SM, Chandra S. An in vitro evaluation of radicular penetration of hydrogen peroxide from bleaching agents during intra-coronal tooth bleaching with an insight of biologic response. J Clin Pediatr Dent. 2011; 35(3):289-94. [ Links ]
15. Rokaya ME, Beshr K, Hashem-Mahram A, Samir-Pedir S, Baroudi K. Evaluation of extraradicular diffusion of hydrogen peroxide during intracoronal bleaching using different bleaching agents. Int J Dent. 2015; 2015:493795. [ Links ]
16. Jimenez-Rubio A, Segura JJ. The effect of the bleaching agent sodium perborate on macrophage adhesion in vitro: Implications in external cervical root resorption. J Endod. 1998; 24(4): 229-232. [ Links ]
17. Kandalgaonkar SD, Gharat LA, Tupsakhare SD, Gabhane MH. Invasive cervical resorption: a review. J Int Oral Health. 2013; 5(6):124-30. [ Links ]
18. Bahuguna N. Cervical root resorption and non vital bleaching. Endodontology. 2013; 25(2): 106-111. [ Links ]
19. Teixeira EC, Hara AT, Turssi CP, Serra MC. Effect of nonvital tooth bleaching on resin/enamel shear bond strength. J Adhes Dent. 2002; 4(4):317-322. [ Links ]
20. Bonato JF, Souza-Gabriel AE, Marchesan MA. Influence of the bleaching agent and adhesive system on the bond strength of the restorative material to intracoronary dentin. RSBO. 2012; 9(3): 303-8. [ Links ]
21. Alqahtani MQ. Tooth-bleaching procedures and their controversial effects: A literature review. Saudi Dent J. 2014; 26(2):33-46. [ Links ]
22. Kim ST, Abbot PV, McGinley P. The effects of Ledermix paste on discoloration of inmature teeth. Int Endod J. 2000; 33(3): 233-7. [ Links ]
23.Partovi M, Al-Havvaz AH, Soleimani B. In vitro computer analysis of crown discolouration from commonly used endodontic sealers. Aust Endod J. 2006; 32(3):116-9. [ Links ]
24. Jacobowitz M, de-Lima R. Treatment of inflammatory internal root resorption with mineral trioxide aggregate: a case report. Int Endod J. 2008; 41:905-912. [ Links ]
25. Perdigao J, Ballarin A, Gomes G, et al. Intracoronal whitening of endodontically treated teeth. En: Perdigão J. Tooth whitening: An evidence-based perspective. Berlin: Springer International; 2016. p. 160-197. [ Links ]
26. Zimmerli B, Jeger F, Lussi A. Bleaching of nonvital teeth- a clinically relevant literature review. Schweiz Monatsschr Zahnmed. 2010; 120: 306-313. [ Links ]
27. Rotstein I. In vitro determination and quantification of 30% hydrogen peroxide penetration through dentine and cementum during bleaching. Oral Surg Oral Med Oral Pathol. 1991; 72: 602-6. [ Links ]
28. Lee GP, Lee MY, Lum SO, Poh RS, Lim K. Extraradicular diffusion of hydrogen peroxide and pH changes associated with intracoronal bleaching of discoloured teeth using different bleaching agents. Int Endod J. 2004; 37(7):500-6. [ Links ]
29. Vosoughhosseini S, Lofti M, Shahmoradi K, Saghiri M, Zand V, Mehdipour M. Microleakage comparison of glass-ionomer and white mineral trioxide aggregate used as a coronal barrier in nonvital bleaching. Med Oral Patol Oral Cir Bucal. 2011;16 (7):1017-21. [ Links ]
30. Canoglu E, Gulsahi K, Sahim C, Altundasar E, Cehreli ZC. Effect of bleaching agents on sealing properties of different intraorifice barriers and root filling materials. Med Oral Patol Oral Cir Bucal. 2012; 17 (4):710-5. [ Links ]
31. Lambrianidis T, Kapala A, Mazinis M. Effect of calcium hydroxide as a supplementary barrier in the radicular penetration of hydrogen peroxide during intracoronal bleaching in vitro. Int Endod J. 2002; 35(12):985-90. [ Links ]
32. Gupta K, Saxena P. Evaluation of patient satisfaction after non-vital bleaching in traumatized discolored intact anterior teeth. Dent Traumatol. 2014; 30(5):396-9. [ Links ]
33. Kohen S. De Franceschi C, Rodríguez GA. Blanqueamiento de piezas despulpadas (Interno). En: Henostroza G. Estética en odontología restauradora. Madrid: Ripano; 2006. p. 75-101.
34. Valera MC, Camargo CH, Carvalho CA, de-Oliveira LD, Camargo SE, Rodrigues CM. Effectiveness of carbamide peroxide and sodium perborate in non-vital discolored teeth. J Appl Oral Sci. 2009; 17(3):254-61. [ Links ]
35. Heithersay GS. Invasive cervical resorption. Endod Topics. 2004;7: 73-92. [ Links ]
36. Price RBT, Sedarous M, Hiltz GS. The pH of tooth whitening products. J Can Dent Assoc. 2000;66 :421-6. [ Links ]
37. Vaes A. On the mechanisms of bone resorption: the action of parathyroid hormone on the excretion and synthesis of lysosomal enzymes and on extracellular release od acid by bone cells. J Cell Biol. 1968; 39:676-97. [ Links ]
38. Friedman S, Rotstein I, Libfeld H, Stabholz A, Heling I. Incidence of external root resorption and esthetic results in 58 bleached pulpless teeth. Endod Dent Traumatol. 1988; 4:23-6. [ Links ]
39. Madison S, Walton R. Cervical root resorption following bleaching of endodontically treated teeth. J Endod.1990; 16(12): 570-4. [ Links ]
40. Hirata R, Higashi C. Blanqueamiento dental: conceptos y sustancias blanqueadoras. En: Hirata R. Tips: Claves en odontología estética. Buenos Aires: Editorial Médica Panamericana; 2012. p. 27-101.
41. Shinohara MS, Peris AR, Pimenta LA, Ambrosano GM. Shear bond strength evaluation of composite resin on enamel and dentin after nonvital bleaching. J Esthet Rest Dent. 2005; 17(1):22-29. [ Links ]
42. Amaral C, Jorge A, Veloso K, Erhardt M, Arias V, Rodrigues JA. The effect of in-office in combination with intracoronal bleaching on enamel and dentin bond strength and dentin morphology. J Contemp Dent Pract. 2008; 9(5):17-24. [ Links ]
43. Feiz A, Khoroushi M, Gheisarifar M. Bond strength of composite resin to bleached dentin: effect of using antioxidant versus buffering agent. J Dent (Tehran). 2011;8 (2):60-6. [ Links ]
44. Khoroushi M, Saneie T. Post-bleaching application of an antioxidant on dentin bond strength of three dental adhesives. Dent Res J (Isfahan). 2012; 9(1):46-53. [ Links ]
45. Abbot P, Heah SYS. Internal bleaching of teeth: an analysis of 255 teeth. Aust Dent J. 2009; 54: 326–333.
46. Amato M, Scaravilli MS, Farella M, Riccitiello F. Bleaching teeth treated endodontically: long-term evaluation of a case series. J Endod. 2006; 32(4):376-8. [ Links ]
Declaración de financiamiento de conflictos de intereses: El estudio fue financiado por los autores; declaran no tener conflictos de intereses.
Correspondencia:
Lizbeth Cheng
Correo electrónico: lizbeth.cheng.a@upch.pe
Recibido : 16-09-2016
Aceptado: 15-11-2016













