INTRODUCCIÓN
Los estreptococos del grupo viridans (EGV) son un grupo heterogéneo de bacterias saprófitas anaerobias facultativas microaerofílicas que forman parte de la flora normal de cavidad oral y son patógenos mayoritarios en distintas infecciones orofaciales 1,2. Presentan una prevalencia creciente de resistencia frente a determinados agentes antimicrobianos como los mácrolidos (entre el 35%-70%), penicilinas (naturales o sintéticas) y clindamicina en un porcentaje entre el 10% y 15% 3. En España se ha descrito una alta prevalencia de bacteriemias iatrogénicas orales causadas por estreptococos resistentes a la eritromicina (40,8%) y la clindamicina (21%), siendo la mayoría de los aislamientos sensibles a las aminopenicilina 4.
Las penicilinas sintéticas muy utilizada en el tratamiento de las infecciones odontogénicas 2, han disminuido su eficacia y efectividad en los últimos años por el incremento del número de bacterias productoras de betalactamasas; entre las cuales se destacan los estreptococos del grupo viridans.
Aunque la resistencia de los microorganismos a los antibióticos es un problema que se manifestó desde el comienzo de su aplicación, hoy en día los porcentajes de resistencia han alcanzado cifras alarmantes a escala global 5, sumado a esto, la mala utilización de los antibióticos en consulta tanto médica como odontológica así como en el ámbito hospitalario representan un 75% de los antibióticos prescritos de forma incorrecta 6.
Las infecciones odontológicas (caries, pulpitis, abscesos, gingivitis, periodontitis y pericoronaritis) se sitúan como la primera causa de patología infecciosa en el mundo 5. no sólo por su frecuencia sino también por su posible gravedad y complicaciones. Además, la infección odontogénica, es la tercera causa de consumo de antibiótico generando aproximadamente el 10-12% del total de las prescripciones de estos fármacos en la comunidad 6
El incremento de la resistencia a múltiples antibióticos de estreptococos del grupo viridans cobra importancia en las infecciones nosocomiales que se producen como resultado de antibioticoterapias prolongadas en pacientes hospitalizados 7, quienes luego de pocas horas de haber ingresado reciben antibióticos que modifican la flora normal de boca, orofaringe y piel sustituyéndose los microorganismos habituales por bacterias multirresistentes que representa un riesgo no solo para la salud de los individuos sino que contribuyen a la creciente epidemia de resistencia bacteriana, grave problema de salud pública mundial 8.
En este contexto se plantean el presente estudio con el objetivo de conocer el perfil antibiótico de estreptococos del grupo viridans aislados en cavidad oral de individuos con uso prolongado de antibióticos y así reevaluar su uso y manejo responsable en aras de preservar los efectos sobre determinadas infecciones, reducir las resistencias bacterianas y minimizar los posibles efectos secundarios.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional descriptivo de corte transversal, en el que se incluyeron 60 pacientes internados en los Hospitales: Universitario Mayor Mederi y Maissen ESE de la cuidad de Bogotá, con historia de terapia antibiótica por más de 3 semanas.
Para la recolección de la muestra y previa firma del consentimiento informado aprobado por el Comité de Investigación y Ética de la Facultad de Odontología de la Pontificia Universidad Javeriana, Comité de Ética del Hospital Universitario Mayor de Mederi y Junta Directiva del Hospital Meissen, se utilizó la técnica de frotis mediante barrido de la cavidad oral con 2 hisopos (previamente esterilizados) para cada paciente, los que se colocaron en tubos con caldo tioglicolato para su posterior transporte al Laboratorio de Bacteriología Especializada de la Universidad Javeriana; el procedimiento se hizo siguiendo los lineamientos establecidos por el manual de tomas de muestras microbiológicas de la Secretaría Distrital de Salud, y de acuerdo al protocolo institucional.
Las muestras se sembraron en medio selectivo Agar mitis salivarius y Agar chocolate base tripticasa soya, se seleccionaron las colonias con las características morfológicas y tintoriales del género Streptococcus y posteriormente fueron sometidas a la identificación bioquímica Api 20 Strep (Biomerieux).
Para determinar la Concentración inhibitoria mínima (CMI) y confirmar el fenotipo de estreptococos del grupo viridans aislados, las cepas que por la técnica API 20 resultaron positivas fueron confirmadas por método de dilución en caldo por el sistema Microscan System siguiendo las instrucciones de la casa comercial Becton Dickison la cual identifica el fenotipo mediante un panel de 27 pozos reactivos de sustratos para reacción bioquímica que contiene como pruebas: cristal violeta, Micrococcus screen, nitritos, novobiacina, PGR, β-d glucoronidasa, indol fosfatasa, voges proskawer, optoquina, fosfatasa, bilis esculina, pirridolina, arginina, galactosidasa, urea, manitol, lactosa, trehalosa, mannosa, cloruro de sodio, sorbitol, arabinosa, ribosa, inulina, raffinosa, bacitracina, piruvato.
El test de susceptibilidad para determinar los perfiles de resistencia a los antibióticos del microrganismo identificado se realizó bajo las normas del Clinical and Laboratory Standards Institute 9 utilizando las concentraciones mínimas inhibitorias (CMI) reglamentadas terapéuticamente para 24 antibioticos: amoxicilina/clavulanico, ampicilina, ampicilina/sulbactam, cefoxitin, ceftriaxone, ciprofloxacina, clindamicina, daptomicina, eritromicina, gentamicina, gentamicina synercid, clindamicina inducible, levofloxacin, linezolid, moxifloxacina, nitrofurantoina, oxacilina, penicilina, rifampicina, estreptomicina synercid, tetraciclina, trimetropin sulfa, vancomicina.
Para la clasificación de los estreptococos del grupo viridans (EGV) y de otras bacterias se utilizó la última actualización sobre nomenclatura, taxonomía y clasificación de diversos agentes infecciosos aerobios y facultativos realizada por Bruckner y Colonna 10
Los resultados estadísticos se tabularon en tablas de frecuencias absolutas y relativas en Microsoft Excel 2010 y se muestran en porcentajes de: número de sujetos que presentaron EGV en cavidad oral, indicación de terapia antibiótica, combinaciones antibióticas, otras cepas distintas a EGV y número de cepas sensibles o resistentes a los antibióticos de acuerdo al test de sensibilidad empleado.
RESULTADOS
En total se incluyeron 60 pacientes de los cuales el 43,33% fueron hombres y el 56,67% fueron mujeres. Las indicaciones para la terapia antibiótica intrahospitalaria incluyeron infecciones orofaciales (28,33%), infecciones de tejidos blandos (15%), pie diabético e infecciones de vías urinarias 6,67%; sepsis (5%) y otras infecciones en un 38,33% que corresponden a patologías únicas (Figura 1).
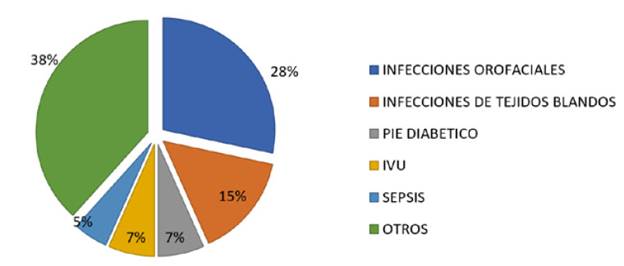
Figura 1 Distribución porcentual de las patologías en pacientes hospitalizados con terapia antibiótica por más de 3 semanas.
En la mayoría de los pacientes 51,67% se utilizó una terapia antibiótica múltiple, en un 30% terapia antibiótica única y en el 18,33% terapia antibiótica combinada. La penicilina fue el antibiótico más utilizado ya sea en terapia única, combinada o múltiple. Dentro del estudio se observó un amplio espectro de antibióticos formulados (38,33%) sin embargo la combinación penicilina - penicilina + clindamicina fue usada en el 23,33% de los pacientes, penicilinas naturales o sintéticas + clindamicina en el 15% y cefalosporinas - carbapenemes en 8,33% (Figura 2).
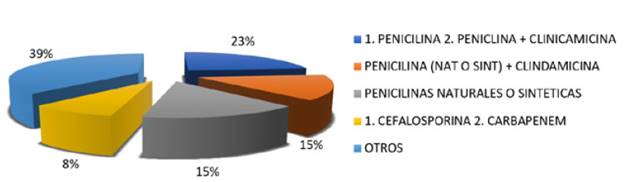
Figura 2 Combinaciones antibióticas más utilizadas en pacientes hospitalizados con terapia antibiótica por más de 3 semanas.
De las muestras tomadas a los 60 pacientes, se aislaron un total de 135 cepas, con un promedio de 2,25 cepas por paciente. El 80 % (108 cepas) correspondían a estreptococos del grupo viridans y el 20% a otros géneros (Figura 3).
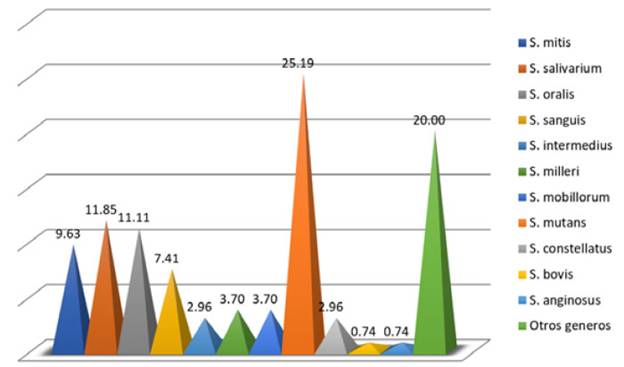
Figura 3 Porcentaje de cepas de estreptococos del grupo viridans aislados de cavidad oral en pacientes hospitalizados con más de 3 semanas de antibiótico
Dentro de los estreptococos del grupo viridans se aislaron 34 cepas de Streptoccocus mutans que corresponden al 31,5% del total de cepas de este grupo y el 25,2% del total de cepas asiladas (figura 3). De los géneros diferentes a estreptococos, Staphylococcus spp correspondió al 62,96% en los cuales se incluyen Staphylococcus aureus meticilin sensible y resistente y Staphylococcus aureus coagulasa negativo (Figura 4).
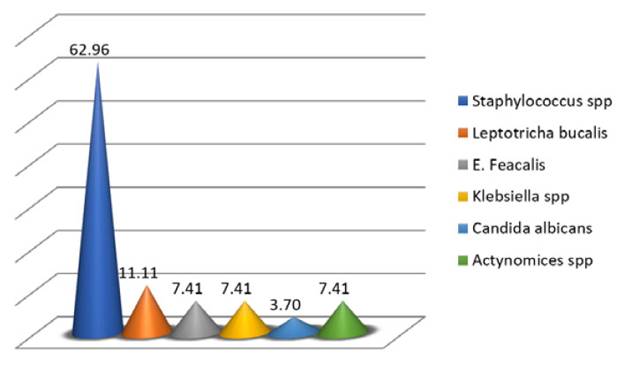
Figura 4 Porcentaje de cepas de géneros diferentes a estreptococos del grupo viridans aislados de cavidad oral en pacientes hospitalizados con más de 3 semanas de antibiótico
El porcentaje de sensibilidad y resistencia del total de cepas de estreptococos del grupo viridans se muestran en la Tabla 1. El 96,3% de las cepas fueron sensibles a todos los antibióticos incluidos en el panel, 1,85% presentaron resistencia intermedia y 1,85% alta resistencia. El perfil antibiótico de este grupo se muestra en la tabla 3.
Tabla 1 Porcentaje de sensibilidad del total de cepas de estreptococos del grupo viridans aislados en pacientes con más de 3 semanas de antibiótico
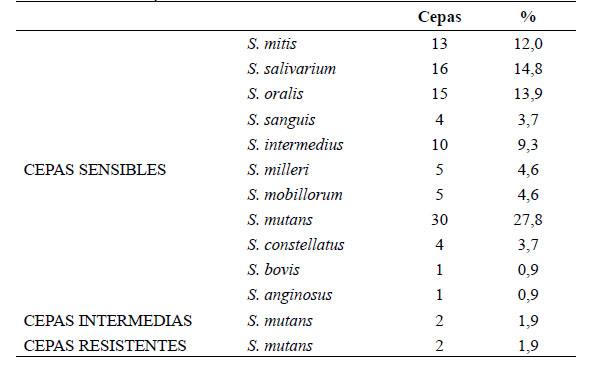
Tabla 2 Porcentaje de sensibilidad del total de cepas de otros géneros aisladas en pacientes con más de 3 semanas de antibiótico
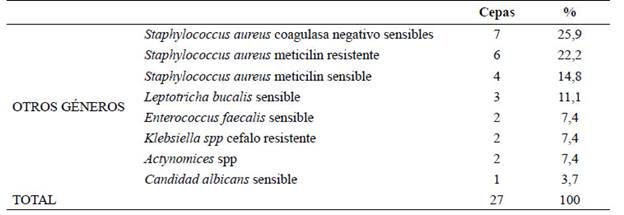
Tabla 3 Perfil antibiótico de cepas de estreptococos del grupo viridans aisladas en pacientes con más de 3 semanas de antibiótico
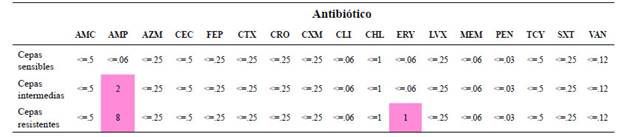
Puntos de corte de interpretación para cada antibiótico tomado del documento M110-S19 de CLSI.Siglas: < significa sensible, > significa Resistente, AMC Amoxicilina/clavulánico AMP Ampicilina, AZM Azitromicina, CEC Cefaclor, FEP Cefepime, CTX cefotaxima, CRO Ceftriaxone, CXM Cefuroxima, CLI clindamicina, CHL Cloranfenicol, ERY eritromicina, LVX Levofloxacina, MEM Meropenem, PEN Penicilina, TCY tetraciclina, SXT trimetropinsulfa, VAN vancomicina
DISCUSIÓN
En el presente estudio se establece el perfil antibiótico de cepas de estreptococos del grupo viridans (EGV) aislados de cavidad oral en pacientes hospitalizados con terapia antibiótica prolongada.
El mayor obstáculo en el conocimiento de la sensibilidad a los antimicrobianos en relación con el género EVG son las manifiestas dificultades de su identificación fenotípica y la diversidad de criterios taxonómicos empleados a lo largo del tiempo, así como la diversidad de bacterias que forman parte de la flora normal de cavidad oral 11
Estudios realizados por Aas et al., 11, y Paster et al., 12 reportan que la diversidad bacteriana en la cavidad oral incluye más de 700 especies, la mitad de las cuales nunca han sido cultivadas. Diferentes sitios en cavidad oral albergan una composición específica y especies únicas, lo cual dependerá del estado de la enfermedad y condiciones del paciente. La prevalencia de estas numerosas especies bacterianas es muy variable, pero son 10 a 20 grupos taxonómicos los más prevalente que comprenden generalmente de 90 a 95% de la microbiota total 13.
Entre los grupos taxonómicos más frecuentes de bacterias odontogénicas aisladas se destacan las especies anaerobias de los géneros Peptostreptococcus spp, Prevotella spp y Fusobacterium spp. Y en menor proporción bacterias aerobias y anaerobias facultativas del género Streptococcus spp, Staphylococcus spp, Corynebacterium entre otros. Dentro de este grupo EGV son la especie aislada con más frecuencia frente al conjunto total de bacterias aerobias aisladas 14. En el grupo de la levaduras, el género comensal más representativo en la cavidad bucal es Candida albicans, y otra especie comúnmente aislada junto con EVG son Actinomyces spp 15. Estos datos concuerdan con los resultados del presente estudio en los cuales EVG corresponden al 80% del total de cepas aisladas seguidos en orden de frecuencia por Staphylococcus spp, Actynomices spp y Candida albicans. Especies bacterianas como Leptotricha bucalis, Enterococcus faecalis y Klebsiella spp aisladas en esta investigación no han sido reportadas comúnmente en cultivos de saliva de cavidad oral 15.
Al analizar los EGV, el número de especies que comprenden este grupo es muy grande y algo complejo por el hecho de que algunos de los organismos comúnmente identificados se pueden separar en especies adicionales si se analiza cuidadosamente por medios bioquímicos y moleculares 16. Actualmente la técnica de referencia para la identificación de las especies de EGV es la secuenciación del RNAr-16S; a pesar de ello existen algunas dificultades para diferenciar las especies S. oralis, S. mutans y S. mitis que presentan una homología genética superior al 99% 17.
En el presente estudio la cepa aislada con más frecuencia de este grupo fue S. mutans; seguida de cepas de S. sallivarium, S.oralis y S.mitis; datos que concuerdan con Kouidhi et al. (18), quienes encontraron que las cepas más aisladas en cavidad oral fueron S. mutans y S.oralis (12% cada uno); en cambio Bilavsky et al. 19 encontraron con mayor frecuencia cepas de S. mitis y S. morbillorum. Al igual que el estudio de Heine et al. 2 en donde S. anginosus y S. mitis fueron las cepas aisladas con mayor frecuencia (42% y 33% respectivamente).
La resistencia de EGV a penicilina ha sido descrita desde 1949 y los porcentajes de resistencia oscilan entre un 10 a un 56.3%. La tendencia hacia la resistencia esta aparentemente correlacionada con la exposición previa al tratamiento antibiótico, sin embargo Bilavsky et al., no encontraron correlación alguna entre la exposición previa y la resistencia antibiótica 19. Loyola et al., encontraron mayor resistencia a clindamicina 59,4% en comparación a un 2,8% de resistencia a amoxicilina con ácido clavulánico en su estudio 7. Sin embargo, una de las principales limitaciones del estudio fue el desconocimiento de la historia previa de uso de antibióticos de los pacientes y el nulo control sobre la vía de administración y el tipo de antibiótico utilizado.
La resistencia de EGV a los antibióticos puede ser explicada en términos de concentración inadecuada del antibiótico o un nuevo concepto denominado resistencia antibiótica colectiva. El primer fenómeno explicado por una concentración muy baja del antibiótico en la mucosa oral en los pacientes con tratamiento antibiótico previo y por una duración relativamente corta del tratamiento para la selección de Streptococcus resistentes. Esta hipótesis se sustenta con datos de niveles séricos máximos después de administración periódica de penicilina que a las 4 semanas alcanza niveles de 0,003UI/ml los cuales no ejercen acción alguna sobre EGV de cavidad oral y además porque la penicilina no se secreta bien a través de la mucosa por lo tanto no es eficaz al momento de erradicar EGV 21, es decir los niveles de penicilina durante la administración parenteral son demasiado bajos para inducir resistencia. De esta forma, se explicarían los resultados obtenidos en este estudio en el cual aunque la penicilina fue uno de los antibióticos más usados (cifras mayores al 39%) las cepas de EGV resistentes fueron muy bajas (3,7%) y por lo tanto sería necesario mayores concentraciones de antibióticos para la inhibición y muerte de la mayoría de especies de EVG de cavidad oral.
El segundo fenómeno de resistencia colectiva se explica desde los factores de virulencia de los Streptococcus spp en general y de S. mutans en particular. Estos factores incluyen la síntesis de polisacáridos extracelulares solubles e insolubles para la formación de biopelículas, la síntesis de polisacáridos intracelulares, la capacidad para iniciar el desarrollo a pH5, e incluso fuera del ámbito oral su participación principalmente en las endocarditis subagudas 22. Estas bacterias además producen una amplia gama de bacteriocinas y mutacinas que son relativamente selectivas en la disminución de la viabilidad o la virulencia de otras especies. Estudios mostraron que el orden en el que las bacterias colonizan una superficie es crucial para que estos mecanismos se expresen o sean eficaces 23. La capacidad de EGV como formadores y colonizadores primarios de biopelículas es uno de los factores de virulencia más importantes y una de sus propiedades más ampliamente estudiadas 24. Se considera que los microorganismos en biopelículas son muy difíciles o casi imposibles de erradicar 25; ya que la biopelícula formada muestra una resistencia a los antibióticos hasta 1000 veces mayor en comparación con las bacterias planctónicas.
El crecimiento dentro de biopelículas otorga a EGV protección frente a los antibióticos debido a la reducida penetración de diversos agentes antimicrobianos en su estructura interior 26. Además las bacterias en los biofilms pueden mostrar disminuciones notables en la susceptibilidad a los antibióticos y otras toxinas, resistiendo concentraciones del fármaco mucho más altas que las requeridas para eliminar las bacterias libres en densidades comparables 27. La inactivación enzimática de antibióticos en las regiones exteriores de un biofilm puede impedir que estas lleguen a las capas más profundas, permitiendo sobrevivir potencialmente a las bacterias sensibles; esto explicaría los datos de sensibilidad en el presente estudio de EGV, los cuales al ser aislados individualmente reportan una sensibilidad muy alta pero como lo indica los datos de Bascones et al., 28, Rodríguez et al., (3, 29), Tomás et al., (4, 30) y Loyola et al., 7, el fenómeno de resistencia en este grupo ha ido aumentado exponencialmente en especial a los antibióticos más comúnmente utilizados en odontología. Los datos incluyen porcentajes de resistencia a los antibióticos que van desde un 35%-70% para macrólidos y del 10-15% para penicilinas (naturales o sintéticas) y clindamicina 1,2,7. Otros autores han confirmado que la alta resistencia a los macrólidos (eritromicina, claritromicina) se asocia frecuentemente a una alta resistencia a las tetraciclinas, a la clindamicina y los azálidos (4, 7, 20); siendo la mayoría de los aislamientos sensibles a las aminopenicilinas. Datos que concuerdan con los resultados de esta investigación.
En conclusión el uso de distintas combinaciones y modalidades de terapia antibiótica no tuvo efecto en la susceptibilidad de estreptococos del grupo viridans aislados de cavidad oral en pacientes hospitalizados independiente de la duración del tratamiento.
Los datos alta sensibilidad obtenidos en el presente estudio en cepas aisladas se podrían explicar a través de la capacidad de EGV de formar biopelículas que les confiere mayor protección pero se necesitan más estudios en este tema.














