INTRODUCCIÓN
El ácido hialurónico (AH) es una sustancia química de la gelatina vítrea de los ojos de vaca; es considerado un polisacárido de alto peso molecular, que se encuentra en la matriz extracelular del tejido conjuntivo, líquido sinovial y está presente en altas concentraciones en el periodonto, la encía y en el ligamento periodontal 12. En el campo de la odontología, el AH ha mostrado efectos antibacterianos y antiinflamatorios durante el proceso de curación de lesiones periodontales 1
Diferentes estudios han comprobado la acción bacteriostática del AH. En la revisión de literatura realizada por Dahiya y Kamal 1, se menciona el estudio de Pirnazar et al., cuyo objetivo fue determinar si, según la concentración o el peso molecular del AH, este poseía efectos bactericidas o bacteriostáticos sobre el crecimiento de ciertas cepas orales y no orales en diferentes especies, a saber: S. mutans, P. gingivalis, Prevotella oris, Actinobacillus actinomycetemcomitans, S. aureus y Propionibacterium acnes. En sus resultados mencionan que no existió efecto bactericida en ninguna cepa, sin importar la concentración o el peso molecular del AH utilizado; sin embargo, hubo efectos bacteriostáticos notables sobre el crecimiento en algunas de ellas, con un patrón diferente según cada cepa. Mencionan que sobre S. mutans y P. gingivalis el efecto fue menor, mientras que, independientemente de la concentración o el peso molecular de AH, S. aureus y A. actinomycetemcomitas mostraron efectos bacteriostáticos más significativos. Esto podría indicar que el uso de AH durante intervenciones quirúrgicas puede reducir el riesgo de infección debido a una disminución en la contaminación bacteriana. El mecanismo de defensa puede atribuirse a características especiales, como que sean viscoelásticas e higroscópicas; estas propiedades modifican el entorno y, de esta manera, aumentan la consistencia del componente activo y sirven de barrera para impedir el paso de bacterias hacia los tejidos, incluyendo el tejido periodontal 12
Por otro lado, las primeras evidencias del consumo de miel datan del período mesolítico (6000 años a. C.), mientras que su uso en forma de medicamento empezó a aplicarse por los mesopotámicos hace 2500 a. C.; además, los antiguos egipcios, griegos, romanos, entre otros, empleaban la miel para curar heridas 34 La miel de abeja puede ser definida como una sustancia de sabor dulce, sin fermentar, elaborada por abejas, que ha sido utilizada desde la edad antigua, ya sea como producto alimenticio y/o medicinal 3. Hipócrates, en su obra Consideraciones sobre el tratamiento de las heridas, menciona que en la curación se puede colocar miel 3-5. La miel de abeja fue redescubierta en la Edad Moderna como tratamiento alternativo antibacteriano frente a microorganismos presentes en heridas que son resistentes a antibióticos 3-6. Es por ello que gran cantidad de estudios tienen como objetivo demostrar las propiedades de la miel que ayudan en la reparación de heridas de diversa etiología 4; además, se considera un tratamiento alternativo natural que reduce el costo de los tratamientos modernos y es de fácil acceso 3.
El mecanismo de acción se produce debido a los antioxidantes de la miel, los cuales limpian los radicales libres como producto de la etapa inflamatoria, reducen el estrés oxidativo y, a su vez, el proceso inflamatorio. Asimismo, la miel disminuye los niveles de prostaglandinas, siendo esta una sustancia que favorece la inflamación; además, mediante la eliminación de bacterias que podrían estimular la respuesta inflamatoria, reduce esta reacción 34 El efecto cicatrizante de la miel puede ser el resultado de la combinación de factores, como la formación de un ambiente con características húmedas para favorecer el aumento celular, la eliminación del tejido desvitalizado con zonas necróticas, la reducción de edema, la formación de tejido de granulación y su consecuente epitelización y propiedades antibacterianas y fungicidas. Además, su acidez aumenta la oxigenación de la sangre, lo que ayuda a reparar los tejidos 34.
La miel de abeja tiene propiedades antibacterianas debido a la presencia de algunas sustancias como acidez natural, compuestos fenólicos y peróxido de hidrógeno. Estos componentes ayudan a inhibir el crecimiento de bacterias, lo que contribuye a su capacidad para combatir infecciones y promover la cicatrización de heridas. La miel de abeja se ha utilizado tradicionalmente con fines medicinales gracias a estas propiedades antibacterianas34.
El cobayo, también denominado conejillo de Indias o cuy, originario de Sudamérica, comparte algunas características similares con la encía de los seres humanos, y al ser extremadamente dócil se convierte en el ideal para animal de laboratorio 78.
El objetivo del presente estudio in vivo fue comparar la aplicación tópica de AH y miel de abeja en la cicatrización y desarrollo de bacterias en la mucosa de cobayos.
MATERIALES Y MÉTODOS
La presente investigación es un estudio de tipo in vivo, simple ciego, comparativo y longitudinal. Los datos del trabajo experimental fueron analizados en el paquete estadístico IBM® SPSS v. 25. A través del software se realizó un análisis estadístico descriptivo. Se aplicó la prueba de normalidad de Kolmogorov-Smirnov para determinar si las variables son paramétricas o no paramétricas. Se aplicó la prueba de chi-cuadrado y ANOVA para muestras independientes, a un nivel de significancia menor de 0,05, que demuestra significancia estadística en relación con las sustancias utilizadas y características clínicas de la herida.
La muestra fue seleccionada con base en las 3 R de la experimentación animal (reemplazar, reducir y refinar). La muestra estuvo compuesta de 30 cobayos, todos en las mismas condiciones (lugar, alimentación y temperatura), con similitudes fisiológicas en cuanto a la formación y constitución de la mucosa bucal. Se formaron grupos de estudio de 10 cobayos cada uno: dos grupos para la aplicación de sustancias (A: ácido hialurónico; B: miel de abeja) y un grupo control (C: cicatrización fisiológica), considerando los criterios de inclusión (machos sanos de la misma raza línea genética y tipo, con un peso de 900-1000 g, de 3 a 4 meses de edad, con alimentación balanceada). Los cobayos enfermos o con lesiones fueron excluidos.
Los cobayos fueron adquiridos en el bioterio de la Universidad Central del Ecuador; además, fueron valorados por el médico veterinario responsable del Centro de Biología para identificar la presencia o ausencia de enfermedades y seleccionarlos de acuerdo a los criterios de inclusión.
Con respecto a las sustancias, el AH (Revanesse Pure®) fue adquirido en Medsurgical Ecuador, centro autorizado de distribución. Fabricante: Prollenium Medical Technologies Inc. Se trata de una sustancia fabricada según serie completa de pruebas conforme a ISO 10993, lote: 18J042-15-1. Presentación: 14 mg/mL con jeringa de 1 mL con aguja 30G, sustancia no reticulada. Fecha de expedición: 08-2019; fecha de vencimiento: 08-2020.
La miel de abeja (Apis mellifera) fue adquirida en Camari (Centro Agropecuario y Artesanal), acreditado por el Sistema de Gestión de Calidad Ecuatoriano ISO 9001-2018. Fabricante: asociación apícola Pacha, lote: 06052019. Presentación: miel de abeja pura de 500 g, que cumple con la Norma Técnica Ecuatoriana NTE INEN 1572. La miel de abeja empleada en el estudio cumple con requisitos físicos, químicos y microbiológicos que aseguran el consumo y la utilización del producto según un análisis microbiológico y de alimentos realizado en la Facultad de Ciencias Químicas de la Universidad Central del Ecuador. Se trata de una sustancia viscosa. Fecha de expedición: 06-2019; fecha de vencimiento: 06-2020.
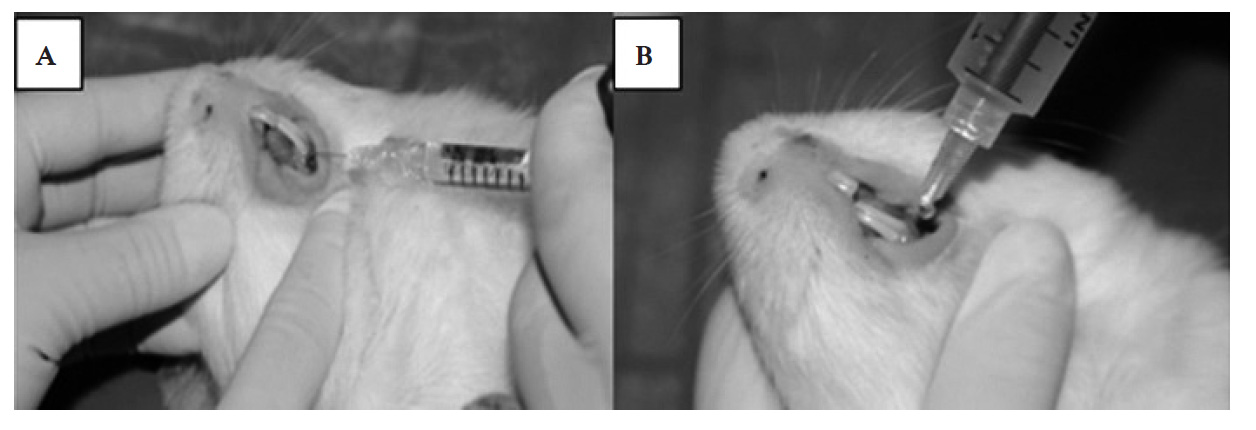
Se inició con la fase de adaptación y cambio gradual de alimentación durante 10 días; al día 11 de permanencia en el bioterio, el veterinario verificó las condiciones y el peso de los cobayos. Para determinar la dosis del anestésico, se utilizó ketamina por vía parenteral intramuscular para sedación consciente con jeringa de 1 cc en dosis de 0,1 mg/kg de peso, más sulfato de atropina en dosis de 0,04 mg/kg de peso (Ket-A-Xyl®). A continuación, se aplicó anestesia tópica (lidocaína en spray al 10 %) y se realizó una incisión circular de 4 mm en la región mandibular del lado izquierdo lateral a las piezas dentarias con bisturí circular n.º 4, posterior a la incisión; inmediatamente después, se aplicó una gota de AH, utilizando una jeringa de 1 cc con una aguja 30G, en el grupo A (figura 1A), mientras que en el grupo B se administró miel de abeja mediante una jeringa de 10 mL con la aguja cortada al nivel del pivote (figura 1B). El grupo C, que sirvió como grupo control, no recibió ninguna sustancia. Posterior al procedimiento, se ubicó a los cobayos en mantas térmicas dentro de las jaulas, con temperatura apropiada para su recuperación.
Al cuarto y sexto día después de la incisión, se realizó el examen clínico de la herida en los tres grupos para evaluar sus características: sangrado, edema y eritema. Además, se evaluó la cantidad de tejido cicatricial existente mediante una sonda periodontal Williams (figura 2). Para la evaluación del tamaño del tejido cicatricial se tomaron mediciones de 0 a 4 mm. Se realizó un cálculo matemático teniendo en cuenta que 4 mm es el 100,00 % de superficie cicatrizada; por tanto, entre los resultados de la medición se encuentran valores porcentuales de referencia: 4 mm = 100,00 %; 3 mm = 75,00 %; 2 mm = 50,00 %; 1 mm = 25,00 %; 0 mm = 0,00 % de superficie cicatrizada.
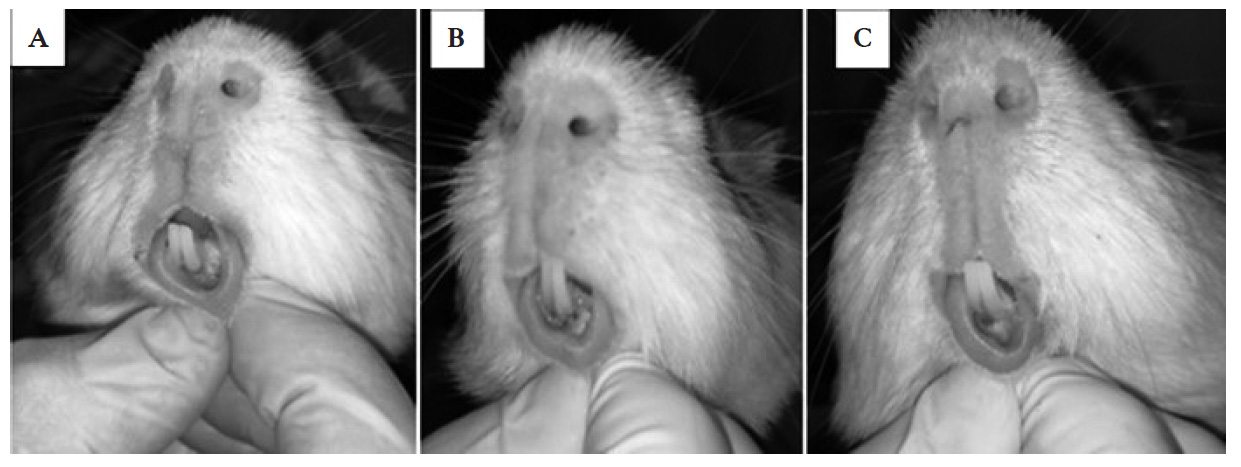
Figura 2 Características de la herida al cuarto día. A. Ácido hialurónico; B. Miel de abeja; C. Grupo control.
Al quinto día después de la incisión, se realizó la toma de la muestra de la herida mediante un hisopado para el cultivo bacteriano en los tres grupos de estudio; a las 24 horas de realizar la siembra, se retira las cajas Petri de la incubadora para proceder a realizar el recuento de las unidades formadoras de colonias (UFC) de los tres grupos de estudio (figura 3). Al octavo día posterior a la incisión, se realizó el examen clínico de la herida en los tres grupos para evaluar las características de la herida: sangrado, edema, eritema, supuración y unión epitelial.

Figura 3 Conteo de UFC de dos cajas Petri para cada muestra del grupo de ácido hialurónico (A), grupo de miel de abeja (B) y grupo control (C).
Se utilizaron datos dicotómicos para la cuantificación de las variables dependientes del estudio, las cuales corresponden a las características de la herida mencionadas previamente, mediante la observación y palpación. Se categorizaron según la ausencia o la presencia de la característica clínica.
La presente investigación contó con la aprobación del Comité de Ética de la Universidad Central del Ecuador, con fecha 26 de noviembre de 2019.
RESULTADOS
La muestra total que se incluyó en el estudio fue de 30 cobayos, divididos en tres grupos de 10 (33,33 %; n = 10): A (ácido hialurónico [AH]); B (miel de abeja); C (grupo control). Todos los cobayos se mantuvieron en las mismas condiciones y se les aplicó sustancias en la mucosa para comparar la cicatrización y el desarrollo de bacterias.
En el cuarto día, el grupo A (AH) presentó sangrado en el 16,67 % (n = 5) de los casos; el grupo B (miel de abeja) en el 23,33 % (n = 7); y el grupo C (grupo control) en el 23,33 % (n = 7). Tanto el eritema como el edema se presentaron en el 100 % (n = 30) de los casos en los tres grupos.
En el sexto día, el grupo A (AH) mostró sangrado en el 13,33 % (n = 4) de los casos; el grupo B (miel de abeja) en el 16,67 % (n = 5); mientras que en el grupo C (grupo control) se presentó en el 23,33 % (n = 7). En cuanto al eritema, el grupo A (AH) lo evidenció en el 13,33 % (n = 4) de los casos, el grupo B (miel de abeja) en el 16,67 % (n = 5), y el grupo C (grupo control) en el 23,33 % (n = 7). Respecto al edema, el grupo A (AH) lo presentó en el 3,33 % (n = 1) de los casos, el grupo B (miel de abeja) en el 10,00 % (n = 3), y el grupo C (grupo control) en el 16,67 % (n = 5).
Al octavo día, el grupo A (AH) presentó sangrado en el 6,67 % (n = 2), el grupo B (miel de abeja) en el 10,00 % (n = 3), y el grupo C (grupo control) en el 20,00 % (n = 6). Respecto al eritema, el grupo A (AH) lo evidenció en el 10,00 % (n = 3), el grupo B (miel de abeja) en el 13,33 % (n = 4), y el grupo C (grupo control) en el 16,67 % (n = 5). Con relación al edema, el grupo A (AH) lo presentó en el 3,33 % (n = 1), el grupo B (miel de abeja) en el 6,67 % (n = 2), y el grupo C (grupo control) en el 10,00 % (n = 3). Los datos indican que el AH contribuye a la disminución de características clínicas de la herida en comparación con el uso miel de abeja y cicatrización fisiológica (Tabla 1).
Tabla 1 Comparación y evaluación de las características clínicas de la herida entre los días 4-8 (día 6: medición de tejido cicatricial; día 8: presencia de secreción purulenta y unión epitelial).
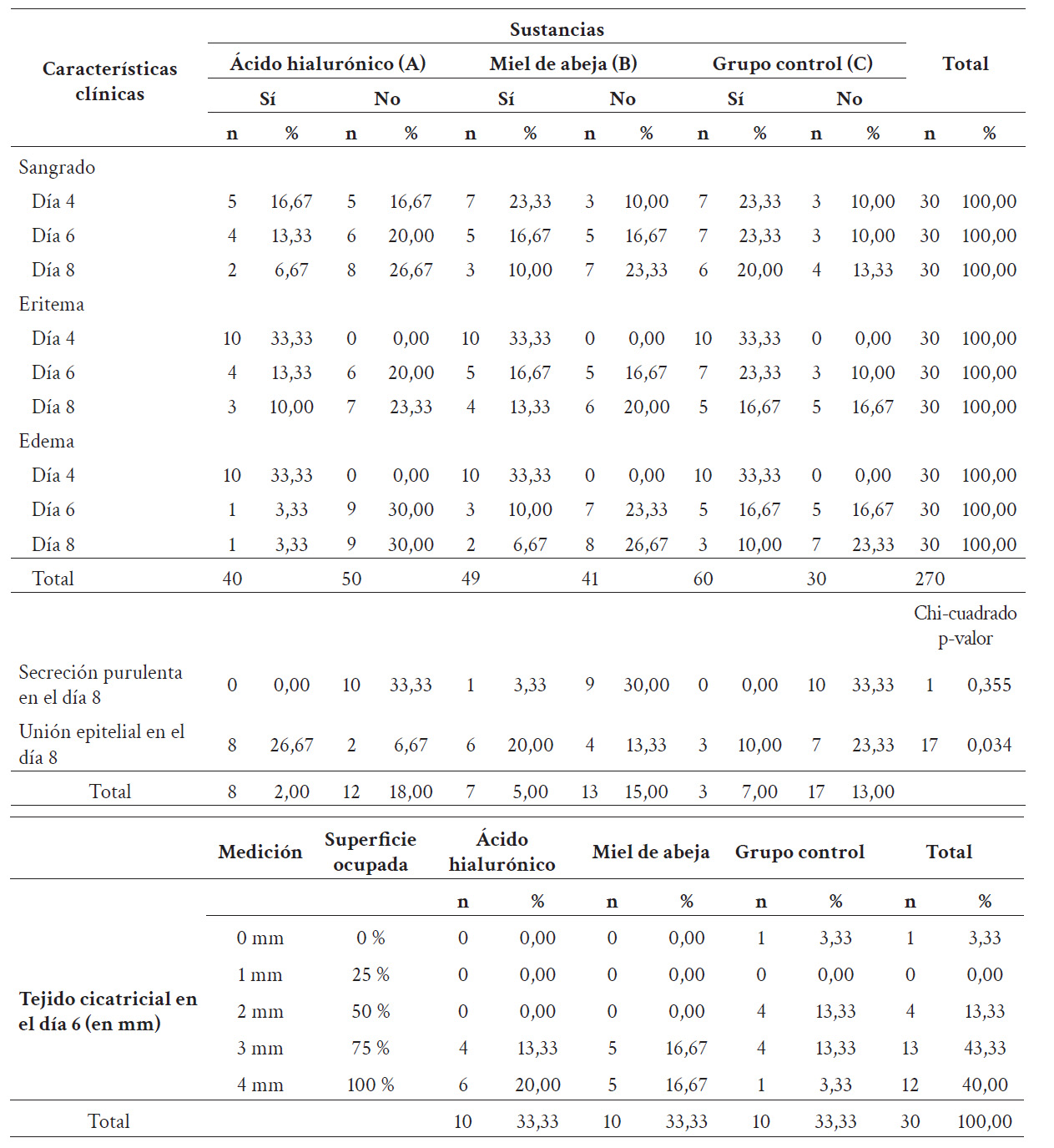
En la evaluación del tejido cicatricial al sexto día, se evidenció que el 43,30 % (n = 13) presentó una medición de 3 mm, equivalente al 75 % de la herida cubierta, siendo predominante en el grupo B (miel de abeja) con un 16,67 % (n = 5). Se observó, asimismo, tejido cicatricial de 4 mm, equivalente al 100 % de la herida cubierta, en el 40,00 % (n = 12), siendo predominante en el grupo A (AH) con un 20,00 % (n = 6). Mientras tanto, el grupo C (grupo control) obtuvo mediciones de entre 0 a 3 mm (Tabla 1). Por tanto, la aplicación tópica de AH promueve la formación de tejido cicatricial en la herida en comparación con el uso de miel de abeja y la cicatrización fisiológica.
Al octavo día, durante la evaluación de la herida, se evidenció supuración en el grupo B (miel de abeja) en el 3,33 % (n = 1) de la muestra total. En relación con la unión epitelial, en el grupo A (AH) se observó una herida cerrada en el 27,67 % (n = 8); en el grupo B (miel de abeja) en el 20,00 % (n = 6), y en el grupo C (grupo control) en el 10,00 % (n = 3). Se obtuvo un p-valor de 0,034, que indica una asociación significativa entre las sustancias administradas y la unión epitelial (tabla 1). Por tanto, la aplicación tópica de AH contribuye al cierre de la herida en comparación con el uso de miel de abeja y la cicatrización fisiológica.
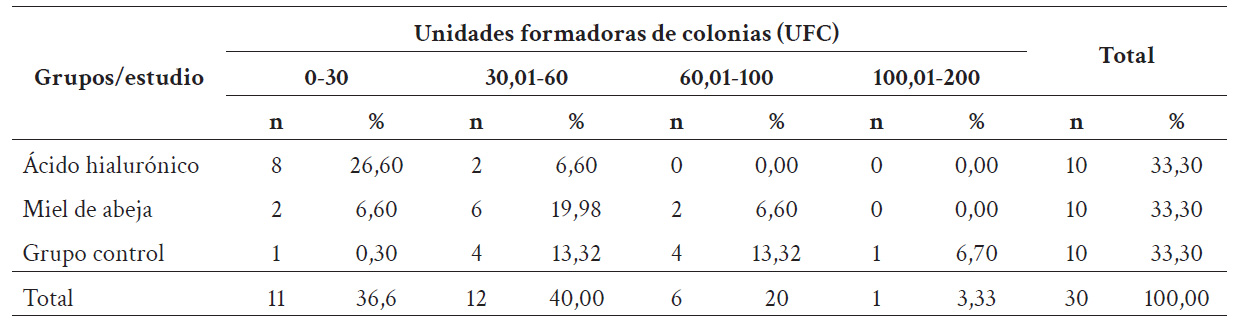
Al realizar el recuento de UFC para cada cobayo, se observó que, en el rango de 0,00-30,00 UFC, el grupo A (AH) presentó el 26,60 % (n = 8); el grupo B (miel de abeja), el 6,60 % (n = 2); y el grupo C (grupo control), el 0,30 % (n = 1). En el rango de 30,01-60,00 UFC, el grupo A (AH) presentó el 6,60 % (n = 2); el grupo B (miel de abeja), el 19,68 % (n = 6); y el grupo C (grupo control), el 13,32 % (n = 4). En el rango de 60,01-100,00 UFC, el grupo A (AH) presentó el 0,00 % (n = 0); el grupo B (miel de abeja), el 6,60 % (n = 2); y el grupo C (grupo control), el 13,32 % (n = 4). En el rango de 100,01-200,00 UFC, el grupo A (AH) presentó el 0,00 % (n = 0); el grupo B (miel de abeja), el 0,00 % (n = 0); y el grupo C (grupo control), el 6,70 % (n = 1) (Tabla 2). La aplicación tópica de AH contribuye a la disminución de UFC, presentando una menor cantidad en la herida en comparación con el uso de miel de abeja y la cicatrización fisiológica.
DISCUSIÓN
El AH, al ser un componente que se encuentra en alto porcentaje en la matriz extracelular, posee la característica de atraer agua en grandes cantidades hacia el espacio intercelular, con lo que consigue una unión celular estrecha y gelatinosa 9; es una sustancia producida por fibroblastos que puede ser administrada exógenamente potenciando la formación de matriz y fibras elásticas, contribuyendo a la síntesis de colágeno. Varios autores han reportado propiedades importantes del AH, como angiogénesis, remodelación y mantenimiento tisular 19. 11
La administración tópica de AH ha demostrado utilidad como terapia coadyuvante en gingivitis, periodontitis crónica, úlceras orales, y en heridas durante el período postquirúrgico, favoreciendo la recuperación tisular 12,13. Pistorius et al. 14 evaluaron la eficacia de la administración tópica de AH para el tratamiento de la gingivitis e identificaron que la aplicación tópica de la preparación que contiene AH era un complemento potencialmente útil.
En el estudio de Park et al. 15, se evidenció en los animales de experimentación, mediante la utilización de AH, una mejor recuperación tisular macroscópica y microscópica: evidencia de abscesos, infiltrado neutrófilo y necrosis menor que en el grupo control. En general, la aplicación local inmediata de AH en las heridas redujo significativamente la aparición y la duración de la infección del sitio quirúrgico en un modelo animal 15-18.
En el presente estudio, con relación a la unión epitelial (medición realizada al sexto día en forma centrípeta con la ayuda de una sonda periodontal), se evidencia que el grupo al que se le aplicó AH muestra una mejor respuesta con mediciones de 4 mm de tejido cicatricial en un 20,00 % (n = 6) de los cobayos, mostrando un tejido de cicatrización más compacto. Al octavo día del análisis clínico, la herida se encuentra cerrada en 8 cobayos (27,67 %) del grupo al que se le aplicó AH; esto indica una actividad cicatrizante en relación con el grupo control. El grupo al que se le aplicó AH presentó mayor cantidad de muestras en el rango de 0-30 UFC, lo que nos permite concluir que posee actividad antibacteriana en relación con el grupo control.
Los estudios sugieren que la miel posee efectos en la reparación de las heridas y que ayuda en el proceso de cicatrización, no solo por su actividad antioxidante, sino también por su propiedad antiinflamatoria y de regulación de la inflamación, efecto que se puede evidenciar durante la evolución de las heridas 5. Ndayisaba 18 trata sobre el redescubrimiento de las propiedades reparativas de la miel de abeja, además realizó un estudio en 40 pacientes que tuvieron heridas con causa variada, así como también quemaduras con infección; dicho autor encontró efectividad reparativa de la miel en el 88 % de los casos.
En el presente estudio, en relación con el grupo al que se le administró miel de abeja, se evidenció que, al cuarto día posterior a la incisión, existió la presencia de sangrado en el 23,33 % (n = 7) de cobayos, además de eritema y edema en la totalidad de cobayos 100,00 % (n = 30); al sexto día posterior a la incisión, se observó sangrado y eritema en el 16,67 % (n = 5) y edema en el 10,00 % (n = 3); al octavo día, la presencia de sangrado fue de 10,00 % (n = 3), de eritema en el 13,33 % (n = 4) y de edema en el 6,67 % (n = 2), además un (3,33 %) cobayo presentó secreción purulenta.
Al sexto día en la medición de la herida en forma centrípeta, el grupo A (AH) evidencia una mejor respuesta con mediciones de 4 mm de tejido cicatricial en un 16,67 % (n = 5) de cobayos, mostrando un tejido de granulación delgado.
Al octavo día del análisis clínico, la herida se encuentra cerrada en 6 cobayos, que corresponden al 20,00 % del grupo al que se le aplicó miel de abeja. Esto nos indica que posee actividad cicatrizante en relación con el grupo control.
El grupo al que se le aplicó miel de abeja presentó mayor cantidad de muestras en el rango 30,01-60 UFC, lo que nos permite concluir que posee actividad antibacteriana en relación con el grupo control.
Durante el transcurso del estudio se evidenciaron algunas limitaciones que están relacionadas con la dificultad en el manejo y en los cambios bruscos del ambiente, que repercuten en el comportamiento y la salud de los sujetos de investigación, así como por la alimentación, que puede ocasionar posibles lesiones durante la masticación y hábitos agresivos de los cobayos.
CONCLUSIÓN
La aplicación tópica de AH contribuye a la formación de tejido cicatricial de 4 mm (sexto día: 20,00 %; n = 6), cierre de la herida (octavo día: 27,67 %; n = 8) y disminución en la formación bacteriana (rango de 0,00-30,00 UFC; 26,60 %; n = 8), en comparación con el uso tópico de miel de abeja y la cicatrización fisiológica. Existe asociación estadísticamente significativa entre las sustancias administradas y la unión epitelial.