Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.22 n.1 Lima ene./mar. 2002
CONTRIBUCIÓN ESPECIAL
Esófago de Barrett
Fernando Barreda Bolaños1; Juvenal Sánchez Lihon2; Oscar Misad Nuñez2; Juan Combe Gutiérrez1; Edgar Amorín Kajatt3; Víctor Rojas Gonzáles3; Juan Celis Zapata4; Mauricio Díaz Del Olmo García5
1 Servicio de Gastroenterología del Departamento de Abdomen del Instituto de Enfermedades Neoplásicas, Dr. Eduardo Cáceres Graziani, (INEN),
2 Departamento de Patología del INEN,
3 Departamento de Tórax del INEN,
4 Departamento de Abdomen del INEN,
5 Médico Residente de Gastroenterología, rotación externa.
RESUMEN
En el presente reporte, se realiza en la primera parte una revisión de la definición, de la historia y de los aspectos clínicos del Esófago de Barrett. A continuación, se presenta los resultados que hemos obtenido en el INEN, Lima - Perú. El primer caso diagnosticado de Esófago de Barrett complicado con adenocarcinoma data de 1956. La prevalencia del Esófago de Barrett en 3904 pacientes examinados por endoscopía es de 0.64%. El Esófago de Barrett en 40 pacientes evaluados afecta preponderantemente al sexo masculino con una relación de 3 a 1 respecto al femenino. El promedio de edad de los pacientes con Esófago de Barrett es de 60 años. La frecuencia de presentación del Esófago de Barrett se incrementa con la edad, sobretodo a partir de los 40 años, alcanzando su máxima expresión en el grupo de 55 a 64 años. La displasia está asociada con la metaplasia intestinal. La frecuencia de presentación del carcinoma epidermoide es de 96% y del adenocarcinoma es de 4% en un período evaluado de 15 años (1985-1999). La tendencia del carcinoma epidermoide en relación al adenocarcinoma no presenta variación en cuanto a sus proporciones en el período en referencia. El adenocarcinoma en el Esófago de Barrett afecta sobretodo al sexo masculino en una relación de 6:1, respecto al femenino. La metaplasia intestinal está presente en 13/14 pacientes evaluados por adenocarcinoma de esófago. El esófago largo de Barrett está en 13/14 pacientes complicados con adenocarcinoma. La longitud promedio del esófago largo de Barrett es de 6cms. en los pacientes con adenocarcinoma.
Palabras Claves: Barrett, Esófago
SUMMARY
The first part of this report reviews the definition, history and clinical aspects of Barretts Esophagus. The next section explains the results obtained at INEN, Lima – Peru. The first case of Barretts Esophagus complicated with Adenocarcinoma was diagnosed in 1956. The prevalence of Barretts Esophagus in 3,904 patients who were administered endoscopy examinations is 0.64%. The evaluation of 40 patients with Barretts Esophagus indicated that it has a greater incidence in males than in females (3:1). The average age of patients with Barrett´s Esphagus is 60 years and its incidence increases as they grow older. It manifests itself in 40 year old persons and is specially strong from 55 to 64 years of age. Dysplasia is associated with Intestinal Metaplasia. The frequency of the epidermoid carcinoma is of 96% and for adenocarcinoma of 4% in the period of evaluation of 15 years (1985-1999). There is no difference in the tendency of epidermoid carcinoma and esophagus adenocarcinoma during the same evaluation period. The incidence of Barretts Esophagus adenocarcinoma is higher in males than in females: (6:1). Intestinal metaplasia is found in 13/14 patients evaluated in relation to the esophagus adenocarcinoma. Long segment Barretts Esophagus, is found in 13/14 patients complicated with adenocarcinoma. The average size of the long segment Barretts Esophagus is of 6 cm in the patients with adenocarcinoma.
Key words: Barrett, Esophagus
INTRODUCCIÓN
Esófago de Barrett es el epónimo aplicado al epitelio columnar que recubre el esófago distal, el cual es adquirido como una complicación debido al reflujo gastro-esofágico crónico(1). El uso de epónimos en medicina puede ser criticado porque generalmente dan poca información acerca de la condición a la cual se refieren, con frecuencia inmortalizan a médicos que no fueron los primeros en describir las condiciones que llevan su nombre, y los estudios posteriores pueden demostrar que las descripciones originales de los investigadores en referencia fueron al menos, parcialmente incorrectas. Estas tres críticas alcanzan y pueden ser hechas precisamente al término Esófago de Barrett(2,3).
Sin embargo, hay términos en medicina que están firmemente enraizados, y siendo epónimos, la misión radica en ponerse de acuerdo en lo que entendemos por dicho nombre, pero antes de ello, no debemos olvidar que el uso precisamente de epónimos en la ciencia médica recuerda a la comunidad científica los aspectos personales e históricos del progreso médico, que con frecuencia se deja de lado en la enseñanza médica.
Norman R. Barrett nació el 16 de Mayo de 1903 en Adelaida, al Sur de Australia, dejando su tierra natal a los 10 años de edad para irse a radicar con su familia a Inglaterra, regresando sólo una vez a su Patria en 1963 como profesor visitante. En los años de colegio en Cambrigde fue motejado perversamente como Pasty por sus mejillas intensamente rosadas y así fue conocido amigablemente por el resto de su vida. Fue un reconocido cirujano de Tórax y trabajó en el Hospital St. Thomas´s desde 1935 hasta el final de su carrera(2).
Fue el primer editor quirúrgico de la revista Thorax, permaneciendo como editor desde 1945 hasta 1971 y su carácter poco ortodoxo se revela en la manera como estableció la unidad de tórax en el St. Thomas´s: una mañana, simplemente caminó hacia una sala y anunció sin consultar previamente con ningún comité, que se creaba la unidad de tórax. Sir Ronald Belsey, que fue un residente de Barrett, recuerda que uno de sus dichos favoritos era: never, under any circumstances, give way to the illusion that you are doing any good.
Norman Barrett llegó a publicar más de 70 artículos, sobre diversos tópicos, con la característica que iniciaba los mismos con una revisión histórica detallada. Como investigador quirúrgico fue llamado The Doyen of Esophageal Surgery por Ellis y Olsen, en la dedicación de su volumen sobre Acalasia(4).
Barrett nunca reclamó ser el primero en describir el esófago distal cubierto por epitelio columnar, e inclusive mencionó 09 reportes posibles previos(5,6), no obstante, fue un investigador inglés, Philip Allison, quien en 1953, en un artículo de la revista Thorax(7), acuñó el nombre de Ulceras de Barrett a las que previamente Norman Barrett había descrito en 1950 en la revista British Journal of Surgery(5), como úlceras pépticas crónicas del esófago, y al epitelio columnar tipo-gástrico circundante, a su vez, lo denominó como Esófago de Barrett.
De esta manera, se hace interesante poder consignar algunos aspectos del desarrollo histórico de la definición del Esófago de Barrett, pues hay pocos términos en medicina que han implicado tantas cosas diferentes para gentes diferentes(8), así que como refieren Modlin y Sachs(9) haciendo sobretodo referencia a una excelente revisión de la historia y terminología de Barrett realizada por Stuart Jon Spechler(10), en 1950, Norman Barrett(5), define el esófago como aquella parte del tracto digestivo superior, distal al esfínter cricofaríngeo, el cual está cubierto por un epitelio de tipo escamoso. Él describió en su artículo un número de pacientes que tenían ulceraciones en un órgano tubular, intratorácico que parecía ser el esófago excepto que su porción distal estaba recubierta extensamente por un epitelio columnar de tipo gástrico. Desde que el esófago era por definición, una estructura cubierta por epitelio escamoso, Barrett creyó que el órgano recubierto por epitelio columnar era un segmento tubular del estómago generado por tracción inducida por un esófago-corto congénito (cubierto por epitelio escamoso) y arrastrado dentro de la caja torácica. En su reporte, Barrett no identificó hallazgos de metaplasia intestinal en el epitelio columnar. Esto fue notado en 1951 por Bosher y Taylor, quienes comentaron acerca de la apariencia de la mucosa gástrica heterotópica en el esófago con formaciones de ulceración y estenosis. Ellos notaron que la mucosa gástrica estaba compuesta de glándulas las cuales contenían células tipo goblet, pero no células parietales(11). Un año más tarde, en 1952, Basil Morson junto a Belcher(12) comentaron acerca de la relación del adenocarcinoma de esófago y la mucosa gástrica ectópica. Ellos puntualizaron que en un individuo con adenocarcinoma de esófago, la mucosa exhibía cambios atróficos con cambios hacia un tipo intestinal que contiene muchas células tipo goblet. En 1953, Allison y Johnstone hicieron notar que Barrett se había equivocado en identificar la estructura intratorácica cubierta por epitelio columnar como estómago y que en realidad era el esófago cubierto por un epitelio de tipo columnar(7). Así que, 7 años después de su reporte original, Norman Barrett aceptó que el órgano con epitelio columnar que él previamente creyó que era el estómago, era de hecho el esófago y sugirió que la condición se denominase como el esófago distal cubierto por epitelio columnar(13), (Fig. 1).
| Fig. 1. Composición de la fotografía de Norman Barrett y su comunicación original de 1957, acerca del epitelio columnar en esófago distal, según adaptación de Modlin y Sachs (9). |
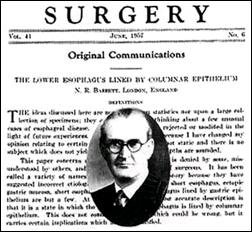
En 1959, Moersch y colaboradores(14), sugirieron de manera implícita que el epitelio columnar podría no ser congénito, sino adquirido como una consecuencia de la esofagitis de reflujo. En 1961 Hayward(15), envió a la revista Thorax de la cual Barrett era editor principal, un argumento persuasivo indicando que el esófago columnar distal, era un proceso metaplásico potencialmente reversible y secundario al reflujo gastro-esofágico, a pesar de ello Barrett continuó promoviendo una etiología de desarrollo congénito para el epitelio columnar distal. Es de resaltar, la posición de Barrett al respecto, ya que en 1957 él sostenía que si por cualquier razón la cubierta escamosa del esófago distal fuese destruida podría ser en teoría, reemplazada por células columnares(13).
A través de la década del 60 hasta mediados de los 70 no sólo los reportes del Esófago de Barrett eran escasos, sino que además se mantenía una controversia considerable acerca de la naturaleza de los hallazgos histológicos del epitelio de Barrett, hecho que fue zanjado en 1976, de acuerdo a un reporte realizado por Paull A. y colaboradores, quienes clarificaron estos conceptos, mostrando que las biopsias obtenidas del esófago distal cubierto con mucosa columnar, de diferentes niveles y con control manométrico, revelaron la presencia de 03 tipos de epitelio columnar localizados proximalmente o por encima del esfínter esofágico inferior: el epitelio de tipo fúndico, el epitelio de tipo cardial y el epitelio especializado o de tipo intestinal con células goblet, intercalados en algunos pacientes, pero con cierta predominancia a una localización más proximal del epitelio columnar tipo intestinal con células goblet (16). En vista que el epitelio de Barrett es un epitelio de tipo glandular, los carcinomas que se originan allí, en general son los adenocarcinomas, sin embargo, algunos carcinomas eventualmente migran hacia la variedad del carcinoma epidermoide(17, 18, 19).
En la década de los 80, diversos investigadores, establecieron criterios arbitrarios en la definición del Esófago de Barrett, considerando su presencia sólo si la extensión del esófago tubular distal cubierto con epitelio columnar fuese de 3 ó más centímetros. Esto fue realizado con fines de investigación y para poder evitar así los diagnósticos falsos positivos, consignando además los autores, que la displasia fue el hallazgo más serio de potencial degeneración maligna en el epitelio de Barrett y que a su vez, estaba particularmente asociada con el epitelio de tipo intestinal(20).
Al limitar el diagnóstico a una extensión igual o mayor de 3 centímetros, se estaba obviando la presencia de epitelio columnar sobre todo de tipo intestinal en los 2 a 3 últimos centímetros del esófago distal, además, se empezó a reconocer cada vez con mayor claridad que el riesgo de cáncer residía primariamente en el epitelio especializado de metaplasia intestinal y no en el de tipo gástrico(21, 22, 23).
Por lo que, hay autores que opinan que el diagnóstico del Esófago de Barrett se debe restringir solamente a aquellos casos que tengan al menos una biopsia con la presencia de células goblet (3), así, el criterio diagnóstico del Esófago de Barrett ha pasado las últimas décadas de considerarse a un esófago extensamente comprometido por epitelio gástrico, hasta la presencia de cualquier extensión de metaplasia intestinal(24).
El Esófago de Barrett tradicionalmente ha sido asociado con la enfermedad del reflujo gastro-esofágico y con el adenocarcinoma, consecuentemente, los estudios acerca del Esófago de Barrett han sido conducidos sea por investigadores primariamente interesados en el reflujo gastro-esofágico o aquellos focalizados primariamente en cáncer, por lo que estos investigadores frecuentemente han diferido en sus perspectivas y aproximaciones para el estudio del Esófago de Barrett, y estas diferencias han contribuido a mantener la controversia acerca de la naturaleza del desorden, y esta controversia acerca de la definición persiste, ya que el mismo término de Esófago de Barrett es artificial, y por los últimos 40 años dicha entidad ha sido definida de diversas maneras y por diferentes investigadores quienes han impuesto criterios arbitrarios para acomodar sus perspectivas personales(25).
Si la exacta localización de la unión esófago-gástrica no puede ser identificada con precisión, entonces cualquier evaluación de la extensión del esófago cubierto por epitelio columnar, es inherentemente imprecisa(24).
Precisamente en esta línea de pensamiento diversos estudios han enfatizado el potencial pre-maligno de segmentos de metaplasia intestinal menores de 3 cms(26, 27, 28, 29). Una serie de reportes remarcan que el riesgo del esófago corto de Barrett para desarrollar el adenocarcinoma está presente, si bien en menor proporción respecto a la variedad del esófago largo, por lo que se recomienda el control clínico, endoscópico y la toma de muestras para ambos grupos(28, 29, 30).
De esta manera regresamos al principio, esto es, la presencia de epitelio columnar en el esófago distal, sea de metaplasia intestinal o gástrica, es evidente que revela el sufrimiento del paciente por la enfermedad del reflujo gastro-esofágico, lo que a su vez afectará a un pequeño grupo de pacientes quienes desarrollarán Esófago de Barrett y es evidente también que sólo una minoría de éstos pacientes, finalmente tendrá la complicación del adenocarcinoma de esófago(31). Visto así en perspectiva, el Esófago de Barrett traduce una complicación de la enfermedad del reflujo gastro-esofágico, y esto debe hacer que el endoscopista al realizar el estudio de estos pacientes, tenga que consignar y biopsiar cualquier hallazgo que sugiera una metaplasia columnar. Entonces, ¿el primer diagnóstico endoscópico sin tener aún el resultado de la histología, se debe considerar como Esófago de Barrett? o ¿sólo se debe considerar como Esófago de Barrett a los pacientes únicamente después de tener el informe de la patología? Esto que parecería ser cuestión de días más o días menos, tiene diversas implicancias, como por ejemplo, el diagnóstico endoscópico tiene que ser uniforme y evitar en lo posible la utilización de términos histológicos, además, se recomienda la utilización de una terminología estándar mínima para la base de datos endoscópica computarizada, en la cual se define la presencia del epitelio columnar en esófago distal simplemente como Esófago de Barrett, de acuerdo al reporte del grupo de trabajo del congreso mundial de gastroenterología, publicado en 1996(26).
Actualmente, para la definición del Esófago de Barrett se requieren los siguientes parámetros: 1- criterio endoscópico: apariencia columnar de la mucosa de cualquier extensión dentro del esófago tubular. 2- criterio histológico: metaplasia intestinal(3,33,34,35,36).
Esta manera de definir el Esófago de Barrett con relación a su potencialidad de desarrollo del adenocarcinoma, orienta al especialista hacia un esfuerzo concentrado en la detección y tratamiento precoz de la neoplasia del esófago, sin embargo deja de lado a la metaplasia columnar de tipo gástrico que también tiene relación con la enfermedad de reflujo gastro-esofágico, y que a partir de esta definición se queda sin nombre propio, más bien sólo con una denominación o terminología con sustento histológico. Como hemos revisado en los últimos 50 años, el nombre de Esófago de Barrett fue dado originalmente a la metaplasia columnar gástrica y actualmente el péndulo se ha movido hacia la esquina del interés de los que investigan el campo del desarrollo de las neoplasias.
La definición del Esófago de Barrett con el criterio endoscópico aunado al criterio histológico, tiene un claro sustento en la evolución molecular de la secuencia Metaplasia-Displasia-Adenocarcinoma en el esófago(37,38), hay experimentos que sugieren que la pérdida del alelo 17p (p53), precede a la pérdida del alelo 5q (APC), durante la progresión neoplásica en el Esófago de Barrett, este ordenamiento de pérdida de alelos tipo 17p (p53) a 5q (APC) contrasta con aquel propuesto para el cáncer de colon, en el cual la pérdida del alelo 5q (APC) tiende a preceder a la pérdida del alelo 17p (p53), lo cual sugiere un orden genético invertido de pérdida de alelos en el desarrollo del adenocarcinoma asociado al Esófago de Barrett(39,40), sin embargo, y como ya se comentó, no se debe perder la perspectiva de que la presencia de metaplasia columnar en esófago, refleja la enfermedad del reflujo gastro-esofágico y más aún, hay reportes recientes que revelan la fuerte asociación entre los síntomas del reflujo gastro-esofágico y el riesgo del adenocarcinoma de esófago, independientemente de la presencia del Esófago de Barrett(41).
Por esta definición moderna, irónicamente, ninguno de los pacientes que Barrett describió, tenía Esófago de Barrett(25).
Si la definición aceptada actualmente privilegia el sustento histológico de metaplasia intestinal como se ha descrito, el criterio previo de definir el Esófago de Barrett como corto y largo (mayor o menor de 3 cm.), no debe caer en desuso sino más bien, debe ser siempre consignado, pues las medidas y formas son importantes cuando se reporta y se hacen estudios comparativos, por ello es que se conoce que la prevalencia del Esófago corto de Barrett parece ser más alta que la del segmento largo, pero de otro lado, vale la pena subrayar que si bien la prevalencia del Esófago de Barrett se incrementa con la edad, no sucede de la misma manera con la longitud del mismo, esto es, que de acuerdo a las observaciones de diversos investigadores, estos sugieren que el epitelio de Barrett se desarrolla a su máxima longitud rápidamente, permaneciendo estable por muchos años(42). Sin embargo, los aspectos demográficos y de patogénesis de ambas entidades parecen ser similares, sugiriendo que ellas representan la continuidad de una sola entidad(36).
El Esófago de Barrett fue raramente diagnosticado antes del uso extendido de la endoscopía flexible, y los reportes consignados antes de la década del 70, eran hechos con base a estudios utilizando endoscopios rígidos(43). Si bien se conoce que la prevalencia de los síntomas del reflujo gastro-esofágico en la población adulta en general, en países de occidente, es de alrededor del 7%, en los que tienen un episodio de pirosis diario y de alrededor del 20% en los que manifiestan un episodio de pirosis semanal, la prevalencia del Esófago de Barrett en la población general no puede ser estimada de la información precedente, porque muchos pacientes con Esófago de Barrett, no tienen una historia previa de reflujo gastro-esofágico(42). Es por ello que cuando se ha evaluado la prevalencia del Esófago de Barrett en estudios retrospectivos y por cualquier sintomatología, esto ha sido mejor consignado en las salas de endoscopía, y por ejemplo, se ha reportado en un estudio sobre un total de 31,133 pacientes, que la metaplasia de Barrett es relativamente común, con 0.3 a 2.0% de prevalencia, y cuando se ha evaluado el mismo dato, pero en los pacientes que presentaron sintomatología de reflujo gastro-esofágico, dicha prevalencia estuvo entre 8 al 20%(44). De la misma manera, se han revisado una serie de reportes recientes tanto prospectivos como retrospectivos y se concluye que es razonable decir que alrededor del 1% de pacientes que acuden a los servicios de endoscopía, por cualquier razón, tendrán Esófago de Barrett y que la prevalencia del mismo se incrementa hasta alrededor del 5%, cuando los pacientes se presentan con síntomas de reflujo gastro-esofágico, y el número es más alto en hombres que en mujeres, en pacientes evaluados en países de occidente(43).
Claro está que, cuando se han realizado estudios de prevalencia de Barrett de acuerdo a los resultados de autopsia en una localidad determinada (Olmsted County, Minnesota, USA), se ha objetivado que la prevalencia de dicha entidad se incrementó 16 veces, lo que llevó a la conclusión de que la mayoría de los individuos con Esófago de Barrett en la población general, no son diagnosticados, y la implicancia es que el control y tratamiento de la neoplasia temprana en los casos conocidos de Esófago de Barrett tendrán solo un pequeño impacto en la tasa de mortandad de la población por adenocarcinoma de esófago(43, 45).
La prevalencia del Esófago de Barrett en Europa es de alrededor del 1-4%, en adultos que acuden a los servicios de endoscopía, con una predominancia de varones de 2.5:1 respecto a las mujeres; en Alemania, la prevalencia del Esófago corto de Barrett es de 3.4% y del segmento largo, de 0.8%(46, 47). En Inglaterra, la prevalencia del Esófago de Barrett se ha incrementado de 0.8 a casi 2% de los pacientes que van a los servicios de endoscopía, en los períodos evaluados de 1987-91 y de 1992-96(31).
En Asia, las enfermedades del esófago (reflujo gastro-esofágico, esofagitis erosiva, Esófago de Barrett y el adenocarcinoma), son infrecuentes. La prevalencia del Esófago de Barrett en Japón, en adultos que acuden a los servicios de endoscopía es de alrededor del 0.3-0.6%, con predominancia del sexo masculino y una edad promedio de 60 años(47). El carcinoma epidermoide aún continúa siendo el cáncer dominante en Japón, con el adenocarcinoma explicando menos del 5% de las neoplasias de esófago(48). La baja prevalencia del Esófago de Barrett y del adenocarcinoma esofágico puede ser secundario a una baja prevalencia de la enfermedad del reflujo gastro-esofágico en esta región, en Singapur por ejemplo, se ha reportado una prevalencia de pirosis en adultos del 1.6% (sobre base mensual), comparada con el 29-44% en países de occidente(49,50).
En países del África y del Oriente Medio, el Esófago de Barrett y el adenocarcinoma de esófago son infrecuentes, siendo la neoplasia prevalente el carcinoma epidermoide. En países tales como Uganda, Kenya, Nigeria, Etiopía y Zimbabwe, el Esófago de Barrett es raro (casi no existe), con el adenocarcinoma de esófago que explica únicamente el 4-6% de todas las neoplasias de esófago. De otro lado, la infección por Helicobacter pylori en esta población es extremadamente común. Por ejemplo, en Soweto, África del sur, el 46% de niños han adquirido el H. pylori al año de edad, y el 100% alrededor de los 12 años. Se ha sugerido que la alta prevalencia de la infección por el H. pylori en estos países, podría llevar a una reducción en la secreción de ácido por parte del estómago y a una consecuente reducción en el reflujo gastro-esofágico, pudiéndose explicar de esta manera la baja prevalencia de enfermedades del esófago relacionadas al factor de la producción del ácido, si bien esta hipótesis aún no ha sido confirmada(47,51,52).
De acuerdo a un estudio internacional multicéntrico, que comprendió países de Europa del Este, del Asia, de América Central y América del Sur, se pudo apreciar que la prevalencia del Esófago de Barrett es del 0.6-1%, con una prevalencia extremadamente baja de displasia y cáncer (47). Las razones para tratar de explicar la disparidad en la prevalencia del Esófago de Barrett y del adenocarcinoma de esófago en las diferentes partes del mundo no están claramente entendidas, no obstante, la prevalencia de la enfermedad del reflujo gastro-esofágico, la obesidad, la infección por el H. pylori y los factores genéticos, han sido implicados(31).
Diversos estudios han intentado estimar la incidencia del adenocarcinoma en el Esófago de Barrett, los estimados de estudios retrospectivos varían entre 1/55 a 1/441 pacientes-año de seguimiento(53,54,55,56,57,58), cuando se evalúan estudios prospectivos la incidencia de adenocarcinoma tiene un rango de 1/52 a 1/98 pacientes-año de seguimiento, sobre un periodo evaluado de 3 a 5 años(59,60,61,62,63). Los datos son difíciles de interpretar cuando son de estudios retrospectivos ya que entre otras razones tienen diferentes criterios diagnósticos de inclusión y cortos periodos de evaluación, de otro lado, los estudios prospectivos mencionados tienen periodos cortos de seguimiento y analizan grupos pequeños, donde la incidencia estimada no es firme ya que un caso adicional agregado ocasionará un impacto determinado sobre la cifra global de seguimiento, sin embargo, cuando se combinan los datos de todas las series prospectivas, la incidencia del adenocarcinoma de esófago es de 1/104 pacientes-año(64).
El uso de la citología sumada a la histología, incrementa el costo mas no la capacidad diagnóstica en la evaluación de los pacientes con Barrett(65), a pesar de reportes que sugieren lo contrario(66). Se han diseñado técnicas que incluyen tinciones y mapeos sofisticados, costosos y laboriosos para la detección del Barrett, que están aún en fase experimental y que no se recomienda su uso en la práctica clínica(67). Las biopsias dirigidas utilizando el azul de metileno, pueden mejorar la detección de la metaplasia intestinal y la displasia en el Esófago de Barrett, en razón a que el azul de metileno tiñe selectivamente la metaplasia intestinal e inclusive las células displásicas(68, 69, 70), sin embargo, hay reportes que han encontrado que el utilizar el azul de metileno no hace sino prolongar el procedimiento, incrementar las molestias del paciente y exponer al mismo a potenciales complicaciones, no encontrándose que sea ni muy sensible ni específico en la detección de la metaplasia intestinal(71). Otros autores plantean inclusive la utilización de la sensibilización de la protoporfirina IX inducida por el ácido 5-aminolevulínico, en la detección endoscópica de la displasia, en pacientes con Esófago de Barrett(72). El uso rutinario de la endosonografía para el despistaje de pacientes con Esófago de Barrett, no está ni justificado ni tiene un sustento adecuado de costos(73), la capacidad de dicho procedimiento en la evaluación de la profundidad del adenocarcinoma es del 84% (1154 pacientes), y la posibilidad de detectar el estadiaje nodular linfático es del 77% (1035 pacientes), por lo que su uso está bajo investigación y su rol debe ser aún mejor determinado(73,74).
De otro lado, la técnica de la mucosectomía podría ser aplicada en la obtención de muestras en bloc, sobre todo para aquellos hallazgos que sugieran degeneración neoplásica del Esófago de Barrett, mejorando de esta manera la acuciosidad diagnóstica del patólogo con relación directa a la cantidad de tejido que se le envía, por lo que se puntualiza que la mucosectomía no solo es terapéutica sino también diagnóstica(75).
Muchos clínicos se sienten sorprendidos cuando aprecian la extensión de la enfermedad en esófago durante la endoscopía y la correspondiente falta de síntomas, aún cuando se hayan tomado historias clínicas detalladas, inclusive algunos autores sugieren que la baja frecuencia de presentación de pirosis en pacientes con Esófago de Barrett, podría ser explicada por una sensibilidad disminuida del epitelio metaplásico, a la acidez gástrica(30,50,76). El promedio de edad para el diagnóstico del Esófago de Barrett varía entre los 55 a los 63 años. Se ha reportado un incremento en la prevalencia del Esófago de Barrett con la edad, alcanzando un plateau a los 60 años. Por lo tanto, cuando un paciente de aquella edad es detectado con Esófago de Barrett, con o sin presencia de adenocarcinoma, el epitelio de Barrett probablemente ha estado presente por más de 20 años y por razones que aún no son claras, los hombres tienen más riesgo de desarrollar adenocarcinoma de esófago(20,42,43,77,78,79), de otro lado, la obesidad es un factor de riesgo, si bien débil, para el desarrollo del Esófago de Barrett, ya que el exceso en la ingesta de grasa predispone el daño en la presión del esfínter esofágico inferior y el retardo del vaciamiento gástrico(80).
El perfil clínico de los pacientes con Esófago de Barrett descrito sobre todo en los países de occidente, donde la incidencia y prevalencia de dicha entidad son importantes, suele comprender a aquellos individuos varones, de raza blanca, de 60 a 70 años de edad, con cierta prevalencia de reflujo gastro-esofágico(81), obesos, con ciertos factores genéticos y asociación con la infección por helicobacter pylori(82), de modo tal que hay autores que plantean que todos los pacientes mayores de 40 años con enfermedad de reflujo gastro-esofágico persistente por más de 5 años, deberán tener estudio de gastroscopía, particularmente si son hombres y de raza blanca, si bien esto es razonable, no existe una prueba directa de que este sea el criterio correcto de selección(83, 84).
Entonces, si conocemos mejor la entidad del Esófago de Barrett y sabemos que hay un perfil más o menos definido de dichos pacientes y a su vez hay un riesgo en algunos de ellos de poder desarrollar cáncer de esófago, la cuestión que necesita ser elucidada no es que extensión de metaplasia se requiere para el diagnóstico de Barrett, sino que pacientes desarrollarán adenocarcinoma. Es claro, que de los estudios publicados, la mayoría de los pacientes con Barrett, nunca desarrollarán adenocarcinoma, luego, los esfuerzos reales deberán orientarse a definir mejor a aquella población con riesgo de progresión a la malignidad(85). En este sentido, reportes recientes revelan que la vigilancia realizada en un estudio de cohorte a 10 años, en pacientes con metaplasia columnar, mostró que la mayoría de pacientes falleció por causas diferentes del Esófago de Barrett, no hubo mayor beneficio para los pacientes de este programa de control, y se concluyó que, hasta que se tenga mejor información con base a estudios prospectivos, parecería ser más apropiado ofrecer la vigilancia o control solamente a aquellos pacientes con metaplasia intestinal y factores de riesgo adicionales como ulceración, estenosis y segmentos largos, mayores de 8 cm. de longitud(86). En la misma línea de pensamiento, una estrategia a largo plazo de estudios de endoscopía y biopsia cada 3 años, resultaría en 15 o más exámenes endoscópicos para un paciente de 30 años con Esófago de Barrett, 7 o más para uno de 45 años, y 4 o más para uno de 60 años, lo que resultaría en más de medio millón de endoscopías por año, lo que desde el punto de vista financiero como de sometimiento de los pacientes a dichos esquemas, son poco probables o poco reales; de allí que, las terapias ablativas endoscópicas sean consideradas como una alternativa interesante, de resultar efectivas, dentro del manejo endoscópico del Esófago de Barrett(85).
Dado que el epitelio del Esófago de Barrett es una condición pre-maligna, la posibilidad de ablación de dicho tejido como medida preventiva, es extremadamente atractiva(87). Si se tiene como armas para el tratamiento del Esófago de Barrett el siguiente arsenal: mecánico, térmico y químico, entonces, se debe precisar antes qué táctica funciona mejor, pero más importante es saber si hay una estrategia adecuada que dirija nuestras acciones(88), sobretodo debido al incremento en incidencia del adenocarcinoma reportada en países occidentales como Estados Unidos, lugar donde el adenocarcinoma pasó de representar el 16% de las neoplasias de esófago en la década del 70, a tener alrededor del 50% de los casos nuevos diagnosticados en la década de los 90, con una tasa de incidencia ajustada por edad en hombres de raza blanca de aproximadamente 5.1 casos x 100 000, cifra que sitúa al adenocarcinoma dentro de las primeras 15 neoplasias en hombres de raza blanca, en dicho país(30, 89, 90), sabiéndose además que la metástasis nodular linfática es del 5% cuando el adenocarcinoma compromete la mucosa y es del 25% cuando la profundidad alcanza la submucosa(91, 92), todo lo cual nos permite recalcar que el Esófago de Barrett y la displasia asociada son considerados como los únicos factores de riesgo reconocidos para el potencial desarrollo del adenocarcinoma(88), por lo que las terapias de ablación están siendo cada vez más tomadas en cuenta. Sin embargo, cabe mencionar que en los Estados Unidos, de acuerdo a una encuesta reciente, se conoce que dicha terapia se aplica solo en el 3.5% de los hospitales y clínicas cuando se trata del Barrett, en el 20% de los nosocomios en referencia cuando se maneja displasia y en el 8% de los centros en mención cuando se maneja el adenocarcinoma(93), entonces lo que traduce dicho acercamiento es su fase experimental, por lo que todos los pacientes que se someten a estos procedimientos deberán estar en grupos controlados de estudio.
Algunos han cuestionado si el incremento dramático en la incidencia del adenocarcinoma de esófago y la metaplasia de Barrett (sobretodo en países de occidente), pueden simplemente reflejar el uso incrementado de la endoscopía, inconsistencias en la definición del carcinoma de esófago o cambios en los modos de reportar dicha patología(30). Para evitar factores de confusión, en la década de los 80 en Pensilvania - USA, se trabajó con un registro para tumores unificado en el cual la definición del adenocarcinoma de esófago era estricta, sin cambios, se encontró que hubo un marcado incremento en la incidencia del adenocarcinoma, siendo el mayor incremento en pacientes varones de raza blanca en los cuales se pudo constatar el incremento de la misma, en un promedio de 8% por año(94).
Así como hay autores que consideran al Esófago de Barrett como una condición pre-maligna(87,88,95,96,97), hay otros que lo definen como una lesión pre-maligna irreversible, que necesita un control endoscópico de por vida para minimizar el riesgo de adenocarcinoma de esófago(30,98,99), sin embargo, la mejor definición es considerar al Esófago de Barrett como una condición pre-maligna, esto es, un estadío clínico que incrementa el riesgo de cáncer(1), por lo cual se ha preconizado durante años los controles periódicos del Esófago de Barrett para detectar la displasia o el adenocarcinoma temprano a pesar de una falta de documentación en la mejora de la tasa de sobrevida, el estatus funcional o la calidad de vida de los pacientes que siguen esta estrategia(100,101,102).
La metaplasia intestinal no es sensible ni específica para el despistaje del adenocarcinoma de esófago, lo que la define como ya hemos puntualizado, como una condición pre-maligna y es más bien la displasia el único marcador clínicamente útil para el riesgo incrementado de cáncer en los pacientes con Esófago de Barrett, representando la alteración neoplásica de las células metaplásicas, y es ampliamente considerada como la precursora de la invasión maligna, por lo que el hallazgo de la displasia, permanece como el biomarcador más apropiado dentro de la evolución clínica de los pacientes con Esófago de Barrett(95,103), e inclusive la displasia de alto grado puede significar, de hecho la posibilidad de ser portador del adenocarcinoma incipiente(95,104). Es dentro de esta perspectiva, que las terapias ablativas endoscópicas para el Esófago de Barrett si se prueba que son efectivas, resultarían en un cambio del paradigma en el manejo endoscópico del Esófago de Barrett, ya que hasta ahora esta lesión ha sido considerada irreversible, pero datos preliminares indicarían que el Esófago de Barrett podría ser endoscópicamente curable y eventualmente podría repercutir en disminuir el adenocarcinoma de esófago y en disminuir o eliminar la necesidad de controles endoscópicos de por vida(85). Por lo que inclusive hay autores que ponderan, que la práctica extendida de controles endoscópicos con toma de muestras para estudio histológico del Esófago de Barrett, debe ser abandonada(96).
Diversos estudios longitudinales no han mostrado una reducción convincente en la extensión de la metaplasia de Barrett después del tratamiento de la fundoplicatura o del tratamiento con base a inhibidores de la bomba de protones(30,105,106,107), siendo esta otra razón interesante a favor de las terapias ablativas, por lo que inclusive se propone asociar la terapia ablativa a la cirugía anti-reflujo(108,109). La hipótesis central de las terapias de ablación radica en que la reversión del Esófago de Barrett deberá requerir una normalización de la exposición del ácido al esófago, sea de manera farmacológica o quirúrgica y luego re-injuriar al epitelio metaplásico para restaurar el epitelio primigenio de células escamosas del esófago(110). Se tiene el consenso actual de que la terapia con base a argón plasma o electrocoagulación multipolar parecería ser más efectiva para el esófago no displásico de Barrett y por ejemplo la terapia fotodinámica, parecería ser el agente más efectivo en el tratamiento de pacientes con displasia o adenocarcinoma temprano(85,111,112,113,114,115,116,117), sin embargo, no se debe perder de vista que el costo promedio por paciente tratado con terapia fotodinámica excede los $ 10 000(118).
Series recientes que evalúan el tratamiento endoscópico del Barrett con base a la utilización del Argón Plasma, reportan ablación completa en rangos que van del 61% al 98.6%, dependiendo ello de la cantidad de energía utilizada (mejores resultados con 90 que con 60 W), y del uso agresivo de los inhibidores de la bomba de protones (mejor respuesta con 120 mg de omeprazol al día que con 40 mg por día), por lo que el seguimiento debe ser periódico(87,119,120,121). Evidentemente, los límites de la terapia con base a la ablación con Argón Plasma deben sopesar no solo las potenciales complicaciones, sino los costos de la terapia y la factibilidad del seguimiento y control de estos pacientes, de la misma manera y como ya se mencionó, deberá tenerse en cuenta si esto tendrá o no un impacto en la potencial reducción de la presencia del adenocarcinoma, en los pacientes tratados de esta manera(122). Además, aún no ha sido examinado el efecto de las técnicas ablativas en la inestabilidad genómica. Hasta que estas cuestiones sean resueltas, las técnicas ablativas no pueden ser recomendadas para uso rutinario excepto en pacientes seleccionados y bajo riguroso protocolo de investigación. Más aún, hasta que se demuestre que el riesgo potencial de cáncer haya disminuido por medio de éstas técnicas ablativas, los controles periódicos y el tratamiento médico no podrán ser reducidos(30).
El tratamiento quirúrgico del Esófago de Barrett es idéntico al de la esofagitis de reflujo, hasta que la displasia severa o de alto grado demande por una Esofaguectomía. El tratamiento quirúrgico antireflujo, reestablece la función del esfínter esofágico inferior y logra abolir el reflujo gastro-duodenal al esófago. El tratamiento quirúrgico para el reflujo gastro-esofágico puede controlar los síntomas adecuadamente mediante la técnica de fundoplicatura, y se suele recomendar una fundoplicación de 360°. En pacientes que tengan una presión menor de 25 mm Hg en el cuerpo del esófago y en los pacientes que tengan la peristaltis muy disminuida, es evidente que, se recomienda la fundoplicatura parcial (Toupet, Belsey-Mark IV, Watson y Dor). Una presión mayor de 25 mm Hg, se requiere para limpiar con eficacia el esófago del bolo alimenticio, de la misma manera, se debe tener presente que ante la presencia de una hernia complicada > de 5 cms, se deberá considerar el tratamiento alternativo transtorácico de Collis y el procedimiento antireflujo, usualmente el tipo Belsey-Mark IV(123).
La recomendación en la década del 90, para los pacientes que tengan displasia leve en Esófago de Barrett, ha sido la del tratamiento intensivo anti-reflujo y controles seriados posteriores, hasta negativizar en dos estudios consecutivos la presencia de la displasia, y en cuanto a la displasia de alto grado, además de solicitarse la revisión de la histología por patólogos expertos, se ha recomendado de ser factible, el tratamiento quirúrgico(34,35), y en los que la cirugía implica un riesgo prohibitivo, las terapias de ablación como la terapia fotodinámica, o la terapia de láser combinada con la electrocoagulación multipolar, deben considerarse(117,124). Claro está que, si la decisión pasa por la cirugía para el tratamiento de la displasia de alto grado, la resección quirúrgica estándar recomendada incluye una Esofaguectomía total, removiendo todo el tejido de Barrett y cualquier adenocarcinoma potencialmente asociado. La reconstrucción generalmente es llevada a cabo subiendo el estómago a través del mediastino posterior, con la realización de la anastomosis en el cuello. Se recomienda evitar la anastomosis intratorácica debido a la alta prevalencia de síntomas de reflujo que siguen a esta modalidad de esófago-gastrostomía intratorácica(125).
El potencial de la resección quirúrgica limitada en pacientes con neoplasias tempranas del esófago distal o de la unión esófago-gástrica, ha sido recientemente reconocido por diversos autores(126,127), sin embargo, una resección limitada reúne ventajas para el paciente sólo si está combinada con un procedimiento de reconstrucción que provea una función de alimentación óptima y que a su vez prevenga el reflujo gastro-esofágico(128), dicho concepto descansa en la interposición de un segmento de yeyuno como un sustituto para el esfínter esofágico inferior, tal como fue sugerido por Merendino y Dillard en 1955(129). Ciertamente, para un paciente con neoplasia limitada a la mucosa y cuyas características sugieran una posibilidad de metástasis ganglionar muy baja o ausente, entonces una resección limitada tal como la mucosectomía endoscópica, debería considerarse(128,130,131,132).
EXPERIENCIA EN EL INEN
El Servicio de Gastroenterología perteneciente al Departamento de Abdomen de nuestro Instituto, inicia sus actividades con el Dr. Fernando Salazar C. en 1974, desde allí es que se tienen consignados los procedimientos endoscópicos digestivos en el INEN, con equipos flexibles. Previa a esta fecha la evaluación del tracto digestivo superior era realizada por los cirujanos con instrumentos rígidos, tal como la esofagoscopía rígida. Sin embargo, el primer caso evaluado en el INEN de Esófago de Barrett complicado con Adenocarcinoma lo encontramos en una magnífica descripción escrita a máquina de una historia clínica del archivo, que data de 1956. En aquella oportunidad, un paciente varón de 66 años natural y procedente del Cuzco es intervenido quirúrgicamente por los Doctores Carlos Payet y Juan Antonio Montalbetti, médicos del Departamento de Abdomen, por presentar un cuadro de disfagia progresiva, epigastralgia y baja ponderal.
El hallazgo patológico de la pieza quirúrgica resecada fue producto de una Esofaguectomía distal y Gastrectomía proximal, asociada a una Esplenectomía con resección de ganglios regionales. El informe del Servicio de Patología, realizado por el Dr. Oscar Misad, reveló la presencia de Adenocarcinoma en el Esófago originado en una Metaplasia Intestinal, la descripción literal de la misma nosotros la publicamos en la Figura 2, como podrá verse es una descripción elegante y precisa de la pieza resecada, habiéndose publicado en la literatura mundial una descripción semejante con relación al adenocarcinoma de esófago con base en una mucosa con presencia de metaplasia intestinal cuatro años antes, esto es en 1952(12). Es interesante anotar que de acuerdo al reporte quirúrgico, se expresa la ausencia de hernia diafragmática y de otro lado, se consigna el compromiso de metástasis ganglionar en 2 de 12 ganglios evaluados. El paciente fue controlado en el INEN, hasta el 02 de Junio de 1966, fecha de su fallecimiento; lo cual significa que tuvo una sobrevida de 10 años luego de la cirugía, y la causa de su fallecimiento se relaciona directamente con la presencia de recurrencia de enfermedad, metástasis en tráquea y recidiva en esófago residual.
| Figura 2. Copia del informe de Anatomía Patológica del primer caso diagnosticado en el INEN de Esófago de Barret complicado con Adenocarcinoma, en 1956. |
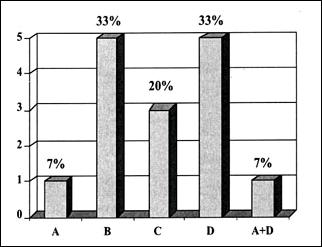
El Esófago de Barrett, fue raramente diagnosticado en la literatura mundial antes de la década del 70, con sólo decenas de casos publicados al respecto y con relación al uso de endoscopios rígidos(10). Como ya hemos revisado en la década de los 80 el concepto de Esófago de Barrett reflejaba esencialmente los criterios de diferentes grupos de investigadores sea con relación al reflujo gastro-esofágico, a la presencia o no de adenocarcinoma y al criterio histológico y endoscópico para poder definir adecuadamente dicho concepto(25). En nuestro medio, los criterios para la definición del Esófago de Barrett no han hecho sino reflejar los diferentes cambios propuestos por diversos autores en diferentes épocas, lo que hemos podido graficar con claridad cuando la Sociedad Peruana de Gastroenterología organizó un curso sobre Consenso en Esófago de Barrett en 1999(133), realizándose una encuesta a diferentes hospitales y clínicas de Lima, siendo la primera pregunta el definir el Esófago de Barrett, y los criterios de las respuestas fueron diversos tal como se consigna en la Tabla I y el Gráfico 1.
| Tabla I. Relación de Clínicas y Hospitales que Respondieron a la encuesta, así como de los expertos consultados en cada centro (133) |

| Gráfico 1. Relación de criterios considerados para la definición del Esófago de Barrett (133) |
| A.- Esófago de Barrett de segmento largo y corto. |
En el INEN el diagnóstico de Esófago de Barrett, ha sido infrecuente hasta fines de la década del 90, de acuerdo a la revisión que hemos realizado, entre 1956 y 1998, tenemos 19 casos consignados como Esófago de Barrett, que tienen tanto el criterio endoscópico e histológico respectivo, de los cuales 15 tienen metaplasia intestinal y 4 metaplasia gástrica. Entre 1999 y Julio del 2001, hemos logrado identificar 83 casos consignados como Esófago de Barrett, siendo los que tienen presencia de Metaplasia Intestinal 25 casos y metaplasia gástrica 58 casos. De esta manera, de acuerdo a la definición actual de Esófago de Barrett, son 40 los casos que reúnen los requisitos de criterio endoscópico e histológico de metaplasia intestinal. De otro lado, la explicación de la diferencia del número de casos en ambos periodos es sugerida por Alan J. Cameron cuando refiere que: Older reports show that Barretts esophagus could be found if it was looked for(43). Esto significa, que en nuestro Servicio desde el año 1999, no solamente identificamos endoscópicamente un probable Esófago de Barrett; si no que obligatoriamente tomamos muestras de biopsia para estudio histológico, por lo que los números consignados previamente reflejan aquellos casos confirmados patológicamente, esto es, el número eventualmente podría ser mayor, ya que se requiere no sólo el criterio endoscópico sino un criterio histológico estricto, de modo tal que es más probable diagnosticar Barrett en menor cuantía, que el diagnosticarlo en exceso(84).
Debemos recordar que la implicancia en definir el Esófago de Barrett con base a la metaplasia intestinal está en relación directa a su potencial complicación, de persistir la injuria del reflujo, en adenocarcinoma. Así, idealmente deberíamos tener la perspectiva de lo que significa el Cáncer de Esófago, en nuestro medio y específicamente el adenocarcinoma. De acuerdo a las cifras reportadas por el Centro de Investigación en Cáncer Maes Heller sobre el Registro de Cáncer de Lima Metropolitana entre 1990 y 1993(134), se sabe que el Cáncer de Esófago ocupa, el lugar 26 de acuerdo al ranking de frecuencia de cáncer, con una tasa de incidencia por edad de 1.09 x 100 000 habitantes. (Tabla II).
| Tabla II. Frecuencia y Tasa de Incidencia por Cáncer en ambos sexos en Lima Metropolitana 1990-1993. |
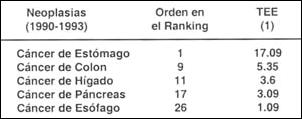
| (1) TEE Tasa Estandarizada por Edad x 100 000. Registro de Cáncer de Lima Metropolitana, 1990-1993 Centro de Investigación en Cáncer Maes Heller (134). |
Cuando a su vez, desglosamos la histología del Cáncer de Esófago y precisamos si es Carcinoma Epidermoide o Adenocarcinoma y lo correlacionamos con el sexo tenemos lo siguiente (Tabla III):
| Tabla III. Tasa Estandarizada por Edad de Cáncer de Esófago en hombres y mujeres, según tipo histológico. |
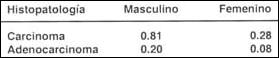
| (1) TEE Tasa Estandarizada por Edad x 100 000. Registro de Cáncer de Lima Metropolitana, 1990-1993 Centro de Investigación en Cáncer Maes Heller (134). |
Se aprecia con claridad que la incidencia de las neoplasias de esófago en general, y del adenocarcinoma en particular, es baja en nuestra población, de acuerdo a la muestra analizada(134). El carcinoma epidermoide es 4 veces más frecuente que el adenocarcinoma. La incidencia del adenocarcinoma de esófago es mayor en hombres que en mujeres, lo que está de acuerdo a otras series reportadas(31,43).
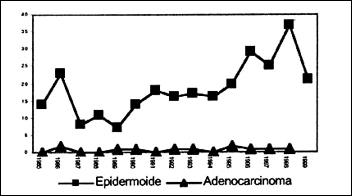
Según datos del Departamento de Estadística del INEN, en una evaluación realizada para estimar la frecuencia de presentación del carcinoma epidermoide con relación al adenocarcinoma de esófago y en un período de 15 años (1985-1999), hemos podido apreciar que el carcinoma epidermoide tiene una frecuencia de presentación del 96% y el adenocarcinoma del 4%, sobre un total de 287 casos. No se ha objetivado el incremento en la presentación del adenocarcinoma en dicho período de estudio, manteniéndose por el contrario, el carcinoma epidermoide como la neoplasia de presentación más frecuente en el esófago, lo que estaría más bien en relación al comportamiento de esta patología descrito en países del tercer mundo, como el nuestro(31) Gráfico 2.
| Gráfico 2. Datos preliminares de la frecuencia de presentación del carcinoma epidermoide respecto al adenocarcinoma de esófago, en un periodo de 15 años en el INEN (Departamento de Estadística) |
| (1) TEE Tasa Estandarizada por Edad x 100 000. Registro de Cáncer de Lima Metropolitana, 1990-1993 Centro de Investigación en Cáncer Maes Heller (134). |
De acuerdo a la definición actual del Esófago de Barrett, nosotros al momento de hacer la revisión de nuestros casos hemos definido como pacientes con Esófago de Barrett, a aquellos con diagnóstico histológico confirmado de metaplasia intestinal. Según esta perspectiva, en el Servicio de Gastroenterología del INEN entre 1999 y Julio del 2001, se han realizado 3904 gastroscopías en pacientes consecutivos (se eliminaron las gastroscopías de control cuando se repetían en un mismo paciente), por lo que podemos mostrar la prevalencia del Esófago de Barrett en el INEN, en dicho período. (Tabla IV).
| Tabla IV. Porcentaje de pacientes con Esófago de Barrett en 3,904 Gastroscopías, en el Servicio de Gastroenterología del INEN. (1999-2001) |

Vale la pena enfatizar que la metaplasia intestinal definida como Esófago de Barrett, ha sido diagnosticada en todos nuestros pacientes siempre y cuando hayan contado con el requisito de un aspecto de metaplasia columnar en cualquiera de sus variedades en un esófago tubular y no se ha consignado ningún caso de metaplasia intestinal en la unión escamo columnar con aspecto endoscópico de normalidad, al respecto, cabe precisar que algunos de los autores del presente trabajo han reportado previamente que la frecuencia de presentación de la metaplasia intestinal en la unión esófago gástrica de aspecto conservado es del 21%, en pacientes que acuden al Servicio de Gastroenterología del INEN, en el mismo sentido, se ha logrado identificar que la metaplasia intestinal en dicha región está asociada con un grupo etáreo mayor con promedio de edad de 60 años (p=0.002), de la misma manera, este hallazgo estuvo coligado con la metaplasia intestinal en antro (p<0.001 y OR: 14.6), no encontrándose relación con la enfermedad del reflujo gastro-esofágico(135).
En la revisión histológica de nuestra casuística consignamos en la Figura 3, de manera secuencial el Esófago de Barrett, con la presencia de células goblet, los sucesivos cambios displásicos y la complicación e infiltración con el adenocarcinoma.
| Figura 3. Se aprecia secuencialmente desde la Foto A hasta la E, las alteraciones producidas en el epitelio esofágico, por la presencia sucesiva de metaplasia intestinal, cambios displásicos y adenocarcinoma. |
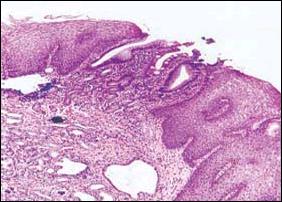
| A. Microscopía a poco aumento. Típico Esófago de Barrett. Se observa en los extremos epitelio poliestratificado plano, característico del esófago. En la parte central el cambio del epitelio del esófago por epitelio columnar (metaplasia columnar) y metaplasia intestinal (células caliciformes). |
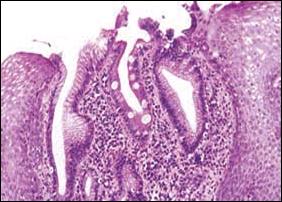
| B. Microscopía a mayor aumento. Esófago de Barrett. Se observa en el epitelio columnar, atipia celular que corresponde a Displasia Leve (Displasia de bajo grado). |
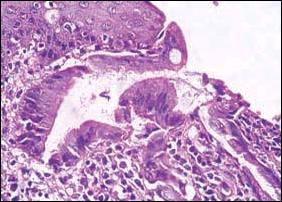
| C. Microscopía a mayor aumento. Esófago de Barrett. Se observa en el epitelio glandular células con alteraciones del núcleo, citoplasma y distorsión total del epitelio que corresponde a Displasia moderada y severa (Displasia de alto grado). |
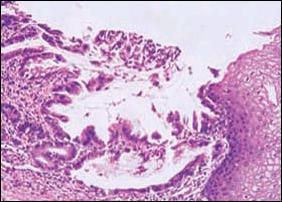
| D. Microscopía a mediano aumento. Esófago de Barrett y Adenocarcinoma Tubular con células epiteliales malignas, distorsión y dilatación glandular. |
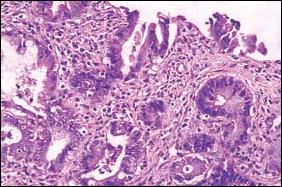
| E. Microscopía a gran aumento. Esófago de Barret y Adenocarcinoma Tubular con franca infiltración del estroma. |
De la misma manera mostramos las características endoscópicas de la presentación del Esófago de Barrett sea corto o largo (Fig. 4). El Esófago corto de Barrett a su vez, tiene diversas variedades, siendo las más destacadas: la variedad en isla, la variedad en lengüeta o digitiforme y la variedad en unión escamo-columnar prominente(25,136). El Esófago largo de Barrett resalta de mejor manera cuando se utiliza material de tinción(115), nosotros destacamos, por contraste, el Esófago largo tubular al teñir con lugol el epitelio escamoso.
| Figura 4. Características endoscópicas en la presentación del Esófago de Barrett, secuencialmente desde la foto A hasta la G. |
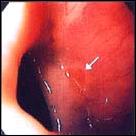
Foto A. Esófago Corto de Barrett: Variedad en Isla.
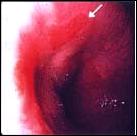
Foto B. Esófago Corto de Barrett: Variedad en Isla.
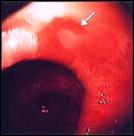
Foto C. Esófago Corto de Barrett: Variedad en Lengüeta.
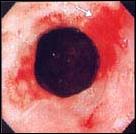
Foto D. Esófago Corto de Barrett: Variedad en Lengüeta.
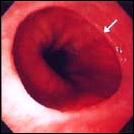
Foto E. Esófago Corto de Barrett: Variedad UEC Prominente.
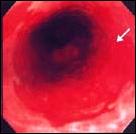
Foto F. Esófago Largo de Barrett
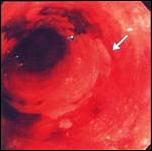
Foto G. Esófago Largo de Barrett: Tinción con Lugol.
En la figura 5, se muestra el resultado del tratamiento quirúrgico para el reflujo gastro-esofágico en un paciente varón de 50 años de edad, con evolución satisfactoria con relación a la sintomatología de reflujo que motivó dicho procedimiento, sin embargo, los controles posteriores han mostrado persistencia de la metaplasia intestinal en esófago distal.
Figura 5. Tratamiento Quirúrgico del Reflujo Gastro-esofágico mediante técnica de Fundoplicatura y persistencia del Esófago de Barrett post tratamiento.
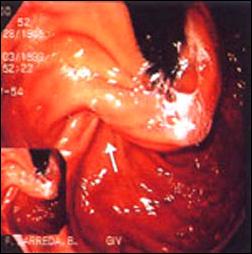
| Foto A. Vista de la fundoplicatura mediante maniobra de Retroversión. |
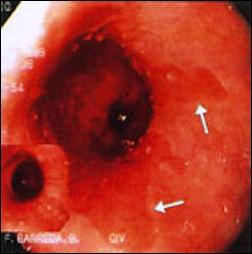
| Foto B. Persistencia del epitelio de Barrett, posterior al tratamiento de fundoplicatura. |
En la Figura 6, apreciamos las complicaciones del Esófago de Barrett, en el primer caso observamos el desarrollo de una estenosis severa por úlcera de Barrett retráctil, que manejamos actualmente con dilataciones periódicas, y en el otro caso, mostramos con nitidez la presencia del adenocarcinoma en un sustento de metaplasia intestinal, en el tercio medio de esófago.
Figura 6. Complicación de Esófago de Barrett
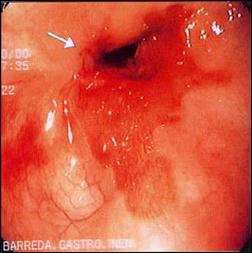
| Foto A. Complicación de Esófago de Barrett: Ulcera y estenosis severa de la luz. |
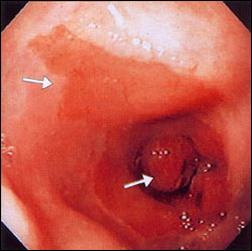
| Foto B. Complicación de Esófago Largo de Barrett: Adenocarcinoma a los 32 cms. de la arcada dentaria. |
En la Figura 7, mostramos un caso representativo de Esófago de Barrett tratado endoscópicamente con Argón Plasma, y la respuesta posterior de reepitelización de la mucosa con epitelio escamoso, confirmado con estudio histológico.
Figura 7. Tratamiento Endoscópico con Argón Plasma del Esófago de Barrett
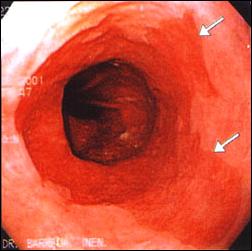
| Foto A. Esófago Corto de Barrett: Variedad en Lengüeta. |
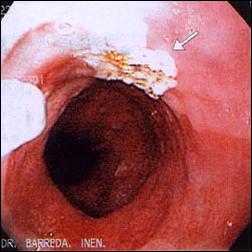
| Foto B. Tratamiento endoscópico con Argón Plasma del Esófago de Barrett. |
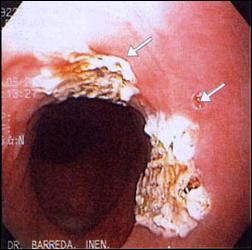
| Foto C. Finalización del tratamiento endoscópico con Argón Plasma del Esófago de Barrett. |
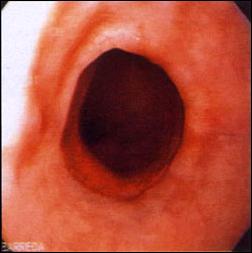
| Foto D. Control endoscópico y verificación de la reepitelización de la mucosa con epitelio escamoso post tratamiento con Argón Plasma. |
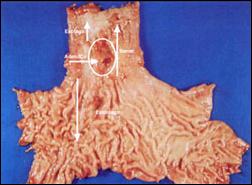
Finalmente, en la Figura 8, se consigna una pieza operatoria con presencia de adenocarcinoma en Esófago de Barrett, que la contrastamos con la Figura 9, que corresponde a un espécimen quirúrgico que presenta la complicación del adenocarcinoma en el Esófago de Barrett, concomitantemente con una hernia hiatal esofágica justo por debajo de la neoplasia.
| Figura 8. Pieza Operatoria de Adenocarcinoma en Esófago Largo de Barrett. |
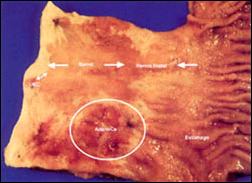
Figura 9. Adenocarcinoma en Esófago Largo de Barrett justo por encima de la Hernia Hiatal Esofágica.
Para el análisis del Esófago de Barrett, definido con base a la presencia de metaplasia intestinal, se han considerado los 15 casos recolectados entre los años 1956-1998 y los 25 casos evaluados entre los años 1999 y Julio del 2001, lo que nos da un total de 40 casos de metaplasia intestinal. De la misma manera, se han considerado los 62 casos recolectados de metaplasia gástrica en ambos períodos con fines comparativos y de análisis.
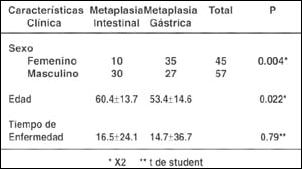
En la Tabla V, se ve con claridad que la metaplasia intestinal afecta preponderantemente a pacientes del sexo masculino con una relación de 3 a 1 respecto al femenino, y con significancia estadística (p=0.004). El promedio de edad de los pacientes con metaplasia intestinal es de 60 años, y no encontramos mayor diferencia respecto al tiempo de enfermedad en ambos grupos.
| Tabla V. Correlación de aspectos clínicos con la metaplasia intestinal y gástrica. |
*X2 **t de student
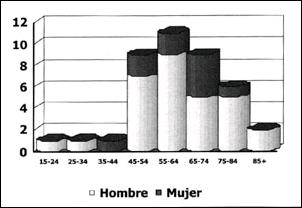
El Gráfico 3, nos muestra que la prevalencia del Esófago de Barrett se incrementa con la edad y afecta principalmente a pacientes del sexo masculino.
Gráfico 3. Pacientes con Esófago de Barrett según Edad y Sexo.
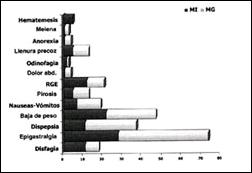
El cuadro clínico de presentación de los pacientes con Esófago de Barrett difiere en algunos aspectos relevantes al compararlos con pacientes que tienen metaplasia columnar de tipo gástrico, sin embargo, de acuerdo al grupo analizado (40 pacientes con metaplasia intestinal y 62 pacientes con metaplasia gástrica), no alcanzan significancia estadística, lo significa, que la mayoría de pacientes con Esófago de Barrett no tienen un cuadro clínico de presentación característica e inclusive a pesar de tener lesiones severas en esófago, la manifestación sintomática suele ser pobre, por lo que se recomienda que más que evaluar la intensidad de los síntomas, se debe precisar mejor la frecuencia y duración de los mismos(137). Vale la pena mencionar, no obstante, que es más factible encontrar en los pacientes con Esófago de Barrett la presencia de disfagia, reflujo gastro-esofágico y ciertamente la hematemesis como manifestación de la complicación del Esófago de Barrett sea por úlcera péptica estenótica o por la presencia del adenocarcinoma ulcerado. (Gráfico 4).
Gráfico 4. Cuadro Clínico del Esófago de Barrett en relación a la metaplasia columnar gástrica.
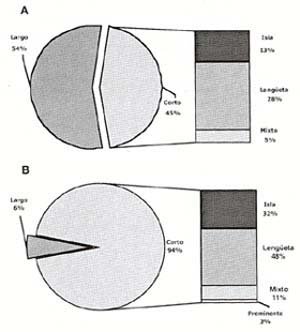
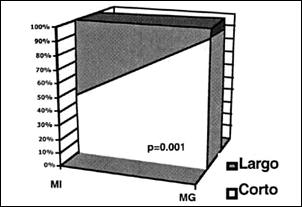
Una relación interesante que hemos podido estimar, la mostramos en la Tabla VI y en el Gráfico 5, en donde se aprecia con claridad la concordancia directa de la metaplasia gástrica con la variedad endoscópica de Esófago Corto de Barrett con una significancia estadística de p<0.001, de otro lado, la metaplasia intestinal se distribuye de una manera algo mayor en el esófago largo respecto al corto. Cabe resaltar que la alta predominancia de metaplasia gástrica en Esófago Corto de Barrett podría tener relación en algunos de nuestros casos con variedades prominentes de Línea Z, que estén dentro de rangos de normalidad y que puedan significar factores de confusión al analizar los datos en referencia, precisamente por esta posibilidad es que grupos de investigadores durante muchos años han considerado al Esófago de Barrett, sólo si este tenía más de 3 cms. de longitud y con presencia de metaplasia intestinal, eliminando de esta manera los potenciales riesgos de confusión, sin embargo, se acepta ahora considerar también la presencia de metaplasia intestinal en el Esófago Corto de Barrett(25).
Tabla VI. Correlación de la longitud del Esófago de Barrett con la metaplasia intestinal y gástrica.

Gráfico 5. Correlación endoscópica con los hallazgos histológicos. en la Figura A, se aprecia todos los pacientes con metaplasia inetstinal (n=40) y en la Figura B, todos los pacientes con metaplasia gástrica (n=62)
Al valorar los hallazgos endoscópicos de metaplasia columnar y correlacionarlos con la histología (Gráfico 6), es de resaltar que los pacientes con metaplasia intestinal tienen una mayor presencia de esófago largo de Barrett respecto a la variedad corta, de otro lado, en los pacientes con metaplasia gástrica, se da la circunstancia opuesta, esto es, la variedad predominante es la corta con el 94% de los pacientes. En ambos casos, dentro de la variedad corta, la forma más frecuente es la de lengüeta seguida de la forma en isla.
Gráfico 6. Correlación endoscópica con los hallazgos histológicos. En la Figura A, se aprecia todos los pacientes con metaplasia intestinal (n=40) y en la Figura B, todos los pacientes con metaplasia gástrica (n=62).
Desde fines del año 2000, venimos realizando en nuestro Servicio el tratamiento endoscópico de pacientes con Esófago de Barrett con base a Argón Plasma, siendo nuestros primeros resultados alentadores, con reepitelización del tejido columnar por epitelio escamoso, aún nuestros resultados están en evaluación y en proceso de seguimiento, por lo que no son mostrados en el presente reporte y serán motivo de una próxima comunicación.
Hemos podido valorar que la metaplasia intestinal tiene una relación directa con la presencia de displasia como complicación de la misma, como se observa en la Tabla VII, a diferencia de la metaplasia gástrica, en donde no hemos apreciado ningún cambio de displasia, y la mayor parte de los pacientes con displasia de alto grado han presentado la complicación con el adenocarcinoma en el Esófago de Barrett.
Tabla VII. Correlación de la Displasia con la Metaplasia Intestinal

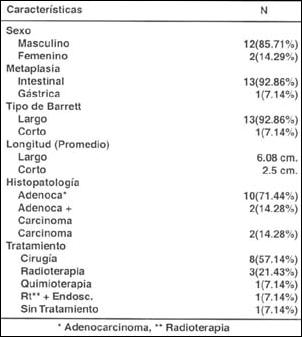
Se han seleccionado 14 casos de Esófago de Barrett complicados con neoplasia, los cuales tienen confirmación histológica, endoscópica, radiológica y en algunos casos, de resección quirúrgica. En la Tabla VIII, se resume las características más significativas que han sido evaluadas, dentro de las que cabe destacar, la preeminencia de afección al sexo masculino en una relación de 6 a 1 respecto al femenino, de la misma manera, el claro sustento de metaplasia intestinal en la génesis de la neoplasia, con una relación de 13 a 1, respecto a la metaplasia gástrica. El Esófago Largo de Barrett, está presente en 13 de los 14 casos complicados con neoplasia y el promedio de longitud del mismo es de 6 cms. El tratamiento quirúrgico, ha sido el predominante en los 14 casos evaluados.
Tabla VIII. Características clínicas de pacientes con Esófago de Barrett complicado con neoplasia
* Adenocarcinoma, ** Radioterapia
CONCLUSIONES
La definición actual del Esófago de Barrett requiere dos criterios:
1. Criterio endoscópico: apariencia columnar de la mucosa de cualquier extensión dentro del esófago tubular.
2. Criterio histológico: metaplasia intestinal.
De acuerdo a los datos revisados en nuestro medio, que corresponden al Registro de Cáncer de Lima Metropolitana (1990 – 1993), Centro de Investigación en Cáncer Maes Heller, y al archivo del INEN, podemos aseverar lo siguiente:
- El primer caso diagnosticado de Esófago de Barrett complicado con adenocarcinoma en el INEN, data de 1956.
- La frecuencia y tasa de incidencia por cáncer de esófago en ambos sexos en el periodo 1990-1993, es de 1.09 de TEE, ocupando el lugar 26 en frecuencia de presentación por cáncer.
- La TEE para el adenocarcinoma, es de 0.2 para el sexo masculino y de 0.08 para el femenino.
- La prevalencia del Esófago de Barrett en el INEN con base a 3,904 gastroscopías en 30 meses evaluados, es de 0.64.
- La frecuencia de presentación de la metaplasia intestinal en la unión escamo columnar (UEC), de aspecto endoscópico normal es del 21%.
- La metaplasia intestinal en la UEC normal está asociada con un grupo etáreo mayor, con promedio de edad de 60 años (p=0.002)
- La metaplasia intestinal en la UEC normal esta asociada con la metaplasia intestinal en antro (p<0.001 y OR: 14.6), no encontrándose asociación con la enfermedad del reflujo gastro-esofágico.
- El Esófago de Barrett en 40 pacientes evaluados afecta preponderantemente al sexo masculino con una relación de 3 a 1 respecto al femenino (p=0.004).
- El promedio de edad de los pacientes con Esófago de Barrett es de 60 años.
- La frecuencia de presentación del Esófago de Barrett se incrementa con la edad, sobretodo a partir de los 40 años, alcanzando su máxima expresión en el grupo de 55 a 64 años.
- El cuadro clínico de los pacientes con Esófago de Barrett difiere poco de aquellos con metaplasia columnar de tipo gástrico, sin embargo la presencia de disfagia, reflujo gastro-esofágico y hematemesis, es más sugerente de la presencia del Esófago de Barrett.
- La metaplasia intestinal es más frecuente en el esófago largo de Barrett a diferencia de la metaplasia gástrica, donde la forma corta es la preponderante (p<0.001).
- La displasia tanto de alto como de bajo grado, se asocia con la presencia de metaplasia intestinal. No hemos visto dicha asociación con la metaplasia gástrica.
- El tratamiento con Argón Plasma se realiza en el INEN desde fines del 2000, con resultados preliminares alentadores.
- De acuerdo a cifras del Departamento de Estadística del INEN, la frecuencia de presentación del carcinoma epidermoide es del 96% y del adenocarcinoma del 4%, en un período evaluado de 15 años (1985-1999).
- Según los mismos datos del INEN, la tendencia del carcinoma epidermoide y del adenocarcinoma de esófago, no presentan variación en cuanto a sus proporciones, en los 15 años evaluados.
- El adenocarcinoma en Esófago de Barrett, afecta sobretodo al sexo masculino en una relación de 6 a 1, respecto al femenino.
- La metaplasia intestinal está presente en 13/14 pacientes evaluados por adenocarcinoma de esófago.
- El esófago largo de Barrett, está en 13/14 pacientes complicados con adenocarcinoma.
- La longitud promedio del esófago largo de Barrett es de 6 cm, en los pacientes con adenocarcinoma (3 a 10 cm).
RECOMENDACIONES
- Se recomienda que, para unificar criterios en nuestro medio, se adopte también la definición del Esófago de Barrett, de acuerdo al consenso actual de la literatura mundial; esto es, que se requiera la sumatoria del criterio endoscópico de apariencia columnar de la mucosa tubular esofágica, aunado a la presencia de metaplasia intestinal, en todos los reportes.
- Probablemente, el mejor nombre para el esófago de aspecto columnar pero con sustento histológico de metaplasia gástrica, sea el sugerido por el mismo Norman Barrett, esto es, Epitelio Columnar en Esófago Distal.
- El tratamiento endoscópico de Esófago de Barrett bajo la modalidad de Argón Plasma u otra modalidad de ablación del tejido, está en fase experimental, por lo que se recomienda el manejo de dichos pacientes bajo grupos de estudio y control.
- No se recomienda de manera rutinaria la toma de muestras para estudio histológico de la unión escamo-columnar de aspecto normal, salvo con fines de investigación.
- La recomendación en nuestro medio para un paciente asintomático del sexo masculino mayor de 40 años y para una paciente asintomática del sexo femenino mayor de 35 años, es la gastroscopía, como parte del plan de despistaje para la detección del cáncer gástrico temprano; de otro lado, dicha recomendación se podría duplicar, para aquellos pacientes varones, mayores de 40 años y con una historia recurrente de reflujo gastro-esofágico no menor de 5 años, como parte del plan para la detección del Esófago de Barrett.
- El grupo de riesgo en nuestros pacientes para el desarrollo de adenocarcinoma en Esófago de Barrett tiene las características de afectar sobretodo al sexo masculino, a pacientes con esófago largo de Barrett y en algunos casos con sintomatología de reflujo de larga data, por lo que este grupo de pacientes deberán tener un seguimiento y control más estricto y cercano.
AGRADECIMIENTO
El presente trabajo fue llevado a cabo con la valiosa colaboración de la Dra. Dolly Quispe Leveau y de la Sra. María Farfán Toledo.
BIBLIOGRAFIA
1. HAMILTON SR. Esophagitis. In Phatology of the Gastrointestinal Tract. Second edition. Siu-Chun Ming, Harvey Goldman Editors. Williams and Wilkins, 1998. 20:433-474 [ Links ]
2. LORD REGINALD V. N. FRACS. Norman Barrett, «Doyen of Esophageal Surgery». Lippincott Williams & Wilkins. Annals of Surgery, March 1999. Volume 229. Number 3. [ Links ]
3. WEINSTEIN WM, IPPOLITI AF. The diagnosis of Barretts esophagus: goblets, goblets goblets. Gastrointests Endosc, 1996. 44:91-95. [ Links ]
4. ELLIS FH Jr., OLSEN AM. Achalasia of the Esophagus. Philadelphia. WB Saunders, 1969. [ Links ]
5. BARRETT NR. Chronic peptic ulcer of the oesophagus and «oesophagitis». Br J Surg,, 1950. 38:175-182. [ Links ]
6. LYALL A. Chronic peptic ulcer of the oesophagus: a report of eight cases. Br J Surg, 1937. 24:534-547. [ Links ]
7. ALLISON PR, JOHNSTONE AS. Oesophagus lined with gastric mucous membrane. Thorax, 1953, 8:87-93. [ Links ]
8. PARA CHANDRASOMA. Seminars in Thoracic and Cardiovascular Surgery, 1997. Vol 9, No3 (July), pp270-278. [ Links ]
9. MODLIN IM, SACHS G. Barretts. In Modlin Irvin M, Sachs George ed. Acid Related Diseases. Biology and Treatment. Schnetztor-Verlag GmbH D-Konstanz, 1998. Ch 5; 302-307. [ Links ]
10. SPECHLER STUART JON. The Columnar-Lined Esophagus: History, Terminology, and Clinical Issues. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
11. BOSHER LH, TAYLOR FH. Heterotopic gastric mucosa in the esophagus with ulceration and stricture formation. J Th Surg, 1951 21:306-312. [ Links ]
12. MORSON BC, BELCHER JR: Adenocarcinoma of the esophagus and ectopic gastric mucosa. Br J Cancer, 1952. 6: 127- 130. [ Links ]
13. BARRETT NR. The lower esophagus lined by columnar epithelium. Surgery,1957. 41:881-894. [ Links ]
14. MOERSCH RN, ELLIS FH, MC DONALD JR: Pathologic changes occurring in severe reflux esophagitis. Surg Gynecol Obstet, 1959. 180: 476. [ Links ]
15. HAYWARD J. The lower end of the oesophagus. Thorax, 1961. 16: 36- 41. [ Links ]
16. PAULL A, TRIER J, DALTON, et al. The histologic spectrum of Barretts esophagus. N Engl J Med, 1976. 295:476-480. [ Links ]
17. RESANO CH, CABRERA N, GONZALES-CUETO D, et al. Double early epidermoid carcinoma of the esophagus in columnar epithelium. Endoscopy, 1985. 17:73-75. [ Links ]
18. SI-CHUN MING. Adenocarcinoma and other epithelial tumors of the esophagus. In Pathology of the Gastrointestinal Tract. Second edition. Siu-Chun Ming, Harvey Goldman Editors. Williams and Wilkins, 1998. 22: 499-521. [ Links ]
19. TAMURA H, SCHULMAN SA. Barrett type esophagus associated with squamous carcinoma. Chest, 1971. 59:330-332. [ Links ]
20. SKINNER DB, WALTHER BC, RIDDELL RH, et al. Barretts esophagus: comparison of benign and malignant cases. Ann Surg, 1983. 198:554-565. [ Links ]
21. GRAY MR, HALL PA, NASH J, et al. Epithelial proliferation in Barretts esophagus by proliferating cell nuclear antigen immunolocalization. Gastroenterology, Vol 103, 1769-1776, 1992. [ Links ]
22. REID BJ, WEINSTEIN WM. Barretts esophagus and adenocarcinoma. Annu Rev Med, 1987. 38:477-492. [ Links ]
23. RUSTGI ANIL K. Biomarkers For Malignancy In The Columnar-Lined Esophagus. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
24. SPECHLER STUART JON. Esophageal columnar metaplasia (Barretts esophagus). Gastrointestinal Endoscopy Clinics of North America, 1997. Vol 7, Nº 1, 1-18. [ Links ]
25. SPECHLER STUART JON. The Columnar-Lined Esophagus. Gastroenterology Clinics, 1997. Vol 26, Nº 3, 455-467. [ Links ]
26. HIROTA WK, LOUGHNEY TM, LAZAS DJ, et al: Specialized intestinal metaplasia, dysplasia and cancer of the esophagus and esophagogastric junction: prevalence and clinical data. Gastroenterology, 1999. 116:277-285. [ Links ]
27. SCHNELL TG, SONTAG SJ, CHEJFEC G: Adenocarcinoma arising in tongues or short segment of Barretts esophagus. Dig Dis Sci, 1992. 37:143-173. [ Links ]
28. SHARMA PRATEEK, MORALES THOMAS G., BHATTACHARYYA ACHYUT, et al. Dysplasia in Short-Segment Barretts Esophagus: A Prospective 3-Year Follow-Up. American College of Gastroenterology. American Journal of Gastroenterology, November 1997. Volume 92. Number 11. [ Links ]
29. WESTON ALLAN P., KRMPOTICH PHILIP T., CHERIAN RACHEL, et al. Prospective Long-Term Endoscopic and Histological Follow-Up of Short Segment Barretts Esophagus: Comparison with Traditional Long Segment Barretts Esophagus. American College of Gastroenterology. American Journal of Gastroenterology, March 1997. Volume 92. Number 3. [ Links ]
30. REYNOLDS JAMES C., WARONKER MICHAEL DO, SIBAYAN PACQUING MARICAR DO, et al. Gastroesophageal Reflux Disease. Barretts Esophagus: Reducing the Risk of Progression to Adenocarcinoma. W. B. Saunders Company. Gastroenterology Clinics, December 1999. Volume 28. Number 4. [ Links ]
31. PRATEEK SHARMA. The Worldwide Prevalence of Barretts Esophagus. World Gastroenterology News, 2001. Vol 6, 1, 22-25. [ Links ]
32. CRESPI M, DELVAUX M, SCHAPIRO M et al. Working party report by committee for minimal standards of terminology and documentation in digestive endoscopy of the european society of gastrointestinal endoscopy. Am J Gastroenterol, 1996. Vol. 91, No 2, 191-216. [ Links ]
33. BRONNER MP. Pathology of Barretts Esophagus. Annual Post Graduate Course. ASGE. Endoscopy in Context: A multidisciplinary approach, 2001. 15-22. [ Links ]
34. CAMERON ALAN J., CARPENTER HERSCHEL A. Barretts Esophagus, High-Grade Dysplasia, and Early Adenocarcinoma: A Pathological Study. American College of Gastroenterology. American Journal of Gastroenterology, April 1997. Volume 92. Number 4. [ Links ]
35. SAMPLINER RE. Practice guidelines on the diagnosis, surveillance, and therapy of Barretts esophagus. Am J Gastroenterol, 1998. 93: 1,028-32. [ Links ]
36. SHARMA PRATEEK. Barretts Esophagus: Definition and Diagnosis. In Sharma P, Sampliner RE, ed. Barretts Esophagus and Esophageal Adenocarcinoma. Blackwell Science, 2001. Ch 1, 1-7. [ Links ]
37. JANKOWSKI JA, HARRISON RF, PERRY I, et al. Barretts metaplasia. The lancet, 2000. Vol 356: 2079-2085. [ Links ]
38. JANKOWSKI JA, WRIGHT NA, MELTZER SJ, et al. Molecular evolution of the metaplasia-dysplasia-adenocarcinoma sequence in the esophagus. Am J Pathol, 1999. 154: 965-973. [ Links ]
39. SOUZA RHONDA F., MELTZER STEPHEN J. The Molecular Basis For Carcinogenesis In Metaplastic Columnar-Lined Esophagus. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
40. WEINSTEIN WILFRED M. Predicting who will develop cancer: role of biopsy, flow cytometry, cell and genetic markers. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3.
41. LAGERGREN J, BERGSTROM R, LINDGREN A, et al. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med, 1999. Vol 340: 825-831. [ Links ]
42. CAMERON ALAN J. Epidemiology Of Columnar-Lined Esophagus And Adenocarcinoma. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
43. CAMERON ALAN J. Epidemiology and prevalence of Barretts esophagus and adenocarcinoma. In Sharma P, Sampliner RE, ed. Barretts Esophagus and Esophageal Adenocarcinoma. Blackwell Science, 2001. Ch 2, 8-17. [ Links ]
44. PHILIPS RW, WONG RKH. Barretts esophagus: natural history, incidence, etiology, and complications. Gastroenterol Clin North Am, 1991. 20, Nº 4, 791-816. [ Links ]
45. REID BRIAN J. Barretts esophagus and esophageal adenocarcinoma. Gastroenterol Clin North Am, 1991. 20, Nº 4, 817-834. [ Links ]
46. PRACH AJ, MacDONALD TA, HOPWOOD DA, et al. Increasing incidence of Barretts oesophagus: education, enthusiasm or epidemiology?. Lancet, 1997. 350:933. [ Links ]
47. SHARMA P, McCALLUM RW, LUNDELL L, et al. The geoprevalence of Barretts esophagus. (Paper presented at the Sixth OESO World Congress, Paris, France , September 2000)
48. NAKAMURA M, KAWANO T, ENDO M, et al. Intestinal metaplasia at the esophagogastric junction in Japanese patients without clinical Barretts esophagus. Am J Gastroenterol, 1999. 94:3145-9. [ Links ]
49. HO KY, KANG JY, SEOW A. Prevalence of gastrointestinal symptoms in a multiracial Asian population, with particular reference to reflux-type symptoms. Am J Gastroenterol 93:1816-22, 1998. [ Links ]
50. TER ROLAND B., CASTELL DONALD O. Gastroesophageal Reflux Disease In Patients With Columnar-Lined Esophagus. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
51. GADOUR MO, AYOOLA EA. Barretts oesophagus and oesophageal cancer in Saudi Arabia. Gastroenterology, 1999. 20:111-5. [ Links ]
52. MASON RJ, BREMNER CG. The columnar-line (Barretts) oesophagus in black patients. S Afr J Surg, 1998. 36:61-2. [ Links ]
53. ACHKAR E, CAREY W. The cost of surveillance for adenocarcinoma complicating Barretts esophagus. Am J Gastroenterol, 1988. 3:291-4. [ Links ]
54. CAMERON AJ, OTT BJ, PAYNE WS. The incidence of adenocarcinoma in columnar-lined (Barretts) esophagus. N Engl J Med, 1985. 313:857-9. [ Links ]
55. OVASKA J, MIETTINEN M, KIVILAAKSO E. Adenocarcinoma arising in Barretts esophagus. Dig Dis Sci, 1989. 34:1336-9. [ Links ]
56. SPECHLER SJ, ROBBINS AH, RUBINS HB, et al. Adenocarcinoma and Barretts esophagus: An overrated risk? Gastroenterology, 1984. 87: 927 -33. [ Links ]
57. VAN DER VEEN AH, DEES J, BLANKENSTEIJN JD, et al. Adenocarcinoma in Barretts oesophagus. An overrated risk. Gut, 1989. 30: 14-18. [ Links ]
58. WILLIAMSON WA, ELLIS FH, GIBB SP, et al. Barretts esophagus: Prevalence and incidence of adenocarcinoma. Arch Intern Med, 1991. 151:2212-6. [ Links ]
59. BONELLI L, GOSPE (Gruppo Operativo per lo Studio delle Precancerosi Esofagee). Barretts esophagus: Results of a multicentric survey. Endoscopy 25 (suppl.) , 1993; 652-4. [ Links ]
60. HAMMEETEMAN W, TYTGAT NJ, HOUTHOFF HJ, et al. Barretts esophagus. Development of dysplasia and adenocarcinoma. Gastroenterology, 1989. 96:1249-56. [ Links ]
61. IFTIKHAR SY, JAMES PD, STEELE RJC, et al. Length of Barretts oesophagus: An important factor in the development of dysplasia and adenocarcinoma. Gut, 1992. 33: 1155-8. [ Links ]
62. MIROS M, KERLIN P, WALKER N. Only patients with dysplasia progress to adenocarcinoma in Barretts oesophagus. Gut, 1991. 32:1441-6. [ Links ]
63. ROBERTSON CS, MAYBERRY JF, NICHOLSON DA, et al. Value of endoscopic surveillance in detection of neoplastic change in Barretts oesophagus. Br J Surg, 1988. 75: 760-3. [ Links ]
64. DREWITZ D. J., SAMPLINER R. E., GAREWAL H. S. The Incidence of Adenocarcinoma in Barretts Esophagus: A Prospective Study of 170 Patients Followed 4.8 Years. American College of Gastroenterology. American Journal of Gastroenterology, February 1997. Volume 92. Number 2. [ Links ]
65. ALEXANDER JEFFREY A., JONES SUSAN M., SMITH CAROL J., et al. Usefulness of cytopathology and histology in the evaluation of Barretts esophagus in a community hospital. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, October 1997. Volume 46. Number 4. [ Links ]
66. FALK GARY W., RICE THOMAS W., GOLDBLUM JOHN R., et al. Jumbo biopsy forceps protocol still misses unsuspected cancer in Barretts esophagus with high-grade dysplasia. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, February 1999. Volume 49. Number 2. [ Links ]
67. EISEN GLENN M., MONTGOMERY ELIZABETH A., AZUMI NORIO, et al. Qualitative mapping of Barretts metaplasia: a prerequisite for intervention trials. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy December 1999. Volume 50. Number 6. [ Links ]
68. CANTO MARCIA IRENE. Vital staining and Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3. [ Links ]
69. CANTO MARCIA IRENE F., SETRAKIAN SEBOUH, WILLIS JOSEPH, et al. Methylene blue-directed biopsies improve detection of intestinal metaplasia and dysplasia in Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, May 2000. Volume 51. Number 5. [ Links ]
70. KIESSLICH RALF, HAHN MARTIN, HERRMANN GUNTER, et al. Screening for specialized columnar epithelium with methylene blue: Chromoendoscopy in patients with Barretts esophagus and a normal control group. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 2001. Volume 53. Number 1. [ Links ]
71. UMAKANT DAVE, SAMI SHOUSHA, DAVID WESTABY. Methylene blue staining: Is it really useful in Barretts esophagus?. American Society for Gastrointestinal Endoscopy Gastrointestinal Endoscopy, March 2001. Volume 53. Number 3. [ Links ]
72. MESSMANN HELMUT, KNUCHEL RUTH, BAUMLER WOLFGANG, et al. Endoscopic fluorescence detection of dysplasia in patients with Barretts esophagus, ulcerative colitis, or adenomatous polyps after 5-aminolevulinic acid-induced protoporphyrin IX sensitization. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 1999. Volume 49. Number 1. [ Links ]
73. WAXMAN IRVING. Endosonography In Columnar-Lined Esophagus. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
74. ROSCH T. Endosonographic staging of esophageal cancer. Gastrointest Endosc Clin North Am, 1995. 5:537-544. [ Links ]
75. NIJHAWAN PARDEEP K., WANG KENNETH K. Endoscopic mucosal resection for lesions with endoscopic features suggestive of malignancy and high-grade dysplasia within Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, September 2000. Volume 52. Number 3. [ Links ]
76. JOHNSTON DA, WINTERS C, SPURLING TJ, et al. Esophageal acid sensitivity in Barretts esophagus. J Clin Gastroenterol, 1987. 9:23. [ Links ]
77. HARLE IA, FINLEY RJ, BELSHEIM M, et al. Management of adenocarcinoma in columnar-lined esophagus. Ann Torca Surg, , 1985. 40:330-336. [ Links ]
78. MENKE-PLUYMERS MB, HOP WC, DEES J, et al. Risk factors for the development o fan adenocarcinoma in columnar-lined (Barretts) esophagus: The Rotterdam Esophageal Tumor Study Group. Cancer, 1993. 72:1155-1158. [ Links ]
79. SARR MG, HAMILTON SR, MARRONE GC, et al. Barretts esophagus: Its prevalence and association with adenocarcinoma in patients with symptoms of gastroesophageal reflux. Am J Surg, 1985. 149: 187-193. [ Links ]
80. BROWN LM, SWANSON CA, GRIDLEY G, et al. Adenocarcinoma of the esophagus: role of obesity and diet. J Natl Cancer Inst, 1995. 87:104-109. [ Links ]
81. LIEBERMAN DAVID A., OEHLKE MEGAN B.A., HELFAND MARK. Risk Factors for Barretts Esophagus in Community-Based Practice. American College of Gastroenterology. American Journal of Gastroenterology, August 1997. Volume 92. Number 8. [ Links ]
82. MACDONALD CE, WICKS AC, PLAYFORD WR. Final results from 10 years cohort of patients undergoing surveillance for Barretts oesophagus: observational study. BMJ, 2000. 321: 1252-1255. [ Links ]
83. CASTELL DONALD O., KATZKA DAVID A. Barretts esophagus: continuing questions and controversy. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3. [ Links ]
84. EISEN G. M., SANDLER R. S., MURRAY S. et al. The Relationship between Gastroesophageal Reflux Disease and Its Complications with Barretts Esophagus. American College of Gastroenterology. American Journal of Gastroenterology, January 1997. Volume 92. Number 1. [ Links ]
85. FENNERTY M. BRIAN. Perspectives on endoscopic eradication of Barretts esophagus: who are appropriate candidates and what is the best method? Gastrointestinal endoscopy, 1999. Vol 49, Nº 3, part 2, s24-s28. [ Links ]
86. DENT J, BREMNER CG, COLLEN MJ, et al. Working party report to the world congresses of gastroenterology, Sydney, 1990: Barretts Esophagus. J Gastroenterol Hepatol, , 1991. 6:1-22. [ Links ]
87. SCHULZ HEINRICH, MIEHLKE STEPHAN, KLAUS-ULRICH SCHENTKE DAVID ANTOS, et al. Ablation of Barretts epithelium by endoscopic argon plasma coagulation in combination with high-dose omeprazole. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, June 2000. Volume 51. Number 6. [ Links ]
88. LIGHTDALE CHARLES J. Ablation therapy for Barretts esophagus: Is it time to choose our weapons?. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 1999. Volume 49. Number 1. [ Links ]
89. BLOT WJ, DEVEA S, KNELLER RW, et al. Rising incidence of adenocarcinoma of the esophagus and gastric cardia. JAMA, 1991. 265:1287-9. [ Links ]
90. BLOT WJ, DEVESA SS, FRAUMENI JF. Continuing climb in rates of esophageal adenocarcinoma: an update (setter). JAMA, 1993. 270:1320. [ Links ]
91. RICE TW, ZUCCARO G, ADELSTEIN DJ, et al. Esophageal carcinoma: depth of tumor invasion is predictive of regional lymph node status. Ann Thorac Surg, 1998. 65:787-92. [ Links ]
92. SABIK JF, RICE TW, GOLDBLUM JR, et al. Superficial esophageal carcinoma. Ann Torca Surg, 1995. 60:896-902. [ Links ]
93. FALK GARY W., OURS TINA M., RICHTER JOEL E. Practice patterns for surveillance of Barretts esophagus in the United States. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, August 2000. Volume 52. Number 2. [ Links ]
94. KIM R, ROSE S, SHAR AO, et al. Extent of Barretts metaplasia: A prospective study of the serial change in area of Barretts measured by quantitative endoscopic imaging. Gastrointest Endosc, 1997. 45:456-462. [ Links ]
95. ANTONIOLI DONALD A., WANG HELEN H. Morphology of Barretts Esophagus and Barretts-Associated Dysplasia and Adenocarcinoma. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
96. GOSSNER LIEBWIN, MAY ANDREA, STOLTE MANFRED, et al. KTP laser destruction of dysplasia and early cancer in columnar-lined Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 1999. Volume 49. Number 1. [ Links ]
97. KOMOROWSKI RICHARD A., HOGAN WALTER J., CHAUSOW DOUGLAS D. Barretts Ulcer: The Clinical Significance Today. American College of Gastroenterology. American Journal of Gastroenterology, November 1996. Volume 91. Number 11. [ Links ]
98. FENNERTY MB. Barretts esophagus: what do we really know about this disease? Am J Gastroenterol, 1997. 92: 1-3. [ Links ]
99. SPECHLER ST, GOYAL RK. Barretts esophagus. N Engl J Med, 1986. 315:362-71. [ Links ]
100. FALK GARY W. Endoscopic surveillance of Barretts esophagus: risk stratification and cancer risk. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3. [ Links ]
101. PROVENZALE D, KEMP A, ARORA S, et al. A guide for surveillance of patients with Barretts esophagus. Am J Gastroenterol, 1994. 89: 670-80. [ Links ]
102. TYTGAT GNJ. Does endoscopic surveillance in esophageal columnar metaplasia have any real value? Endoscopy, 1995. 27:19-26. [ Links ]
103. SCHMIDT HG, RIDDELL RH, WALTHER B, et al. Dysplasia in Barretts esophagus. J Cancer Res Clin Oncol, 1985. 110:145-152. [ Links ]
104. MENDES DE ALMEIDA JOSE C., CHAVES PAULA, DIAS PEREIRA A., et al. Is Barretts Esophagus the Precursor of Most Adenocarcinomas of the Esophagus and Cardia? A Biochemical Study. Lippincott-Raven Publishers. Annals of Surgery, December 1997. Volume 226. Number 6. [ Links ]
105. HAAG SEBASTIAN, NANDURKAR SANJAY, TALLEY NICHOLAS J. Regression of Barretts esophagus: the role of acid suppression, surgery, and ablative methods. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, August 1999. Volume 50. Number 2. [ Links ]
106. SAMPLINER RE, GAREWAL HS, FENNERTY MB, et al. Lack of impact of therapy on extent of Barretts esophagus in 67 patients. Dig Dis Sci, 1990. 35:93-96. [ Links ]
107. SAMPLINER RICHARD E. Barretts esophagus: electrocoagulation. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3. [ Links ]
108. GARCIA MONTES CIRO, ARY BRANDALISE NELSON, DELIZA ROSANGELA, et al. Antireflux surgery followed by bipolar electrocoagulation in the treatment of Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, August 1999. Volume 50. Number 2. [ Links ]
109. SALO J A, SALMINEN J T, KIVILUOTO T A, et al. Treatment of Barretts esophagus by endoscopic laser ablation and antireflux surgery. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 1999. Volume 49. Number 1. [ Links ]
110. SAMPLINER RE, HIXSON LJ, FENNERTY MB, et al. Regress of Barretts esophagus by laser ablation in an acid environment. Dig Dis Sci, 1993. 38:365-8. [ Links ]
111. BARHAM C P, JONES R L, BIDDLESTONE L R, et al. Photo thermal laser ablation of Barretts oesophagus: endoscopic and histologic evidence of squamous re-epithelialisation. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, December 1998. Volume 48. Number 6.
112. GRADE ANDREW J., SHAH IFAT A., MEDLIN SUSAN M., et al. The efficacy and safety of argon plasma coagulation therapy in Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, July 1999. Volume 50. Number 1. [ Links ]
113. KOVACS BRENT J., CHEN YANG K., LEWIS TERENCE D., et al. Successful reversal of Barretts esophagus with multipolar electrocoagulation despite inadequate acid suppression. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, May 1999. Volume 49. Number 5. [ Links ]
114. MICHOPOULOS SPYROS, TSIBOURIS PANAYOTIS, BOUZAKIS HELIAS, et al. Complete regression of Barretts esophagus with heat probe thermocoagulation: mid-term results. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, August 1999. Volume 50. Number 2. [ Links ]
115. OVERHOLT BERGEIN F., PANJEHPOUR MASOUD, HAYDEK JOHN M. Photodynamic therapy for Barretts esophagus: follow-up in 100 patients. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, January 1999. Volume 49. Number 1.
116. SHARMA PRATEEK, BHATTACHARYYA ACHYUT, GAREWAL HARINDER S., et al. Durability of new squamous epithelium after endoscopic reversal of Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, August 1999. Volume 50. Number 2. [ Links ]
117. WANG KENNETH K. Current status of photodynamic therapy of Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, March 1999. Volume 49. Number 3. [ Links ]
118. OVERHOLT BF, PANJEHPOUR M. Photodynamic therapy for Barretts esophagus: Clinical update. Am J. Gastroenterol, 1996. 91:1719-1723. [ Links ]
119. BYRNE JP, ARMSTRONG GR, ATTWOOD SEA. Restoration of the normal squamous lining in Barretts esophagus by argon beam plasma coagulation. Am J Gastroenterol, 1998. 93:1810-5. [ Links ]
120. MORK H, BARTH T, KREIPE HH, et al. Reconstitution of squamous epithelium in Barretts oesophagus with endoscopic argon plasma coagulation: a prospective study. Scand J Gastroenterol, 1998. 33:1130-4. [ Links ]
121. VAN LAETHEM JL, CREMER M, PENY MO, et al. Eradication of Barretts mucosa with argon plasma coagulation and acid suppression: immediate and mid term results. Gut, 1998. 43:747-51. [ Links ]
122. KOCHMAN MICHAEL L. Eradication of Barretts mucosa with argon plasma coagulation and acid suppression: immediate and mid term results. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, December 1999. Volume 50. Number 6. [ Links ]
123. BREMNER CEDRIC G., BREMNER ROSS M. Barretts Esophagus. W. B. Saunders Company. Surgical Clinics of North America, October 1997. Volume 77. Number 5. [ Links ]
124. SHARMA PRATEEK, JAFFE PHILIP E., BHATTACHARYYA AYCHUT, et al. Laser and multipolar electrocoagulation ablation of early Barretts adenocarcinoma: long-term follow-up. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, April 1999. Volume 49. Number 4. [ Links ]
125. LORD RVN, PETERS JH. Surgical Therapy of Barretts Esophagus. In Sharma P, Sampliner RE, ed. Barretts Esophagus and Esophageal Adenocarcinoma. Blackwell Science, 2001. Ch 18, 181-197. [ Links ]
126. NIGRO JJ, HAGEN JA, DeMEESTER TR, et al. Occult esophageal adenocarcinoma: extent of disease and implications for effective therapy. Ann Surg, 1999. 230:433-438. [ Links ]
127. TAKESHITA K, SAITO N, SAEKI I, et al. Proximal gastrectomy and jejunal pouch interposition for the treatment of early cancer in the upper third of the stomach: surgical techniques and evaluation of postoperative function. Surgery, 1997. 121:278-286. [ Links ]
128. STEIN HUBERT J., FEITH MARCUS, MUELLER JAMES, et al. Limited Resection for Early Adenocarcinoma in Barretts Esophagus. Lippincott Williams & Wilkins. Annals of Surgery, December 2000. Volume 232. Number 6. [ Links ]
129. MERENDINO KA, DILLARD DH. The concept of sphincter substitution by an interponed jejunal segment for anatomic and physiological abnormalities at the esophagogastric junction. Ann Surg, 1955. 142:486-506. [ Links ]
130. HARADA MASARU, NAGASHIMA RYUICHI, TAKEDA HIROAKI, et al. Endoscopic resection of adenocarcinoma arising in a tongue of Barretts esophagus. American Society for Gastrointestinal Endoscopy. Gastrointestinal Endoscopy, September 2000. Volume 52. Number 3. [ Links ]
131. MAKUUCHI H. Endoscopic mucosal resection for early esophageal cancer: indication and techniques. Dig Endosc, 1996. 8:175-9. [ Links ]
132. SOEHENDRA N, BINMOELLER KF, BOHNACKER S, et al. Endoscopic Snare Mucosectomy in the Esophagus without Any Additional Equipment: A Simple Technique for Resection of Flat Early Cancer. Endoscopy, 1997. 29:380-383. [ Links ]
133. BARREDA F., REBAZA S. Consenso en Esófago de Barrett. Curso Internacional de Post Grado «Avances en Gastroenterología, Hepatología y Endoscopía Digestiva». Sociedad de Gastroenterología del Perú, , Octubre de 1999. 206-221. [ Links ]
134. CENTRO DE INVESTIGACION EN CANCER «MAES HELLER». Registro de Cáncer de Lima Metropolitana, Agosto 1998. 1990 - 1993, Vol II. [ Links ]
135. BARREDA F., SANCHEZ J., TELLO W, et al. Metaplasia Intestinal en la unión esófago-gástrica, frecuencia y correlaciones. Rev Gastroent Perú, 2001. 21:185-197. [ Links ]
136. TYTGAT GNJ. Endoscopic Features Of The Columnar-Lined Esophagus. W. B. Saunders Company. Gastroenterology Clinics, September 1997. Volume 26. Number 3. [ Links ]
137. KATZKA DAVID A., RUSTGI ANIL K. Gastroesophageal Reflux Disease And Barretts Esophagus. W. B. Saunders Company. Medical Clinics of North America., September 2000. Volume 84. Nu mber 5. [ Links ]