Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Gastroenterología del Perú
versão impressa ISSN 1022-5129
Rev. gastroenterol. Perú v.23 n.3 Lima jul./set. 2003
TRABAJOS ORIGINALES
Factores pronósticos de sobrevida quinquenal de pacientes con carcinoma gástrico avanzado resecable con serosa expuesta
Edgar Fermín Yan-Quiroz1; Juan Alberto Díaz-Plasencia2; Othoniel Abelardo Burgos-Chávez1; Adrián Manuel Rojas-Vergara4; Juan Santillán- Medina4; Edwin Stewart Vilela-Guillén3; Thierry Balmaceda-Fraselle4.
1. Médico cirujano.Docente Jefe de Prácticas del Curso de Morfofisiología I de la Facultad de Medicina de la Universidad Privada "Antenor Orrego".
2. Doctor en Medicina. Médico Jefe del Departamento de Cirugía del Hospital Belén de Trujillo. Coordinador del Curso de Cirugía I de la Facultad de Medicina de la Universidad Privada "Antenor Orrego".
3. Médico Cirujano. Docente del curso Informática Médica de la Universidad Privada "Antenor Orrego".
4. Médico Cirujano
RESUMEN
OBJETIVOS: Identificar los principales factores pronósticos de sobrevida quinquenal en pacientes con carcinoma gástrico avanzado resecable con serosa expuesta sometidos a gastrectomía radical con linfadenectomía limitada y extendida.
MATERIAL Y MÉTODOS: Este estudio retrospectivo evalúo 137 pacientes con adenocarcinoma gástrico avanzado resecable con serosa expuesta atendidos en el Hospital Belén, Trujillo, Perú, entre 1991 y 2000.
RESULTADOS: La edad media de la serie total fue de 58.1± 14.8 años (límites, 20 a 84 años). La presente serie estuvo constituida por 137 pacientes, de los cuales 77 (56.2%) fueron varones y 60 (43.8%) mujeres (proporción M:F, 1.3:1). En el análisis univariado, usando el test de log-rank, las siguientes variables estuvieron asociadas significativamente con la sobrevida quinquenal: ausencia de masa palpable (p= 0.0308), hemoglobina sérica mayor o igual a 10 g/dl (p= 0.05), neoplasias ubicadas en el tercio distal del estómago (p=0.0001), estado ganglionar regional N0-N1 (p=0.03), estadio clínico II (p=0.0327), disección ganglionar D2-D3 (p= 0.0366) y cirugía con intención curativa (p= 0.000). La tasa de sobrevida actuarial de toda la serie a los 5 años fue de 16.3%. En el grupo sometido a linfadenectomía D0-D1 (n= 105) la sobrevida a los 5 años fue de 12.6%; en cambio en el grupo sometido a D2-D3 (n= 32) fue de 30.2% (p= 0.0366). En los pacientes que tuvieron cirugía con intención curativa (n= 56) la sobrevida quinquenal fue de 33.4% respectivamente y los que tuvieron resección paliativa (n= 81) fue 3.1% (p< 0.0001).
CONCLUSIONES: La detección precoz, la disponibilidad de resección curativa y el uso de linfadenectomía extendida son factores que influyen en la sobrevida; parámetros que deberían ser considerados para la estratificación de pacientes y su posterior tratamiento adyuvante postoperatorio.
PALABRAS CLAVE: Carcinoma gástrico avanzado. Serosa expuesta. Factores pronósticos. Sobrevida.
SUMMARY
Purpose: To identify the main five-year survival prognosis factors in patients with resectable advanced serosa exposed gastric carcinoma, who have undergone radical gastric resection with limited and extended lymphadenectomy.
Material and methods: This restrospective study examined 137 patients with resectable advanced serosa exposed gastric carcinoma, in the Belén Hospital, Trujillo, Peru, between 1991 and 2000.
Results: The average age of the total series was 58.1 °" 14.8 year (ranging from 20 to 84 years). This series was formed by 137 patients, of which 77 (56.2%) were male and 60 (43.8%) were female (M:F ratio = 1.3:1). The univaried analysis using the log-rank test, showed that the following variables were significantly associated with five-year survival: lack of palpable mass (p=0.0308), serum haemoglobin concentration of 10 g/dl or higher (p=0.05) neoplasias located in the distal third of the stomach (p=0.0001) regional ganglionic condition N0-N1 (p=0.03), clinical stage II (p=0.0327) ganglionic dissection D2-D3 (p=0.0366) and curative intended surgery (p=0.000). The actual survival rate of the entire series after 5 years was of 16.3%. In the group subjected to lymphadenectomy D0-D1 (n=105) survival rate after 5 years was of 12.6%, while in the group subjected to D2-D3 (n=32) it was of 30.2% (p=0.0366). Five-year survival rate in patients who underwent curative intended surgery (n=56) was of 33.4% and those who had palliative surgery (n=81) had a five-year survival rate of 3.1% (p=0.000).
Conclusions: Early detection, availability of curative surgery and the use of extended lymphadenectomy are factors that have an influence on the survival rate. These parameters should be considered for the staging of patients and their subsequent post-surgery assisting treatment.
KEY WORDS: Advanced gastric carcinoma, serosa exposed, prognosis factors, survival.
INTRODUCCIÓN
El carcinoma gástrico ocupa ,en Trujillo, el primer lugar en la tabla de incidencias de enfermedades neoplásicas que se presenta en varones y el tercer lugar en mujeres (1). En la actualidad, la cirugía constituye la única modalidad con potencial curativo en pacientes con esta enfermedad tanto en su forma precoz como avanzada (2). Para el médico en general, y el cirujano en particular, el estudio de factores pronósticos mejora nuestro conocimiento de la historia natural de la enfermedad, ayuda a comprender mejor sus mecanismos y permite predecir el lapso de sobrevida luego del tratamiento quirúrgico (3).
Diversos estudios (4-5) muestran que el pronóstico del carcinoma gástrico está relacionado con su detección precoz y empeora a medida que la lesión se extiende más allá de la muscular propia. Rochelle (7) señala que la profundidad de la invasión tumoral y el compromiso de ganglios regionales son componentes igualmente importantes en la determinación del pronóstico y que deberían ser examinados en combinación. Los hallazgos por separado del compromiso ganglionar linfático y la penetración del tumor en la pared gástrica tienen una acción independiente pero aditiva como indicadores del pronóstico de sobrevida (8,9). Maruyama (10) en un análisis multivariado evalúa 25 variables en pacientes con carcinoma gástrico e identifica 5 factores estadísticamente significativas en la sobrevida: profundidad de la invasión, metástasis ganglionar, forma macroscópica, localización de la lesión y tipo histológico. De las 11 variables investigadas por Curtis et al (11) en 4785 pacientes con carcinoma gástrico, la profundidad de la invasión, compromiso ganglionar regional y metástasis a distancia constituyen los 3 factores más significativos. Nakazato et al (12) también señalan que los factores pronósticos más importantes en dichos pacientes eran la metástasis a distancia, compromiso ganglionar regional y compromiso de la serosa.
Boku et al (13) en una serie de 521 pacientes, encuentran una mejor tasa de sobrevida a 5 años en aquellos pacientes sin compromiso de la serosa (So) en comparación con aquellos que si presentaron serosa expuesta (Se) (75.9 % vs 47.1%; p<0.01) y que cuando la lesión se extiende verticalmente o va más allá de la muscular propia el compromiso ganglionar se hace notablemente evidente (So: 18.4% vs Se: 80.0%; p<0.01). Además el mismo estudio señala que el pronóstico de pacientes que presentan invasión de la serosa (Se) es más favorable cuando no existe metástasis ganglionar (n0) y que la tasa de sobrevida quinquenal decae progresivamente cuando hay compromiso de este último factor (n+) (67.9% vs 32.8%, p<0.01).
Diversos estudios (11-15) demuestran por análisis univariado y de regresión multivariado que el compromiso de la serosa es el factor pronóstico negativo de mayor impacto en la sobrevida ya que si la neoplasia infiltra la serosa, el impacto de la disección ganglionar en la sobrevida se reduce porque la cirugía no puede controlar la diseminación peritoneal transcelómica, principal causa de recurrencia y muerte de pacientes gastrectomizados por esta neoplasia.
La evaluación del impacto en la sobrevida actuarial del compromiso de la serosa, en un contexto clínico, tiene serios inconvenientes ya sea porque es compleja o no ha sido objeto de un análisis estadístico suficiente. Por ello el presente trabajo se plantea el siguiente problema de investigación: ¿Qué factores predicen la sobrevida de pacientes con carcinoma gástrico avanzado resecable con serosa expuesta?
Los objetivos trazados fueron:
Objetivo General:
Identificar los principales factores pronósticos de sobrevida quinquenal en pacientes con carcinoma gástrico avanzado resecable con serosa expuesta sometidos a gastrectomía radical con linfadenectomía limitada y extendida.
Objetivo Específico:
Determinar la tasa de sobrevida actuarial quinquenal en pacientes con carcinoma gástrico avanzado resecable con serosa expuesta.
MATERIAL Y MÉTODOS.
El presente estudio con diseño empírico, de una sola casilla, descriptivo, longitudinal y observacional, analizó de manera retrospectiva información de una serie de 137 pacientes (censo muestra) con adenocarcinoma gástrico avanzado resecable con serosa expuesta (T3)y que tuvieron confirmación histológica de su enfermedad en el Hospital Belén de Trujillo entre el 1° de enero de 1966 al 31 de diciembre del 2000. Fueron excluidos del presente estudio aquellos pacientes con diagnóstico de cáncer precoz del estómago (n=10) y aquellos con neoplasias gástricas primarias diferentes a las de carcinoma (n=13).
Para la obtención de la información, los datos de cada paciente fueron incluidos en una ficha clínica obtenida de las historias clínicas de los Archivos de Estadística, Sala de Operaciones y del Registro de Cáncer del Hospital Belén de Trujillo. Para efectos del presente estudio se confeccionó una base de datos con el Software estadístico SPSS V. 10.0, que incluyó datos sobre los hallazgos clínicos al momento de la admisión, exámenes auxiliares (ecográficos, endoscopias, biopsias, otros), extensión de la enfermedad, fecha de la operación, tipo de cirugía, hallazgos histopatológicos, localización, tamaño de la neoplasia, complicaciones y mortalidad postoperatorias.
DEFINICIONES OPERACIONALES
Las neoplasias se clasificaron por estadios usando los criterios propuestos por la Unión Internacional Contra el Cáncer (Anexo 1) (16), macroscópicamente según la clasificación de Borrmann (17) y de las Reglas Generales para el Estudio de Cáncer Gástrico en Cirugía y Patología de la Sociedad de Investigación Japonesa para el Cáncer Gástrico (Anexo 2) (18) y por tipos histológicos de acuerdo a la clasificación de Laurén y Jarvi (19).
Los pacientes se consideraron RESECABLES cuando presentaron lesiones S0, S1, S2 ó S3 (cuando se extirpó en bloc el órgano removido); P0 ó P1 ; H0 , H1 (cuando no fue posible resecar la metástasis única); N0 ó N(+).
Los pacientes fueron divididos de acuerdo a la extensión de la linfadenectomía en los siguientes grupos: D0, cuando no se efectuó o hubo remoción incompleta del grupo ganglionar N1; D1, si la disección incluyó sólo los ganglios N1; D2, si incluyó los grupos ganglionares N1 y N2 ; D3 si además incluyó los ganglios linfáticos N3. La gastrectomía radical convencional o estándar (D0/D1), incluyó a las denominadas gastrectomías subtotales radicales para los tumores distales (lesiones pilóricas o antrales), resecciones subtotales altas para las lesiones gástricas medias o pequeñas y gastrectomías totales para tumores gástricos proximales o en lesiones más grandes ubicados en el tercio medio. Estas operaciones incluyeron resección del omento mayor y menor y remoción de los ganglios acompañantes de la arteria gástrica izquierda hasta su origen en el tronco celíaco. La gastrectomía total también incluyó en su mayoría esplenectomía y pancreatectomía distal.
La gastrectomía radical con linfadenectomía extendida (D2/ D3), incluyó remoción hasta un grupo ganglionar por encima del macroscópicamente afectado tal como se consideró durante el acto operatorio. Así, si hubo compromiso ganglionar aparente del grupo N1 Se realizó una disección D2 , y si se advirtió afectación del grupo N2 se efectuó una disección D3.
Se consideró RESECCIÓN CURATIVA, cuando no se encontró metástasis hepática, ni compromiso peritoneal, los límites de sección oral y caudal fueron efectuados a más de 10 mm de la infiltración macroscópica del tumor, el compromiso de la serosa fue S0 - S1 - S2 y la resección gástrica se acompañó de una disección y extirpación del grupo ganglionar siguiente o más allá al compromiso macroscópico. Además cuando cumplidas las condiciones antedichas, la resección ganglionar fue de todas las barreras con infiltración tumoral (N1 , N2 y N3) o cuando el tumor fue S3 pero se pudo resecar en bloc.
La resección se consideró PALIATIVA, si hubo compromiso de órganos por vecindad y no se pudo resecar en bloc el órgano invadido o la totalidad de los grupos ganglionares comprometidos o los márgenes fueron positivos.
ANÁLISIS ESTADÍSTICO
Los datos numéricos fueron presentados en medias + DE. Las tasas de sobrevida actuarial a 5 años fueron calculadas usando el método de Kaplan-Meier. Los decesos en el post-operatorio fueron considerados como muertos con enfermedad neoplásica. Hubo 6 pacientes (4.4%) perdidos de vista durante el seguimiento los cuales junto con los decesos por causas intercurrentes fueron considerados como censurados a partir del último control registrado en la historia clínica o al momento del fallecimiento. La evaluación de los efectos de las variables discretas en la sobrevida fue realizado usando el test de log-rank. Se consideró un valor p < 0.05 como estadísticamente significativo. En el análisis de los datos se utilizó el paquete estadístico SPSS versión 10.0 y EpiInfo versión 2000.
RESULTADOS
Población de pacientes: La edad media de la serie total fue de 58.1± 14.8 años (límites, 20 a 84 años). La presente serie estuvo constituida por 137 pacientes, de los cuales 77 (56.2%) fueron varones y 60 (43.8%) mujeres (proporción M:F, 1.3:1).
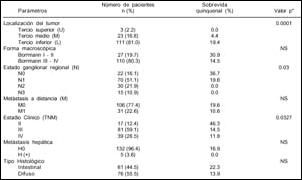
Factores pronósticos de sobrevida. En el análisis univariado, usando el test de log -rank, las siguientes variables estuvieron asociadas significativamente con la sobrevida quinquenal: masa palpable (p= 0.0308), hemoglobina sérica (p= 0.05), localización del tumor (p= 0.0001), estado ganglionar regional (p=0.03), estadio clínico (p=0.0327), tipo de disección ganglionar (p= 0.0366) y la intención de la cirugía (p= 0.000). Así, la ausencia de masa palpable, hemoglobina sérica mayor o igual a 10 g/dl, neoplasias ubicadas en el tercio distal del estómago, estado ganglionar regional N0 - N1, estadio clínico II, disección ganglionar D2-D3 y la cirugía con intención curativa tuvieron mejor sobrevida comparado con aquellos pacientes que tuvieron presencia de masa palpable, hemoglobina sérica menor a 10 g/dl, lesiones neoplásicas localizadas en el tercio superior y medio del estómago, estado ganglionar N2 y N3, estadio clínico III-IV, disección ganglionar D0-D1 y cirugía con intención paliativa. Otros factores evaluados como edad, sexo, tiempo de enfermedad, síndrome de obstrucción de salida gástrica, hemorragia digestiva, tamaño tumoral, forma macroscópica, tumor primario, metástasis a distancia, tipo histológico y tipo de gastrectomía no alcanzaron significancia estadística con relación a la sobrevida actuarial quinquenal (Tablas 1, 2 y 3).
Tasas de sobrevida. La tasa de sobrevida actuarial de toda la serie a los 12, 36 y 60 meses fue de 63.7%, 23.9% y 16.3% respectivamente (Fig. 1).
En el grupo sometido a linfadenectomía D0-D1 (n= 105) la sobrevida actuarial a 1, 3 y 5 años fue de 64.1%, 19.7% y 12.6% respectivamente; en cambio en el grupo sometido a D2-D3 (n= 32) fue de 62.5%, 38.8% y 30.2% respectivamente (p= 0.0366). En los pacientes que tuvieron cirugía con intención curativa (n= 56) la sobrevida actuarial a los 12, 36 y 60 meses fue de 73.2%, 47.2% y 33.4% respectivamente y los que tuvieron resección paliativa (n= 81) fue 56.9%, 7.7% y de 3.1% respectivamente (p= 0.000) (Cuadro 3)
Tabla 1. Factores pronósticos clínicos de pacientes con cáncer
gástrico avanzado con serosa expuesta
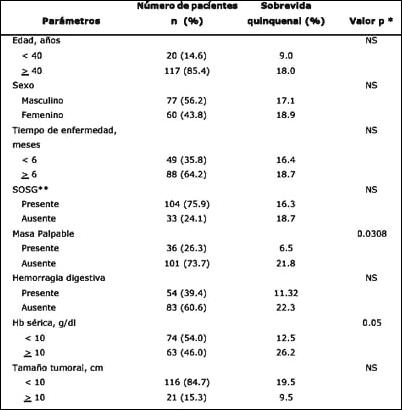
Tabla 2. Factores pronósticos anatomopatológicos de pacientes Tabla 3. Factores pronósticos quirúrgicos de acuerdo al compromiso Figura 1. Curva de sobrevida global en pacientes con carcinoma
con cáncer gástrico avanzado con serosa expuesta
de la serosa en pacientes con
carcinoma gástrico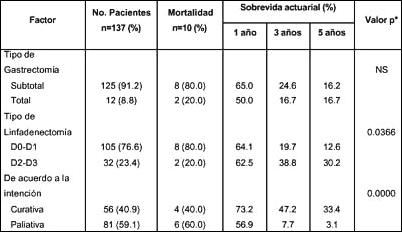
gástrico avanzado con serosa expuesta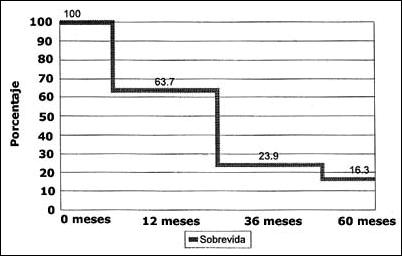
DISCUSIÓN
Según la historia natural del carcinoma gástrico las células neoplásicas se originan en el epitelio glandular de la mucosa, propagándose en su evolución hasta la luz del estómago y/o invadiendo en profundidad las diferentes capas de la pared gástrica (submucosa, muscular propia, subserosa y serosa) e inclusive llegando a infiltrar estructuras vecinas (20). La profundidad de la invasión tumoral en la pared gástrica determina dos estadios evolutivos: el carcinoma gástrico precoz si la neoplasia comprende hasta la submucosa y el carcinoma gástrico avanzado si la neoplasia invade más allá de ésta comprometiendo a la muscular propia, subserosa, serosa expuesta o infiltrando órganos vecinos observándose que a medida que el adenocarcinoma penetra en la pared gástrica invade los vasos linfáticos y sanguíneos condicionando la posibilidad de metástasis linfática y hematógena (20).
El análisis de factores pronósticos en una serie de pacientes proporciona información más útil que la experiencia clínica en las decisiones terapéuticas ya que identifica de manera objetiva que variables inciden significativamente en la sobrevida. Quien decida la atención de manera anárquica sin considerar estos factores probablemente pueda resolver los casos de carcinoma gástrico que le toque atender; sin embargo es más alta la probabilidad que su performance esté siendo ejecutada de manera empírica y sujeta al azar. En esta serie de pacientes, el análisis estadístico de los parámetros clínico patológicos de pacientes con carcinoma gástrico avanzado resecable con serosa expuesta mostró diferencias significativas con respecto a masa palpable, hemoglobina sérica, localización del tumor, estado ganglionar regional, estadio clínico, tipo de linfadenectomía e intención de la cirugía, factores que afectaron las tasas de sobrevida a 5 años.
En el presente trabajo, los pacientes con edades menores de 40 años presentaron una sobrevida quinquenal de 9% en comparación con aquéllos que presentaron edad mayor de 40 años cuya tasa de supervivencia quinquenal fue de 18% aunque no hubo diferencia estadísticamente significativa. Con relación a la edad, existe cierta evidencia que los pacientes jóvenes con carcinoma gástrico tienen un peor pronóstico en relación con los de mayor edad y esto se deba tal vez a que los adultos jóvenes presentan comúnmente tumores clínicamente avanzados que poseen actividad biológica incrementada ya que en su mayoría son carcinomas difusos y además en éstos existe un bajo índice de sospecha, por parte del clínico, para considerar la enfermedad como maligna (21). En la presente serie las tasas de sobrevida quinquenal en varones y mujeres fue de 17.1% y 18.9% (p=NS). Allgayer et al (22) refieren que el sexo femenino se encuentra asociado a un mejor pronóstico en pacientes sometidos a disección D0 con intención curativa; aunque algunos autores (23, 24) coinciden en que no encuentran relación del género con la supervivencia quinquenal. El tiempo de historia digestiva registrada en el presente trabajo mostró que los pacientes con menos de 6 meses de enfermedad tuvieron un similar pronóstico de sobrevida en comparación con los que presentaron mayor tiempo de molestias (16.4% vs 18.7% respectivamente). Por otro lado, se evidenció un mayor porcentaje de pacientes con menos de 10 g/dl de hemoglobina sérica (54%) quienes alcanzaron tasas de sobrevida quinquenal de 12.5% cifra inferior a la encontrada en pacientes que presentaron niveles séricos de hemoglobina mayor o igual a 10 g/dl en la observó una tasa de supervivencia de 26.2% siendo estadísticamente significativo (p= 0.05). Estos bajos niveles de hemoglobina se explicarían porque la mayoría de pacientes con anemia tuvieron lesiones ulceradas (78.1%) que erosionan los vasos sanguíneos lo cual ocasionó pérdida crónica de sangre (25).
En el presente trabajo se encontró que el tamaño tumoral no fue un factor pronóstico significativo aunque su significancia práctica es evidente ya que aquellos pacientes con lesiones menores de 10 centímetros alcanzaron una sobrevida quinquenal de 19.5% en comparación con aquéllas que alcanzaron diámetros tumorales mayor o igual a 10 centímetros quienes solamente obtuvieron tasas de supervivencia de 9.5%. Haugstvedt et al (26) consideran que el valor pronóstico del tamaño del tumor no está bien esclarecido aunque Moriguchi et al (27) señalan que el tamaño del tumor es un factor pronóstico independiente. La masa palpable reconocida en la admisión en el 26.3% del total de nuestros pacientes constituyó un factor de mal pronóstico con respecto a los que no presentaron masa palpable (6.5% vs. 21.8% ; p= 0.0308). Moriguchi et al (28) indican que su presencia muy a menudo está relacionada con enfermedad no curativa ya que al parecer la masa tumoral produce sangrado periulceroso o del lecho neoplásico con la subsecuente disminución de los niveles séricos de hemoglobina. En el presente estudio el 30.6% de los pacientes con masa palpable tuvieron cirugía paliativa.
En la presente serie las lesiones tipo Borrmann I-II presentaron un mejor pronóstico con un tasa de sobrevida quinquenal en comparación con la observada en las lesiones tipo Borrmann III-IV (30.9% vs 14.5% respectivamente; p= NS). Las lesiones ulceradas tienen un mejor pronóstico debido tal vez que síntomas como dolor y hemorragia son bastante comunes en este tipo de lesiones. El pobre pronóstico de lesiones tipo Borrmann IV generalmente está asociado a un carcinoma histológicamente indiferenciado, que compromete extensas áreas de la pared gástrica llegando a ser rígida, con metástasis ganglionares y diseminación peritoneal (29).
Anatómicamente se encontró un mejor pronóstico de sobrevida con aquellas lesiones localizadas en el tercio inferior en comparación con el tercio superior y medio (19.4% vs % 0.0 y 4.4, respectivamente; p= 0.0001) tal vez debido a que los síntomas precoces causados por una obstrucción de salida gástrica condujo a un diagnóstico más temprano el cual se presentó en el 75.9 % de los casos. Algunos autores (30, 31) sugieren que mientras más proximal el tumor peor es la tasa de sobrevida, situación que ha permanecido invariable durante los últimos 35 años. Para explicar esta diferencia, León Barúa et al (32) refieren que esta situación se observa en poblaciones con elevado riesgo para carcinoma gástrico como el Perú donde es bien conocido que al descubrir una lesión neoplásica maligna en la región antropilórica, ésta se da de preferencia en pacientes de mayor edad, generalmente de sexo masculino, el tipo histológico predominante es el intestinal y tiene un relativo mejor pronóstico tal como se evidenció en nuestros resultados.
Cuando estratificamos la sobrevida de nuestros pacientes de acuerdo al compromiso metastásico ganglionar (N) encontramos que los pacientes que no tienen metástasis ganglionar tienen mejor sobrevida (N0: 36.7%); esta sobrevida disminuye progresivamente a medida que el compromiso ganglionar es mayor (N1: 19.6%, N2 y N3: 0%; p= 0.03) lo cual nos muestra que la metástasis ganglionar es un factor pronóstico a tener en cuenta cuando compromete la serosa, hallazgo similar a los informado por Karpeh et al (33) quienes señalan que el número de ganglios positivos es el indicador que mejor define el pronóstico del compromiso ganglionar en la sobrevida actuarial de pacientes con carcinoma gástrico.
Todos los análisis estadísticos multivariados muestran que el estadio clínico es el único y más importante determinante pronóstico (34) (35) (36). Al analizar la tasa de sobrevida encontramos un empeoramiento gradual del pronóstico en relación con el estadio clínico encontrándose mayor sobrevida en el estadio clínico II (46.3%) en comparación con los estadios III y IV (14.5% vs. 11.8%; p=0.0327). Además en nuestro estudio la clasificación histológica de Laurén, no modificó la tasa de supervivencia a 5 años, aunque se apreció una mejor sobrevida en pacientes con lesiones de tipo intestinal en comparación con las que presentaron el tipo difuso (22.3% vs 13.9%; p= NS), ya que los cánceres difusos, a diferencia de los intestinales, a menudo infiltran la pared gástrica extensamente (37). Esto resultados se correlacionan con un estudio de Haraguchi et al (38) quienes encuentran, independientemente del tipo histológico sea del tipo intestinal y/o difuso, una relación inversa entre la extensión de la invasión serosa del carcinoma y el tiempo de sobrevida postoperatorio.
En la presente serie, la tasa de sobrevida a 5 años de 30.2 % conseguida en los pacientes sometidos a linfadenectomía extendida (D2-D3) en pacientes con serosa expuesta, es una cifra comparativamente notable respecto a la de solamente 12.6 % obtenida en aquellos en quienes sólo se efectuó linfadenectomía limitada (DO-D1). El objetivo principal del procedimiento paliativo es liberar al paciente de complicaciones como infección, sangrado, obstrucción, perforación y/o dolor intratable. En la presente serie la tasa de sobrevida a 5 años en el grupo de pacientes con sometidos a cirugía con intención paliativa (n= 81) fue de 3.1 %, en cambio en aqueéllos con resección curativa (n= 56) fue de 33.4%; sin embargo, las tasas de sobrevida en la resección paliativa se han mantenido de 10.4% a 11.2% (39). Akoh y Macintyre (40), al realizar un estudio de la literatura sobre las tasas de sobrevida a 5 años, encuentran una tasa media de 60.5% para los trabajos japoneses y de 39.4% para los no japoneses. Sin embargo, hay controversias sobre la influencia del tipo de resección y linfadenectomía en la supervivencia. Adachi et al (41), no encuentra diferencia significativa en la sobrevida a 5 y 10 años; por el contrario Kodama et al (42) señalan que la tasas de sobrevida luego de disección ganglionar D2-D3 es más alta que la linfadenectomía limitada D0-D1 (39% vs 18% respectivamente; p<0.001).
En vista de la influencia de ciertos factores pronósticos en la sobrevida de pacientes con carcinoma gástrico avanzado con serosa expuesta, los únicos factores que estuvieron estadísticamente relacionados con la sobrevida a largo plazo en el análisis univariado fueron: la ausencia de masa palpable, hemoglobina sérica mayor o igual a 10 g/dl, lesión neoplásica localizada en el tercio distal del estómago, estado ganglionar regional N0 - N1, estadio clínico II, disección ganglionar D2-D3 y la cirugía con intención curativa; parámetros que nos permitirá seleccionar a un determinado grupo de pacientes con las características ya descritas para su estratificación y su posterior tratamiento adyuvante postoperatorio.
REFERENCIAS BIBLIOGRÁFICAS.
1. ALBÚJAR P. El Cáncer en Trujillo, 1991-1995. Estudio de incidencia y mortalidad. Registro de Base Poblacional de la ciudad de Trujillo-Perú. Concytec. Monografía Nro 3. Trujillo 2000; 17. [ Links ]
2. BARBOZA E. Cáncer de estómago. Rev Med Hered 1996; 7: 87-100. [ Links ]
3. DÍAZ-PLASENCIA J, RAZÚRI-ARAUJO R. Factores pronósticos de sobrevida en cáncer gástrico con ganglios regionales negativos. Rev Gastroent Peru 1999; 19: 26-34. [ Links ]
4. KURTZ R, SHERLOCK P. The diagnoses of gastric cancer. Semin Oncol 1985; 12: 11-8. [ Links ]
5. YAMASAKI H, OSHIMA A, MURAKAMI R, ENDO S, UBUKATA T. A long-term follow-up study of patients with gastric cancer detected by mass screening. Cancer 1989; 63: 613-7. [ Links ]
6. LONGO WE, ZUCKER KA, ZDON MJ, MODLIN IM. Detection of early gastric cancer in aggressive endoscopy unit. The American Surgeon 1989; 55: 100-4. [ Links ]
7. ZILIOTTO JRA. Evolutive and prognostic aspects in gastric cancer: analysis of 189 cases. Cancer 1987; 39: 811-7. [ Links ]
8. MORIGUCHI S, MAEHARA Y, KORENAGA D, et al. Relationship between age and the time surgery and prognosis after gastrectomy for gastric cancer. J Surg Oncol 1993; 52: 119-123. [ Links ]
9. OKA M, YOSHINO S, HAZAMA S, et al. Prognostic significance of regional lymph node reaction after curative resection of advanced gastric cancer. Br J Surg 1992; 79: 1091-94. [ Links ]
10. MARUYAMA K. Results of surgery correlated with staging. In: Preece PE, Cuschiere A, Wellwood JM (eds). Cancer of the stomach. London: Grune and Strution; 1986.p. 145-63. [ Links ]
11. CURTIS RE, KENNEDY BJ, MYERS MH, HANKEY BF. Evaluation of AJC stomach cancer staging use the SEER population. Semin Oncol 1985; 12: 21-31. [ Links ]
12. NAKAZATO H, KATO O, YAMAUCHI M, YAMADA E. An analysis of prognostic variables in gastric cancer patients treated surgically. J Jpn Soc Cancer Ther 1981; 16: 121-3. [ Links ]
13. BOKU T, NAKANE Y, MINOURA T, TAKADA H, YAMAMURA M, HIOKI K, YAMAMOTO M. Prognostic significance of serosal invasion and free intraperitoneal cancer cells in gastric cancer. Br J Surg 1990; 77: 436- 439. [ Links ]
14. MARUYAMA K. The most important prognostic factors for gastric cancer patients. A study using univariate and multivariate analyses. Scand J Gastroenterol 1987; 22 (Suppl 133): 63-8. [ Links ]
15. RUIZ E, QUISPE D, CELIS J, BERROSPI F, PAYET E. Cáncer gástrico con invasión hasta la muscular propia. Rev Gastroent Peru 2001; 21: 102-106. [ Links ]
16. International Union Against Cancer. TNM - Classification of malignant tumors. En: Sobin LH, Wittekind Ch, Eds. Stomach. 5th. ed. New York : Willy - Liss; 1997. p. 59 - 62. [ Links ]
17. BORRMANN R. Gesch wulste des magens und duodenums. In : Honke F, Lubarsh O. Hanbuch der speziellen pathologischen anatomic und histologic. Berlin : J Springer; 1926. p. 812 - 1054. [ Links ]
18. Japanese Research Society for Gastric Cancer. Japanese Classification of Gastric Carcinoma. 2sd. ed. Tokyo : Kanehara and Co; 1998. p. 10-24. [ Links ]
19. LAUREN P. The two histology main types of gastric carcinoma : Diffuse and so - called intestinal type carcinoma : An attempt at histo - clinical classification. Acta Pathol Microbial Scand 1965; 64 : 31 - 49. [ Links ]
20. RUIZ E, QUISPE D, CELLS J, BERROSPI F, PAYET E. Cáncer gástrico con invasión hasta la muscular propia. Rev Gastroent Peru 2001; 21: 102-106. [ Links ]
21. MAEHARA Y, OSHIRO T, OIWA H, ODA S, BABA H, AKAZAWA K, et al. Gastric carcinoma in patients over 70 years of age. Br J Surg 1995; 82: 102 - 105. [ Links ]
22. ALLGAYER H, HEISS MM, SCHILDBERG FW. Prognostic factors in gastric cancer. British Journal of Surgery 1997; 84: 1651-1664. [ Links ]
23. MAEHARA Y, WATANABE A, KAKEJI Y, EMI Y, MORIGUCHI S, ANAI H, et al. Prognosis for surgically treated gastric cancer patients is poorer for women than men in all patients under age 50. Br J Cancer 1992; 65: 417 - 20. [ Links ]
24. SÁNCHEZ-BUENO F, GARCÍA-MARCILLA JA, PÉREZ-FLORES D, PÉREZ-ABAD JM, VICENTE R, ARANDA F, RAMÍREZ P, PARRILLA P. Prognostic factors in a series of 297 patients with gastric adenocarcinoma undergoing surgical resection. Br J Surg 1998; 85 : 255 - 60. [ Links ]
25. SIEWERT JR, BOTTCHER K, STEIN HJ, et al. Relevant prognostic factors in gastric cancer 1998; Annals of surgery 1998; 228: 449-461. [ Links ]
26. HAUGSTVEDT TK, VISTE A, EIDE GE, et al. Norwegian multicentre study of survival and prognostic factors in patients undergoing curative resection for advanced gastric carcinoma. J Clin Gastroenterol 1995; 21:208-10. [ Links ]
27. MORIGUCHI S, MAEHARA Y, KORENAGA D, et al. Prediction of survival time after curative surgery for advanced gastric cancer. Eur J Surg Oncol 1992; 18:287-92. [ Links ]
28. MORIGUCHI S, MAEHARA Y, KORENAGA D, et al. Relationship between age and the time of surgery and prognosis after gastrectomy for gastric cancer. J Surg Oncol 1993; 52: 119-123. [ Links ]
29. KIM DY, KIM HR, KIM YJ, KIM SK. Clinicopathological features of patients with Borrmann type IV gastric carcinoma. ANZ J Surg 2002; 72: 739-742. [ Links ]
30. MICHELASSI F, TAKANISHI DM JR, PANLATONE D, HART J, CHAPELL R, BLOCK GE. Analysis of clinicopathologic prognostic features in patients with gastric adenocarcinoma. Surgery 1994: 116: 804 - 10. [ Links ]
31. SALVON-HARMAN JC, CADY B, NIKULASSON S, KHETTRY U, STONE MD, LAVIN P. Shifting proportions of gastric adenocarcinomas. Arch Surg 1994; 129 : 381- 9. [ Links ]
32. LEÓN BARÚA R, RECAVARREN-ARCE S, GILMAN RH, BERENDSON R. Can eradication of Helicobacter pylori prevent gastric cancer?. Drugs 1993; 46: 341-346. [ Links ]
33. KARPEH MS, LEON L, KLIMSTRA D, BRENNAN MF. Lymph node staging in gastric cancer: is location more important than number?. Annals of Surgery 2000; 232: 362-371. [ Links ]
34. ARVEUX P, FAIORE J, BOUTRON MC, PIARD F, DUSSURRE - GUION L, MONNET E, et al. Prognosis of gastric carcinoma after curative surgery. A population based study using multivariate crude and relative survival analysis. Dig Dis Sci 1992; 37: 757 - 63. [ Links ]
35. SHIU MH, PERROTTI M, BRENNAN MF. Adenocarcinoma of the stomach: a multivariate analysis of clinical, pathologic and treatment factors. Hepatogastroenterology 1989; 36 : 7 -12. [ Links ]
36. ADACHI Y, KAMATURA T, MORI M, BABA H, MAEHARA Y, SUGIMACHI K. Prognostic significance of the number positive lymph nodes in gastric carcinoma. Br J Surg 1994; 81: 414-16. [ Links ]
37. CLENDENES ALVARADO D, COK GARCÍA J, BUSSALLEU RIVERA A. Tipos histológicos de cáncer gástrico de acuerdo a la clasificación de Lauren en el Hospital Nacional Cayetano Heredia. Rev Gastroent Peru 1995; 15: 239-246. [ Links ]
38. HARAGUCHI M, WATANABE A, KAKEJI Y, et al. Prognostic significance of serosal invasión in carcinoma of the stomach. Surg Gynecol Obstet 1991; 172: 29-32. [ Links ]
39. KINOSHITA T, MARUYAMA K, SASAKO M, OKAJIMA K. Treatment results of gastric cancer patients: Japanese experience. In: Nishi M, Ichikawa H, Nakajima T, eds. Gastric cancer. Tokyo: Springer-Verlag; 1993: 319-330. [ Links ]
40. AKOH J, MACINTYRE I. Mejora de la supervivencia en el cáncer gástrico: Revisión de las tasas de supervivencia a 5 años en publicaciones en lengua inglesa desde 1970. Br J Surg 1992; 79: 293-299. [ Links ]
41. ADACHI Y, KAMAKURA T, MORI M, MAEHARA Y, SUGIMACHI K. Role of lymph node disecction and splenectomy in node-positive gastric carcinoma. Surgery 1994; 116: 837-841. [ Links ]
42. KODAMA Y,SUGIMACHI K, SOEJIMA K, et al. Evaluation of extensive lymph node dissection for carcinoma of the stomach. World J Surg 1981; 5: 241-248. [ Links ]