Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.24 n.3 Lima jul./set. 2004
TRABAJOS ORIGINALES
Morbilidad post operatoria y mortalidad intra-hospitalaria de la gastrectomía por adenocarcinoma gástrico: análisis de 50 años
Eloy Ruiz1; Carlos Payet2; Juan Antonio Montalbetti2; Juan Celis3; Eduardo Payet1; Francisco Berrospi1; Iván Chávez1; Frank Young1
1 Médico asistente
2 Consultor del Departamento de Abdomen.
3 Jefe de Departamento de Abdomen.
Departamento de Abdomen de Instituto de Enfermedades Neoplásicas Lima-Perú
RESUMEN
Con la finalidad de determinar la morbilidad post-operatoria y la mortalidad intra- hospitalaria de la gastrectomía por cáncer gástrico se revisaron las historias clínicas de todos los pacientes incidentes con diagnóstico histológicamente comprobado de adenocarcinoma del estómago que entre enero de 1950 y diciembre de 1999 tuvieron una gastrectomía en el Instituto Nacional de Enfermedades Neoplásicas.
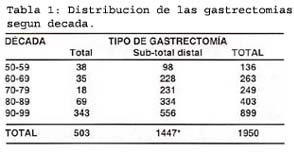
En este periodo se realizaron 2033 gastrectomías de las cuales 503 fueron gastrectomías totales y 1447 gastrectomías sub-totales distales.
La morbilidad post-operatoria de la gastrectomía total y gastrectomía sub-total distal disminuyó de 23.7% y 14.3% en la década del 50 a 19.8% y 7.4% en la década del 90 respectivamente, la mortalidad intra-hospitalaria de la gastrectomía total y gastrectomía sub-total disminuyó de 28.9% y 19.4% en los años 50 a 4.4% y 2.2 % en los 90.
Las complicaciones más frecuentes fueron las fístulas esófago-yeyunal, gastro-yeyunal y duodenal, las infecciones respiratorias, los abscesos intra-abdominales, la fístula pancreática, la obstrucción intestinal temprana, la hemorragia de la anastomosis y la infección de herida operatoria.
Por análisis de regresión logística multivariado los factores de riesgo para mortalidad intra-hospitalaria de la gastrectomía total fueron la hipo albuminemía, la transfusión sanguínea intra operatoria y la reoperación ( OR de 2.4, 5.9 y 17.4 respectivamente). Para la gastrectomía sub-total distal los factores de riesgo para mortalidad intra- hospitalaria fueron la hipo-albuminemía, la transfusión sanguínea intra-operatoria , la extirpación del bazo y la reoperación (OR de 2.6, 2.46, 2.42 y 6.3 respectivamente.)
Según nuestros resultados el riesgo de mortalidad intra-hospitalaria depende mas de las variables peri-operatorias (hipoalbuminemía, transfusión sanguínea intra-operatoria, esplenectomia y reoperación) que de las variables peri-operatorias que el cirujano no puede controlar (edad, sexo, estadio clínico , etc).
Palabras claves: Adenocarcinoma gástrico, Gastrectomía, Morbilidad post operatoria, Mortalidad intra-hospitalaria
SUMMARY
Objective: Determine the postoperative morbidity and in-hospital mortality of gastrectomy due to gastric cancer.
Method: The study involved the review of the clinical records of all patients with histologically confirmed diagnostic of gastric adenocarcinoma, which underwent a gastrectomy at the Peruvian Institute of Neoplastic Diseases between January 1950 and December 1999. During that period, 2,033 gastrectomies were performed, 503 of which were total gastrectomies and 1,447 were distal subtotal gastrectomies.
Postoperative morbidity of total and distal subtotal gastrectomy dropped from 23.7% and 14.3% during the 1950 decade, to 19.8% and 7.4% during the 1990 decade,respectively, while the in-hospital mortality of total and subtotal gastrectomy dropped from 28.9% and 19.4% during the 50s to 4.4% and 2.2% during the 90s.
The most common complications were the esophagojejunal, gastrojejunal and duodenal fistulas, respiratory infections, intra-abdominal abscesses, pancreatic fistula, early intestinal obstruction, hemorrhage from the anastomosis site and surgical site infection.
Results:Multivariatelogisticsregressionanalysisshowedthattheriskfactorsforin-hospital mortality of total gastrectomy were hypoalbuminemia, intraoperative blood transfusion and re-resection (OR: 2.4, 5.9 and 1.7, respectively). For distal subtotal gastrectomy, the risk factors for in-hospital mortality were hypoalbuminemia, intraoperative blood transfusion, splenectomy and re-resection (OR: 2.6, 2.46, 2.42 and 6.3, respectively).
Conclusions: Based on our results, the in-hospital mortality risk depends on the postoperative variables (hypoalbuminemia, intraoperative blood transfusion, splenectomy and re-resection) more than on the pre-operative variables, beyond the surgeons control (age, sex, clinical stage, etc.).
Key words: Gastric adenocarcinoma, gastrectomy, postoperative morbidity, In hospital mortality.
INTRODUCCIÓN
Para el adenocarcinoma gástrico localizado (precoz o avanzado) la extirpación completa del tumor sin dejar enfermedad residual es el tratamiento de elección; Para cumplir este objetivo se debe necesariamente obtener bordes de sección libres de neoplasia y resecar todos los grupos ganglionares potencialmente comprometidos. (1-5)
Respecto a los bordes de sección, de acuerdo a la experiencia acumulada por los Japoneses (4) la distancia mínima entre el borde macroscópico del tumor y la línea de sección debe ser de 2 cm para el carcinoma precoz, 3 cm para el cáncer localizado (Borrmann I y II) y mayor de 5 cm para el carcinoma infiltrativo (Borrmann III y IV).
En relación a la disección ganglionar se recomienda realizar al menos una linfadenectomía D2 lo cual implica de acuerdo a las reglas dictadas por la sociedad Japonesa para el estudio del cáncer gástrico (5) la extirpación completa de los grupos ganglionares de la primera y segunda estación.
Dependiendo de la localización, tamaño y profundidad de invasión del tumor (T) ambos objetivos pueden lograrse mediante una gastrectomía total D2, una gastrectomía sub-total distal D2 o una gastrectomía sub-total proximal D2.
A pesar de las mejoras en los cuidados peri-operatorios, suturas y técnica quirúrgica, la mortalidad post-operatoria de la gastrectomía en series occidentales de la última década es aun elevada (4% a 11.4% ) (22), sin embargo en publicaciones japonesas, la mortalidad post operatoria es inferior al 2% (8) (9) (12), inclusive se ha reportado 1000 gastrectomías consecutivas sin mortalidad post-operatoria (10).
En el Perú el cáncer gástrico es la neoplasia maligna más frecuente en varones y la tercera en mujeres (18). Un porcentaje importante de estos pacientes han sido tratados en el Instituto de Enfermedades Neoplásicas (INEN), entidad que desde su creación en 1950 lleva un cuidadoso archivo de las historias clínicas de todos los pacientes que tuvieron gastrectomía por esta neoplasia.
En este trabajo se analizarán las historias de los pacientes que tuvieron gastrectomía por cáncer gástrico en el INEN entre 1950 y 1999 con el propósito de:
-Determinar las tasas, tipo y tendencias de la morbilidad post-operatoria
-Determinar las tasas, tipo y tendencias de la mortalidad intra-hospitalaria
-Identificar cuales son los factores de riesgo asociados a la mortalidad por gastrectomía.
MATERIAL Y METODOS
Se revisaron las historias clínicas de todos los pacientes con adenocarcinoma gástrico admitidos al INEN entre enero de 1950 y diciembre de 1999, seleccionándose aquellas que correspondían a pacientes que tuvieron una gastrectomía total o sub total distal.
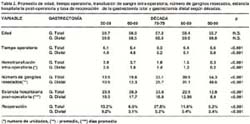
De las historias clínicas seleccionadas se obtuvo información respecto a: edad, sexo, hemoglobina y albúmina pre-operatorias, fecha de la intervención, tipo de gastrectomía, total de ganglios resecados, hemotransfusión intra-operatoria, extirpación de bazo y/o páncreas, resección en bloque de órganos adyacentes infiltrados por tumor, enfermedad residual, tipo de sutura empleado en la anastomosis esófago-yeyunal, tiempo operatorio, TNMp, tipo de morbilidad post-operatoria, causa de mortalidad por gastrectomía y fecha de alta o muerte.
Los datos obtenidos fueron codificados y transferidos a una base de datos confeccionada en Foxpro 2.6
Definición operacional.
-Gastrectomía sub-total distal: Si se extirpo los dos tercios dístales del estómago (antro y cuerpo).
-Gastrectomía total: Si se reseco todo el estómago.
-Extensión de la disección linfática de acuerdo a las reglas de la sociedad japonesa para el estudio del cáncer gástrico (5).
D0: Si no se resecó ningún grupo ganglionar.
D1: Si se resecó completamente la primera estación ganglionar.
D2: Si se resecó completamente la primera y segunda estación ganglionar.
-Resección en bloque: Cuando para poder obtener bordes de sección libres se resecó en conjunto con el estómago los órganos adyacentes infiltrados por la neoplasia. (p.e.: colon, páncreas, hígado, etc.)
-Enfermedad residual (R) de acuerdo la clasificación de la UICC (12) en:
RO: Ausencia de enfermedad residual.
R1: Enfermedad residual microscópica.
R2: Enfermedad residual macroscópica
-Tiempo operatorio: Tiempo en horas transcurrido entre la inducción de la anestesia y el término de la cirugía.
-TNMp: TNM obtenido de la integración de los hallazgos operatorios y el informe de patología (12).
-Estancia hospitalaria post-operatoria: El tiempo en días transcurrido entre la fecha de la cirugía y la fecha de alta o muerte del paciente.
-Morbilidad post-operatoria: Todos los casos de complicaciones post operatorias intermedias y mayores.
Complicación intermedia: Aquella que prolongó la estancia hospitalaria post-operatoria pero no constituyó amenaza para la vida del paciente.
Complicación mayor: La que prolongó la estancia hospitalaria post-operatoria, puso en riesgo la vida del paciente o produjo su muerte.
Convencionalmente la morbi-mortalidad post-operatoria fue agrupada en:
a) Complicaciones directamente relacionadas al procedimiento quirúrgico p.e.: Fístulas, abscesos intra-abdominales, pancreatitis, etc.
b) Complicaciones médicas relacionadas a la cirugía p.e.: Neumonías, infección del tracto urinario, etc.
-Mortalidad intra-hospitalaria: la muerte producida por complicaciones quirúrgicas, independiente del tiempo en que ocurra (30 días<= muerte > 30 días).
ANÁLISIS ESTADÍSTICO
Se evaluó el efecto de las variables clínico patológicas en la ocurrencia de la morbilidad post operatoria y mortalidad intra hospitalaria mediante las pruebas del Chi cuadrado (variables discretas), T de Students (variables continuas) y/o log rank test. (análisis univariado para series temporales)
Las variables clínico-patológicas que en el análisis univariado tuvieron efecto significativo (p<0.05) fueron comparadas en conjunto mediante análisis multivariado de regresión logística. (13)
Para la confrontación de variables se utilizo SPSS 11.
RESULTADOS
Entre enero de 1950 y diciembre de 1999, 6270 pacientes incidentes con diagnóstico histológico de adenocarcinoma gástrico fueron admitidos al Departamento de Abdomen del Instituto Nacional de Enfermedades Neoplásicas de Lima - Perú.
De este total, al momento del diagnostico, 2544 pacientes tuvieron un cáncer gástrico diseminado y fueron considerados inoperables, 1693 pacientes tuvieron un tumor irresecable y 2033 pacientes un tumor resecable.
En los pacientes con tumor resecable se realizaron: 1448 gastrectomías sub-totales distases, 503 gastrectomías totales y 51 gastrectomías proximales, en 32 pacientes no se pudo precisar el tipo gastrectomía.
La distribución del número de gastrectomías por década se muestra en la tabla 1.
De los 1447 p. sometidos a Gastrectomía sub-total distal un paciente falleció por paro cardiaco intra operatorio por lo cual ha sido excluido del análisis, en lo sucesivo el número de gastrectomías sub-totales distales será de 1446 .
En estas 5 décadas tanto para la gastrectomía total como para la gastrectomía sub total distal el promedio de edad no ha variado significativamente. Han disminuido el tiempo operatorio, el número de unidades de sangre transfundidas en el intra-operatorio, la estancia hospitalaria y la tasa de reoperación. Asimismo se ha incrementado significativamente el número de ganglios resecados (Tabla 2)
La morbilidad post-operatoria de la gastrectomía total y gastrectomía distal disminuyen de 23.7% y 14.3% en la década de los años 50 a 19.8% y 7.4% en la década de los 90 (Tabla 3).
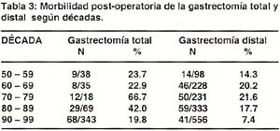
Las complicaciones post operatorias (directamente relacionadas a la cirugía y medicas) se muestran en las tablas 4 y 5.
La mortalidad intra-hospitalaria de la gastrectomía total y gastrectomía sub-total han disminuido de 28.9% y 19.4% en la década de los años 50 a 4.4% y 2.2% en los años 90 respectivamente (Tabla 6).
Las causas de mortalidad intra-hospitalaria de la gastrectomía total y sub-total se muestran en la Tabla 7.
Para la gastrectomía total según análisis de regresión logística multivariado la hipo-albuminemía pre operatoria, la transfusión sanguínea intra-operatoria y la reoperación fueron factores de riesgo para mortalidad intra-hospitalaria, mientras que para la gastrectomía sub-total distal se asocia a los factores ya descritos la esplenectomia. Tabla 8.
DISCUSIÓN
La gastrectomía por cáncer es una operación compleja que históricamente ha tenido una alta morbi-mortalidad (14) (15). Los primeros pacientes que fueron sometidos a este procedimiento en 1879 y 1880 por Jules Pean y Rydygier respectivamente, fallecieron en el post-operatorio inmediato.
El 29 de Enero de 1881 Theodor Billroth realizó en Therese Heller, quien tenia un tumor pilórico, la primera gastrectomía con sobreviva post operatoria, para restituir el transito intestinal se anastomoso el estómago remanente al duodeno, reconstrucción que actualmente se conoce como Billroth I. la paciente falleció 4 meses después por metástasis hepática. (16).
En 1885 luego de realizar una resección más amplia Billroth cerró el muñón duodenal y anastomosó el yeyuno al muñón gástrico, (reconstrucción tipo Billrtoh II). Para 1897 este brillante cirujano y sus pupilos habían realizado 46 resecciones gástricas con una mortalidad post operatoria de 35% (16).
La primera gastrectomía total con sobreviva post-operatoria fue efectuada por Karl Schlatter en 1897 (16), posteriormente la gastrectomía por cáncer gástrico fue aceptada por la comunidad médica y su uso se difundió a los demás países europeos y al continente americano.
En el Perú, según la tesis Doctoral del Dr. Sánchez Huaco (17) la primera gastrectomía sub-total distal con sobreviva post operatoria fue realizada en 1904 por el Dr. Juvenal Denegri; posteriormente en 1950 el Dr. L. Gurmendi (17) realiza la primera gastrectomía total con sobreviva post operatoria.
En el INEN la primera gastrectomía sub-total fue realizada el 10 de mayo de 1950 por los doctores Luis Esteves y R. Mazzetti, posteriormente el 15 de octubre de 1952 los Drs. Carlos Payet G. y Alberto Sabogal ejecutaron la primera gastrectomía total, ambos pacientes sobrevivieron al post operatorio pero fallecieron por progresión de la enfermedad.
Entre 1950 y 1999 en el INEN se han realizado dos mil treinta y tres gastrectomías, lamentablemente esta cifra representa sólo el 32.42 % de todos los pacientes admitidos por cáncer gástrico
De estas 2033 gastrectomías sólo analizamos 1950 casos (503 gastrectomías totales y 1447 gastrectomías sub-totales distales), no incluimos las gastrectomías sub-totales proximales y aquellas en las que no se pudo precisar el tipo.
En estas 5 décadas de estudio se observan claramente dos tendencias:
1. Aumento constante del número de gastrectomías.
2. Disminución significativa de la morbilidad post-operatoria y de la mortalidad intra-hospitalaria
El incremento en el número de gastrectomías por década pese a que la incidencia del cáncer gástrico ha disminuido desde 1968 en 40% y 27% para hombres y mujeres respectivamente (18) (19), se debe probablemente al incremento de la población nacional, en 1950 el Perú tenia 7633,000 habitantes cifra que aumento a 26 millones en 1999 (19).
Nuestras cifras de morbilidad son semejantes a las publicadas por otros autores, pero al tratar de contrastarlas nos hemos encontrado con la dificultad que no se especifica con claridad la definición de morbilidad y no se estratifica en función del tipo de gastrectomía (Total y Sub total) pese a ser operaciones de diferente riesgo operatorio y complejidad.
Encontramos la misma dificultad al tratar de contrastar nuestra mortalidad a consecuencia de una gastrectomía, la mayoría de series publicadas agrupa la mortalidad de la gastrectomía total y gastrectomía sub-total distal en un sólo resultado, con el inconveniente adicional de que no hay una definición consensual de mortalidad debido a gastrectomía. Las definiciones encontradas incluyen: muerte hasta los 30 días, muerte intra hospitalaria, fallecimiento como resultado directo de la operación y muerte hasta 3 meses. (15)
En nuestro estudio hemos adoptado la definición de mortalidad intra-hospitalaria la cual considera como muerte debida a la cirugía a cualquier fallecimiento secundario a complicaciones de la gastrectomía, independiente del tiempo en que ocurra.
La mortalidad intra- hospitalaria puede ser hasta un 50% más alta que la mortalidad a 30 días (22), pero es definitivamente una medida más exacta. En la definición de mortalidad a los 30 días, si un paciente fallece en el trigésimo primer día, esta muerte no se reporta como debida a la cirugía. Por ejemplo en nuestra serie entre 1980 y 1989 la mortalidad post operatoria (30 días) de la gastrectomía total fue de 0% pero la mortalidad intra-hospitalaria fue de 11.1 % (Tabla 6 ).
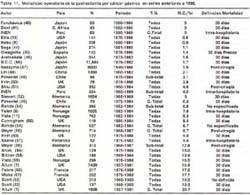
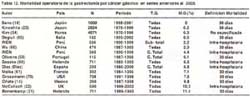
Esclarecidos estos aspectos y con la finalidad de poder comparar nuestros resultados con la literatura mundial, hemos agrupados las series que hemos revisado en aquellas cerradas antes de 1970, 1980, 1990 y 2003, de cada serie revisada se consigna el autor, el país , el número de casos, el tipo de gastrectomía, la tasa de mortalidad y su definición. (Tablas 9, 10, 11,12). Es necesario tener en cuenta que las series analizadas reportan estudios que se iniciaron y terminaron en años diferentes, pero al agruparlas por el año de cierre nos permite indirectamente obtener información de la mortalidad de la década.
La Tabla 12 abarca hasta el año 2003 debido a que existen tres importantes trabajos (10) (65) (22) que terminaron el 2002.
En las Tablas 9,10,11,12 se aprecia que la tasa de mortalidad luego de una gastrectomía tiene un rango muy amplio. Por ejemplo va de 3.8% a 28.7% para series anteriores a 1970, de 1.5% a 37.2% para series anteriores a 1980, de 0% a 30.7% para series anteriores a 1990 y de 0% a 11.4% para series anteriores al 2003.
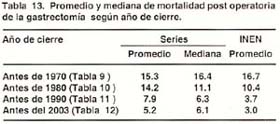
Con la finalidad de tener una tasa que nos indique indirectamente la mortalidad post- operatoria global de las series de cada periodo, ordenamos las series de cada tabla en forma ascendente respecto a la mortalidad, pudiendo de esta forma obtener la mediana y el promedio de dicho lapso de tiempo tal como lo sugiere Macintyre (15)
En general se observa una disminución progresiva de la mortalidad post operatoria de un promedio de 15.3% para los estudios publicados antes de 1970 a un 5.2% para las series publicadas antes del 2003. Las cifras de mortalidad del INEN a partir de los años 70 esta por debajo del promedio del periodo pese a ser mortalidad intra-hospitalaria. (tabla13)
Nuestros resultados sin embargo son inferiores a los reportados en las series japonesas las cuales se caracterizan por un gran número de casos y su mortalidad cercana a cero, esta diferencia respecto a la series occidentales ha sido siempre tan grande que se ha postulado que la biología y la historia natural del cáncer gástrico en Japón es diferente, pero es más probable que esta diferencia se deba a la alta proporción de cáncer temprano y a que los pacientes japoneses tienen en promedio 10 años menos de edad que los pacientes occidentales y por lo tanto tienen una baja incidencia de enfermedades coronarias, cerebro-vasculares y pulmonares. (15)
Por análisis de regresión logística encontramos que los factores de riesgo para mortalidad intra-hospitalaria de la gastrectomía total fueron la hipo-albuminemia, la transfusión sanguínea intra-operatoria y la reoperación, mientras que para la gastrectomía sub-total distal se adiciona a los factores ya mencionados la esplenectomía
Otros estudios que también emplean análisis de regresión logística para determinar los factores de riesgo de la mortalidad post-operatoria reportan resultados diferentes. Wu (66) por ejemplo en 474 gastrectomías encuentra que son factores de riesgo la edad, la extensión de la cirugía, la resección combinada de órganos, la localización del tumor, la enfermedad respiratoria, el tiempo operatorio y la perdida sanguínea intra-operatoria.
Sasako (69) en un estudio prospectivo randomizado en 711 pacientes que compara disección ganglionar D1 vs. disección ganglionar D2 halla que la extensión de la disección, la esplenectomía, el sexo y la edad están relacionados con la mortalidad post-operatoria.
Díaz (71) en 203 pacientes sometidos a gastrectomía total reporta que la dehiscencia de la anastomosis esófago-yeyunal, los abscesos intra-abdominales y la reoperación estuvieron asociados con un incremento de la mortalidad post-operatoria
Estas discrepancias pueden ser explicadas por que tanto Wu (66) como Sasako (69) agrupan la mortalidad de la gastrectomía total y gastrectomía sub-total distal pese a ser operaciones con riesgos y técnicas diferentes, ambos consideran que la edad es uno de los factores de riesgo más importantes, sin embargo análisis recientes (7) a similitud nuestra serie muestran que la mortalidad post operatoria de la gastrectomía no esta influida por la edad, esto corrobora lo encontrado en un estudio previo (72) en el que hallamos que mortalidad intra- hospitalaria de los pacientes mayores de 70 años sometidos a gastrectomía total no difiere de la mortalidad intra-hospitalaria de los pacientes jóvenes (4.6% vs. 2,2 respectivamente; p>0.05).
Aunque no se ha demostrado convincentemente el beneficio de la disección ganglionar en la sobrevida a 5 años, la mayoría de los cirujanos considera la gastrectomía tipo D2 (Remoción completa de los ganglios de la primera y segunda estación) como el tratamiento estándar, inclusive se ha establecido en 25 ganglios el número mínimo de ganglios linfáticos que deben ser resecados para que una gastrectomía sea considerada como D2. (52) (65) (87) (88)
Según los controles de calidad (Número de ganglios reportados en el informe anátomo patológico), en el INEN la gastrectomía D2 se viene realizando desde 1970, en la última década se ha resecado en promedio 54.3 y 40.6 ganglios para la gastrectomía total y gastrectomía sub-total distal respectivamente, lo que certifica que en nuestra institución se realiza actualmente una disección ganglionar D2 ya que el número de ganglios resecados es mayor al mínimo requerido (25 ganglios) (52).
La disección ganglionar D2 no aumenta la mortalidad intra-hospitalaria ni constituye, a diferencia de lo reportado por Wu (66) y Sasako (69) un factor de riesgo para muerte post-operatoria. Según nuestros resultados desde 1970 a pesar de un aumento en el número de ganglios resecados a consecuencia de una linfadenectomía mas radical no se observa un aumento de la mortalidad intra-hospitalaria, por en contrario hay una disminución de la misma. Recientemente Degiuli (65) ha publicado el primer estudio prospectivo randomizado realizado en occidente en el que la mortalidad de la disección D2 no difiere de la disección D1.
La reoperación es el factor de riesgo para mortalidad intra-hospitalaria más importante, sin embargo pese a la elevada mortalidad la reoperación no tiene una contraindicación absoluta ya que es la única posibilidad de recuperar al paciente complicado en quien las medidas médicas no han dado resultado.
Debido a que la tasa de mortalidad de la reoperación es de 10 a 40% si un órgano esta en falla, de 53% si se trata de 2 órganos y de 79 a 100% si son 3 los órganos o sistemas en falla (73), se debe reoperar precozmente a los pacientes que así lo requieran (pacientes con necrosis del muñón gástrico, hemorragia intra abdominal masiva o peritonitis, etc.) para evitar que el paciente entre al quirófano en falla orgánica multi-sistémica. (82) (83), pero evidentemente es más importante prevenir y evitar las complicaciones que conlleven a una reintervención.
Las fístulas son las complicaciones más frecuentes relacionadas directamente con la cirugía, de estas la fístula esófago-yeyunal se presenta hasta en el 15% de las gastrectomías totales (10) (74), 6% en nuestra serie. Su manejo es complejo, prolongado y usualmente implica el uso de nutrición parenteral total. La anastomosis esófago yeyunal tiene un alto riesgo de fístula por que se realiza en un campo operatorio profundo y estrecho que limita la maniobrabilidad del cirujano. Con la finalidad de facilitar la ejecución de la anastomosis y disminuir el riego de dehiscencia desde 1980 se emplean grapadoras mecánicas (Staplers) como una alternativa a la sutura manual.
Los estudios que comparan ambas técnicas son controversiales, mientras que algunos autores señalan que la introducción de las grapadoras fue el factor más importante en la reducción de la tasa de fístula esófago yeyunal, otros señalan que su incidencia es similar en ambas técnicas y cuestionan el uso de la sutura mecánica por su elevado costo y la mayor tasa de estenosis postoperatoria (10) (74).
En el INEN la primera anastomosis esófago-yeyunal con sutura mecánica fue realizada en enero de 1986, desde entonces esta anastomosis se ha hecho indistintamente en forma manual o mecánica. En un análisis publicado (75) encontramos que la tasa global de fístula esófago-yeyunal no difirió significativamente entre ambas técnicas (4.1 % para sutura mecánica en 197 pacientes vs. 2.4 % para sutura manual en 170 pacientes), cuando se analizó la tasa de fístula esófago-yeyunal por periodos hallamos que entre 1986 y 1989 el 15% de las anastomosis mecánicas y el 11% de las anastomosis manuales tuvieron dehiscencia, pero para el periodo 1995-1999 la incidencia de fístula esófago-yeyunal había disminuido a 0.7% para sutura mecánica y a 1.9% para sutura manual.
La mortalidad a consecuencia de una fístula esófago-yeyunal en nuestra serie es del 33%, para el mismo periodo otros autores reportan una mortalidad que varia desde un 36.4% (76) hasta un 52% (78). Reportes últimos muestran que la mortalidad a consecuencia de la fístula esófago yeyunal ha disminuido a 7.2% (74).
La fístula gastro-yeyunal tiene una mortalidad de 56.6%, fue frecuente entre 1950 y 1970, pero en la década del 90 ningún paciente presentó esta complicación, probablemente a consecuencia de un mejor dominio de la técnica y mejores suturas.
La fístula duodenal generalmente se presenta en pacientes en quienes por infiltración del píloro o duodeno fue necesario ampliar el borde de sección distal, quedando un muñón duodenal corto difícil de cerrar, su manejo requiere NPT y análogos de la sandostatina, esta fístula se puede evitar realizando un cuidadoso afrontamiento de los bordes del duodeno o en caso de muñón difícil recurriendo al uso de grapadoras metálicas.
La fístula de la yeyunostomía es una complicación infrecuente pero grave y tiene una mortalidad de 25%, ocurre cuando el catéter se retira antes de que se haya formado un trayecto fistuloso entre el intestino y la pared abdominal. Puede prevenirse fijando el asa yeyunal a la pared abdominal y retirando el catéter después de las 4 semanas, actualmente el uso de la yeyunostomía para alimentación post-operatoria es discutible y se tiende a reemplazarla por sondas nasoyeyunales.
Independiente del tipo de anastomosis el riesgo de dehiscencia disminuye si se expone adecuadamente el campo operatorio para poder aproximar delicadamente los tejidos sin tensión ni torsión, si se comprueba que existe un riego sanguíneo adecuado pero sin sangrado de los bordes de corte, si se evita la contaminación , si la anastomosis queda impermeable pero con lumen adecuado para evitar estenosis, si adicionalmente se cierran los defectos mesentéricos, se drenan las colecciones peri anastomóticas y se comprueba que no existe obstrucción distal que incremente la presión intra-luminal. (79) (87) (88) (90).
Los abscesos intra-abdominales y sub-frénicos se forman por contaminación de la cavidad peritoneal durante el transoperatorio o por el escape de contenido intestinal a través de una fístula. Su incidencia disminuye si se usa antibiótico profilaxis, si se toman medidas para prevenir la contaminación durante la cirugía, si se lava prolijamente la cavidad abdominal y si se drenan los espacios sub frénicos, la zona perianastomótica, el área pancreática y obviamente si las anastomosis se realizan correctamente para evitar las dehiscencias. Los drenes no deben ser extraídos antes de la resolución total del absceso, ya que cuando se retiran precozmente el orificio de la pared abdominal cicatriza y evita que la pus residual drene propiciando la formación de nuevos abscesos. (79)
La fístula pancreática se produce por escape de jugo pancreático y se debe principalmente a lesión del páncreas durante la pancreato-esplenectomía, operación en la cual se reseca en bloque la arteria esplénica, vena esplénica, el cuerpo y cola del páncreas así como el bazo (8).
La pancreato-esplenectomía se realiza porque las neoplasias del cuerpo y/o fondo del estómago tienen una incidencia de metástasis linfática hacia el páncreas e hilio esplénico (grupos 11 y 10) de 18 al 20% (8) (80) (81) .
La fístula pancreática es difícil de manejar, prolonga la estancia hospitalaria post operatoria requiere del uso de nutrición parenteral total y análogos de la sandostatina. Con la finalidad de evitar esta complicación Maruyama (80) e Iwanaga (81) diseñaron la gastrectomía con preservación de páncreas operación en la cual se resecan en bloque los grupos ganglionares 10 y 11 junto con la arteria esplénica y el bazo pero preservando todo el páncreas y la vena esplénica; ambos autores (80) (81) indican la factibilidad y bajo riesgo operatorio de esta técnica comparada con una pancreato-esplenectomía De la morbilidad no relacionada directamente con la cirugía, la neumonía es la complicación más frecuente tanto en la gastrectomía total como en la gastrectomía sub-total distal. Su frecuencia a través de las décadas se mantiene sin variación significativa aunque en los últimos años existe una tendencia decreciente.
En concordancia con otros autores, nuestros resultados nos permiten afirmar que el riesgo de mortalidad intra-hospitalaria depende más de las variables peri-operatorias como la hipoalbuminemia, transfusión sanguínea intra-operatoria; esplenectomía (gastrectomía sub total distal) y reoperación que de las variables pre-operatorias que el cirujano no puede controlar (edad, sexo, estadio clínico , etc.).
BIBLIOGRAFÍA
1. WATANABE S, SHOICHIRO T, YMAGUCHI N. ETIOLOGY EN SUGIMURA T, SASAKO M. Gastric cancer. Oxford university press 1997 . pp: 33-51 [ Links ]
2. RUIZ E, BERROSPI F, CELIS J. Operabilidad y resecabilidad del cáncer gástrico: Análisis de 2280 casos en 15 años. REV. GASTROEN. PERU. 1997;17:135-142. [ Links ]
3. FUJITA S. Ocurrence and development of gastric cancer by cell kinetics. Proc Japan Pathol. Society 1981; 70: 23-54. [ Links ]
4. OKAJIMA K, ISOZAKI H. Principles of surgical treatment en Nishi, Ichikawa, Nakajima, Maruyama, Thara (Eds.) Gastric cáncer. 1° edition. Tokio Springer-Verlag 1993. 280-292. [ Links ]
5. Japanese gastric cancer association. Japanese classification of gastric carcinomas, 2nd ed. Gastric Cancer 1998; 1: 10-24. [ Links ]
6. VALEN B, VISTE A, HAUGSTVEDT T. Treatment of stomach cancer a national experience. Br J Surg. 1988; 75(7): 708-712.
7. ALLUM W, POWELL DJ, MC CONKEY, et al. Gastric cancer: a 25 year review B J Surg. 1989; 76 (6) : 535-540. [ Links ]
8. FURUKAWA H, HIRATSUKA M. A rational technique for surgical operation of Borrmann type 4 gastric carcinoma: Left upper abdominal evisceration plus appeblys method. Br J Surg. 1988: 75: 116-119. [ Links ]
9. HABU H, ENDO M. Gastric cáncer in elderly patients-results of surgical treatment. Hepatogastroenterlogy 1989;36:71-74 [ Links ]
10. SANO T, KATAI H, SASAKO M, MARUYAMA K. One thousand consecutive gastrectomies without operative mortality B J Surg. 2002; 89: 122-123. [ Links ]
11. VISTE A, HAUGSTVEDT T, EDIE GE , et al : Post operative complications and mortality after surgery for gastric cancer. Ann Surg. 1988; 207:7-13. [ Links ]
12. UICC International Union Against Cancer . TNM classification of malignant tumours. Fith Ed. Lyon edited by L.H. Sobin Wiley-Liss 1997. [ Links ]
13. KATZ M. Multivariable analysis: A practical guide for clinicians. First ed. Cambridge University Press 1999. [ Links ]
14. OÑATE-OCAÑA L, CORTEZ-CARDENAS S. Preoperative multivariate prediction of morbidity after gastrectomy for adenocarcinoma. Ann Surg Oncol. 2000; 7 (4): 281-288. [ Links ]
15. MACINTYRE I, AKOH J. Improving survival in gastric cancer: Review of operative mortality in English language publications from 1970. Br J Surg. 1991 Jul;78(7):771-6. Review. [ Links ]
16. WEIL P, BUCHBERGER R. From Billroth to PVC: A century of gastric surgery. World J Surg. 1999 Jul;23(7):736-42. [ Links ]
17. SÁNCHEZ HUACO M . La historia de la gastrectomía en el Perú. en : Neoplasia Maligna del Estómago , experiencia de un hospital. Tesis para optar el grado de Doctor en Medicina. Universidad Nacional Mayor de San Marcos 1970: 17-18. [ Links ]
18. Registro de cáncer de Lima metropolitana 1990-1991. Publicación del Centro de investigación en cáncer Maes Héller Abril 1995. [ Links ]
19. POQUIOMA E. Tendencia en la incidencia de cáncer de Lima Metropolitana 1968-1991. tesis para optar el titulo de médico cirujano. UPCH Lima Peru. 1995. [ Links ]
20. ROVIELLO F, MARRELLI D, DE STEFANO A, et al: Complications after surgery for gastric cancer in patients aged 80 years and over. Jpn J Clin Oncol. 1998; 28(2): 116-122. [ Links ]
21. BONENKAMP J, SONGUN I.: Randomized comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995; 345:745-748. [ Links ]
22. MCCULLOCH P, WARD J, TEKKIS PP, et al. Mortality and morbility in gastro-oesophageal cancer surgery: initial results of ASCOT multicentre prospective cohort study. BMJ 2003;327:1192-1197. [ Links ]
23. KINOSHITA T, MARUYAMA K, et al. Treatment results of gastric cáncer: Japanese experience. en Nishi, Ichikawa, Nakajima, Maruyama, Thara eds. Gastric cáncer. First edition , Tokio Springer-Verlag 1993 : 319-330. [ Links ]
24. WHITE RR, MACKIE JA. An analysis of twenty years experiencie with operations for carcinoma of the stomach. Ann Surg. 1975; 181: 611-15 [ Links ]
25. MINE M, MAJIMA S, HARADA M, et al . End results of gastrectomy for gastric cancer: effect of extensive lymph node dissection. Surgery 1970; 68:753-58. [ Links ]
26. MC NEER G, BOWDEN L.. Elective total gastrectomy for cancer of the stomach: end results. Ann Surg 1974;180: 252-56. [ Links ]
27. GILBERTSEN V. Result of treatment of stomach cancer. An appraisal efforts for more extensive surgery and a report of 1983 cases. Cáncer 1969; 1305-08. [ Links ]
28. YAP P, PANTANGCO E, YAP A, et al. Surgical management of gastric carcinoma. Follow-up results in 465 consecutive cases. Am J Surg. 1982; 143(3): 284-7. [ Links ]
29. NOGUCHI Y, IMADA T, MATSUMOTO A, et al. Radical surgery for gastric cancer. A review or Japanese experience. Cancer 1989; 64: 2053-62. [ Links ]
30. CARTIA Q, QUARANTA L, LUCARINI L, et al. Analysis of surgical treatment of 592 cases of cancer of the stomach. Minerva Med. 1977; 68(22): 1495-02. [ Links ]
31. ARMSTRONG C, DENT D. Factors influencing prognosis in carcinoma of the stomach. Surg Gynecol Obstet 1986;162:343-48. [ Links ]
32. Hoerr S. Prognosis for carcinoma of the stomach. Surg. Gynec Obst. 1973; 137: 205-9. [ Links ]
33. ADASHEK K, SANGER J, LONGMIRE W, et al. Cancer of the stomach. Review of consecutive ten years intervals. Ann Surg.1978;189(1):6-10. [ Links ]
34. NIELSEN J, AAGAARD J, TOFTGAARD C.Gastric cancer with special reference to prognosis factors. A review or 779 cases. Acta Chir Scand. 1985;151(1):49-55. [ Links ]
35. PAULONI A, TOSATO F, CASSESE M et al. Total gastrectomy in the treatment of adenocarcinoma of the cardia. Review of the results in 73 resected patients . Am J Surg 1986; 151:238-43. [ Links ]
36. DUPONT B, LEE J, BURTON GR, et al. Adenocarcinoma of the stomach: Review of 1497 cases. Cancer 1978; 41(3): 941-7. [ Links ]
37. BATTEZZATI M, PERCIVALE P, SECCO GB, et al. Gastric cancer : A review of 400 consecutive cases. Int Surg 1986;71:27-31. [ Links ]
38. HENRICHSEN S, KRONBORG O, BRENOE E. Total gastrectomy for cancer of the stomach. Act Chir Scan 1974;140 :147-50. [ Links ]
39. LULU DJ, OCHOA P. Carcinoma of the stomach. Int Surg 1974; 59: 18-19. [ Links ]
40. FURUKAWA H, HIRATSUKA M, ICHIKAWA O, et al. Total Gastrectomy with dissection of lymph nodes along the splenic artery : A pancreas preserving method. Ann Surg oncol. 2000;7 (9):669-73. [ Links ]
41. DENT D, MADDEN M, PRICE SK. Randomized comparison for R1 and R2 gastrectomy for gastric carcinoma. Br J Surg 1988;75:110-2. [ Links ]
42. BEACH M, CADE R, STEEDMANN PK. Superficial (early) gastric cancer. Aust NZ J Surg 1990; 60: 99-102. [ Links ]
43. ELLIS FH, GIBB SP, WATKINS E. . Limited esophago-gastrectomy for carcinoma of the cardia. Indications, technique and results. Ann Surg. 1988;208:354-61. [ Links ]
44. SOGA J, OHYAMA S. MIYASHITA K. et al. A statistical evaluation of advancement in gastric cancer with special reference to the significance of lymphadenectomy for cure. World J Surg 1988;12:398-405. [ Links ]
45. OLEAGOITIA JM, ECHEVARRIA A, SANTIDRIAN J, et al. Early Gastric cancer. Br J Surg. 1986;73:804-6 [ Links ]
46. DE ARETXABALA X, KONISHI K, YONEMURA Y, et al. Node dissection in gastric cancer. Br. J. Surg. 1987; 74: 770-3. [ Links ]
47. Nakajima T, Nishi M. Surgery and adjuvant chemotherapy for gastric cancer. Hepatogastroenterology 1989;36 (2):79-85. [ Links ]
48. LIN CHAO-HONG. Clinical experience in the surgical treatment of 1399 cases of gastric carcinoma. Chinese Med J. 1987;100:273-80 [ Links ]
49. PIMENTEL F, GUZMÁN S, LLANOS O, et al. Gastric cancer surgical results and survival. Rev Med Chil. 1989; 116(6):525-31. [ Links ]
50. IRVIN TT, BRIDGER J, et al. Gastric cancer. An audit of 122 consecutive cases and results of R1 gastrectomy . Br J Surg. 1988; 75 (2): 106-109. [ Links ]
51. SHIU M, KARPEH M, MURRIA F, BRENNAN M. End results of surgical treatment of Gastric adenocarcinoma : American experience en Nishi, Ichikawa, Nakajima, Maruyama, Thara, eds. 1° Ed. Gastric cáncer. Tokio Springer-Verlag 1993: 331-40. [ Links ]
52. SIEWERT JR, BOTTCHER K, RODER JD, et al : Prognostic relevance of systematic lymph node dissection in gastric carcinoma: GB German Gastric Cancer study. Br J Surg. 1993; 80 (8):1015-8. [ Links ]
53. SVARTHOLM E, LARSSON S. Total gastrectomy in the elderly patients. Acta Chir Scand 1987; 153:677-680 [ Links ]
54. ROHDE H. End results of surgical treatment: German experience en Nishi, Ichikawa, Nakajima, Maruyama, Thara, eds First ed. Gastric cáncer. Tokio Springer-Verlag 1993: 349-57. [ Links ]
55. CUNNINGHAM D, HOLE D, TAGGAR DJ, et al. Evaluation of the prognostic factors in gastric cancer: The effect of chemotherapy on survival. Br J Surg. 1987; 74 (8): 715-20. [ Links ]
56. MEYER H, JAHNE J, PICHLMAYR R. Surgical treatment of gastric carcinoma: Approach according to tumor stage or total gastrectomy as the operation of choice. in Hotz J, Meyer H, Schmoll J, eds First ed. Gastric Carcinoma. Classification diagnosis and therapy Berlin :Springer-Verlag 1987. 49- 59. [ Links ]
57. SAARIO I, SALO J, LEMPINEN M,et al. Total and near total gastrectomy for gastric cancer in patients over 70 years of age. Am J Surg 1987;154 (3):269-70. [ Links ]
58. BITTNER R, SCHIRROW H, BUTTERS M, et al. Total gastrectomy. A 15-year experiencie with particular reference to the patient over 70 years of age. Arch Surg. 1985; 120(10): 1120-25. [ Links ]
59. VISTE A, RYGH AB, SOREIDE O. Cancer of the stomach is a follow-up program of any importance for the patient? Clin Oncol 1984; 10 (4) : 325-32. [ Links ]
60. FAIVRE J, JUSTRABO E, HILLON P, et al. Gastric carcinoma in Cote Dor. A population based study. Gastroenterology 1985; 88 (6): 1874-79 [ Links ]
61. MSIKA D, BENHAMICHE A, TAZI MA, et al. Improvement of operative mortality after curative resection for gastric cancer: a Population-based Study. World J Surg. 2000; 24 (9):1137-42. [ Links ]
62. SCOTT HW, ADKINS RB, SAYERS JL. Results of an aggressive surgical approach to gastric carcinoma during a twenty three year period . Surgery 1985;97 (1):55-9. [ Links ]
63. SJOSTEDT S, PIEPER R. Gastric cancer. Factors influencing long term survival and post operative mortality. Acta Chir Scand (Suppl) 1986;530:25-29. [ Links ]
64. KIM J. Results of surgery on 6589 gastric cancer patients indicating inmunochemosurgery as being the best multimodality treatment for advanced gastric cancer en Nishi, Ichikawa, Nakajima, Maruyama, Thara, eds First ed. Gastric cáncer. Tokio Springer-Verlag 1993. :358-77. [ Links ]
65. DEGIULI M, SASAKO M, CALGARO M, et al. Morbidity and mortality after D1 and D2 gastrectomy for cancer: Interim analysis of the Italian Gastric Cancer Study Group (IGCSG) randomized surgical trial EJSO Elsevier 2003: 1-6 (www. Sciencedirect.com) [ Links ]
66. WU CW, HSIEWH MC. Morbidity and mortality after radical gastrectomy for patients with carcinoma of the stomach. J Am Coll Surg 1995; 181: 26-32. [ Links ]
67. WANG CS, HSIEH CC, CHAO TC, et al. Resectable gastric cancer: operative mortality and survival analysis. Chang Gung Med J. 2002; 25(4): 216-27. [ Links ]
68. OLIVEIRA FJ, FERRAO H, FURTADO E, et al. Total gastrectomy for gastric adenocarcinoma. Analysis of 115 consecutive patients Hepatogastroenterology. 1999;46(27): 2044-47. [ Links ]
69. SASAKO M. Risk factors for surgical treatment in the Dutch gastric cancer trial., Br J Surg. 1997; 84(11):1567-71. [ Links ]
70. GROSSMANN EM, LONGO WE, VIRGO KS, et al. Morbidity and mortality of gastrectomy for cancer in Department of Veterans affairs Medical Centers. Surgery 2002; 131(5):484-90. [ Links ]
71. DIAZ A, CIEZA M, et al. Factors involved in morbidity and mortality of total gastrectomy for gastric cancer. Rev Oncol 2002;4(5):265-70. [ Links ]
72. RUIZ E. QUISPE D. CELIS J, y col. Gastrectomía total por cáncer gástrico en pacientes mayores de 70 años. Rev Gastroenterol Peru. 2001;21(3):205-11. [ Links ]
73. SHCHEPOTIN I, EVNAS S, CHORNY VA, et al. post operative complications requiring relaparotomies after 700 gastrectomies performed for gastric cancer. Am J Surg. 1996; 171(2): 270-3. [ Links ]
74. CAMPION J, NOMIKOS J, LAUNOIS B. Duodenal closure and esophagojejunostomy experience with mechanical stapling devices in total gastrectomy for cancer. Arch Surg. 1988;123(8) :979-83. [ Links ]
75. CELIS J, RUIZ E, BERROSPI F, y col. Sutura mecánica versus sutura manual en la anastomosis esófago yeyunal después de gastrectomía por cáncer gástrico. Rev Gastroenterol Perú. 2001; 21 (4):271-5. [ Links ]
76. RUIZ J, ORTEGA P. Morbimortalidad atribuible a la fístula esófago yeyunal tras gastrectomía total por cáncer gástrico. Cir Esp 2001;70: 3-5. [ Links ]
77. INBERG M, HEINONEN R, LAUREN P, RANTAKOKKO V, VIIKARI S. Total and proximal gastrectomy in the treatment of gastric carcinoma: a series of 305 cases. World J Surg. 1981;5:249-57. [ Links ]
78. SCHROCK T, WAY L. Total gastrectomy. Am J Surg 1978;135:348-55 [ Links ]
79. HEDBERG S, HEIMY A. Experiencias con el grapado gastro intestinal en el Massachusetts General hospital en Clínicas quirúrgicas de norte América 1984; 3: 497-515. [ Links ]
80. MARUYAMA K, SASAKO M, KINOSHITA T, et al: Pancreas preserving total gastrectomy for proximal gastric cancer World J Surg. 1995;19 (4):532-6. [ Links ]
81. IWANAGA T, TANIGUCHI K, Indication and method of total gastrectomy with preserving pancreas and splenectomy for gastric carcinoma. Shokakigeka 1982; 5: 59-67. (artículo en japonés, Abstract en Ingles) [ Links ]
82. PINE RW, WERTZ MJ, LENNARDS ES, et al. Determinants of organ malfunction or death in patients with intra abdominal sepsis. Arch Surg.1983;118(2):242-9. [ Links ]
83. BELLAPONTE R, SITGES-SIERRA A, BOSSOLA M, et al. Transfusion timing and postoperative septic complications after gastric cancer surgery. Arch surg. 1998; 133 (9): 988-92. [ Links ]
84. AHOK J, SEDGWIC D, MACYNTIRE IM. Improving results in the treatment of gastric cancer: an 11 year audit. Br J Surg. 1991;78(3):349-351. [ Links ]
85. FURUKAWA H, HIRATSUKA M, ISHIKAWA O, et al. Total Gastrectomy with dissection of lymph nodes along the splenic artery : A pancreas preserving method. Ann Surg Oncol. 2000;7 (9):669-73. [ Links ]
86. Japanese Research Society for Gastric Cancer. Treatment results of Gastric carcinoma in Japan: 30th report of nation wide registry in 1979-1982. Tokio: National Cancer Center Press, 1995. [ Links ]
87. CUSCHIERI A, FAYERS P, FIELDING J, et al. Post operative morbidity and mortality after D1 and D2 Resections for gastric cancer: preliminary results of the MRC randomized surgical trial. The surgical cooperative Group. Lancet 1996; 347(9007): 995-9. [ Links ]
88. YASUDA K, SHIRAISHI N, ADACHI Y, et al. Risk factors for complications following resection of large gastric cancer. Br J Surg 2001; 88(6):873-7. [ Links ]
89. DÍAZ DE LIAÑO A, AIZCORBE M. Dehiscencia de la anastomosis esófago yeyunal tras gastrectomía total por carcinoma gástrico. Cir Esp. 1999;65: 127-9. [ Links ]
90. SCHARDEY HM, JOOSTEN U, FINKE U, et al: The prevention of anastomotic leakage after total gastrectomy with local decontamination. A Prospective randomized double blind placebo-controlled multicenter trial. Ann Surg. 1997; 225(2): 172-80. [ Links ]