Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.24 n.4 Lima oct./dic. 2004
REPORTE DE CASOS
Hepatitis tóxica colestásica por terbinafina:Reporte de caso
Zuño Burstein1; Herman Vildósola2; Zenaida Lozano3; Roger Verona4; Gloria Vargas5.
1 Profesor Emérito (Dermatología – Medicina Tropical) UNMSM. Jefe del Servicio de Dermatología Sanitaria de Instituto de Medicina Tropical–Daniel A. Carrión, UNMSM. Ex Jefe del Departamento de Lepra y Micología Médica del Instituto Nacional de Salud, MINSA.
2 Profesor Principal de Medicina UNMSM. Presidente de la Asociación Peruana Para el Estudio del Hígado. Miembro del Instituto de Medicina Tropical Daniel A. Carrión, UNMSM
3 Departamento de Patología del Hospital Arzobispo Loayza
4 Departamento de Patología del Hospital Arzobispo Loayza y de la UNMSM
5 Jefe del Servicio de Gastroenterología del Hospital Arzobispo Loayza y profesor de Medicina de la UNMSM.
RESUMEN
Las onicomicosis tricofíticas de los pies representan un importante y serio problema médico. Hasta años recientes, no se contaba con una terapia que ofreciera curación para esta desagradable patología. Recién a partir de los años 50, sobre todo con el advenimiento de la terapia sistémica antimicótica, se puede ofrecer un elevado porcentaje de curaciones clínico-micológicas.
Con el propósito de contribuir al mejor conocimiento de los efectos indeseables de estos agentes antimicóticos, actualmente tan difundidos, presentamos el caso de una paciente joven y gozando de buena salud que, 6 semanas después de iniciada la terapia con terbinafina oral a dosis terapéuticas, 1 comprimido de 250 mg por día, para tratar una onicomicosis tricofítica universal de ambos pies, desarrolló un cuadro sintomático severo de hepatitis tóxica colestásica, comprobado por las pruebas pertinentes, que, afortunadamente, remitió hasta su recuperación, varios meses después de interrumpida la terapia, sin dejar, aparentemente, secuelas.
Se revisa la literatura al respecto y se llama la atención de la necesidad de controlar previamente y durante el tratamiento con esta droga la función hepática y se señala la necesidad de continuar con las investigaciones hasta el hallazgo de un antimicótico ideal, todavía no logrado.
PALABRAS CLAVE. Terbinafina. Hepatitis colestásica, toxicidad hepática
SUMMARY
Trichophytic onychomycosis of the feet represents an important and serious medical problem.
Until recent years, there was not cure for this unpleasant pathology. It is only at the beginning of the 50s, especially at the onset of the antimycotic systemic therapy that a cure is available offering high rate of clinical and mycological therapy.
The purpose of this report is to better inform on the undesirable side-effects of antimycotic agents which are currently so largely disseminated. The case of a young patient is presented who was enjoying good health and who after 6 weeks of starting therapy with terbinafine on a dosis of 1 pill of 250 mg a day, to treat a trichophytic onychomycosis in both feet, developed severe symptoms of toxic colostatic hepatitis duly corroborated after pertinent testing. Patient had a full recovery after a few months of having interrupted her therapy, apparently without any sequel.
The literature in this regard has been revised and a close monitoring of the hepatic function is recommended prior and during treatment with this drug. The need to continue research to find an ideal antimycotic still not found is also recommended.
KEY WORDS: Terbinafine, colostasic hepatitis, hepatic toxicity.
INTRODUCCIÓN
Las onicomicosis de los pies, particularmente las producidas por hongos filamentosos (Onicomicosis tricofíticas), representan un importante y serio problema de salud individual y colectiva, no sólo por su frecuencia y alta contagiosidad, sino también por el severo deterioro, habitualmente progresivo, de las uñas, provocando un desagradable aspecto que afecta la imagen corporal, así como por la capacidad de propagarse a otras regiones corporales y por producir manifestaciones alérgicas a distancia. La demostrada vinculación con condicionamientos genéticos y el rol que juega el estado inmunoreactor del huésped son factores que hacen más compleja esta patología. Es conocido que una onicomicosis severa, progresiva y resistente a la terapia se considera como uno de los marcadores de inmunodeficiencia humana adquirida, por VIH/SIDA.
Hasta años recientes no se contaba con una terapia que ofreciera curación para esta desagradable patología, limitándose la conducta médica a la eliminación quirúrgica o química de las uñas afectadas, con resultados poco alentadores. Recién a partir de los años 50, con el descubrimiento de antimicóticos tópicos cada vez más potentes (aunque hasta el momento, ninguno de ellos por si solo puede resolver las onicomicosis tricofíticas), pero, sobre todo, con el advenimiento de la terapia sistémica antimicótica, se puede ofrecer un elevado porcentaje de curaciones clínicas y micológicas, que llega hasta el 90 %,
La griseofulvina, que se puso en el mercado el año 1958, con capacidad de curar el 100 % de las tiñas tricofíticas del cuero cabelludo, resultó efectiva en menos del 40 % de casos tratados con onicomicosis, pese a una prolongada administración. Los derivados imidazólicos, inicialmente los diazólicos, como el ketoconazol, que salió el año 1979, ofrecía más del 60 % de curas, administrándose por un lapso continuo de, por lo menos, 10 meses; pero, con riesgo de hepatotoxicidad y otros efectos secundarios. Desde el año 1987, con la presencia de los derivados triazólicos, como el itraconazol y el fluconazol, así como, desde el año 1986, con una alinamina, la terbinafina, el arsenal terapéutico contra las Onicomicosis se enriqueció valiosamente, mejorando considerablemente la eficacia terapéutica, disminuyendo la toxicidad y acortando el tiempo de administración, que, en el caso del itraconazol y la terbinafina, se acortó a 3 o 4 meses, administrados, ya sea en pulsos o en forma continua.
Sin embargo, hasta el momento no se ha logrado el éxito deseado de total efectividad con ninguno de estos medicamentos y, sobre todo, no contamos todavía con alternativas que nos ofrezcan seguridad en cuanto a carencia de efectos secundarios, ya que se reportan en todo el mundo manifestaciones clínico patológicas, a veces graves, e interacciones medicamentosas indeseables, que obligan a un vigilancia médica exigente.
Con el propósito de contribuir al mejor conocimiento de los efectos indeseables de estos, actualmente tan difundidos, agentes antimicóticos, pretendidamente seguros y de bajo riesgo, presentamos el caso de una paciente joven, gozando de buena salud, que 6 semanas después de iniciada la terapia con terbinafina oral, administrada para controlar una onicomicosis tricofítica universal de ambos pies, desarrolló un cuadro severo de hepatitis tóxica colestásica, comprobada por todas las pruebas pertinentes y que, afortunadamente, remitió hasta su recuperación, varios meses después de interrumpida la terapia, sin dejar secuelas, aparentemente.
CASO CLÍNICO
J.C.R., mujer de 31 años, con 65 kg de peso y 1.54 mt de talla, natural de Loja (Ecuador) y residente en Lima desde hace 3 años, casada, con dos hijos de 9 y 7 años, sanos. Refiere antecedentes de dermatitis de contacto alérgica al cuero, metales y detergentes; sensibilidad a la picadura de zancudos y a la radiación solar; tuvo en una oportunidad un episodio de angioedema facial de origen alimenticio, relacionado con ingestión de moluscos. Salvo alguna infección urinaria ocasional y dermatomicosis interdigital no tuvo antecedentes patológicos de importancia ni de ingesta de alcohol u otros agentes hepatotóxicos.
La paciente concurre a la consulta en óptimas condiciones de salud, el día 6 de febrero de 2003, por una onicomicosis tricofítica universal de ambos pies en demanda de tratamiento. En vista de las buenas condiciones de salud de la paciente, se le indica terapéutica antimicótica sistémica oral con terbinafina, a dosis de 250 mg 1 vez al día. A los 15 días concurre a su control sin manifestar ningún síntoma ni signo de intolerancia medicamentosa. Se indica proseguir con la terapia y regresar a control 30 días después. En esta oportunidad, la paciente manifiesta que, desde 4 días antes de su consulta( día 40 de tratamiento) empieza a notar cansancio, vómitos, prurito generalizado y coluria, al examen clínico se detecta dermografismo y subictericia. Se suspende la medicación y se indica exámenes auxiliares de laboratorio donde se comprueba compromiso parenquimal hepático, con transaminasas elevadas, hiperbilirrubinemia a predominio directo, alcemia y gamma glutamil transpeptidasa elevadas, e hipercolesterolemia. El tiempo de protrombina y otros factores de coagulación se encontraron dentro de límites normales. Así mismo los marcadores para hepatitis viral A y B, anticuerpos antinucleares, anti músculo liso y antimitocondriales fueron negativos; la inmunoglobulina G se encontraba muy elevada y presentaba adicionalmente una gamma globulina elevada en el proteinograma electroforético (ver tablas 1-2-3-4-5-6).
Adicionalmente se le practica una ultrasonografía hepática que fue normal y posteriormente una laparoscopia que muestra un hígado de color verde oscuro y en su cara inferior se aprecian tractos fibrosos; se toma una biopsia hepática que obtiene una muestra de color verde oscuro, informándose como colestasis de causa a determinar.
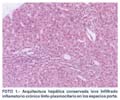
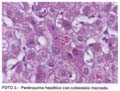
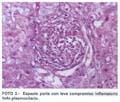
El informe histopatológico informa: arquitectura hepática conservada. A nivel de los espacios porta se aprecia presencia de ductos, arterias y venas con leve a moderada inflamación crónica linfocítica. En el parénquima hepático se comprueba colestasis marcada (fotos 1, 2 y 3). La conclusión diagnóstica es de una hepatitis toxico-medicamentosa de tipo colestásico por terbinafina.
Se le indica corticoterapia sistémica, prednisona 30 mg al día, que la paciente toma por tres días, suspendiendo la medicación por motu propio. En el seguimiento del proceso a través del tiempo (ver tablas), se observó que no se presentaron alteraciones hematológicas, el metabolismo hidrocarbonado (glicemia) y proteínico (ácido úrico y proteínas sanguíneas) no se alteró; la función renal no se comprometió; en cambio, el perfil lipídico sufrió alteraciones significativas que se normalizaron a partir del segundo mes de interrumpida la terapia con terbinafina. El perfil hepático evidenció que la hiperbilirrubinemia inicial, con predominio de la bilirrubina directa, se normalizó al segundo mes. Igual conducta siguieron las transaminasas y la GGTP, encontrándose en cifras normales 9 meses después del evento tóxico. El examen de orina, que presentaba inicialmente pigmentos biliares, se normalizó rápidamente.
El cuadro clínico mejoró y recuperándose completamente después del segundo mes, permaneciendo totalmente asintomática hasta los 9 meses después del evento, en que fue el último control.
DISCUSIÓN
La terbinafina, una alinamina antimicótica, de amplio espectro, que entró en la práctica clínica desde el año 1986, ha significado un avance terapéutico de gran importancia en el control de las micosis superficiales producidas por hongos filamentosos, sobre todo, por su pretendida acción fungicida, a diferencia de otros antimicóticos sistémicos que son predominantemente micostáticos, Las posibilidades de que la terbinafina cumpla un rol terapéutico importante en micosis producidas por hongos levaduriformes y difórmicos, productores de micosis subcutáneas y profundas, gozando de una esperada baja toxicidad comparativa con los derivados azólicos, ha provocado un interés especial en el ambiente médico y en las empresas de provisión de medicamentos, que la han promocionado y adoptado como un antimicótico ideal, poniéndolo en el mercado con entusiasmo y gran publicidad.
Pero, nuestra experiencia en este caso, con compromiso hepático tóxico que podría haber sido severo si no se interrumpe la terapia a tiempo y otras manifestaciones menos importantes detectadas en nuestra casuística, como transtornos en la gustación, en el olfato y alteraciones digestivas (diarreas), entre otras, permiten alertar al ambiente médico, tal como lo hicimos con el ketoconazol, primer derivado imidazólico, diazólico, cuando el año 1979 entró en circulación como el antimicótico ideal, pero que, la experiencia clínica ulterior en todas partes y la nuestra en el Hospital Dos de Mayo, en el tratamiento de micosis profundas (Blastomicosis Sudamericana) por largo tiempo, demostró su potencialidad hepatotóxica y otros efectos secundarios e interacciones medicamentosas, bien conocidas en la actualidad, que obligan a un control médico cercano en los casos de tratamiento con esa droga.
La terbinafina se administra por vía oral, siendo metabolizada por el hígado y excretada por el riñón. Para las onicomicosis tricofíticas se indica en adultos 1 comprimido de 250 mg diarios, por 3 a 4 meses, obteniéndose elevados índices de curación clínica y micológica. Los efectos secundarios reportados habitualmente son leves o moderados y transitorios. Los más frecuentes son síntomas gastrointestinales (anorexia, naúseas, diarreas, que, ocasionalmente, obligan a interrumpir la terapia). Se describen como transtornos poco comunes las alteraciones del gusto, incluyendo su pérdida (1)(2). Se han referido, en diferentes partes del mundo, reacciones cutáneas, como urticaria, ocasionalmente síndrome de Steven Johnson, necrosis epidérmica tóxica, exantemas pustulosos agudos generalizados y reacciones anafilácticas(3-6) y manifestaciones músculo esqueléticas (artralgias, neuralgias). Sin embargo en un estudio de cohorte sobre el riesgo de injuria hepática aguda entre los usuarios de ketoconazol y otros antimicóticos, se comprobó que la terbinafina presentaba un riegos mucho menor que otros antifúngicos, pues la tasa de incidencia de injuria hepática aguda fue de 2.5 por 100,000 personas mes, frente a 134 de ketoconazol y el riesgo relativo para terbinafina fue de 4.2 versus 228 de ketoconazol y 17.7 de itraconazol frente a los que no lo usan (7). Desde el año 1994, encontramos en la literatura referencias de 6 a 9 casos de hepatotoxicidad producida por la terbinafina (12)(7)(3). Gupta AK (10) señala, el año 1998, que la administración oral de terbinafina se asocia raramente con el desarrollo de disfunción hepatobiliar idiosincrática sintomática; la hepatitis producida tiene un componente de necrosis hepatocelular (con elevación de las enzimas hepáticas) y con manifestaciones de injuria colestásica (elevación de fosfatasas alcalinas y de los niveles de colesterol). El período de latencia, nos dice Gupta, entre la administración de la medicación y el desarrollo de la injuria es, aproximadamente, de 4 a 6 semanas, por lo que recomienda que las enzimas hepáticas deben ser controladas y monitorizadas en personas recibiendo terbinafina por más de 6 semanas.
El mecanismo preciso por el que la terbinafina produce daño hepático es desconocido y es probable que se deba a un tipo de reacción idiosincrática. Se cree que la 7,7-dimetilhept-2-ene-4-ynal(TBF-A) el metabolito aldehido alílico de la terbinafina, puede jugar un rol en la patogénesis de la hepatotoxicidad (11-14).
Mallat y col., en Francia (10-12) reportaron, el año 1997, un caso de colestasis prolongada después de la administración de terbinafina, con prurito, que apareció después de 4 semanas de iniciada la terapia y que se asoció con una mezcla de anormalidades hepatocelulares y colestasis. La bilirrubina sérica retornó a la normalidad a los 3 meses de suspendida la terapia; pero una colestasis anictérica persistiò por más de 6 meses. Una biopsia hepática practicada meses después de suspendida la terapia mostraba colestasis centro lobulillar, discreta fibrosis portal y una reducción en el número de conductos biliares interlobulillares. Concluyen los autores que la terbinafina debe ser adicionada a las drogas que pueden causar reducción de las vías biliares interlobulillares Otro reporte (13) también enfatiza el hecho observado en algunos pacientes, del tiempo prolongado, hasta un año, para lograr la normalización de las enzimas hepáticas.
Ocasionalmente, la terbinafina puede producir daño hepático severo, fulminante; Kosh y col., el año 1999 (6-14), reportan el caso de una paciente de 48 años, sin antecedentes de patología o factores de hepatotoxicidad que tomó por 5 días terbinafina para una onicomicosis, desarrollando una hepatitis fulminante, obligando a un trasplante de hígado por haber desarrollado una encefalopatía hepatotóxica y un deterioro severo de su salud; el examen histopatológico del hígado reveló una necrosis masiva hepatocelular sin evidencias de enfermedad crónica latente; los hallazgos fueron compatibles con reacción idiosincrática a la terbinafina. Estos autores señalan que han sido reportados cuadros de menor significación en un 4 % de pacientes, durante el tratamiento con terbinafina, refiriendo, predominantemente, colestasis reversible asociada a la injuria hepática por terbinafina.
CONCLUSIÓN
La paciente presentada por nosotros en esta ocasión, que recibió terbinafina para tratamiento de onicomicosis pedia, desarrolló a la sexta semana de medicación una hepatitis tóxica colestática, con todas las características clínicas, de laboratorio y anatomopatológicas que han sido descritas en la literatura para estos casos y que, afortunadamente, evolucionó favorablemente hasta su recuperación total, varios meses después de haberse suspendido la terbinafina. Consideramos, como lo recomiendan otros autores, que la administración de esta droga debe ser siempre acompañada de una estricta vigilancia de la función hepática, monitorizándose, sobre todo, después de la 4ª semana de terapia, para suspender oportunamente su administración si se presentan signos de alteración y evitar, así, un mayor daño hepático.
BIBLIOGRAFÍA
1.- LUJAN C. Ageusia por terbinafina; reporte de un caso. Dermatología Peruana 2002; 12: 218-19. [ Links ]
2.- DUXBURY et al. Persistent impairment of taste resulting from Terbinafine. Br J Dermatol 1998; 193:747-48. [ Links ]
3.- LOMBARDO M et al. Acute generalized exanthemetous pustulosis induced by Terbinafine. J. Am. Acad. Dermatol. 2003; 49:158-9. [ Links ]
4.- CONDON CA et al. Terbinafine induced acute generalized exanthemetous pustulosis. Br J Dermatol 1998; 138:709-10. [ Links ]
5.- ROGALSKY C et al. Drug reaction to Terbinafine simulating acute generalized exanthematous pustulosis. Hautarzt 2001; 52:444-8. [ Links ]
6.- VANIT JW et al. Terbinafine: associated hepatic injury. J. Hepatol. 1994; 21:115-7. [ Links ]
7.- GARCIA RODRIGUEZ LA et al A cohor tstudy on the risk of acute liver injury among users of ketoconazoleand other antifungal drugsBr J Clin Pharmacol, 1999, 48, 847-852 [ Links ]
8.- LAZAROS GA et al. Terbinafine induced cholostatic liver disease. J. Hepatol 1996; 24:753-6. [ Links ]
9.- FERNANDEZ NF et al. Terbinafine hepatotoxicity: case report and review of the literature. Am. J. Gastroenterology 1998; 93:459-60. [ Links ]
10.- GUPTA AK et al. Hepatitis associated with Terbinafine therapy: three cases report and a review of the literature. Clin. Exp. Dermatol 1998; 23:64-7. [ Links ]
11.- AJIT C, SUVANNASANKHA A, ZAERI N, MUÑOZ SJ Terbinafine-associated hepatotoxicitity. Am J Med Sci 2003, 325: 292-5 [ Links ]
12.- MALLAT A et al. Terbinafine induced prolonged cholostasis with reduction of interlob. ducts. Dig Dis Sci 1997; 42:1286-8. [ Links ]
13.- VIVAS S et al Acute hepatitis associated with Terbinafine. Gastroenterol Hepatol 1997; 20: 456 [ Links ]
14.- KOSH A et al. Terbinafine and fulminant hepatic failure. New England of Medicine 1999; 340(16). [ Links ]