Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.25 n.1 Lima ene./mar. 2005
CONTRIBUCIÓN ESPECIAL
Cáncer Gástrico Temprano: estudio de 371 lesiones en 340 pacientes en el Hospital E. Rebagliati. Lima - Perú
Hernán Espejo Romero1; Jesús Navarrete Siancas2
1 Catedrático Principal de Clínica Médica de la Facultad de Medicina de San Fernando de la Universidad Nacional Mayor de San Marcos. Profesor de la Facultad de Medicina de la Universidad San Martín de Porres. Consultor de los Servicios de Gastroenterología del Hospital Rebagliati y Loayza.
2 Catedrático Principal de Anatomía Patológica de la Facultad de Medicina de San Fernando de la Universidad Nacional Mayor de San Marcos. Profesor de la Facultad de Medicina de la Universidad San Martín de Porres.
RESUMEN
Se atribuye al alemán M. Versé en 1903 la primera descripción concreta del Cáncer Gástrico Temprano, en su libro Die Histogenese der Schleimhautcarcinome, pero el primero en emplear el termino, fue el francés Bayle en 1833 denominándolo "Cáncer gástrico en su primera etapa".
De 1963 al 2002 en el hospital Edgardo Rebagliati Martins de EsSalud de Lima se hizó el diagnóstico histológico de 5118 cánceres gástricos. Se resecaron 2337(46%); en 340 de los especímenes resecados se encontraron 371 cánceres gástricos catalogados como tempranos (CGT) 15.87%.
Distribución: por quinquenios el número y la proporción de cánceres tempranos se han incrementado, de 10(6.8%) en el primer quinquenio, a 78(21.0%) en el último.
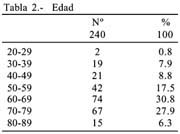
Edad: promedio 64 años para hombres y 58 para mujeres con un promedio global de 61 años. La menor edad fue de 23 años en una mujer. La mayor edad en los hombres fue de 93 años y 81 años en las mujeres.
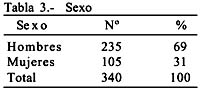
Sexo: 235 hombres y 105 mujeres, con una relación de 2.2:1.
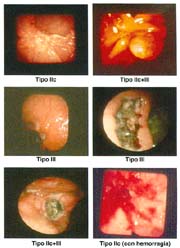
Macroscopía: TIPO ELEVADO: Tipo I 70(18.9%), IIa 66(17.8%), IIa+IIc 26(7.0%), IIa+I 1 (0.3%) I+IIa 0(0.0), IIa+III 1(0.3%), IIa+IIb 1 (0.3%),promedio global de elevados 44.6%.
TIPO SUPERFICIAL: IIb 17(4.6%) TIPO DEPRIMIDO: IIb+IIc 10(2.7%), IIc 127(34.2%), IIc+I 0(0.0%), IIc+III 43(11.6%), III 3(0.8%) III+IIc 5(1.3%), IIc+IIa 1(0.3%), IIa+IIb 0(0.0%) promedio global de deprimidos 50.9%.
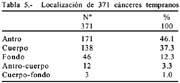
Localización: antro 171(46.1%), cuerpo 138(37.3%), fondo 46(12.3%), antro-cuerpo 12(3%) y cuerpo-fondo 3(1%).
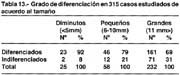
Tamaño: Máximo 90mm, Mínimo 1.5mm, promedio 24.9mm; 25(8%) diminutos (microcarcinomas), 58(21%) pequeños (small).
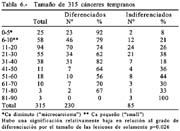
Histología: diferenciados 219(64%), indiferenciados 121(36%). Grado de diferenciación en hombres 74% y en mujeres 26%. Grado de diferenciación en diminutos 92%, en pequeños 79% y en grandes 69%.
Profundidad: 204(55%) en mucosa, 167(45%) en mucosa / submucosa. En diferenciados 182(63%) en mucosa, 108(37%) en mucosa / submucosa.
Metástasis ganglionar: En los 187 situados en mucosa, 13(3.8%) positivos, en los 153, situados en mucosa / submucosa 30(8.8%) positivos. Porcentaje global de ganglios positivos 12.3%.
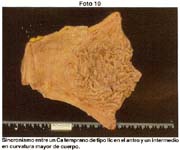
Lesiones sincrónicas: General de lesiones sincrónicas en 54.6%; con otros cánceres 12.7%.
Metaplasia intestinal: Presente en 65%, de las cuales las incompletas constituyeron el 50%.
Síntomas y Signos: Dispepsia 82.2%, hiporexia 32.9%, baja de peso 23.3%, dolor no característico 23.3%, dolor ulceroso 20.5%, melena 8.2%, anemia 7.7%, diarrea y/o estreñimiento 7.4%, vómito 2.2%, hematemesis 1.9.
Grupo Sanguíneo: 0 (63.2%), A (24.7)%, B (11.3)%, AB (0.6)%.
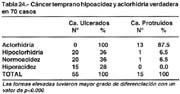
Secreción gástrica: Se determinó en 70 pacientes: En 55 ulcerados, ninguno presentó aclorhidria 0%, 20(36%) hipoclorhidria, 20(36%) normoclorhidria y 15(28%) hiperacidez. En 16 de forma elevada 13(87.5%), cursaron con aclorhidria, 1(6.5%) con hipoclorhidria, 1(6.5%) con normoacidez. Promedio en formas ulceradas DAB 3.04 ±1.25 mEqh y DAM 12.31 ± 8.00. En las formas elevadas: DAB 0.89 ± 0.32 y DAM 2.20 ± 0.95 mEqh.
Palabras clave: Cáncer gástrico temprano.
SUMMARY
The first concrete description of the Gastric Cancer in Early Stage is attributed to the German, M. Versé in 1903, in his book "Die Histogenese der Schleimhautcarcinome", but the first to use the term, was the French, Bayle in 1833, calling it "First Stage Gastric Cancer".
From 1963 to 2002, 5118 gastric cancers were histologically diagnosed, in our hospital from which 2337 (46%) were resected in 340 of the resected specimens, 371 early gastric cancers (EGC) (15.87%) were found.
Distribution: For every five periods, the number and proportion of early cancers increases, from 10 (6.8%) in the first five years to 78 (21,0%) in the last one.
Age: The average is: 64 years old for men and 58 for women with a global average of 61 years old. The youngest case was in a woman of 23 years old. The oldest case in men was 93 years old, and in women, 81 years old.
Sex: 235 males and 105 females, with a ratio of 2,2:1.
Macroscopy: ELEVATED TYPE: Type l 70 (18.9%) Ila 66 (17.8%) Ila+Ilc 26 (7.0%) lla+l 1 (0.3%) I+lla 0 (0.0) IIa+III 1 (0.3%) IIa+IIb 1 (0.3%). Global average of the elevated type: 44.6%.
SUPERFICIAL TYPE: llb 17 (4.6%), DEPRESSED TYPE: llb+llc 10 (2.7%), llc 127 (34.2%), llc+l 0 (0.0%) llc+lll 43 (11.6%) lll 3 (0.8%) lll+llc 5 (1.3%) llc+lla 1 (0.3%) lla+llb 0 (0.0%). The global average of the depressed type is: 50.9%.
Location: antrum 171 (46.1%) body 138 (37.3%) bottom 46 (12.3%) antrum-body 12 (3%) and body-bottom 3 (1%).
Size: Maximum 90 mm, minimum 1.5 mm, average 24.9 mm; 25 (8%) diminute (microcarcinomas), 58 (21%) small.
Histology: Differentiated 219 (64%) undifferentiated 121 (36%). Degree of differentiation in men 74% and in women 26%. Degree of differentiation in diminutes 92%, in small 79% and in large 69%.
Depth: 204(55%) in mucous, 167(45%) in mucous / submucous. In differentiated 182(63%) in mucous, 108(37%) in mucous / submucous.
Ganglion Metastasis: In the 187 located in mucous, 13 (3.8%) were positive, in the 153 located in mucous / submucous 30 (8.8%) were positive. Global percentage of positive ganglions: 12.3%.
Synchronic lesions: General in synchronic lesions in 54.6% in other types of cancer 12.7%.
Intestinal Metaplasia: Present in 65%, of which 50% of them were uncompleted
Symptoms and signs: Dyspepsia 82.2%, hyperoxia 32.9%, loss of weight 23.3%, non-characteristic pain 23.3%, ulcer pain 20,5%, melena 8,2%, anemia 7,7%, diarrhea and/or constipation 7,4%, vomiting 2,2%, hematemesis 1,9%.
Blood Type: O (63.2%) A (24.7%) B (11.3%) AB (0.6%).
Gastric secretion: This was determined in 70 patients: In 55 with ulcer, none showed achlorhydria 0%, 20 (36%) hypochlorhydria, 20 (36%) normochlorhydria and 15 (28%) hyperacidity. In 16 in an elevated form 13 (87.5%) with achlorhydria, 1 (6.5%) with hypochlorhydria, 1 (6.5%) with normal acidity. Average in ulcerated cases DAB 3.04 ± 1.25 mEqh and DAM 12.31 ± 8.00. In elevated cases: DAB 0.89 ± 0.32 and DAM 2.20 ± 0.95 mEqh.
Key words: Early Gastric Cancer
INTRODUCCIÓN
El Cáncer Gástrico Temprano (CGT) es el que compromete la mucosa y la mucosa/ submucosa y que puede tener metástasis regional. De acuerdo a la concepción sobre cáncer [1,2] se considera a la neoplasia maligna intraepitelial, definitivamente como cáncer, por lo tanto, el CGT, para nosotros, debe definirse como: neoplasia maligna que compromete el epitelio de superficie, a la mucosa y a la mucosa/submucosa del estómago y que puede dar metástasis regional.
Sinonimia
Desde lejana época, el concepto de CGT ha sido expresado en diversos, términos y por diferentes autores:
1833 (Francia) Bayle: "Cáncer gástrico en su primera etapa"
1883 (Alemania) Hauser: "Ulcer cancer"
1888 (Italia) Bizzozero: "Elementi labili"
1888 (Francia)Menetrier : Polyadenomes polypeuxy polyadenomes en nape
1903 (Alemania) Versé: Schleimhautcarcinome.
1905 (Japón) Yamagiwa: Carcinoma en el margen de la úlcera.
1909 (Alemania) Aschoff: "Malignant transformation of gastric mucosae in ulcer"
1909 (Alemania) Aschoff:""Malignant transformation of gastric mucosae in glandular polip"
1922 (Inglaterra) Handley: Cáncer que se extiende gradualmente
1931 (Alemania) Hamperl: Umbau carcinome
1932 (Inglaterra) Newcomb: "Atypical and proliferated epithelia in the margin of the ulcer"
1936 (USA) Ewing: Superficial carcinoma.
1936 (USA) Ewing: Superficial erosive cancer.
1936 (USA) Ewing: The beginning of gastric cancer
1939 (Francia) Gutmann, Bertrand, Peristiany : Le cancer de l' estomac au début
1940 (USA) Mallory: Cancer preinvasivo
1940 (USA) Mallory: Carcinoma, in situ.
1942 (USA) Stout: Superficial Spreading Carcinoma.
1946 (USA) Mc Carty: Pólipo carcinomatoso.
1946 (USA) Mac Carty: Citoplasia secundaria
1946 (USA) Mac Carty: Pequeño Cáncer en el borde de la úlcera.
1946 (Alemania) Broders: Pólipo adenomatoso maligno.
1946 (USA) Kerklin: Carcinoma de comienzo (mucosa en vidrio deslustrado)
1946 (USA) Kerklin Infiltración con poca o ninguna ulceración).
1946 (Alemania) Broders: Carcinoma in situ.
1946 (Alemania) Broders: Adenocarcinoma grado I
1952 (Alemania) Konjetzny: Früekrebscarcinome
1953 (Alemania) Konjetzny: Oberflächlicher Schleimhautkrebs.
1953 (Alemania) Konjetzny: Superficial cancer.
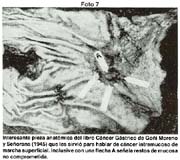
1954 (Argentina) Señorans y Goñi Moreno: Cancer pequeño, Cancer mucoso.
1954 (Argentina) Lescano: Carcinoma intramucoso.
1956 (Francia) Gutmann: cancer de l¢ estomac á la période utile.
1956 (Francia) Gutmann: Cancer mucoerosivo
1956 (Francia) Gutmann: Cancer ulceriforme con degeneración in situ
1962 (Japón) Japanese Research Society for Gastric Cancer: Early gastric cancer.
1965 (Francia) Mason: Surface carcinoma.
1967 (USA) Lewis: Cancer in situ
1667 (USA) Pack y Banner: "Early" Gastric Cancer.
Otras denominaciones actuales:
Cáncer Gástrico Temprano (CGT).
Cáncer Gástrico Precoz (CGP).
Cáncer Gástrico Incipiente (CGI).
Cáncer gástrico Avanzado (CGA)
MATERIAL Y MÉTODO
MATERIAL
El trabajo se ha realizado en el Hospital Edgardo Rebagliati Martins del Seguro Social (EsSsalud Lima-Perú)
Se revisaron las piezas anatómicas de estómago, los protocolos, las láminas y las historias clínicas correspondientes a los CGT y de un número adecuado de Cánceres Gástrico Avanzado (CGA) diagnosticados en el período comprendido entre los años 1963 al 2002.
MÉTODO
A partir del año 1963 se consideró adecuado utilizar un protocolo, en el que debía consignarse fundamentalmente:
- Datos epidemiológicos y clínicos
- Examen endoscópico, biopsia, polipectomía o mucosectomía
- En lo posible radiografía de doble contraste
- El examen anatomopatológico debía precisar datos sobre:
- Tamaño
- Localización
- Tipo macroscópico
- Tipo histológico
- Estado de la mucosa adyacente
- Metástasis ganglionar
- Invasión vascular linfática
- Sincronismo de lesiones
- Fijación de la pieza
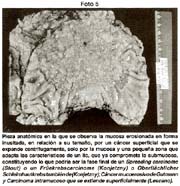
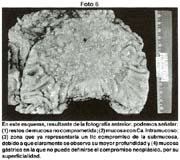
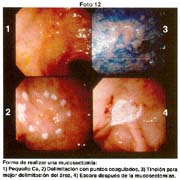
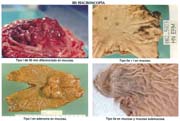
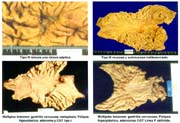
- Copia xerox de la pieza fijada Fotos 1, 2
- Ocasionalmente "perennización" de la pieza en un yeso especial.
Las piezas anatómicas obtenidas por polipectomía, mucosectomía y resección quirúrgica, fueron estudiadas retrospectivamente a partir del año 1963 con las exigencias de la Escuela Japonesa. Como contribución inédita, algunas piezas fueron "perennizadas" utilizando un procedimiento a base de yeso. Foto 3
- También se consignaron datos clínicos adicionales: síntomas y signos, grupo sanguíneo, etc.
- En 72 casos se practicó estudio de la acidez, por el método de la máxima estimulación con histalog.
- Se correlacionaron los datos obtenidos.
- El método estadístico empleado para la información que proporcionaban las fichas fue codificada utilizando el paquete estadístico SPSS. 11.0 se utilizo el X2 de Pearson, teniendo en cuenta las tablas de contingencia, medidas simétricas y estimados de riesgo, para una adecuada interpretación global de los resultados. Para dar significado del p.
RESULTADOS Y DISCUSIÓN
En relación a la sinonimia, el emplear la palabra precoz o incipiente (está última utilizada, en un momento por los autores del presente trabajo, es discutible).
La Escuela Japonesa acuño el término anglosajón de "Early Cancer" el año 1962, que como adverbio significa "temprano" y como adjetivo "temprano","primitivo", "remoto", "anticipado" o "matinal".
Temprano en castellano proviene del latín "tempranus", por "temporaneus" que como adjetivo significa "anticipado" o que es "antes del tiempo regular u ordinario".
Algunos autores, no toman en cuenta propiamente la etimología y lo llaman "incipiente" del latín incipies, y que en ingles es incipient "biginning o initial", que como adjetivo significa comenzar o que empieza. El cáncer, desde el punto de vista evolutivo, como señalaremos, tiene una larga evolución entre los 15 a 25 años según Fujita [3] y no podría ser, de acuerdo a este criterio, ni "remoto" ni "matinal" y tampoco que se presenta en un "tiempo anterior al regular" u "ordinario", por lo tanto, no lo podríamos catalogar de incipiente, por no saber cuando empezó.
El término Precoz en ingles "precocious" y aún "advanced" en algunos diccionarios, no es el más adecuado; de tal suerte, el término "early" o "temprano" debe ser aceptado, ya que los autores Japoneses lo denominaron EARLY CANCER.
En relación al criterio para catalogar este tipo de neoplasia maligna se basa en observaciones claramente especificadas como lo describe Nakajima [4] sobre la base de características nucleares y estructurales de las glándulas y células del tumor, aun en neoplasias sin patrón de invasión, como ocurre en el adenoma con displasia de alto grado.
Hay criterios como el de Hampson [5], que considera que es un pseudocancer, criterio por lo demás discutible, ya que como lo demuestran innumerables autores, entre ellos Tsukuma [6] que siguió 56 casos de CGT de 6 á 137 meses, 20 permanecieron como tempranos y 36 evolucionaron a la fase avanzada, desvirtuando la afirmación del mencionado autor.
FRECUENCIA:
En la gráfica 1 se señala el número de pacientes operados por CG en nuestro hospital que ha sido de 2,337, (45.66%) en relación a los 5118 CG. De estos 2,337, 371 fueron CGT que representaron el 15.87%.
El porcentaje de los CGT, en relación a los CGA, ha tenido un incremento progresivo: en el quinquenio comprendido entre 1963 á 1967 de 148 cánceres, 10 fueron catalogados como tempranos (6.8%), mientras que en el último quinquenio, entre los años 1998 á 2002, de 372 cánceres, se registraron 78 tempranos (21.9%). El promedio global de CGT a sido de 15.87%.
La frecuencia, de cánceres en general, en nuestra institución, ha aumentado notoriamente, lo que se debería a diversos factores, entre ellos, a un incremento de la población asegurada, y al aumento en la demanda, por ser nuestro Hospital referencial. Cabe señalar también, que la edad promedio del asegurado, se ha incrementado ostensiblemente y por lo tanto el riesgo para contraer la enfermedad es mayor.
El porcentaje de CGT, es el mayor registrado en nuestro medio nacional, que se sitúa en un promedio del 7%. El obtenido por nosotros nos parece bueno, para un país en desarrollo. En el último quinquenio ha sido del 21.9%, pero aún lejos de las cifras obtenidas por los japoneses, ya que hasta el año 1985 lo detectaban en un 52.1% en el National Cancer Center Hospital de Tokio, registrándose actualmente, en algunos centros del Japón, cifras superiores al 60%.
En nuestro medio, los primeros casos del CGT fueron reportado por Espejo [7] con la denominación de "cáncer precoz". Existe reportes de casos de CGT por diversos autores nacionales, en diferentes épocas:
Navarrete [8] registró 424 casos de CG entre ellos, 22 "incipientes" en el Hospital Rebagliati, en el período comprendido entre el 1959 al 1973, es decir el 5%.
Ramírez Ramos en el año 1982 [9] registró 8 casos en el Hospital de Aeronáutica. Sánchez [10] hasta el año 1996 reportó 89 casos. Nago [11] 40 casos.
Ramírez Ramos recopiló información en varios Hospitales de Lima en el año 1986: 126 casos de CGT de un total de 2316 CG, que hacían el 5.44%, y en el año 1996 el promedio fue de 6.9%. En 1996 en forma casi paralela el INEN registró 89 casos y Espejo y Navarrete [12] 200 lesiones en 181 pacientes con una proporción 12.65%.
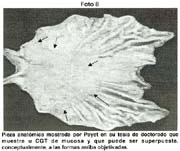
En el Instituto de Enfermedades Neoplásicas (INEN) Payet [13] reporta 236 CGT en 204 pacientes en 3,793 CG, que representan el 5.37%, desde el año 1952 al año 2000. En dicha Institución se ha observado un aumento progresivo de esta patología desde 298 entre los años 1952 al 1960 á 1634 en la década 1990 al 2000, notándose un progresivo incremento del porcentaje de CGT desde 1.01% en la primera década al 7.58% en la última. Lo registrado en el Instituto, coincide con la nuestra, en el sentido de que excluyendo otros factores, esta neoplasia se va incrementando en el Perú, tanto en lo referente al CGA como al CGT. Albujar [14] por ejemplo, señala en Trujillo, área poblacional más cautiva que la de Lima Metropolitana, que de 28.9 de incidencia entre los años 1984 al 1987 llego al 35.8 en el periodo 1991 á 1995.
En información verbal de la Dra. Miyasato del Hospital Almenara el porcentaje de CGT fue de 2.7% en 200 cánceres gástricos, en los últimos 5 años.
Debemos precisar que en el registro de cáncer gástrico para estudios poblacionales de Lima Metropolitana y los de Albujar para Trujillo Metropolitano, se consignan datos globales para todo tipo de neoplasia, sin lógicamente efectuar el análisis de los mismos.
El número mayor de CG, también hace posible que aumente el número de CGT, aunque su proporción en relación a los CGA, sigue en nuestro medio nacional, en general bajo.
En Brasil según Gama-Rodriguez [15] en el Hospital de las Clínicas de Sao Paulo, entre los años de 1971 á 1994, diagnosticaron 106 casos de CGT o sea 4.6 por año, que si lo comparamos con nuestros hallazgos, estos fueron mayores ya que se alcanzó al 9.5 por año.
En el mismo Brasil, Sakay informa que en el Instituto Nacional de Cancerología (INCA), de Sao Paulo el año 2002 se registraron 13,600 CG de los cuales 136 (10%) fueron CGT.
En América Latina los países que tienen mejor registros según Corrales [16] son: Costa Rica, Ecuador, Lima Perú, Trujillo Perú, Cali Colombia, Uruguay Montevideo y Chile. El Ecuador cuenta con 6 registros poblacionales de CG que varían en relación a su incidencia: 29.1 en la provincia de Guayas, a la cifra impresionante de 93.3 en la provincia de Loja, área geográfica colindante con el del Perú (el nudo de Loja nace en el Perú y se cierra en la provincia ecuatoriana de Loja). Los países andinos tienen una incidencia que bordea los 50x105 a diferencia de los de la Cuenca del Plata que cuya incidencia no sobrepasa al 20x105, exceptuando a Uruguay, que a pesar de ser región netamente platense, sobrepasa en mucho al de toda la Cuenca, posiblemente se deba a una diferencia del sistema de registro, como ocurre en forma similar a Costa Rica que aparece como el país Latinoamericano de mayor incidencia la que alcanza una tasa estandarizada de 70x105; este hallazgo estaría influenciado por un trabajo apoyado por la JICA en un estudio cooperativo muy bien desarrollado.
La incidencia señalada, que sólo se refiere en general a CGA no registra la de los CGT, pero en Ecuador (Quito provincia de Solca) el porcentaje de CGT fue de 7%. Que coincide con la mayoría de los datos registrado en nuestros centros nacionales, pero por debajo de lo encontrado en algunos Centros Institucionales.
En Chile LLorens [17] en un estudio tamizado en 42,496 endoscopías encuentra 11.02% de CGT en relación a los CGA; en una ultima referencia del mismo autor. [18], se mencionan 173 casos de CGT en 1555 CG, (11%). En el mismo país Calvo [19] en un estudio poblacional en 365,373 en un área de Santiago Chile, en mayores de 40 años, desde julio de 1996 al 2000 consigna 133 de CG, de los cuales 41 (31%) fueron CGT a razón de 17 CG por año y 5 CGT, número por año, también inferior a nuestra casuística.
Pisani [20] en Venezuela-Táchira el año 1980, en 114.000 estudios, con el apoyo logístico de la JICA para un programa de detección, encontraron 441 casos de cáncer que representaron el 0.39% no consignándose, en la comunicación el porcentaje de cáncer temprano.
En un estudio piloto en 5000 endoscopías, en población tamizada se encontró 27% para concurrentes con condiciones precancerosas y 21% en concurrentes sin riesgo y condiciones precancerosas.
Aparcero [21] En el Instituto de la Seguridad Social de Venezuela, en 17,389 endoscopía diagnosticaron 21 CGT de los 428 avanzados que representaron el 5%.
Everett [22] en una revisión de 30 artículos europeos, australianos, 32 japoneses, 3 coreanos y un brasileño que reunían el suficiente número de requisitos para su publicación, señala que en la serie occidental, las cifras variaron de Institución a Institución, siendo la menor de 11 y la mayor de 271 casos, que hacían un porcentaje del 10% al 20% en relación a los avanzados. En este mismo artículo se señala que en el Japón se registraron 17,212 CGT que representaron más del 50%, vale decir una diferencia abismal comparada con la serie occidental.
Otra información proporcionada por Gotoda [23], señala que en sólo 5 centros de alto nivel en el Japón se registraron 5,265 pacientes portadores de CGT hasta el año 2000 que representaron un porcentaje entre el 50% y 58%.
Consideramos que la proporción de los CGT en áreas especialmente occidentales y en los países latinoamericano sigue siendo baja como también ocurre en otras áreas no japonesa señalaremos por ejemplo que Han [24] en 1478 casos de CG en 10 años, el porcentaje de tempranos fue de 21%, en programa de detección y 13% en diagnósticos, de rutina.
En Italia, Perri [25] en 465 cánceres, encontró 20.5% de CGT.
Biasco [26] de 542 cánceres operados entre 1976 á 1982 (30 años) 80 fueron CGT (15.3%) 2.6 por años.
Según Borie [27] en Francia entre 1979 y 1988 se diagnosticaron 332 CGT en 23 Centros Franceses lo que hace 1.5 pacientes por año y por institución.
Craanen [28] en Holanda entre 1973 á 1989, en 302 cánceres gástricos en un Hospital general con 144 gastrectomizados (47.7%). 28 fueron CGT (19.4%). Ohman [29] en Suecia 1980,durante 3.5 años reporta 75 cánceres; 40 fueron operados 53% y fueron CGT 11casos (15%).
En Korea, Kong [30] reportó que hasta el año 1996, en 1277 casos de CG sólo el 4.7% fueron tempranos y que este porcentaje en el año 2001 se elevó al 17.2%.En Birmingham Halisey [31], describe el diagnóstico de CGT fue de 1% en 1980, y alcanzó el 10% en 1990.
Del África no existe muchos datos al respecto, pero según lo informa Oluwasola [32] parece que el cáncer gástrico es relativamente infrecuente, no obstante que existe una prevalencia del 80 al 85% de portadores de helicobacter pylori y lógicamente el CGT debería ser más frecuente.
El promedio de edad en nuestra serie fue de 64 años para hombres y 58 para mujeres que hacen una cifra global de 61 años, La edad promedio en los pacientes del INEN, reportada por Payet, fue de 62 años para varones y 58 para mujeres con una cifra global de 60, prácticamente igual a la nuestra.
En Chile Miranda [33] señala la edad de sus pacientes con CG en 60.9 años.
Everett [22] reporta que la edad de la serie acumulada en Europa de 1147 casos la edad fue de 59.9 años, esta cifra coincide casi exactamente con las anteriores. En otra serie japonesa de Yuasa [34] Los 3378 pacientes tuvieron una edad promedio de 57.8% años, cifra ligeramente menor a las observaciones anteriores; probablemente, debido a que en ese país oriental se realiza en gran escala programas de detección, en los que se incluye una gran población de menor edad.
La edad de las mujeres es menor, asunto conocido y reportado en muchos países tabla 1.
El mayor número de caso de nuestra serie se situó entre los 60 y 69 años tabla 2.
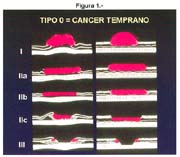
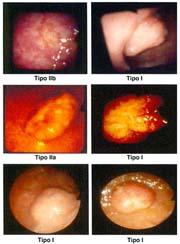
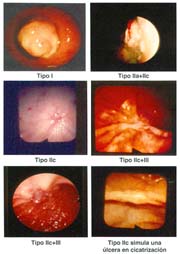
El cáncer gástrico (CG) se clasifica macroscópicamente en los siguientes tipos: 0 = Cáncer gástrico temprano (CGT) con sus tipos: I, IIa, IIb, IIc, III y sus combinaciones.
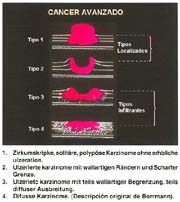
El cáncer gástrico avanzado (CGA) con sus tipos: 1, 2, 3, 4 y 5, que por la costumbre, se les denomina: Borrmann: I, II, III y IV. Borrmann no señaló el tipo V, como algunos autores los designan.
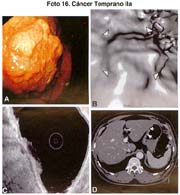
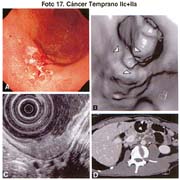
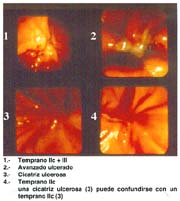
El tipo macroscópico puede ser determinado por la radiología, la endoscopía, por imágenes y finalmente, por observación de la lesión o pieza anatómica que corroborá el diagnóstico tabla 4.
En nuestro estudio, las formas elevadas (I, IIa, IIa+IIc, IIa+I) alcanzaron el 44.6%, porcentaje mayor al reportado por Hirota 24% y Nakamura 27%, pero más cercanos a lo señalado por Llorens 31.7% y aun más al del INEN, conforme lo señala Payet 41.4%.
Cabe mencionar que Gotoda en 3016 casos de CGT señala un porcentaje de 42.6 para lesipones "sin erosión o úlcera que podrían corresponder a formas elevadas excluyendo las de tipo IIb.
El hecho de que tengamos nosotros en el Perú y Llorens en Chile, mayor número de lesiones elevadas, que lo reportado por los autores mencionados se deba posiblemente a tener un mayor número de adenomas con malignización, Espejo y Navarrete [35] y también al hecho de que en nuestro medio las formas diferenciadas son muy frecuentes, donde precisamente priman los tipos elevados.
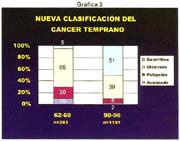
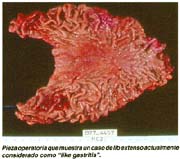
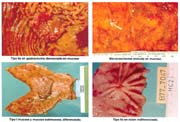
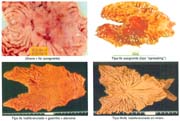
Las formas IIb, en todas las series, hasta el momento de analizar estos trabajos, son infrecuentes, pero hoy debe reconocerse que ellas, actualmente denominadas, "like gastritis" por algunos autores japoneses, como es el caso en el Nacional Cancer Center Hospital East Chiba, están siendo más frecuentemente reconocidas gráfica 2 y foto 4.
LOCALIZACIÓN
El 46.1% de las lesiones estuvieron situadas en el antro, el 37.3% en cuerpo, y 12.3% en el fondo.
En el National Cancer Center Hospital de Tokio, según Hirota [36] la localización más frecuente fue en el cuerpo con un 56% seguida en el antro 33% y 11% en el fondo También lo señala Nagayo que en 87 casos de CGT, 38 se encontraban en antro. y 49 entre cuerpo y fondo [46].
En el registro Nacional de Cáncer Gástrico del Japón Hirota [37] el tercio distal fue la localización más común, Gotoda en 5077 casos de CGT encuentra que el 32.3% se localizaban en el antro y 67.7% en cuerpo y 9.7% en el fondo.
Es posible que una de las causas que explique la localización más frecuente en nuestros casos sea en el antro, se deba al mayor número de adenomas con malignización y otras de tipo protruído que generalmente se sitúan en dicha región.
Esta localización preferentemente en antro también es señalada por Payet que le encuentra en 68.7%, 25.4% en cuerpo y 5.9% en el fondo. Llorens encuentra la localización en antro en el 42.5% y 35.3% en cuerpo con un total de 78.8% en ambas regiones.
La localización en el fondo es relativamente infrecuente en otras casuísticas y en la nuestra, salvo en lo reportado por alguno autores como Llorens que señala el 20%.
Según Siewert [38] la discrepancia que se encuentra en relación a la localización de las lesiones podría explicarse por varias razones, a saber: forma en la que es estudiado el espécimen quirúrgico y probablemente a la pericia, a la práctica y experiencia de endoscopistas cirujanos y patólogos.
TAMAÑO
Las variaciones del tamaño (tabla 8) son amplias, desde 5mm á 70mm en Europa y USA Biasco (26) Los carcinomas diminutos y pequeños de nuestra serie constituyeron el 26%, la de Llorens el 18.5% Fukotomi y Sakita encuentran 17% de cánceres diminutos y pequeños Chia reporta en Australia 21%(43). En la misma categoría, en Italia Everett reportó 35%(22). La mayor parte de los 16 diminutos fueron observados en piezas operatorias, generalmente acompañando a lesiones mayores y aún a otro tipo de patología, como adenomas y úlceras.
Estos rangos, en nuestra serie estuvieron comprendidos entre 1.5mm y 90mm. En 1987 Xuan revisando 2846 CGT en el Japón, encontró 50% de lesiones menores de 30mm y nosotros hasta el año 2002 encontramos en el 74%, Llorens en el 67%.
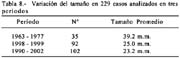
En las tabla 8 se muestra la evolución en el tamaño en relación a los quinquenios y a 3 períodos diferentes, lo que significaría, que a través del tiempo, las lesiones de menor tamaño han sido mejor observadas.
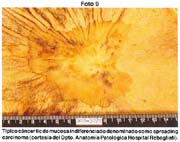
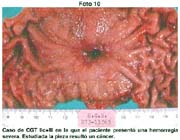
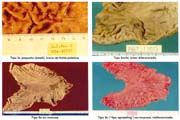
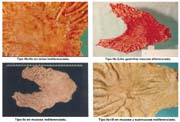
El tamaño de las lesiones también tiene otra interpretación en relación a su forma de extenderse en la mucosa y así el antiguo termino empleado por Stout [39] en el año 1942 de "Superficial Spreading Carcinoma" es decir "Carcinoma que se extiende superficialmente" ha sido retomado por los japoneses, como lo describe por Kasakura [40] pero en el sentido de ser considerados como tal, a las formas de erosión superficial de más de 25cm2 de superficie. (Fotos 1-8)
En relación a los "spreading carcinoma" demostrarían, que los cánceres de este tipo, relacionables a los IIc, se profundizan al expandirse (spreading) a la submucosa y tienen tendencia, como señalaremos, a evolucionar a morfología de neoplasias menos diferenciadas.
En los llamados cánceres "que se extienden superficialmente en la mucosa" (Superficial spreading carcinoma de Stout) definido como cáncer temprano de 5x5cm o más, Kasacura (encontró 59 casos (11.0%) entre los 538 canceres tempranos en los cuales la lesión comprometía la submucosa en 67.8% y pequeños carcinomas small que tenia 73.0% situado solamente en la mucosa.
En 393 pacientes del mismo autor, catalogados como portadores de tamaño reducido, es decir los pequeños el 55% comprometieron la submucosa; en nuestra serie, 68 casos pertenecientes a esta categoría, el 54% tuvieron compromiso de la submucosa.
Aunque no lo consignen los autores señalados, tabla 10 en 25 carcinomas diminutos (minute) es decir con un tamaño menor de 5mm, el 89.3% estuvieron localizado en la mucosa.
En los CGT catalogados como pequeños (small), es decir de 6 á 10mm, la localización estuvo en el 70.7% en la mucosa.
En contraposición en 27 CGT que tuvieron un tamaño comprendidos entre los 51 o más milímetros solamente el 26% comprometieron la mucosa. Estos resultados demuestran la estrecha relación entre el tamaño y la profundidad lo que nos permitirá tomar en cuenta como factor importante para el pronóstico.
Esta forma de spreading carcinoma fue encontrada por nosotros en el 6%, a diferencia de lo encontrado por Kasakura [40]. En el Hospital Universitario Nihon que los describió en el 11% en 538 CGT y en los cuales el 67.8% estuvieron situado en la submucosa. En nuestros pocos casos señalados, el 66.6% comprometían la submucosa, coincidiendo con el hallazgo japonés.
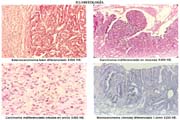
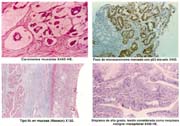
ASPECTO ANATOMOPATOLÓGICO
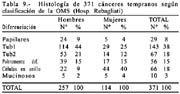
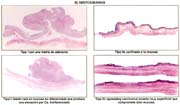
Existen muchas clasificaciones relacionadas al cáncer gástrico [43] siendo las más usadas, la de la OMS (tabla 9) muy práctica para la rutina. En ella se considera a los adenocarcinomas papilares, tubulares: bien diferenciados (tub1), medianamente diferenciados (tub2), pobremente diferenciado (tub3) y a los adenocarcinomas en células en anillo (mucocelulares), propiamente indiferenciados y mixtos; mucinosos o mucoides, que no deben ser confundidos con los mucocelulares; además formas raras de tipo escamocelular. Los papilares son de hecho diferenciados y a los tubulares pobremente diferenciados se les agrupa juntos con los mucocelulares y los propiamente indiferenciados, como indiferenciados.
Los mucinosos, que en nuestra serie han constituido sólo el 3%, en la práctica, según el grado o presencia de mucinas se le considera como diferenciados o indiferenciados, según prima el grado de diferenciación del tejido. En algunas series como la de Yasuda [44] el cáncer mucinoso, en 806 pacientes tratados entre 1983 al 2002, alcanzó el 1.1%, y en los CGT, el 0.9%.
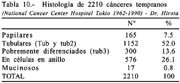
Es necesario precisar que para considerar a los carcinomas como diferenciados, más del 50% del tumor debe de estar compuesto por glándulas según Contreras [45] cuando utilizamos la clasificación de la OMS, la mostramos en la tabla 9 y comparándola con la del National Cancer Center en la tabla 10.
Para Nagayo [46] es más "razonable y práctico" clasificar de acuerdos a las características histológicas, en bien diferenciados, moderadamente y pobremente diferenciados, de alguna manera parecida a la antigua clasificación de Broders como lo señalamos en un trabajo anterior Espejo y Navarrte [43]. La clasificación de Lauren, que se apoya en la matriz de la mucosa con o sin metaplasia en: intestinales y difusos es útil para estudios epidemiológicos y es muy usada, sobre todo en los países europeos y como hemos remarcado no es excluyente con las otras clasificaciones, ya que en general las formas intestinales son más frecuentes en los países de alto riesgo, en varones, en persona de mayor edad y en portadores de lesiones elevadas.
Los japoneses sobre las bases de las características histológicas y el grado de diferenciación los encuadran dentro de los términos de diferenciados e indiferenciados Japanese [47].
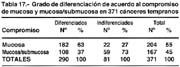
Cuando se examina la tabla 17 se ve claramente que en los casos en que solamente la mucosa estaba comprometida, priman las formas diferenciadas como es señalado por muchos autores Ferrari [41] Hampson [5] Maehara [42]. De los 25 microcarcinomas de nuestra serie, todos estuvieron situados en la mucosa, sólo un caso fue indiferenciado y ninguno tuvo metástasis ganglionar ni invasión linfática y venosa.
CARACTERÍSTICAS HISTOLÓGICAS
Debemos reconocer que las 3 clasificasiones y aun otras no se excluyen y más para nosotros se pueden complementar [43].
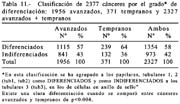
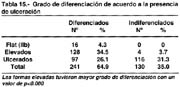
En 1956, 1115 CGA fueron diferenciados (57%) y 841 indiferenciados (43%). En 371 CGT 239 fueron diferenciados (64%) y 132 indiferenciados (36%) con porcentajes globales de 58% y 42% respectivamente lo que indica que cuanto más temprano es un cáncer su grado de diferenciación es mayor.
En relación al sexo tabla 12 el grado de diferenciación fue de 74% en hombres y 42% en mujeres.
En relación al tamaño (tabla 13) cuanto más pequeño es un cáncer, como se observa en la misma tabla el grado de diferenciación es mayor; de 25 diminutos 92% fueron diferenciados, cuando eran pequeños el 79 fueron diferenciados y los de mayor tamaño a 11mm el grado de diferenciación alcanzó el 69%.
En un estudio comparativo entre lo obtenido por nosotros (tablas 9 y 10) comparados con lo encontrado por Hirota y Ming en 2210 casos, 60% fueron diferenciados [36], lo que evidencia una significativa concordancia; que no ocurre con lo reportado por otros autores japoneses como Gotoda del National Cancer Center Hospital, Tokio, Japan [23] que consigna que el 54.6% de sus 3016 casos fueron diferenciados.
En la serie Europea señalada por Everett, 60% fueron diferenciados [22]; Craanen [28] encuentra que todos los de tipo elevado fueron intestinales y de los tipo deprimido el 70% fueron difusos y el 10% intestinal y el 20% mixtos.
Las formas elevadas definitivamente son muchos mas diferenciadas con cualquier tipo de clasificación a las que se les relaciona; nosotros encontramos que el 90% de las formas elevadas fueron diferenciadas; Craanen empleo la clasificación de Lauren y su resultado no es incompatible con el nuestro.
Llorens en Chile encuentra 67.6% diferenciados en un estudio de 168 casos.
En nuestro medio Payet en 236 adenocarcinomas señala 67.7% de diferenciados, 20.8% de indiferenciado y 11.5% de mixtos, estos últimos, en los que arbitrariamente habría una proporción igual de diferenciados e indiferenciados, el grado de diferenciación sería aún mayor.
La tabla 11 muestra claramente que el grado de diferenciación es mayor en los tempranos (64%) que en los avanzados 57%.
En relación al sexo tabla 12 en los hombres los diferenciados representaron el 74% y en las mujeres el 42%.
El grado de diferenciación también esta de acuerdo a la profundidad y existencia de ulceración en las lesiones.
Cuando las lesiones ocuparon tabla 17 sólo la mucosa el 63% fueron diferenciados y cuando avanzaron hasta la submucosa el 37% tuvieron esta diferenciación. En general tanto los diferenciados como los indiferenciados representaron el 55% cuando ocuparon la mucosa.
De acuerdo al tipo las formas elevadas en la tabla 15 las formas elevadas fueron 90.1% diferenciados en las formas ulceradas el 45% y en los 16 todos fueron diferenciados.
En 23 canceres diminutos se encontró 22 casos con metaplasia 95.6% en los 46 pequeños 39 se acompañaron de metaplasia 84.7% y en el de mayor tamaño disminuyo el porcentaje de metaplasia.
Comparando lo descrito en relación al grado de diferenciación con la serie de Hirota del NCCH de Tokio, las formas diferenciadas alcanzaron en esta serie japonesa un porcentaje de 59.5%. Otras series japonesas señalan porcentaje alrededor del 60% Ohta [48]. Xuan [49] Maehara [42], Endo [50].
En las formas iniciales de los cánceres por lo tanto no se presentan las formas mixtas cosa que ocurren cuando los cánceres adquieren más volumen y mayor grado de profundidad apareciendo las formas mixtas de allí la importancia de establecer los grados de diferenciación según el criterio de temporalidad.
Es necesario remarcar que lo reportado por nosotros 64%, por el INEN, 67.7% y por Llorens en Chile 67.6% demostraría que en las áreas de alto riesgo, que es el caso de los países del área andina las formas diferenciadas priman claramente sobre las indiferenciadas.
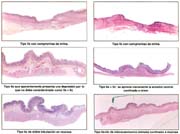
PROFUNDIDAD
El 55% de nuestros CGT se localizaron en la mucosa y el 45% en la mucosa/submucosa con una proporción de mucosa/submucosa 1.13:1. En los primeros 4 quinquenios tabla 16 esta relación fue de 0.4:1 y en los 4 últimos de1.4:1 porcentaje para ambas regiones del 12.6%. Los 182 situados en mucosa tuvieron un 63% de diferenciación; los 108 situados en mucosa/submucosa 37% fueron diferenciados, lo que significa que a menos profundidad existe mayor grado de diferenciación.
Los datos obtenidos por nosotros concuerdan, de alguna manera, con lo reportado por Everett [22] de 1:1. Fukutomi y Sakita [51] en 17,212 casos de CGT observan una relación de mucosa y submucosa de 2.3:1. Gotoda [23] en 5,265 casos señala la relación de 2.2:1, cifras muy superiores a la encontrada por nosotros; sinembargo, aún en el Japón, en el Dpto. de Cirugía del Nihon University School Kasakura [40] durante 10 años entre 1986 á 1995 diagnosticó 538 pacientes con CGT (38.1%) de los cuales 244 (45.4%) estuvieron en la mucosa y 294 (54.6%)se situaron en la submucosa, con una relación de 0.8:1; es probable que esta relación haya mejorado a partir de ese año, como también a ocurrido en nuestra serie, tabla 15 como lo hemos señalado.
En Chile Llorens [52] en sus 21 primeros casos estudiados entre los año 1978 á 1981 obtuvo una relación de m:ms 1.1:1 y Payet en nuestro medio reporta que de 209 CGT tabulados, la relación fue de 1.2:1 en comparación a la nuestra que en 371 casos fue de 1.13:1.
INVASION DE GANGLIOS LINFATICOS
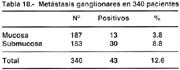
La invasión ganglionar tabla 18 es relativamente común en este tipo de cáncer, que esta entre el 10 al 20%, como lo señalan la mayoría de las comunicaciones. La presencia de nódulos metastáticos guarda una estrecha relación con la profundidad de la invasión (tabla 18). En nuestros casos cuando la lesión estuvo confinada a la mucosa el porcentaje fue del 3.8% y cuando comprometían la mucosa y submucosa fue de 8.8% que hacían un porcentaje global de 12.3%. Everett informa que estos porcentajes estuvieron entre el 15 al 30% en la serie europea, cuando la lesión comprometía la submucosa y de menos de 5% cuando el compromiso era solo de la mucosa.
Ono [53] en el Japón en el NCCH IAST de Tokio y en el Dpto. de Oncología señala que la presencia de nódulos linfáticos es mayor que en el occidente, debido probablemente a que en ese país se efectuaba una limpieza ganglionar mucho más prolija: ("cirugía de ganglios"); Sin embargo, existe una clara tendencia actualmente, en efectuar resecciones más económicas, polipectomías y mucosectomías, que permitirían en un número considerable de cánceres, no efectuar resección en ganglios más allá de la cadena N1, siempre y cuando se cumpla con los requisitos exigidos para efectuar estos procedimiento, como lo señala Sasako [54] Cuschieri [55].
Coincide en señalar estos criterios de resecabilidad como también lo señala últimamente Yoshikawa [56] del Dpto. de cirugía Yokohama, que de un total de 280 pacientes operados por CGT las metástasis fueron sólo del 6.5%.
Gotoda [23] en 5,265 pacientes portadores de CGT del National Cancer Center Hospital de Tokio, del Cancer Institute de Tokio, del Oncology National Cancer Center Hospital y del National Cancer Center Research de Tokio, señala que la metástasis ganglionares fueron menores en los hombres (2.3%), lo situados en el antro (2.3%), en las formas elevadas en el 0.5% en los de menos de 10mm en el 1.1%, en las formas diferenciadas en el 0.4%, en las formas sin ulceración en el 0.5%.
Craanen [28] en Holanda señala que los CGT en el 9.7% tuvieron metástasis y ninguno de los situado en mucosa presentó esta condición.
Payet señala que el porcentaje fue encontrado por ello en el 14.3% y solamente el 2.2% cuando comprometieron la mucosa y el 24.6% cuando el compromiso fue hasta la submucosa.
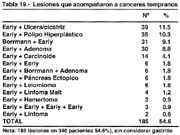
LESIONES CONCOMITANTES
Desde hace mucho tiempo existen criterios para considerar cánceres sincrónicos como lo estableció Moertel [57].
1. Cada lesión debe ser patológicamente probada.
2. Cada lesión estar separada por intervalos de mucosa microscópicamente normal.
3. La posibilidad de que sea una extensión o metástasis, debe ser excluida.
En los 340 estómagos examinados encontramos 185 lesiones concomitantes que hacen el 54.6%. En los 340 casos se encontró sincronismo de early con early en 9 casos (2.7%) en la serie Europea esta situación se dio entre el 2% y 14% y en el Japón de 5% a 13%; pero si consideramos el porcentaje de cánceres sincrónicos tempranos y avanzados, el porcentaje se sitúa en el 12.8%.
En 37 casos hubo sincronismo entre cánceres CGA y CGT, lo que representó 10.9%.
56 lesiones neoplásicas benignas acompañaron a los CGT 16.5%. 6 linfomas acompañaron a CGT (4 Malt) 1.8% y en 14 casos estuvieron asociados al carcinoide 4.1% no se debe dejar mencionar en casos de CGT se encontró asociados con páncreas aberrantes 1.8%. Solo en 3 casos se encontraron lesiones hamartomatosas 0.9%. Comparando con otras observaciones como la de Noguchi [58] en que el diagnóstico fue de 35% de microcarcinomas sincrónicos.
Taketshita [59], en 400 casos de CGT encontró 52 lesiones sincrónicos (11.7%).
Craanen [28] en Holanda señala una concomitancia del 10%.
Moreaux [60] en Francia puntualiza que el sincronismo fue del 12.9% en 101 casos de pacientes con CGT.
Excepcionalmente en la literatura se reporta hasta un 48% de lesiones sincrónicas, como la serie de Gardiner [61] que posiblemente se refiera a todo tipo de lesiones que en nuestra serie representaron el 54.6%. El hecho de encontrar frecuentemente CGT con otros tempranos y avanzados según Gardiner [61] representaría la convergencia de múltiples focos primarios que en un tiempo y en circunstancias especiales evolucionaría a una sola lesión.
Muchos de los cánceres sincrónicos detectados por nosotros fueron encontrados en un examen minucioso de la pieza operatoria como también lo señala Noguchi que detecto un 35% de microcarcinomas sincrónicos.
En nuestro estudio, estos pequeños cánceres fueron detectados después de haberse practicado gastrectomías, con el diagnóstico de avanzados. Sólo en 6 casos el diagnóstico primario fue de tempranos, generalmente correspondientes a adenomas de tamaño considerable y con focos de malignización.
En la tabla 20 se indica, que todos nuestros casos se acompañaron de cualquier tipo de gastritis; 232 fueron metaplásicas 63%. De estas gastritis metaplásicas el 50% fueron incompletas. 20 casos de gastritis verrucosa, que representaron el 5%, son consignados, por el hecho de que estas lesiones, como lo señaló Sano, referido por Espejo y Navarrete [43] son alteraciones que sirven para explicar en algunos casos la histogénesis de la neoplasia, los 8 casos de CGT del muñón asentaron en gastritis metaplásica incompleta, lo que elevaría el porcentaje de gastritis metaplásica al 65% en nuestra serie. Sánchez [62] reporta que en los 89 CGT hasta el año 1990, 70.7% tuvieron metaplasia. En nuestro Hospital y el INEN las formas diferenciadas que son muy relacionables al tipo intestinal de Lauren, son muy numerosas, lo que explicaría el alto porcentaje de metaplasia.
Actualmente Kirchner [63], se señala la importancia de estudios minuciosos sobre metaplasia intestinal el autor puntualiza que las L cytokeratin-7 (CK7) están presentes en el feto y largamente ausente en el adulto. Se investiga la expresión del CK7 en estómagos de fetos, en estómagos sin neoplasia, con metaplasia, en neoplasias malignas intraepiteliales y en los CGT, situaciones en que los cambios metaplásicos y neoplásicos, serían secuénciales hasta llegar al cáncer explicando los términos de las "stem cell" y "diferenciación". Sin embargo para otros autores como Barbosa [64] la metaplasia debe ser fundamentalmente considerada como un elemento que crea un ambiente adecuado para la acción de cancerigenos y pobre acción de antioxidantes y que modificación del tejido, sería más bien un epifenómeno de adaptación de la mucosa.
Kase, señala que la expresión del p53 fue significativamente mayor en los cánceres intramucosos y en los adenomas, lesiones ambas con gran componente metaplásico, conforme lo hemos observado nosotros [35].
SINTOMAS Y SIGNOS
Morlock y Hartman [66] manifestaban textualmente: "Los síntomas del carcinoma del estómago no siempre son típicos o definidos, como ha afirmado con razón MacCarty, el carcinoma precoz del estómago no presenta signos o síntomas de un libro de texto, y cuanto antes se aprecie esta verdad, más pronto se tratará el problema de un modo inteligente y con éxito, pues el cáncer de estómago comienza como una lesión pequeña curable e incumbe al clínico la responsabilidad de reconocer dicha lesión como lo que realmente es".
Tener en cuenta que la gastritis, especialmente en sus formas severas, acompaña a las lesiones malignas, considerándosele como un precursor o más bien como una condición importante para el desarrollo de la enfermedad.
Las úlceras gástricas grandes, o aun las pequeñas y circunscritas constituyen un reto para el clínico, porque suscitan el delicado problema de establecer una decisión exacta sobre si son benignas o malignas, acentuándose aun más difícil el diagnóstico, en el caso de que exista una historia de dispepsia ulcerosa típica y recidivante de largo tiempo de evolución, pues dichas lesiones pueden responder fácilmente al peligroso "tratamiento de prueba" con respuesta favorable al comienzo, cuando se ha tratado el denominado componente ulceroso, demostrándose más tarde que fueron lesiones malignas desde su inicio o "ulceras cancerificadas".
El 82% de casos presentaron síntomas dispépticos que es explicable en pacientes que concurrían al Hospital por alguna molestia digestiva, pero también por el hecho de que la gran mayoría de ellos eran portadores de gastritis ("No hay cáncer sin gastritis") el dolor estuvo presente en el 44% en nuestro estudio, y en mitad de ellos, 20.6% fue de tipo ulceroso, explicable por el hecho, de que un número grande de casos, tenían lo que se ha dado por llamar, el componente "ulcero péptico" del cáncer, especialmente en las formas III, IIc+III y III+IIc. En el INEN el dolor fue registrado en el 52.9%, en la de Nago constituyo 77.5%. La hemorragia digestiva estuvo presente en el 10.1%, explicable también, por la circunstancia de presentar ulceración que compromete especialmente el sistema arterial.
Nago lo reporta en el 17.5% de sus 40 casos. En el INEN fue de sólo de 3.8%.
El síntoma predominante en nuestra serie fue la dispepsia en el 82.2%, en el INEN en el 37.4%.
En la serie europea el cuadro dispéptico se presentó entre el 60 y 90%. Otros síntomas fueron menos importantes en toda la series.
Debe precisarse, que en una determinada población sometida a exámenes de detección, en el que no es requisito presentar síntomas, estos pueden no ser observados.
Pero debe señalarse, que existe, según el tipo de estudio, un gran número de ellos, asintomático como lo señala Kong [30]
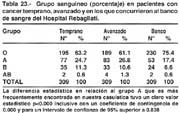
GRUPO SANGUÍNEO
Siempre se ha considerado controversial la mayor incidencia de cáncer en el grupo A. la asociación entre este grupo y el CG se conoce desde hace ya más de 30 años siendo el trabajo original el de AORD [67] que también fue estudiada por otros autores como DOLL 1960 y por HOSKING en 1965. Hirayama [68] desde hace mucho tiempo, en grandes series japonesas, no encontró diferencia significativa. En nuestro estudio, es interesante señalar que 24.7% de pacientes portadores de CGT tuvieron el grupo sanguíneo A, que comparado con un mismo tipo de población del banco de sangre que presentaba, 17.4%, evidentemente hay una clara diferencia, estadísticamente muy significativa. La población peruana tiene un manifiesto predominio del grupo 0 por su origen básicamente mongólico, que se reduce significativamente en los portadores de cáncer al menos en nuestra observación. La diferencia entre portadores de CGA y CGT no es estadísticamente significativa. Vojvodic en un estudio que ha servido para optar el titulo de Doctor en Medicina, encuentra cifras parecidas y aun mayores a la nuestra, en una población hospitalaria semejante; considerando que también sería, para él, un factor de riesgo relativo. Braghetto, [69] señala un riesgo hasta del 20%. En Chile, por el contrario, Csendes [70] tampoco encontró diferencia entre paciente con cáncer gástrico, úlcera duodenal y testigos.
Se podría postular que existen factores genéticos presentes en los portadores del grupo A y del complejo A, B ó AB.
ACIDEZ GÁSTRICA
La acidez gástrica no es elemento practico para el diagnostico de cáncer, pero nos ha servido para interpretar otros aspectos en relación, a esta patología.
Históricamente se ha relacionado el grado de acidez con el cáncer gástrico, señalándose que es 3 ó 4 veces más frecuente en personas con aclorhidria que en aquellas que tienen acidez normal. Ya en 1956 Berkson [71] encontró en 837 pacientes con aclorhidria una incidencia 6 veces mayor de cánceres que en la población general.
El bajo grado de acidez o la aclorhidria es encontrada con más frecuencia en los países de alto riesgo por la existencia mayor de gastritis, como lo ha observado Ramírez Ramos [72] y otros autores nacionales como León Barúa [73] Pero no existen muchos trabajos que lo relacionen con el CGT. Nosotros hemos prejuzgado, que este tipo de cáncer gástrico, asienta sobre una mucosa gástrica con diferente producción de ácido, sobre la base, de que las formas especialmente diferenciadas, asientan sobre mucosa gástrica con gastritis crónica atrófica, especialmente metaplásica en la que no existe producción de ácido. Estos cánceres cursarían con aclorhidria o por lo menos, con hipoclorhidría, como se observa en las tablas 24 y 25. Los cánceres protruidos y no ulcerados, básicamente son diferenciados y cursan con un marcado déficit en la producción de ácido y por el contrario, las formas ulceradas, todas tienen, en más o en menos, presencia de ácido y en 28% inclusive, con hiperclorhidria, ninguno de ellos presentó aclorhidria verdadera (la aclorhidria verdadera se define cuando se a presentado con cuádruple dosis del estimulante, n nuestro caso, el histalog). Al estudiar lesiones precancerosas los adenomas y aun los pólipos hiperplásticos[35] consideradas como condiciones precancerosas tienen un comportamiento fisiológico similar, lo que indicaría una histogénesis común.
Debe presumirse, que las neoplasias que asientan en mucosa de tipo gástrico (mucocelulares) tienen preservada su capacidad para secretar ácido, ya que su sistema oxíntico, no esta comprometido y la acción del ácido daría lugar a erosión o ulceración de carácter péptico, como ocurre en las formas III, IIc, IIc+III o III+IIc que conservarían los focos de cáncer, sea en la mucosa o mucosa/submucosa en los márgenes de las úlceras, las que representan el componente ulceroso, lesión que inclusive puede penetrar a capas más profundas, constituyendo una típica úlcera péptica, hecho que a dado lugar al viejo concepto controversial de la famosa malignización de la úlcera.
Autores extranjeros como Shiotani [74] manifiestan que la combinación de hipoacidez con alto contenido de nitritos, inducida por la infección del helicobacter pylori, está asociada especialmente con cánceres de tipo intestinal y de forma elevada. En nuestra observación este tipo de cánceres con un marcado descenso del tenor de ácido se debería aun número de lesiones con matriz de adenoma.
DIAGNÓSTICO
El diagnóstico de este tipo de cáncer fundamentalmente se ha hecho sobre la base del estudio endoscópico con comprobación anatomopatológica siguiendo los criterios japoneses [75].
El diagnóstico endoscópico puede llegar al 90% de lesiones deprimidas en la rutina endoscópica [76].
En el Japón [77] se señala que el carcinoma gástrico es diagnosticado sobre criterios de alteraciones nucleares y estructurales, aun cuando la invasión esta ausente, interpretación contraria al punto de vista occidental, discrepancia que se reduce cuando se correlaciona la biopsia, que es una muestra superficial, con el espécimen de la resección final. Este hecho, puede contribuir junto con otros, a la alta incidencia y al mejor pronóstico de cáncer en el Japón y también aunque en menor proporción, en los países del tercer mundo y específicamente al nuestro.
Cabe señalar que en 27 casos practicamos la polipectomía, previa biopsias, las que demostraron la existencia de tejido neoplásico maligno. Hasta ese entonces, salvo en algunos casos, no teníamos ni siquiera la indicación precisa para este tipo de procedimiento: (Ca diferenciados, con superficie erosionada de menos de 15mm, de tipo elevado I y IIa hasta de 20mm, todas con compromiso sólo de mucosa) actualmente las indicaciones se han ampliado como lo señala Ono [53] de los 27 casos polipectomizados, 25 tuvieron un tamaño menor de 20mm y 2 de más de 25mm, uno de ellos, de tamaño inusitado, de 70mm, que por ser de carácter hamartomatoso y semi pediculado se consideró posible extraerlo por partes, resultando un caso raro de hamartoma con foco de neoplasia maligna intraepitelial. Sólo un caso de los estudiados comprometía la submucosa y fue seguido hasta la actualidad sin que se encuentre recidiva.
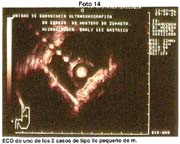
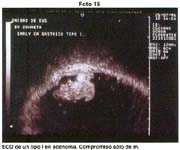
Cuando dispusimos de la ecografía endoscópica, practicamos mucosectomía en 3 casos de lesiones deprimidas de tipo IIc que ecográficamente no comprometían submucosa y de carácter diferenciado, ninguna de las mucosas obtenidas por este procedimiento presentó neoplasia maligna en la submucosa. Igualmente hemos tenido oportunidad de efectuar estudio ecográfico en lesione elevadas y practicar más cómodamente la polipectomía sabiendo que la neoplasia sólo comprometía la mucosa.
La radiografía de doble contraste a sido para nosotros un elemento secundario, a pesar de reconocer, que en manos expertas, como lo de mostró Shirakabe es de gran utilidad y que permite como sucede con en la endoscopía hacer estudio "semiológico" de los pliegues e intuir la profundidad. La ecografía endoscópica es empleada, en algunos casos para efectuar mucosectomías y determinar el estadiaje T. este procedimiento como lo hemos manifestado Es empleado con más frecuencia, con las indicaciones señaladas. En el Japón fácilmente se llegó al 20% de mucosectomía.
En algunos centros especializados como es el caso del Nacional Cancer Center Hospital de Tokio Ono [53] y colaboradores señalan que en el año 1978 la mucosectomía endoscópica se practicó en el 5% de casos de CGT y ya en el año 1988 se practicaron 479 mucosectomías que hacían el promedio de 48%. Cuando se efectuó 479 resecciones se encontró cáncer intramucoso en 405 casos que estaban confinados en la mucosa y que sólo tuvieron una recurrencia en 5 casos 2% los que fueron sometidos a la aplicación del láser. 74 casos tuvieron un compromiso de la submucosa, 44 fueron sometidos a cirugía oncológica y 30 de ellos seguidos y controlados y sólo 11 casos tuvieron recurrencia local.
Esta conducta nos induce a considerar la enorme importancia que puede ofrecer este tipo de tratamiento endoscópico que permite una reducción drástica de la mortalidad operatoria, que puede llegar hasta cero, y que influye en forma notable en los costos hospitalarios y también obliga a un buen entrenamiento endoscópico y realizar el procedimiento teniendo en cuenta el criterio de la Japanese Classication of Gastric Carcinoma [2]. Igualmente la tomografía computada es un procedimiento que puede ayudar al diagnóstico.
Últimamente como lo emplea Bhandari [78] Oto, Ogata Wood, Lee entre otros la gastroscopía virtual y la reconstrucción multiplanar; nos muestra imágenes de alta resolución y belleza pero que a nuestro modo de ver, no contribuirían, mayormente, ni establecer diferencias significativa con la endoscopía convencional y la ecografía endoscópica. La ecografía endoscópica fue considerada indispensable para poder realizar la mucosectomia, actualmente, como se ha señalado, las indicaciones clásicas han sido ampliadas y no sería indispensable, como los mismo japoneses lo señalan, para efectuar la mucosectomía, siempre y cuando se tenga un buen diagnóstico endoscópico y se sigan estrictamente las indicaciones actuales como lo señalado. En relación al último criterio, debe presuponerse una adecuada preparación endoscópica sobre todo en las formas superficiales de tipo IIc con lo que se considera una semiología de los pliegues.
En los países occidentales el diagnóstico de CGT es raramente establecido antes de la cirugía y en Birmingham Hallisey MT, solamente 3 de 15 CGT fueron diagnosticado por endoscopía esta situación la reportan otros autores Europeo Ballantyne [79] Kim [80]. recientes estudios han demostrado que la hipermetilación del DNA comienza temprano en la progresión del cáncer, y en algunos casos precede al proceso neoplásico y que sería un mecanismo crucial para inactivar a genes supresores siendo una nueva oportunidad para el diagnóstico muy temprano de cáncer.
TRATAMIENTO
El tratamiento del CGT presupone eliminación de las células neoplásicas malignas y en la actualidad sólo la cirugía a podido ofrecer supervivencia prolongada, incluso en el cáncer avanzado.
La resección endoscópica, sea con polipectomía o mucosectomía, a cobrado últimamente una gran importancia.Por ejemplo Giuli [81] es de opinión que en los cánceres de mucosa menores de 30mm la disección de ganglios linfáticos sería innecesaria, teniendo en cuenta además del tamaño, el grado de diferenciación la macroscopía entre otros aspectos promedio nódulos linfáticos y desviación estándar, grado de diferenciación, macroscopía entre otros Ahn [82]. El cáncer metastático esta relacionado a una condición incurable y la quimioterapia es usualmente aceptada como un método paliativo estándar.
Algunos autores como Abe [83] aun amplían los criterios para la mucosectomía a los de la mucosa con carácter de indiferenciados hasta el tamaño de 10mm, que también en la practica no dan metástasis ganglionar.
PRONÓSTICO
El pronostico esta en relación a los siguientes factores según Gotoda [23] dependiendo de:
- Sexo
- Localización del tumor
- Tipo microscópico
- Tamaño
- Tipo histológico
- Hallazgo de ulceración
- Compromiso ganglionar
- Grado de penetración
- Compromiso linfático-vascular
Debemos adicionar ha esta lista otros elementos que pueden contribuir a establecer el pronostico.
- Edad
- Grupo sanguíneo
Gotoda informa que en 4 centros de alto nivel en el Japón se diagnosticó 5,265 CGT y se estudiaron 9 factores clínicos patológicos. De 3,016 lesiones (57.2%) fueron de mucosa y 2,249 (42.8%) mucosa/submucosa.1,230 fueron bien diferenciados intramucosos de menos de 30mm de diámetro. De las 929 lesiones sin ulceración 95% no tuvieron metástasis. Ninguno de los 145 diferenciados de menos de 30mm tuvieron metástasis. En general sólo 65 casos: (2.2%) de cánceres de mucosa estuvieron asociados con LNM, en comparación, 402 casos en que la submucosa estaba invadida (17.9%) tuvieron LNM.
El compromiso linfático ganglionar se presento sólo en 19 casos. Craanen [28] señala una supervivencia de 85.7% los situados en mucosa y 81.8% los que comprometía submucosa.
Para Yokota [84] la presencia de nódulos linfáticos es el mejor factor para señalar el pronóstico del cáncer.
Aihara [85] considera que los carcinomas en células con anillo tiene un menor grado de metástasis y un mejor pronóstico.
Dionigi [86] señala el BrdU LI puede ser considerado como un buen indicador para señalar la agresividad del cáncer método todavía alejado de nuestras posibilidades.
La sobrevida del CGT en el Japón alcanza cifras impresionante, que van del 95 al 100% en los situados en mucosa de 90 á 95% en los situados en mucosa, mucosa/submucosa.
En el área occidental estas cifras son considerablemente menores. En un estudio llevado a cabo en nuestro medio hospitalario por el doctor Luis Montero se siguieron 70 casos con una vigilancia de 5 años. El porcentaje de sobrevida de los pacientes que portaron CGT localizados en la mucosa fue de 94% y los situados en la submucosa del 88% con un porcentaje global de sobrevida del 91%.
Vojvodic [87] en su observación señala una sobrevida de 87.5% para los menores de 65 años y de 83.33% en los de más 65 años con un porcentaje global del 85% considerando el estadío IA, debemos hace la astingencia de que el estadio IA no es exactamente superponible al criterio del CGT.
Payet en el INEN reporta que la sobrevida global en es tipo de cáncer fue de 87.5% a los 5 años. Estos 3 resultados nacionales, lo nacionales los consideramos como buenos.
Debemos también reconocer el excelente rendimiento cuando se efectuó polipectomías en adenomas, con compromiso sólo de la mucosa pacientes seguidos por 5 años con una sobrevida que alcanzó el 100%.
AGRADECIMIENTO
Se agradece al Sr. Javier Bravo Medrano por su trabajo en la diagramación del presente artículo.
BIBLIOGRAFÍA
1. Japanese Research Society for Gastric Cancer. The general rules for the gastric cancer study in surgery and pathology. Jpn J Surg 1981; 11:127-145. [ Links ]
2. Japanese Research Society for Gastric cancer. NISHI M, OMORI Y, MIWA K, eds. Japanese Classification of Gastric carcinoma. Tokyo: Kanehara and Co., Ltd, 1995. [ Links ]
3. FUJITA S. Biology of Early Gastric Carcinoma. Path. Res. Pract. 1978; 163, 297-309. [ Links ]
4. NAKAJIMA T, OCHIAI T, OGAWA M, et al. Meeting report of the 71st Japanese Gastric Cancer Congress. Gastric cancer. 1999 2:145-150. [ Links ]
5. HAMPSON L, SHENNIB H, LOUGH J, FRIED G. Early gastric cancer: is it a distinct clinical entity? Can Assoc Gen Surg. C Journ Surgery. 1990; 33:349-352 [ Links ]
6. TSUKUMA H, OSHIMA A, NARAHARA H, et al. Natural history of early gastric cancer: a non-concurrent, long term, follow up study. Gut 2000;47:618-621. [ Links ]
7. ESPEJO H, PARODI L, PURÓN R. "Cáncer gástrico precoz en el Hospital Central del Empleado" III CONGRESO PERUANO DE GASTROENTEROLOGIA-ANALES Impreso en INDUSTRIAL gráfica S.A Chavín 1972;96. [ Links ]
8. NAVARRETE J. Patología del cáncer incipiente y avanzado de estómago. Tesis doctoral UNMSM. 1976;13. [ Links ]
9. RAMIREZ A, MORÓN J., GALARZA y cols. Evaluation of eight cases of early gastric cancer. Arq Gastroenterol 1982;19-12. [ Links ]
10. SÁNCHEZ J. Histología del Cáncer gástrico GASTRUM 1996;3741. [ Links ]
11. NAGO A. Cáncer gástrico incipiente estrategia para su detección, Tesis de doctorado U. Cayetano Heredia 1991; 27. [ Links ]
12. ESPEJO H, NAVARRETE S. Cáncer gástrico temprano GASTRUM, 1996;122:14-34. [ Links ]
13. PAYET E. Cancer gastrico precoz tesis para optar el grado de maestria en medicina 2004;pp. 23. [ Links ]
14. ALBUJAR P. El Cáncer en Trujillo-Registro de Cáncer de Trujillo-Perú. Editorial Centro Papelero del Norte S.A 1995; 48. [ Links ]
15. GAMA-RODRIGUEZ J, BRESCIANI C, MATSUDA M, et al. Trends of distribution of early gastric cancer at the stomach wall. Study of a 104 casos series in a 24 year period. IST international gastric cancer congress Ed Mitsumasa Nishi, Haruo Sugano and Toshio Takahashi.1995; 325-27. [ Links ]
16. CORRALES F, CUEVA P, YEPES J. Cáncer gástrico epidemiología en cáncer gástrico Edit: Carlos Robles, Imprenta Gráfica Ramírez Porto Viejo Ecuador 2000; 3-11. [ Links ]
17. LLORENS P. Gastric cancer mass survery in Chile. Semin Surg Oncol 1991; 7(6):339-343. [ Links ]
18. LLORENS P. Cáncer Gástrico en latinoamerica, con especial referencial a sus aspectos epidemiológico en Chile Curso Internacional de Actualización en Cáncer del Tubo Digestivo 2004. [ Links ]
19. CALVO A. Resumen del Curso Internacional de Actualización en Cáncer del Tubo Digestivo octubre -2004. [ Links ]
20. PISANI P, OLIVER WE, PARKIN DM, ALVAREZ N, VIVAS J. Case-control study of gastric cancer screening in Venezuela. Br J Cancer 1994, 69, 1102-1105. [ Links ]
21. APARCERO M, GONZALES J, ROA A. Small gastric carcinoid. Our experience in four patients and ultrastructural observation. Venezuela Institute of Socied Security "Miguel Perez" Caracas 200; 261-267. [ Links ]
22. EVERETT SM, AXON ATR. Early Gastric Cancer in Europe. Gut1997;41:142-150. [ Links ]
23. GOTODA T, YANAGISAWA A, SASAKO M, et al. Incidence of lymph node metastasis from early gastric cancer: estimation with a large nomber of cases at two large centers. Gastric cancer. 2000;3:219-225. [ Links ]
24. HAN JY, SON H, LEE WC, et al. The correlation between gastric cancer screening method and the clinicopathologic features of gastric cancer. Med Oncol. 2003;20(3):265-69. [ Links ]
25. PERRI F, IULIANO R, VALENTE G, et al. Minute and small early gastric cancers in a Western population: a clinicopathologic study. Gastrointest Endosc. 1995;41(5):475-80. [ Links ]
26. BIASCO G, PAGANELLI G, AZZARONI D, et al Early gastric in Italy. Clinical and pathological observations on 80 cases. Dig Dis Sci. 1987; 32(2):113-20. [ Links ]
27. BORIE F, PLAISANT N, MILLAT B, eta l. Appropriate gastric resection with lymph node dissection for early gastric cancer. Ann Surg Oncol. 2004;11(5):512-7. [ Links ]
28. CRAANEN M, DEKKER W, et al. Early gastric cancer : a clinicopathologic study. J Clin Gastroenterol. 1991; 13 (3):274-83. [ Links ]
29. OHMAN U, EMAS S, RUBIO C. Relation between early and advanced gastric cancer. Am J Surg. 1980; 140(3):351-5. [ Links ]
30. KONG SH, PARK DO J, LEE HJ, et al. Clinicopathologic features of asymptomatic gastric adenocarcinoma patients in Korea. Jpn J Clín Oncol. 2004;34(1):1-7. [ Links ]
31. HALLISEY MT, ALLUM WII, JEWKES AJ et al. Early detection of gastric cancer. British Medical Journal 1990;301:513-5. [ Links ]
32. OLUWASOLA AO, OGUNBIYI JO. Gastric cancer:aetiological, clinicopathological and management patterns in Nigeria. Niger J Med. 2003: 12(4):177-86. [ Links ]
33. MIRANDA M. Síntomas y signos clínicos del cáncer gástrico. CANCER GASTRICO. Editores. Atila CSendes, Tomás Strauszer.Editorial Andres Bello. Santiago, Chile. 1984;61-65. [ Links ]
34. YUASA N, NIMURA Y. Survival after surgical treatment of early gastric cancer, surgical techniques, and long-term survival. Langenbecks Arch Surg. 2004 Apr 30. [ Links ]
35. ESPEJO H, NAVARRETE J. pólipos epiteliales gástricos. REV. Gastroenterol. Peru 2004;24:50-74. [ Links ]
36. MING and GOLDMAN Early Gastric Carcinoma Pág. 570 - 583. [ Links ]
37. HIROTA T, MING S and ITABASHI M. Pathology of Early Gastric Cancer. Gastric Cancer. Springer Verlag 1993. 66-87. [ Links ]
38. SIEWERT J, SENDLER A, BOTTCHER K. Early Gastric Cancer. Management of Gastrointestinal Cancer. WB Saunders. 1999. 7: 136 - 159. [ Links ]
39. STOUT AP (1942) Superficial spreading type of carcinoma of the stomach. Arch Surg 44:651-657. [ Links ]
40. KASAKURA Y, FUJII M, MICHIZUKI F, et al. Clinicopathological features of the superficial spreading type of early gastric cancer. Gastric Cancer 1999; 2:129-135. [ Links ]
41. FERRARI M, GHISLANDLE, LANDONIO G, et al, Histology as a prognostic factor in early gastric cancer. Tumory 1992; 78:181-184. [ Links ]
42. MAEHARA Y, OKUYAMA T, OSHIRO T, et al. Early carcinoma of the stomach. Surg Gynecol Obstet 1993; 177:593-597. [ Links ]
43. ESPEJO H, NAVARRETE J. Clasificación de los adenocarcinomas de estómago. Rev Gastroenterol. Perú. 2003;23:199-212. [ Links ]
44. YASUDA K, SHIRAISHI N, INOMATA M, et al. Clinicopathologic characteristics of early-stage mucinous gastric carcinoma. J Clin Gastroenterol. 200438(6):507-511. [ Links ]
45. CONTRERAS (Proposición de protocolo anatomopatológico del cáncer gástrico) Basado en protocolos de CAP, RCPath AJCC,UICC, TNM 6th edition. [ Links ]
46. NAGAYO T. Histogénesis and Precursors of Human Gastric Cancer Springer-Verlag, Berlin. 1986. [ Links ]
47. Japanese Gastric Cancer Association. Japonese Classification of gastric carcinoma. 2nd English Ed. Gastric Cancer 1998:10-24. [ Links ]
48. OHTA (26) (OHTA H, NOGUCHI Y, TAKAGI K, NISHI M et al. Early gastric carcinoma with special referente to macroscopic classification. Cancer 1986;60:1099-1106. [ Links ]
49. XUAN Z, UEYAMA T, YAO T, et al. Time trenes of Early gastric carcinoma. A clinicopathological analisys of 2846 cases. Cancer 1993; 72:2889-2894. [ Links ]
50. Endo M, Habu H. Clinical studies of early gastric cancer. Hepatogastroenterology 1990;37:408-410). [ Links ]
51. FUKUTOMI H, SAKITA T. Analysis of early gastric cancer cases collected from major hospitals and institutes in Japan. Jpn J Clin Oncol 1984; 14:169-179. [ Links ]
52. LLORENS P. en Chile acta gastroenterológica Latinoamérica 1985;13:543-553. [ Links ]
53. ONO H, KONDO H, T GORODA, et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001;48:225-229. [ Links ]
54. SASAKO M. Risk factors for surgical treatment in the Dutch gastric cancer trial. Br J Surg 1997;84:1567-71. [ Links ]
55. CUSCHIERI A, FAYERS P, FIELDING J, CRAVEN J, BANCEWICZ J, JOYPAUL V, et al. Postoperative morbidity and mortality after D1 and D2 resection for gastric cancer. Preliminary results of the MRC randomised controlled surgical trial. Lancet 1996;347:995-9. [ Links ]
56. YOSHIKAWA T, ISHIWA N, MORINAGA S, et al. Can surgical diagnosis of "early" gastric cancer and lymph node metastasis be accurate?. Gastric cancer 2004;7:36-40. [ Links ]
57. MOERTEL CG, BARGEN JA, SOULE EH. Multiple gastric cancers. Review of the literatura and study of 42 cases. Gastroenterology 1957;32:1095-1103. [ Links ]
58. NOGUCHI Y, OHTA H, TAKAGI K, et al Synchronous multiple early gastric carcinoma : a study of 178 cases. World J surg 1985;9:786-793. [ Links ]
59. TAKETSHITA K, TANI M, HONDA T, et al. Treatment of primary Multiple Early Gastric Cancer: From the Viewpoint of Clinicopathologic Features. World J. Surg. 1997; 21, 832-836. [ Links ]
60. MOREAUX J, BOUGARAN J. Early gastric cancer. A25-year surgical experience. Ann Surg. 1993;217(4):347-55. [ Links ]
61. GARDINER KR, WILKINSON AJ, SLOANJM. Early gastric cancer a report of 30 cases. JR coll surg Edinb 1990;35:237-239. [ Links ]
62. SÁNCHEZ J. Cancer precoz del estómago en el Instituto Nacional de Enfermedades Neoplásicas. Acta cancerológica 1990; 21: 11-19. [ Links ]
63. KIRCHNER T, MULLER S, HATTORI T, et al. Metaplasia intraepithelial neoplasia and early cancer of the stomach are related to dedifferentiated epithelial cells defined by cytokeratin-7 expression gastritis. Virchows Arch. 2001;439(4):512-22. [ Links ]
64. BARBOSA A, CASTRO L. BGP expression in gastric epithelium and early gastric cancer. Gastric Cancer 2002; 5:123-124. [ Links ]
65. KASE S, OSAKI M HONJO S, et al. Tubular adenoma and intramucosal intestinal-type adenocarcinoma of the stomach : what area the pathobiological differences?. Gastric Cancer. 2003;6(2):71-9. [ Links ]
66. MORLOCK C, HARTMAN H. Diagnostico de las lesiones malignas del estomago en Carcinoma y otras lesiones malignas del estomago, Ed. Waltman Walters, Howard Gray, James Priestley.Salvat Editores S.A. Barcelona Buenos Aires 1946; 6-28. [ Links ]
67. AORD, C., BENTALL, H.H., ROBERTS, F.A.: A relationship between cancer of the stomach and the ABO groups. Brit. Med. J. 1: 799,1963. [ Links ]
68. HIRAYAMA, T.: Epidemiology of stomach cancer. Gann.Mon. 11:3,1971. [ Links ]
69. BRAGHETTO, I.:Factores relacionados con la génesis del cáncer gástrico.CANCER GASTRICO. Ed. A. Csendes J. T. Strauszer F. Ed. Andres Bello, Santiago de Chile. 1984;13-23. [ Links ]
70. CSENDES, A., MEDINA, E. et al.: Distribución de grupos sanguineos ABO y Rh en pacientes con úlcera gástrica, duodenal, cáncer gástrico y testigo. Rev. Med. Chile 103: 470,1975. [ Links ]
71. BERKSON, M., COMFORT, M. W., BULT, H.R.: Ocurrence of gastric cancer in persons with aclorhydria and with pernicious anemia. Mayo Clinic Proc. 31:583, 1956. [ Links ]
72. RAMÍREZ RAMOS, A. Cáncer gástrico. Helicobacter pylori en el Perú. Editores: Alberto Ramírez Ramos Robert H. Gilman. Impresiones Santa Ana S.A. 2004;141-152. [ Links ]
73. LEÓN BARÚA R, BERENDSON-SEMINARIO R, RECAVARREN-ARCE S, GILMAN RH. Geographic factors modulating alternative pathways in Helicobacter pylori associated gastroduodenalpathology: A Hypothesis. Clin Infec Diseases 1997; 25: 1013-1016. [ Links ]
74. SHIOTANI A, IISHI H, UEDO N, et al. Hypoacidity combined with high gastric juice nitrite induced by Helicobacter pylori infection is associated with gastric cancer. Aliment Pharmacol Ther. 2004; 20 Suppl 1:48-53. [ Links ]
75. LAUWERS GY, SHIMUZU M, CORREA P (1999) Evaluation of gastric biopsies for neoplasia: differences between Japanese and Western pathologists. American Journal of Surgical Pathology 1999 23(5):511-8. [ Links ]
76. SANO T, OKUYAMA Y, KOBORI O, et al. Early gastric cancer endoscopic diagnosis of depth of invasion. Digestive disease Science 1990;35:1340-4. [ Links ]
77. SCHLEMPER RJ, ITABASHI M, KATO Y, et al. Differences in diagnostic criteria for gastric carcinoma between Japanese and Western pathologists. Lancet. 1997;349(9067):1725-9. [ Links ]
78. BHANDARI S, SUP SHIM CH, HOON KIM J, et al. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastroentestinal endoscopy 2004;59, 6: 619-626. [ Links ]
79. BALLANTYNE KC, MORRIS DL, JONES JA et al. Aceuracy of identification of early gastric cancer. British Journal of Surgery 1987;74:618-9. [ Links ]
80. KIM TY, JONG HS, JUNG Y, et al. DNA hypermethylation in gastric cancer. Aliment Pharmacol Ther. 2004; 20 Suppl 1:131-42. [ Links ]
81. GIULI R. EGC: Minimized scope of lymphadenectomy. Journal for residents in surgery 2002. Review Article. [ Links ]
82. AHN MJ. Chemotherapy in the treatment of gastric cancer. Korea J Gastroenterol. 2004;43(2):75-81. [ Links ]
83. ABE N, WATANABE T, SUGIYAMA M, et al. Endoscopic treatment or surgery for undifferentiated early gastric cancer? Am J Surg. 2004; 188(2):181-4. [ Links ]
84. YOKOTA T, ISHIYAMA S, SAITO T, et al. Lymph node metastasis as a significant prognostic factor in gastric cancer: a multiple logistic regression analysis. Scand J Gastroenterol. 2004; (4):380-4. [ Links ]
85. AIHARA R, MOCHIKI E, KAMIYAMA Y, et al. Mucin phenotypic expression in early signet ring cell carcinoma of the stomach: its relationship with the clinicopathologic factors. Dig Dis Sci. 2004;49(3):417-24. [ Links ]
86. DIONIGI P, FERRARI A, JEMOS V, et al. Tumor cell proliferation in early gastric cancer: biological and clinical behavior. Hepatogastroenterology. 2004;51(55):264-8. [ Links ]
87. VOJVODIC I. El carcinoma de estómago en la población geriátrica: características clinico-quirúrgicas y sobrevida. Experiencia en el Hospital Nacional Edgardo Rebagliati Martins-EsSalud 1996-1999. Tesis para optar el grado de Doctor en Medicina. Lima-Perú 2004. [ Links ]