Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.25 n.1 Lima ene./mar. 2005
ARTÍCULO DE REVISIÓN
Tratamiento endoscópico del cáncer gástrico precoz: De la Resección Mucosa Endoscópica (RME) a la Disección Submucosa Endoscópica (DSE)
Miguel Chávez Rossell1
1 Médico Asistente Servicio de Gastroenterología Hospital Nacional Arzobispo Loayza.Docente Universidad Particular San Martín de Porres
RESUMEN
El tratamiento del cáncer gástrico precoz tradicionalmente ha sido la cirugía, pero se sabe que el tratamiento endoscópico, ofrece los mismos resultados con menor morbimortalidad. La primera terapia endoscópica usada fue la polipectomía en casos de tumores pediculados. Pero en tumores deprimidos o planos se utilizan métodos de destrucción tisular usando sustancias esclerosantes, láser o argón plasma. Su desventaja es que no se puede evaluar correctamente el procedimiento, pues destruye el tejido. En cambio, las técnicas de resección mucosa endoscopica (RME) como "strip biopsy", la técnica de inyectar y cortar, la cápsula transparente o el ligador de várices, si permiten evaluar los resultados del tratamiento endoscopico.
Los avances en la RME se deben al uso de la cromoscopía y a la inyección submucosa de diversas sustancias (solución salina normal, hipertónica, acido hialurónico, etc). El problema de la RME es la recidiva local, atribuida a la resección en fragmentos de lesiones de más de 10 mm. Para solucionar esto; se ha desarrollado la técnica de la Disección Submucosa Endoscopica(DSE) utilizando el bisturí endoscópico o modificaciones de este como el bisturí endoscópico con la punta aislada (IT-Knife). Estos últimos demandan mayor tiempo operatorio, requieren mayores habilidades y tienen más complicaciones.
Los esfuerzos por hacer un mejor diagnóstico y tratamiento de estas lesiones continúan día a día, usándose el endoscopio de magnificación y el endoscopio con múltiples inflexiones, entre otros.
Palabras clave: Resección mucosa endoscópica, mucosectomía, disección submucosa endoscopica, cáncer gástrico precoz.
SUMMARY
Surgery has been the traditional treatment for early gastric cancer, but it is known that the endoscopic treatment offers the same results with a lower mortality rate. The first endoscopic therapy used was the polypectomy in cases of pediculate tumors. However, in depressed or flat tumors, tissue-destructive methods are used together with sclerosant substances, laser or plasma argon; their disadvantage is that the procedure cannot be properly evaluated since the tissue is destroyed. On the other hand, the endoscopic mucous resection (EMR) techniques, such as strip biopsy, the injecting and cutting technique, the transparent capsule or the varices ligation, does permit the evaluation of the results of the endoscopic treatment.
Progresses in EMR are due to the use of the chromoscopy and the submucous injection of various substances (normal and hypertonic saline solution, hyaluronic acid, etc.). The problem of the EMR is local relapse, attributed to the resection in lesions fragments of more than 10 mm. To resolve this problem, the Endoscopic Submucous Dissection (ESD) has been developed, using the endoscopic scalpel or its modifications; such as the endoscopic scalpel with the isolated point (IT-Knife). The last ones require more operating time, better skills and have more complications.
The efforts to make a better diagnosis and treatment of these lesions continue day by day, by using the magnification endoscopes, the endoscopes with multiple inflexions, etc.
Key words: Endoscopic Mucous Resection (EMR), mucosectomy, Endoscopic Submucous Dissection (ESD), early gastric cancer.
INTRODUCCIÓN
La incidencia del cáncer gástrico continua siendo muy alta en Japón, China, Europa del Este y Sudamérica,(1) siendo la segunda causa de muerte por neoplasias a nivel mundial,(2) pues la gran mayoría son diagnosticados en etapas avanzadas. La excepción es el Japón, donde la mortalidad ha disminuido grandemente debido aue más de la mitad de los casos se diagnostican en estadios incipientes, gracias a los programas masivos de pesquisa o tamizaje y a los avances en las técnicas diagnósticas y de terapia endoscópica (3,4).
La Escuela Japonesa es pionera en el estudio del Cáncer Gástrico, ya en 1962 la Sociedad Japonesa de Endoscopía Digestiva definió el carcinoma gástrico precoz como el cáncer que permanece limitado a la mucosa o a la mucosa y la submucosa, independientemente de la existencia de metástasis ganglionares (5).
Para tratar el cáncer gástrico precoz el procedimiento quirúrgico ha sido el de elección. Siendo la gastrectomía con disección ganglionar tipo D2 lo preconizado en este etapa del cáncer gástrico (6). No obstante, hay análisis retrospectivos que han reportado la escasa probabilidad de metástasis linfática cuando el carcinoma gástrico solo compromete la mucosa, esto ha permitido la aplicación de tratamientos endoscópicos, menos invasivos, con mejor calidad de vida de vida para el paciente y que ofrecen los mismos resultados a largo plazo que la cirugía convencional (7,8).
Las experiencias iniciales del uso de la endoscopía para el tratamiento del cáncer gástrico precoz, incluyen un estudio de Oguro et al. sobre el uso de la polipectomía en el tratamiento del cáncer gástrico precoz tipo polipoide (9).
En términos generales, la remoción endoscópica del cáncer gástrico precoz puede realizarse usando las técnicas de ablación o de resección. Hay varios métodos de ablación endoscópica los cuales incluyen la electrocoagulación, coagulación con argón plasma, fotocoagulación con láser, terapia fotodinámica, escleroterapia y crioterapia, por nombrar las más comunes. La ablación puede ser más fácil y rápida que la resección, pero es usualmente menos deseable que ésta última porque el espécimen no es obtenido para la evaluación histológica. Por lo tanto, los métodos de ablación no son considerados de primera elección (10,11).
Por el contrario, las técnicas de resección conocidas como Mucosectomía o Resección Mucosa Endoscópica (RME), tienen la ventaja de no solo permitir que la lesión sea examinada histológicamente para revelar su extensión y profundidad de infiltración, sino también el resultado de la terapia puede ser evaluado sobre las bases de los hallazgos macroscópicos e histológicos. En 1983 Tada et al. describieron esta nueva técnica denominándola "Strip biopsy" (biopsia en "losange", método del doble canal o el método de inyectar, levantar y cortar como se le conoce también), aunque en un principio solo se utilizaba como un método diagnóstico (4). Posteriormente se fueron desarrollando otras técnicas de mucosectomía, tales como la resección con copa plástica o utilizando el ligador de várices (11). Con los últimos avances en instrumental endoscópico se esta especializando una nueva técnica que se conoce como "Disección Submucosa Endoscopica" (DSE) (12)
DEFINICIÓN DE RME
Procedimiento endoscopico de avanzada en el cual se resecan lesiones neoplásicas confinadas a la mucosa ( benignas o malignas), a través de una sección longitudinal de la submucosa haciendo uso de diferentes instrumentos y/o aditamentos tales como un endoscopio de doble canal o una cápsula plástica o ligador variceal. Con lo cual se obtiene una muestra completa para un adecuado estadíaje histopatológico en cuanto a su grado de profundidad, compromiso de márgenes laterales y nivel de invasión tumoral (4,10,11,)
Una variante de esta técnica es la Disección Submucosa Endoscópica en la que se utiliza el bisturí endoscópico o una de sus modificaciones. También es usada para extirpar lesiones submucosas.
Los avances en la RME se han debido a la utilización de la tinción endoscopica y a la inyección submucosa, como veremos más adelante.
INDICACIONES DE LA RME EN EL CÁNCER GÁSTRICO PRECOZ
Las indicaciones generalmente aceptadas en la actualidad para la RME en el cáncer gástrico temprano son: Tipo diferenciado (adenocarcinoma y/o adenocarcinoma papilar bien y/o moderadamente diferenciado) confinado a la mucosa. Menos de 2 cm de diámetro en lesiones tipo IIa o menos de 1 cm de diámetro en lesiones tipo IIb o IIc. Sin evidencia de úlcera o cicatriz ulcerosa en la endoscopia y/o patología. Sin evidencia de invasión venosa o linfática (13).
Gotoda et al. (14) analizaron el curso de 3000 cánceres intramucosos. De su análisis los criterios para RME podrían expandirse a lesiones de mayor diámetro: Hasta 30 mm si es ulcerado y sin límite de tamaño si no tiene úlcera. También en aquellos cánceres diferenciados que comprometen la parte más superficial de la submucosa, esto es, no más allá de 300 micrones de la muscular de la mucosa denominado "Invasión Submucosa Mínima" o sm-1, la probabilidad de metastásis es baja.
Pero, la RME puede realizarse en casos de adenomas, lesiones de etiología incierta, enfermedades intercurrentes graves o pacientes de edad muy avanzada, lesiones submucosas como tumores carcinoides, leiomiomas, lipomas, tejido pancreático ectópico, etc.(15)
CROMOSCOPÍA
También llamada tinción endoscopica de la mucosa o cromoendoscopía.
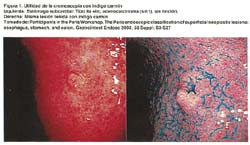
Su utilidad se puede resumir de la siguiente manera: Identifica más fácilmente la lesión, ayuda en la clasificación macroscópica, facilita el diagnóstico diferencial y establece con más seguridad sus límites. Los colorantes más usados son índigo carmín, el lugol y el azul de metileno.(15,16)
INDIGO CARMIN: Se utiliza diluido al 0.1 al 0.4% de indigocarmin. El color azul del indigo carmin aumenta el contraste mucoso. La solución se deposita en las grietas y las depresiones mucosas, causando un realce de los bordes de la lesión que puede no ser muy visible antes de la tinción. Además, aumenta la visualización de las irregularidades de la superficie dentro de la lesión.(15)
LUGOL: Se usa al 2% Iodino. Tiñe el glucógeno de las células normales del esófago. Diferencia la displasia escamosa y el cáncer de esófago de la mucosa normal. El tejido displástico o neoplásico, el epitelio inflamado o el esófago de Barrett no se teñirán.(15)
AZUL DE METILENO: Se le clasifica como una tinción vital o absortiva. Pues tiñe activamente las células absortivas del intestino y del colon (el citoplasma). La ausencia de la tinción usualmente indica cambios neoplásicos. No es tóxico al ser rociado y puede ser excretado en la orina y heces.(16)
El método de tinción más usado en estómago es el índigo carmín. Ver figura 1
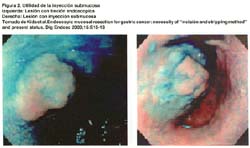
INYECCIÓN SUBMUCOSA
Se basa en el principio que en el tracto gastrointestinal, la mucosa y la capa muscular tienen diferente origen embriológico, estando unidas por un tejido conectivo laxo de la submucosa y pueden ser fácilmente separados por una fuerza externa (17). Así, mediante la inyección submucosa de ciertos materiales, se puede "separar" o "elevar" la lesión haciendo más fácil y segura la escisión de la mucosa, evitando comprometer la capa muscular y la perforación. Para este propósito, la solución salina normal o hipertónica es ampliamente usada debido a su simplicidad, bajo costo y disponibilidad. Sin embargo, la elevación de la mucosa creada por la inyección submucosa de la solución salina normal es mantenida por solo un corto período de tiempo durante el procedimiento. Por lo que, otras sustancias tales como la dextrosa al 20%, el glicerol, hidroxipropil metilcelulosa, hialuronato de sodio, y el fibrinógeno (18,19,20,21,22) han sido probados para la creación de una "almohadilla" submucosa mas duradera. Las elevaciones mucosas creadas por estos nuevos materiales, debido a su viscosidad, persisten por períodos más largos de tiempo y por tanto, definen mejor los límites de la lesión.. Esto hace posible realizar procedimientos más duraderos e incrementa la tasa de resección en bloque, aún en grandes lesiones. Sea cual fuere la solución a utilizar por lo general se le adiciona indigocarmín y adrenalina. Habitualmente se usa un inyector endoscopico y una aguja n· 23.
Si la lesión no se levanta ("Non-lifting sign") luego de la inyección submucosa, puede deberse a varias razones: inyección muy profunda, invasión de la lesión a capas más profundas, reacción desmoplástica o fibrosis de una biopsia previa, cauterización o ulceración.(15) Ver figura 2.
ACIDO HIALURONICO (HIALURONATO DE SODIO): Es una solución muy densa y que tiene una alta viscosidad. Es atoxico y no es antigénico en humanos. Su inyección local crea una protrusión más prominente y duradera que usando solución salina. También retiene localmente la adrenalina y es inocua en los tejidos debido a su isotonicidad, comparado con soluciones hipertónicas como la glucosa al 50% y el glicerol. Su desventaja es el alto costo, requerimientos especiales de almacenamiento y no estar ampliamente disponible(20,21). Recientemente, se esta poniendo en duda su seguridad oncológica, puesto que se ha demostrado en un modelo animal que esta sustancia puede estimular el crecimiento de células tumorales residuales(23).
MIXTURA DE FIBRINOGENO: Lee S et al.(22) han descrito a la mixtura de fibrinógeno como una solución viscosa que produce una elevación submucosa por largo tiempo pero además tiene el efecto de la hemostasia microvascular, de esta forma se consigue un campo visual claro durante la RME. La solución se inyecta con una jeringa de 10 ml y una aguja 21. La mixtura de fibrinógeno fue hecha mezclando 4 componentes: 1 gramo de fibrinógeno (9 ml de mixtura), 50 ml de solución salina normal, 0.5 ml de índigo carmín y 0.5 ml de adrenalina 1:1000
PASOS GENERALES DE TODA MUCOSECTOMÍA(15)
Son los siguientes:
1. Identificación de la lesión.
2. Coloración, habitualmente con índigo carmín
3. Demarcación de lo márgenes periféricos de la lesión, lo cual puede hacerse con la fulguración de la mucosa con el bisturí endoscopico, con la punta del asa de polipectomia o colocando clips metálicos.
4. Inyección submucosa
5. Tracción de la lesión (con una pinza en la strip biopsy o usando la succión del endoscopio como fuerza para traccionar la lesión como con la copa plástica o usando el ligador variceal).
6. Sección de la lesión por lo general con un asa de polipectomía.
La úlcera resultante del procedimiento se trata con inhibidores de la bomba de protones. En un inicio se administraban por 4 semanas, pero Lee et al.(24) postulan que bastaría una semana con omeprazol. Aunque, Itoh et al.(25) sugieren que puede utilizarse el sucralfato con o sin ranitidina con el mismo fin.
La posibilidad de la recurrencia se controla practicando biopsias aproximadamente cada tres meses, durante el primer año del procedimiento, y luego cada seis o doce meses. En el caso de encontrarse lesión residual, pueden tomarse diferentes conductas, dependiendo del caso en particular. Así, puede repetirse la RME, utilizarse las técnicas de coagulación como el láser o el argón plasma; o cirugía convencional.(15)
Si el paciente es positivo para el Helicobacter Pylori se recomienda su tratamiento erradicador pues ello previene la recidiva tumoral.(26)
TÉCNICAS PARA LA MUCOSECTOMÍA
En la actualidad, la metodología no ha sido estandarizada, por lo que existen varias técnicas y de acuerdo a Soetikno et al.(15) para las lesiones gástricas. Se les puede agrupar según la Tabla 1
Según Fujisaki et al.(27), otra forma de clasificar a grosso modo las técnicas de mucosectomía consiste en técnicas no marginales (el método del doble canal y los métodos que utilizan la aspiración como la cápsula transparente y el ligador variceal) y técnicas marginales como el uso del bisturí endoscopico con la punta de cerámica. Ver Tabla 2.
Las técnicas de RME más usadas en las lesiones gástricas son las siguientes:
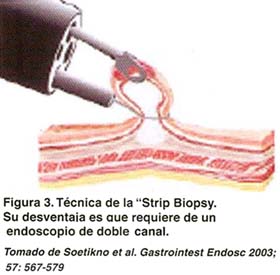
TÉCNICA DE INYECTAR, LEVANTAR Y CORTAR O "STRIP BIOPSY"
Requiere un endoscopio terapéutico de doble canal. Se realizan los pasos de la identificación, cromoscopía y demarcación de la lesión. Aproximadamente 3 a 5 ml de solución salina es inyectada a través de una aguja en las capas submucosas de la lesión "objetivo" y de esta forma es obtenida una elevación artificial de la mucosa tipo Yamada II-III. La elevación es entonces traccionada con la pinza, enlazada con el asa de polipectomia y resecada. Ver figuras 3 y 4.
El procedimiento importante en la "strip biopsy" es atrapar la lesión elevada con la pinza y enlazarla. Sin embargo, cuando la elevación de la lesión no es suficiente para enlazarla, la tasa de remoción completa disminuye aproximadamente al 70% (4,15,28).
TÉCNICA DE LA INYECCIÓN Y CORTE
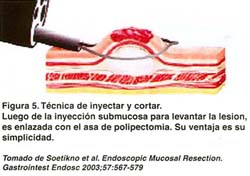
Se utiliza un endoscopio estándar. Se siguen los mismos pasos de la técnica anterior. Se inyecta solución salina en la submucosa. La lesión debe levantarse durante y después de la inyección antes de intentar la resección. El asa es ubicada en la base de la lesión. El asa es cerrada, si el asa parece atrapar la muscular propia, se realizan maniobras para liberar el músculo, antes que la lesión sea cortada con corriente de corte y coagulación(15). Tal como se aprecia en la figura 5.
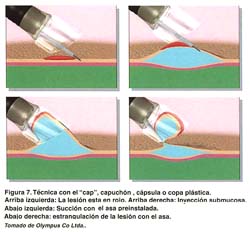
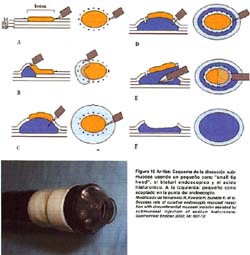
TÉCNICA CON CAPUCHÓN TRANSPARENTE "CAP", COPA O CAPSULA PLÁSTICA (EMR-C)
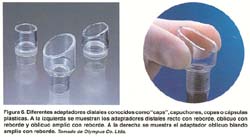
Se utiliza un endoscopio de visión frontal con un capuchón transparente adicionado a la punta del instrumento. Se dispone de varios tamaños de este capuchón transparente (Olympus Co., Ltd., Japan) de 10, 12, 15 y 18 mm en sus diámetros externos y de 10 mm de profundidad, siendo los últimos oblicuos y blandos (ver figura 6). Además se utiliza un fina asa semilunar SD-/P de Olympus. La característica del capuchón es que esta acanalado alrededor de la punta con un surco de 0.3 mm de ancho. Básicamente se siguen los mismos primeros pasos ya descritos. Una vez insertada el asa delgada, se presiona con la punta del capuchón mientras se aspira la mucosa normal bajo presión negativa, permitiendo que el asa quede preinstalada en el surco del capuchón . Luego, se aspira la mucosa "objetivo" dentro del capuchón y se estrangula con el asa. Se confirma la ausencia de muscular propia y el tamaño de la mucosa que se va a resecar, desde un punto distante de visión endoscópica y se realiza la mucosectomía con electrocauterización de alta frecuencia. El espécimen resecado puede ser fácilmente atrapado en el capuchón usando la aspiración(6,7,17). Tal como se ilustra en la figura 7. Esta técnica se puede realizar en cualquier parte del estómago, aún en zonas donde la visualización endoscopica es difícil y el espécimen de mayor tamaño obtenido es de 21x19mm. Recientemente, Tani et al han reportado buenos resultados practicando resecciones fraccionadas planificadas en lesiones de mas de 15 mm(29).
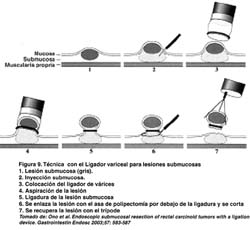
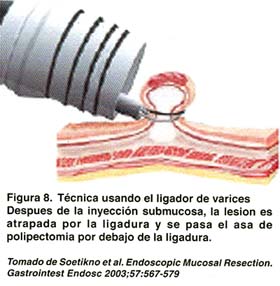
TÉCNICA CON EL LIGADOR ENDOSCÓPICO DE VÁRICES (EMR-L)
Utiliza un dispositivo endoscopico estándar de ligadura de várices que es fijado a la punta de un endoscopio de un solo canal. Después que la periferia de la lesión es marcada, el endoscopio es retirado y es fijado al ligador endoscopico variceal. La mucosa enferma es ligada, con o sin inyección submucosa previa. La cantidad de inyección submucosa es aproximadamente de 5 a 10 ml. Una vez ligada la mucosa, se realiza una polipectomía con el asa estándar por encima o por debajo de la banda elástica. Con esta técnica, el tamaño máximo para una resección en bloque es de 15 mm.(Ver figura 8). Lesiones más grandes pueden requerir resección en fragmentos(15,30,).
Akiko Ono et al (31) ha reportado su utilidad en resecar lesiones submucosas tales como los carcinoides, como puede verse en el esquema de la figura 9.
EVALUACIÓN HISTOLÓGICA(12,15,32,)
El espécimen antes de ser fijado en formol, es estirado al máximo sujetando sus bordes con alfileres. Los cortes deben ser muy finos, habitualmente de 2 mm de ancho, y se tiñen con Hematoxilina-Eosina. La evaluación de los márgenes laterales del espécimen permite clasificar las resecciones como:
1. Resección Completa: Cuando el margen lateral fue claro endoscopica y patológicamente (mínima probabilidad de recurrencia local). Este es el éxito del procedimiento.
2. Resección Incompleta: Cuando el tumor definitivamente invadió los márgenes laterales, endoscopica y patológicamente (alta probabilidad de recurrencia local)
3. No evaluable: Cuando el tumor fue removido endoscopicamente, pero su margen lateral no fue patológicamente evaluable debido quemadura por el tratamiento diatérmico, daño mecánico o cuando la reconstrucción fue difícil debido a la resección en múltiples fragmentos.
Se siguen los lineamientos de la Clasificación Japonesa de Carcinoma Gástrico, si se halla: Invasión submucosa, cáncer indiferenciado o infiltración de vasos, la indicación es cirugía.
DISECCIÓN SUBMUCOSA ENDOSCÓPICA
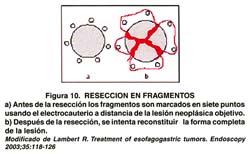
El problema de la RME es la recurrencia local, porque las lesiones resecadas son por lo general multi-fragmentadas, (ver figura 10) debido a que el tamaño ideal de la lesión debe ser muy pequeño, en promedio10 mm, y preferiblemente de ubicación en el antro(33). Al ser resecadas en múltiples fragmentos, es difícil reconstruir por completo la lesión y ello llevaría a una evaluación inapropiada de los resultados del procedimiento(34).
Por lo tanto, el "gold standard" es la resección en un fragmento único o en bloc "resection", (figura 11) aún en lesiones de más de 20 mm, esto es, sin considerar el tamaño de la lesión(35). Ante este desafío se desarrolló una variante de la RME, la Disección Submucosa Endoscopica, (DSE), en la cual se utilizan, por lo general, bisturís endoscopicos (papilótomo de punta o "needle knife") modificados o especiales, tales como:
1. IT- Knife (Insulation tipped knife) bisturí endoscopico con la punta aislada, o con bola de cerámica. (8,9,12, 33,)
2. Flex Knife "bisturí endoscopico flexible" (asa delgada de polipectomía)
3. Hook Knife "bisturí endoscopico gancho "
4. Triangle Knife "bisturí endoscopico triángular"
Pero, estos nuevos métodos necesitan de una mayor habilidad endoscopica, demandan un mayor tiempo en el procedimiento y tienen mayores tasas de complicaciones. Aquí, se debe mencionar como precursor de esta técnica a Hirao(18) que utilizaba el bisturí endoscópico en sus resecciones; y luego Yamamoto(20,21) que lo utiliza con el acido hialuronico y con un pequeño cono distal.
1. IT- KNIFE (bisturí endoscopico con la punta aislada, o con bola de cerámica)(8,9,12,33)
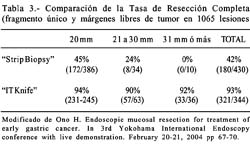
Para obtener la histológicamente "resección completa" en lesiones grandes y difíciles Ono et al. desarrollaron en 1996 un bisturí endoscópico especial llamado bisturí endoscopico con la punta aislada o "Insulation-tipped electrosurgical knife" (IT-Knife). Este método incrementa notablemente la tasa de resección completa, comparándolo con la RME, ver Tabla 3.
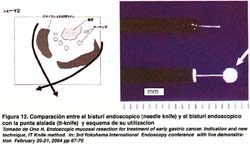
El "IT-Knife" es una modificación del bisturí endoscópico o papilótomo de punta, al que se le ha adicionado una esfera o bola de cerámica en la parte distal, que no permite el paso de la corriente eléctrica en la punta y así evita un sangrado mayor o una perforación si se hace contacto con la capa muscular, de esta forma, la sección de la mucosa se hace en sentido lateral, lo que permite controlar mejor la incisión. Ver figura 12.
El procedimiento de la Disección Submucosa Endoscópica o también conocido como "incision and stripping method" en líneas generales, con ligeras modificaciones según el instrumento a usar, es como sigue:
1. Identificación de la lesión.
2. Tinción de la lesión
3. Demarcación
4. Inyección submucosa
5. Incisión de la mucosa por fuera de la línea de demarcación, que puede realizarse con el bisturí endoscópico, con la punta del asa delgada de polipectomía o con la pinza de biopsia caliente (hot-biopsy forcep). Se introduce el IT-Knife o el flex-Knife en la submucosa, para separar la lesión del área no neoplásica adyacente, al realizar un corte circunferencial de la submucosa, la cual, se ve de color azul por el indigo carmín usado al levantar la lesión mucosa.
6. Nuevamente se inyecta varios mililitros de la solución previa en la capa submucosa justo debajo de la lesión.
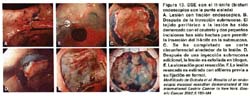
7. Finalmente, la lesión levantada es removida con el asa de polipectomía estándar, pero si el tumor tiene más de 2 cm. la submucosa es disecada con el bisturí endoscopico especial: IT-Knife, o el flex-Knife (asa delgada de polipectomía) hasta que la lesión es completamente separada de la pared gástrica. Esto se puede apreciar mejor en la figura 13.
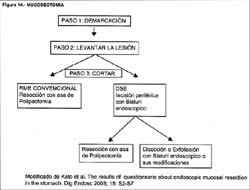
Como se ve los primeros cuatro pasos son idénticos a los de la RME, en la Figura 14 se puede ver un cuadro comparativo de ellas.
COMPLICACIONES:
SANGRADO: Controlable con tratamiento endoscopico usando inyección con etanol, clips y pulverizando trombina en el estomago. De no ser controlado el sangrado, el paciente se deriva a cirugía. Hay mayor riesgo si la lesión esta en la parte alta del estómago y si la zona resecada es de más de 20 mm.
Cuando el sangrado es inmediato durante el procedimiento, también es mayor el riesgo de sangrado tardío (36).
En un consenso sobre sangrado post RME (37) se concluyo lo siguiente: Sangrado intraoperatorio que requieren cirugía de emergencia, hemotransfusión o terapia vasopresora si la hemoglobina cae 2g/dL o más comparado con el nivel preoperatorio o la presencia de sangrado o melena masiva.
PERFORACIÓN: La mayoría de perforaciones no son detectadas durante el examen. Clínicamente pueden cursar con dolor severo durante el procedimiento, o con dolor abdominal persistente y/o distensión abdominal prominente inmediatamente después del mismo. El estudio radiológico mostrará aire subdiafragmático.
Las perforaciones pueden ser tratadas exitosamente por vía endoscopica, usando clips, ya sea afrontando los bordes de la pared en las pequeñas perforaciones o en caso de grandes defectos afrontando el borde de la pared al mesenterio o epiplón como una epìplopastía endoscopica, además de intubación naso-gástrica y antibióticos(38,39).
Recientemente Hamaguchi ha reportado el caso de una perforación vesicular, luego del marcado con el bisturí endoscopico, pero esto es extremadamente raro(40) .
De los métodos de DSE es el que tiene más reportes en la literatura. Con el continuo aprendizaje del mismo, se espera una disminución de sus complicaciones o un mejor manejo endoscopico. Aunque, Yagi (41) sugiere un programa de entrenamiento en disección submucosa para hacer más fácil y seguro el procedimiento.
2. FLEX KNIFE (Bisturí flexible)
Yahagi et al. han desarrollado una nueva técnica de disección submucosa endoscopica usando la punta de un asa delgada de polipectomía como un bisturí endoscopico flexible y así ellos reportan menores complicaciones.
El mérito del bisturí flexible es que la longitud de la punta es ajustable para controlar la profundidad de la incisión, lo cual prevendría la perforación.
Además, es fácil maniobrar debido a su naturaleza flexible y maleable que facilita cortar en cualquier dirección(42,43). Esto puede apreciarse en las figuras 15 y 16.
3. HOOK KNIFE (Bisturí gancho)
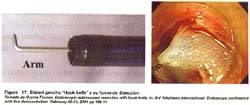
La punta del bisturí gancho es de un ángulo recto, de 1 mm de tamaño y puede ser rotado en cualquier dirección. La dirección de la punta del bisturí gancho debe ser dirigida en forma paralela a la capa muscular propia para evitar la perforación(44). Ver figura 17
4. TRIANGLE KNIFE (Bisturí triangular)
La experiencia es todavía limitada. Es un bisturí endoscopico con una placa metálica en forma de triangulo en la punta(45). Ver figura 18.
OTROS INSTRUMENTOS
Yamamoto et al. usan un cono plástico transparente de 8 mm "small tip hood" conectado a la punta del endoscopio, (ver figura 19) siendo de ayuda para una incisión más segura de la mucosa debido a los movimientos peristálticos hacia el bisturí endoscopico(20,21). Fujisaki et al., utiliza una variante del cono, con una hendidura, la cual facilitaría el uso del bisturí endoscopico(46).
Miyashita et al. han reportado el uso de una tijera endoscopica con hojas de 5 mm de largo, para la resección de lesiones superficiales del esófago y el estómago(47). Pero sus casos reportados son pocos. Además, requiere de un endoscopio de doble canal.
En fase experimental esta el uso del "Hood Knife" Cono o capucha bisturí, el cual se adapta a la parte distal del endoscopio, y se ha usado en mucosectomias de esófago.(48)
También en fase experimental esta el uso de un "ancla magnética" para hacer más rápido y seguro el procedimiento(49).
Por último, nuevos equipos endoscopicos tales como el endoscopio de magnificación y el endoscopio de multiinflexiones se estan probando para realizar de forma mas satisfactoria estos procedimientos(50,51).
RESULTADOS
Kojima et al en 1998 agrupo los reportes de 12 grandes instituciones del Japón, los métodos más usados fueron de Strip Biopsy, EMR-C y EMR-L , la resección en bloque se logro en 76% de los casos. Nueve series incluyeron información del rango de seguimiento, pero no la media, el rango del seguimiento varió de 4 meses a 11 años. La tasa de supervivencia especifica por la enfermedad fue de 99%. La tasa de recurrencia fue reportada en casi el 2%. El cáncer residual se trató con nueva EMR o cirugía(52).
Ono en el 2001 describió su experiencia en un período de 11 años. De 405 cánceres mucosos 69% (278 casos) fueron resecados con márgenes libres. De los restantes 127 con los márgenes comprometidos o en los que no se pudo determinar si estaban libres de enfermedad, en 9 se repitió el tratamiento endoscopico (RME o ablasión con láser), 24 fueron a cirugía y 94 permanecieron en observación. Se les practicó seguimiento endoscopico a los 3 y 6 meses y luego anualmente. Hubo recurrencia en 5 lesiones resecadas con los "márgenes libres" (2%). El promedio del seguimiento fue de 38 meses. En 95 lesiones que tuvieron los márgenes positivos o que no fueron evaluables, desarrollaron recurrencia local en 17 (18%). Estos pacientes fueron a cirugía con resultados satisfactorios. Ninguna muerte relacionada al cáncer gástrico fue registrada(53).
Kato et al. (54) han publicado en el 2003, los resultados de una encuesta sobre RME en 15 instituciones del Japón. El promedio de RME anual por cada centro fue de 84 procedimientos. La relación de el método de RME y DSE varió de 0% a 100% en cada institución. La DSE se había practicado en 908 casos. Con la DSE se logró resección en bloque en 79%. Con relación al tiempo operatorio, este fue mayor si la lesiones eran de gran tamaño. Así, las lesiones de menos de 20 mm podían resecarse en 60 minutos en promedio, en cambio las de más de 20 mm el tiempo operatorio podía sobrepasar los 120 minutos. La frecuencia de complicaciones con la DSE fue reportada en alrededor de 5% para las perforaciones y 25% para la hemorragia.
En el 2004, Ida et al. (55) publicaron un estudio multicéntrico (42 instituciones) con la finalidad de ampliar las indicaciones de RME. Los métodos más usados fueron la strip biopsy, EMR-C y la inyección de solución salina hipertónica. Clasificaron las lesiones en dos grupos, Grupo I: con lesiones tipo I, IIa, IIb y IIc sin úlcera, carcinoma intramucoso moderada a bien diferenciado de menos de 20mm de diámetro y Grupo II de las mismas características del Grupo I, pero con diámetro de 20 a 40 mm y también incluía carcinoma indiferenciado menor de 40 mm. Se registraron 412 sujetos, 305 en el grupo I y 107 en el Grupo II. De ellos, finalmente se evaluaron solo 258, 199 del Grupo I y 59 del Grupo II incluyendo 7 casos de carcinoma indiferenciado. La tasa total de resección en bloque del Grupo I fue de 71.9%, la cual declinaba con el incremento del tamaño de la lesión: 82.4% para menores de 10 mm, 67.2% de 11-15 mm y 45.5% de 16 - 20 mm. La recurrencia ocurrió en 8 casos de 199 (4%), en 5 de los cuales se logró la cura con tratamiento endoscopico adicional, alcanzando un 98.5% (196 casos) de cura endoscopica local final. La tasa de resección en bloque del Grupo II fue de 46.2% y con tratamiento endoscopico adicional se logro una cura local en 57 de 59 casos (96.6%). Los restantes dos casos fueron a cirugía abierta. En cuanto a las complicaciones, la hemorragia ocurrió en el 1.7% y la perforación en 0.2%.
Utilizando el método de la Disección Submucosa Endoscopica Oda et al.(56) el 2005, han reportado el tratamiento de 1033 EGC utilizando el "IT knife". Encontrando una tasa de resección en una sola pieza de 98% (1008/1033) y la tasa de resección en una sola pieza con márgenes libres del tumor fue de 93% (957/1033). Un análisis por subgrupos encontró ser 86% (271/314) para las lesiones mayores de 21mm y 89% (216/243) entre las lesiones ulceradas. La tasa de resección total no evaluable fue de 1.8% (19/1033). El tiempo operatorio promedio fue de 60 minutos (rango de 10 a 540 minutos). Sangrado inmediato fue objetivado en el 7% y el tardío en 6%. Perforaciones ocurrieron en el 4%. Todos los casos de complicaciones excepto uno fueron tratados exitosamente por endoscopia.
Corolario: La RME es de gran importancia para los endoscopistas. Para todos los cánceres gastrointestinales, el pronóstico se correlaciona con el estadío diagnóstico de la enfermedad. La supervivencia de los pacientes con cáncer gástrico no mejorará por más sofisticadas técnicas quirúrgicas o por mejores formas de radio o quimioterapia. La supervivencia será mejorada por un diagnóstico más precoz. Y el diagnóstico precoz esta ligado a métodos de pesquiza más efectivos. Llegará el día cuando el despistaje se acompañe con una simple prueba genética o molecular. Pero ese día aún no ha llegado y el acceso endoscopico al tracto digestivo será necesario para más que el simple despistaje. La cromoendoscopia, endoscopia de magnificación/alta resolución y la espectroscopia fluorescente inducida por láser encontrarán las lesiones malignas y premalignas más precozmente(11).
Que vendrá posteriormente, la utilización de los sistemas robóticos asistidos por computadora(57), nuevas indicaciones del tratamiento endoscópico del cáncer gástrico precoz, o una nueva clasificación basados en los resultados de la terapia endoscopica.
Experiencia en el Perú y Latinoamérica.- En 1998 en el Perú, Barreda publicó su experiencia inicial en la resección mucosa endoscópica con 5 casos, 4 de ellos fueron cáncer gástrico temprano y un adenoma, no reportando complicaciones. (58)
El mismo año, Castro y cols. reportaron el tratamiento endoscópico en 35 casos de cáncer gástrico temprano en Venezuela. En el seguimiento, 4 fallecieron por causas no relacionadas con el cáncer y 9 tenían una supervivencia mayor de 5 años. (59)
El 2000, en Chile, Llorens y cols. publicaron su experiencia en la mucosectomía endoscópica en 12 lesiones que ocurrieron en 10 pacientes, de los cuales fueron 10 carcinomas diferenciados, un carcinoma indiferenciado y un carcinoide. Con buenos resultados, 8 pacientes no presentaron recurrencia en el seguimiento.(60)
El 2001, Rey Ferro en Colombia publicó 17 resecciones endoscópicas gástricas de cánceres tempranos y adenomas utilizando el método de la copa plástica y el bisturí endoscópico con la punta aislada.(61)
AGRADECIMIENTOS
A la Agencia de Cooperación Internacional del Japón (JICA) por las facilidades para concurrir al 35avo Curso: "Detección Precoz del Cáncer Gastrointestinal y Tumores Digestivos Relacionados" realizado en Tokio-Japón del 6 de Enero al 4 Marzo del 2004.
BIBLIOGRAFÍA
1. PAVITHRAN K, DOVAL D, PANDEY K. Gastric Cancer in India. Gastric Cancer 2002; 5: 240-243 [ Links ]
2. PLUMMER M, FRANCESCHI S, MUNOZ N. Epidemiology of gastric cancer. IARC Sci Publ. 2004(157):311-26 [ Links ]
3. MAEHARA Y, KAKEJI Y, ODA S. et al. Time trends of surgical treatment and the prognosis for Japanese patients with gastric cancer. Br J Cancer 2000; 83: 986-991 [ Links ]
4. TADA M, TANAKA Y, MATSUO N, SHIMAMURA T, YAMAGUCHI K. Mucosectomy for gastric cancer: Current status in Japan. J of Gastroent Hepatol 2000;15: D98-102 [ Links ]
5. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma. Gastric Cancer 1998; 1: 10-24 [ Links ]
6. TAKESHITA K, TANI M, INOUE H. A New Method of Endoscopic Mucosal Resection of Neoplastic Lesions in the Stomach: Its Technical Features and Results. Hepato-Gastroenterology 1997;44:1602-1611 [ Links ]
7. TAKESHITA K, TANI M, INOUE H. et al. Endoscopic treatment of early oesophageal or gastric cancer. Gut 1997; 40:123-127 [ Links ]
8. MORITA Y, AOYAMA N, SHIRASAKA D. et al. Prospect of endoscopic mucosal resection for early gastric cancer: our devices in insulated-tip electrosurgical knife method. Dig Endosc 2003;15: S12-S14 [ Links ]
9. KIDA M, TANABE S, SAIGENJI J. Endoscopic mucosal resection for gastric cancer: necessity of "incision and stripping method" and present status. Dig Endosc 2003; 15:S15-S18 [ Links ]
10. FLEISCHER, DAVID. Endoscopic mucosal resection: (not) made in the USA (so commonly). A dissection of the definition, technique, use and controversies. Gastrointest Endosc 2000;52: 440-444 [ Links ]
11. NELSON D, BLOCK K, BOSCO J. et al. Endoscopic mucosal resection May 2000. Guidelines: technology status evaluation report. Gastrointest Endosc 2000;52: 860-863 [ Links ]
12. ONO, HIROYUKI. Endoscopic mucosal resection for treatment of early gastric cancer. Indication and new technique, IT Knife method. In: 3rd Yokohama International Endoscopy conference with live demonstration February 20-21, 2004 pp 67-70 [ Links ]
13. NAKAJIMA TOSHIFUSA. Gastric Cancer Treatment Guidelines in Japan. Gastric Cancer 2002;5:1-5 [ Links ]
14. GOTODA T, YANAGISAWA A, SASAKO M. et al. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000;3:219-25 [ Links ]
15. SOETIKNO RM, GOTODA T, NAKANIHSI Y, SOEHENDRA N. Endoscopic mucosal resection. Gastrointest Endosc 2003;57:567-579 [ Links ]
16. FLEISCHER DAVID. Chromoendoscopy. In: Waye J, Rex D & Williams C, ed. Colonoscopy. Principles and Practice. Massachusetts. Blackwell Publishing 2003: 501-508 [ Links ]
17. INOUE H, KAWANO T, TANI M, TAKESHITA K, IWAI T. Endoscopic mucosal resection using a cap: techniques for use and preventing perforation. Can J Gastroenterol 1999;13: 477-480 [ Links ]
18. HIRAO M, MASUDA K, ANANUMA T, et al. Endoscopic resection of early gastric cancer and other tumors with local injection of hypertonic saline-epinephrine. Gastrointest Endosc 1988; 34: 264-269 [ Links ]
19. ARNALDO B, CHRISTOPHER J, LAWRENCE J, ALEXANDER B, LORI J, et al. Hydroxypropyl methilcellulose: a better submucosal fluid cushion for endoscopic mucosal resection. Gastrointest Endosc 2003; 57: 41-47 [ Links ]
20. YAMAMOTO H, YUBE T, ISODA N. et al. A novel method of endoscopic mucosal resection using sodium hyaluronate. Gastrointest Endosc 1999; 50:251-256 [ Links ]
21. YAMAMOTO H, KAWATA H, SUNADA K. et al. Success rate of curative endoscopic mucosal resection with circumferential mucosal incision assisted by submucosal injection of sodium hialuronate. Gastrointest Endosc 2002; 56: 507-12 [ Links ]
22. LEE S, CHO W, KIM H, et al. A new method of EMR: Submucosal injection of a fibrinogen mixture. Gastrointest Endosc 2004;59: 220-224 [ Links ]
23. MATSUI Y, INOMATA M, IZUMI K. et al. Hyaluronic acid stimulates tumor-cell proliferation at wound sites. Gastrointest Endosc 2004; 60: 539-543 [ Links ]
24. LEE S, KIM J, LEE J. et al. Healing rate of EMR-induced ulcer in relation to the duration of treatment with omeprazole. Gastrointest Endosc 2004; 60: 213-217 [ Links ]
25. ITOH, T, KUSAKA K, KAWAURA K et al. Selective binding of sucralfate to endoscopic mucosal resection-induced gastric ulcer: evaluation of aluminium adherence. J Int Med Res 2004;32:520-9 [ Links ]
26. KAMADA T, HARUMA K, SUGIU K, NAGASHIMA Y, MEI QIAN D, et al. Case of early gastric cancer with nodular gastritis. Dig Endoscopy 2004; 16:39-43 [ Links ]
27. FUJISAKI J, MATSUDA K, TAJIRI H. Endoscopic mucosal resection for early gastric cancer: aiming at safety, speed and reliability. Dig Endosc 2003;15:S8-S11 [ Links ]
28. YANAI H, MATZUBARA Y, KAWANO T, et al. Clinical impact of strip biopsy for early gastric cancer. Gastrointest Endosc 2004;60: 771-777 [ Links ]
29. TANI M, TAKESHITA K, KAWANO T. Characteristics and role of endoscopic mucosal resection using cap-fitted panendoscope for early gastric cancer. Dig Endosc 2005;17:17-20[ [ Links ]STANDARDIZEDENDPARAG]
30. SUZUKI Y, HIRAISHI H, KANKE K. et al. Treatment of gastric tumors by endoscopic mucosal resection with a ligating device. Gastrointest Endosc 1999; 49: 192-99. [ Links ]
31. ONO A, FUJII T, SAITO Y, et al. Endoscopic submucosal resection of rectal carcinoid tumors with a ligation device. Gastrointest Endosc 2003; 57: 583-587 [ Links ]
32. Participants in the Paris Workshop. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. Gastrointest Endosc 2003; 58 Suppl: S3-S27 [ Links ]
33. OKUWA M, HOSOKAWA K, BOKU N. et al. New Endoscopic treatment for Intramucosal Gastric Tumors Using an Insulated-Tip Diathermic Knife. Endoscopy 2001; 221-226 [ Links ]
34. YAHAGI N, FUJISHIRO M, IGUCHI M. et al. Theoretical and technical requirements to expand EMR indications. Dig Endosc 2003; 15: S19-S21 [ Links ]
35. EGUCHI T, GOTODA T, ODA I. et al. Is endoscopic one-piece resection essential for early gastric cancer? Dig Endosc 2003; 15: 113-116 [ Links ]
36. OKANO A, HAJIRO K, TAKAKUWA H. et al. Predictors of bleeding after endoscopic mucosal resection of gastric tumors. Gastrointest Endosc 2003; 57:687-690 [ Links ]
37. TAJIRI HISAO & KITANO SEIGO. Complications associated with endoscopic mucosal resection: definition of bleeding that can be viewed as accidental. Dig Endosc 2004;16:S134-S136 [ Links ]
38. ONO HIROYUKI. Endoscopic Mucosal Resection. In 35th Curso" Detección Precoz del Cáncer Gastrointestinal y Tumores Digestivos Relacionados" Tokio-Japón. 6 de Enero al 4 Marzo del 2004 [ Links ]
39. TSUNADA S, OGATA S, OHYAMA T. Endoscopic closure of perforations caused by EMR in the stomach by application of metallic clips. Gastrointestin Endosc 2003;57: 948-951 [ Links ]
40. HAMAGUCHI M, KATOH T, SHIMAZAKI S. et al. Gallbladder perforation associated with gastric EMR for gastric adenoma. Gastrointest Endosc 2004; 60: 488-490 [ Links ]
41. YAGI K, NAKAMURA A, SEKINE A. Is it difficult for endoscopists who have done conventional endoscopic mucosal resection to perform submucosal dissection? Dig Endosc 2004;16:S76-S79 [ Links ]
42. YAHAGI N, FUJISHIRO M, KAKUSHIMA N, et al. Endoscopic submucosal dissection for early gastric cancer using the tip of an electrosurgical snare (thin type). Dig Endosc 2004; 16:34-38. [ Links ]
43. YAHAGI NAOHISA. Endoscopic submucosal dissection for early gastric cancer using Flex knife. In: 3rd Yokohama International Endoscopy conference with live demonstration February 20-21, 2004 pp 85-86 [ Links ]
44. OYAMA TSUNEO. Endoscopic submucosal resection with hook knife. In: 3rd Yokohama International Endoscopy conference with live demonstration February 20-21, 2004 pp 106-11 [ Links ]
45. INOUE HARUHIRO. Cut and submucosal disecction EMR using a triangle-tipped knife. In: 3rd Yokohama International Endoscopy conference with live demonstration February 20-21, 2004 pp 122-25 [ Links ]
46. FUJISAKI J, YAMAMOTO Y, TAKAHASHI H. Endoscopic mucosal resection for early gastric cancer: a new technique using a slit-hood and hook knife. Dig Endosc 2004;16:S80-S81 [ Links ]
47. MIYASHITA M, TAJIRI T, MARUYAMA H. et al. Endoscopic mucosal resection scissors for the treatment of early gastric cancer. Endoscopy 2003;35: 611-12 [ Links ]
48. RAJAN E, GOSTOUT C, FEITOZA A. et al. Widespread EMR: a new technique for removal of large areas of mucosa. Gastrointest Endosc 2004;60: 623-627 [ Links ]
49. KOBAYAHI T, GOTOHDA T, TAMAKAWA K et al. Magnetic anchor for more effective endoscopic mucosal resection. Jpn J Clin Oncol 2004;34: 118-23 [ Links ]
50. ISSHI K, TAJIRI H, FUJISAKI K. et al. The effectiveness of a new multibending scope for endoscopic mucosal resection. Endoscopy 2004; 36: 294-7 [ Links ]
51. SUMIYAMA K, KASIE M, NAKAYOSHI T. et al. Combined use of a magnifying endoscope with a narrow band imaging system and a multibending endoscope for en Bloc EMR of early stage gastric cancer. Gastrointest Endosc 2004; 60: 79-84 [ Links ]
52. KOJIMA T, PARRA-BLANCO A, TAKAHASHI H, FUJITA R. Outcome of endoscopic mucosal resection for early gastric cancer: review of the Japanese literature. Gastrointest Endosc 1998;48:550-5 [ Links ]
53. ONO H, KONDO H, GOTODA T. et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001;48:225-9 [ Links ]
54. KATO M, SHIMIZU Y, NAKAGAWA S, SUGIYAMA T, ASAKA M. The results of questionnaire about endoscopic mucosal resection in the stomach. Dig Endosc 2004;15:S2-S7 [ Links ]
55. IDA K, NAKASAWA S, YOSHINO J. Multicentre collaborative prospective study of endoscopic treatment of early gastric cancer. . Dig Endosc 2004;16:295-302 [ Links ]
56. ODA I, GOTODA T, HAMANAKA I. et al. Endoscopic submucosal dissection for early gastric cancer: technical feasibility, operation time and complications from a large consecutive series. Dig Endosc 2005;17:54-58 [ Links ]
57. LIU R, CHAND B, PONSKY J. The future of surgical endoscopy. Endoscopy 2005;37: 38-41 [ Links ]
58. BARREDA FERNANDO & sánchez juvenal. Tratamiento endoscópico del cáncer gástrico temprano y lesiones premalignas gástricas mediante mucosectomía. Rev Gastroenterol Perú 1998; 18: 214-26 [ Links ]
59. CASTRO D, CASTAÑEDA L, SILVA O. y cols. Resección mucosa endoscópica en cáncer gástrico temprano y lesiones limítrofes. Rev Col. Gastroenterol 1998; 13: 176-180 [ Links ]
60. LLORENS S, PEDRO, PISANO V RAÚL & PISANO O RAÚL. Mucosectomía endoscópica en lesiones gástricas malignas incipientes. Rev Méd Chile 2000; 128: 969-976 [ Links ]
61. REY FERRO, MARIO. Aplicación de nuevos abordajes en el tratamiento de lesiones malignas y premalignas de esófago, estómago, colon y recto. Rev Col Cirugía 2001; 16: 127-136 [ Links ]
CORRESPONDENCIA
Calle Virrey Amat 277 Urbanización La Colonial. Callao
E-mail: miguelchavez11@hotmail.com