Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.25 no.4 Lima Oct./dic. 2005
TRABAJOS ORIGINALES
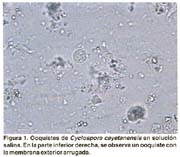
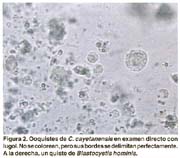
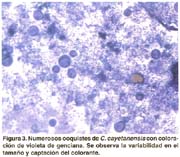
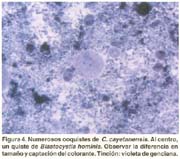
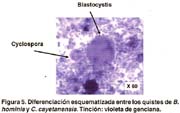
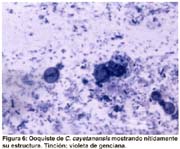
Ciclosporosis: una parasitosis emergente (II). Diagnóstico Microbiológico mediante una nueva técnica de coloración Sonia Burstein Alva1 1 Profesor Principal de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos. Lima, Perú. RESUMEN Objetivos: Se describe una nueva técnica de coloración para el diagnóstico de laboratorio de las infecciones por Cyclospora. Se hace el diagnóstico microscópico diferencial entre la Cyclospora y el Blastocystis hominis. Material y métodos: La investigación se efectuó en heces que fueron remitidas a un laboratorio de atención privada, en la ciudad de Lima, Perú. Se practicó examen directo «en fresco», empleando solución salina y lugol parasitológico. Se prepararon frotices de heces muy delgados y se empleó una técnica de coloración utilizando violeta de genciana. Resultados: Se muestran microfotografías de los quistes de Cyclospora en fresco y mediante la nueva técnica de coloración, así mismo se demuestran las diferencias morfológicas y estructurales entre Cyclospora y Blastocystis hominis. El blastocystis es de mayor tamaño, capta pobremente el colorante y presenta vacuolas. Conclusiones: Se recomienda el empleo rutinario de esta nueva técnica, en todas las investigaciones de heces, por ser sencilla y económica y por permitir hacer un diagnóstico rápido en este tipo de infecciones que tienen una elevada prevalencia en nuestro medio y pueden ser tratadas en forma precoz y específica. SUMMARY Purpose: Describe a new staining technique for the diagnosis of Cyclospora infection through lab tests. A differential microscopic diagnosis between Cyclospora and Blastocystis hominis is conducted. Materials and Methods: The research was conducted by using fecal samples referred to a private lab in the city of Lima, Peru. A direct fresh assay was made by using a saline solution and Lugols solution. Very thin fecal smear were prepared, and a staining technique using gentian violet was applied. Results: Microphotography of Cyclospora cysts are shown with the fresh assay method and the new staining technique. Moreover the morphological and structural differences between Cyclospora and Blastocystis hominis were shown: the latter is larger, shows poor staining, and has vacuoles. Conclusions: The routine use of this technique is recommended for all fecal tests due to its simplicity and low cost, and because it allows a quick diagnosis of this type of infection that has a high prevalence in our country so it may be treated prematurely and specifically. INTRODUCCIÓN Cyclospora,es un coccidio intestinal de reciente descripción que realiza su ciclo vital tanto en el medio ambiente, esporulación (1), como en el tubo digestivo donde se reproduce por vía sexual y asexual dentro de los enterocitos (2) causando destrucción de las células epiteliales y ocasionando diarrea como la manifestación clínica más importante. La elevada frecuencia con que se encuentra últimamente y la diversidad de cuadros clínicos que produce, nos obliga a hacer un diagnóstico de laboratorio rápido y preciso para poder indicar el tratamiento adecuado. El diagnóstico se hace mediante la observación microscópica de las heces en preparados «en fresco», por método directo o con contraste de fase y por técnicas de coloración (3). La Cyclospora, no se cultiva ni puede ser inoculada en animales de experimentación (4). Se ha demostrado que este microorganismo fluoresce con luz ultravioleta. No existen pruebas serológicas, pero actualmente se han empleado técnicas moleculares, especialmente en el estudio de gran cantidad de muestras de agua y alimentos (5). También se ha introducido la técnica de citometría de flujo en brotes epidémicos, cuando se investiga la presencia de ooquistes en numerosas muestras de heces (6). La primera coloración que se empleó para la observación de Cyclospora fue la de Kinyoun, una modificación de la técnica ácido-alcohol resistente que se utiliza para la detección de Cryptosporidium (7). Ambos microorganismos se ven muy similares salvo por el mayor tamaño de la Cyclospora que hizo que inicialmente se le denominara «Crypto-gigante» (8,9). Esta técnica es laboriosa, motivo por el cual no se incluye rutinariamente en la investigación parasitológica, y ha llevado a estudiar diversos procedimientos que no sólo fueran más sencillos sino más específicos. Visvesvara y colaboradores (10), presentan una coloración utilizando safranina modificada, que requiere calentamiento en un horno de microondas. Para simplificar el procedimiento otros investigadores han empleado baño maría a diferentes temperaturas, obteniendo imágenes más homogéneas. Uno de los problemas más importantes es que en nuestro medio la Cyclospora se está informando erróneamente como Blastocystis hominis. La diferencia entre ambos es marcada como demuestra Zerpa en una magnífica galería de fotos (11). Lamentablemente con los aumentos más pequeños que normalmente utilizamos en el laboratorio, cabe la posibilidad que este error se cometa, si sólo empleamos observaciones «en fresco». La finalidad de esta comunicación es presentar una nueva técnica de coloración que nos permite hacer un diagnóstico rápido y preciso de este parásito, así como diferenciarlo de Blastocystis hominis, con el que es confundido con mucha frecuencia. MATERIAL Y MÉTODOS Para la investigación de la Cyclospora se emplearon muestras de heces frescas que fueron remitidas, sin emplear preservantes, a un laboratorio de atención privada, de la ciudad de Lima, Perú. Todas las muestras fueron observadas «en fresco», con solución salina y lugol parasitológico. Para la coloración se empleó la siguiente técnica: efectuar un frotis muy delgado colocando sobre una lámina portaobjetos una gota pequeña de solución salina. Se recoge con un asa de micrón una mínima cantidad de heces y se extiende finamente para dispersar los restos celulósicos. Este paso es muy importante para poder visualizar los quistes en forma aislada, lo cual inclusive nos permite diferenciarlos de otros parásitos con los que, al examen «en fresco», se les confunde con mucha frecuencia. El preparado se fija a medio ambiente o en estufa a 37 grados hasta que seque completamente. Se aplica violeta de genciana durante 10 segundos, se lava con agua de caño y se añade lugol bacteriológico durante otros 10 segundos. Lavar y dejar secar a medio ambiente. Observar con objetivo de 40, que abarca un campo más amplio y permite detectar rápidamente la presencia de los quistes. Para apreciar la estructura más nítidamente, emplear el objetivo de 100. Es preferible utilizar la violeta de genciana de uso comercial, que se emplea en preparaciones farmacológicas tópicas y que se expende en droguerías (1 gr. de colorante, 10 ml. de alcohol etílico absoluto y 89 ml. de agua destilada) ya que el cristal violeta que se utiliza en la técnica convencional de la coloración de Gram, no colorea la Cyclospora. También se puede emplear el colorante del set de Gram, que en nuestro medio se puede adquirir ya preparado para uso de laboratorio y que está elaborado con la violeta de genciana mencionada. Es necesario controlar los reactivos, porque si están muy concentrados oscurecen mucho la lámina y no permiten visualizar adecuadamente los quistes. RESULTADOS En el estudio microscópico efectuado, observamos en la Figura 1, un quiste de Cyclospora en solución salina. Aparece como una esfera hialina, más o menos del tamaño de un hematíe, ya que su diámetro varía de 8 a 10 micras, con una cápsula externa bien definida y no refráctil y un material granular interno que simula una mórula de color verdoso. En la Figura 2, apreciamos que la coloración «en fresco» con lugol, no tiñe los quistes pero delimita muy claramente sus bordes, algunos irregulares, como arrugados. Además en esta foto, podemos observar al examen directo, las diferencias entre el quiste de Cyclospora y el de Blastocystis, tanto en el tamaño como en su aspecto estructural. En las láminas coloreadas, Figura 3, vemos que la Cyclospora se detecta como formas esféricas de gran variabilidad en tamaño y captación del colorante. Algunas formas son oscuras, con una cápsula muy gruesa y un contenido también bien coloreado. Otras son más claras y otras completamente tenues y sin ningún contenido. Es posible encontrar en un mismo campo microscópico, numerosos elementos parasitarios de diferente tamaño, forma y color. En las láminas teñidas se aprecia nítidamente la diferencia entre la Cyclospora y el Blastocystis, Figura 4. El Blastocystis muy grande, teñido tenuemente y con un contenido vacuolar, mientras que los quistes de Cyclospora son muy pequeños y toman mejor la coloración. En la Figura 5, se observa esquemáticamente estas diferencias. La Figura 6, muestra con gran nitidez la morfología típica de los quistes de Cyclospora, lo cual se logra cuando el preparado se ha diluido adecuadamente evitando así la interferencia con los detritus propios de las heces. DISCUSIÓN Existe la idea muy difundida, tanto en otros países como en el nuestro, que la investigación de la Cyclospora es muy compleja y debe ser solicitada en forma especial al laboratorio. El método de coloración que nosotros recomendamos, es sumamente sencillo y está al alcance de cualquier laboratorio. Este procedimiento lo hemos empleado desde hace mucho tiempo en niños, para el diagnóstico directo de Campylobacter y posteriormente, con la aparición de la epidemia del cólera, lo introducimos como parte de la rutina en todos los exámenes de heces. Mediante el empleo de técnicas microscópicas «en fresco», pudimos observar en heces líquidas la presencia de formas quísticas, que al examen directo, se veían como elementos redondeados y refringentes que hasta entonces nos eran desconocidos, pudiendo confundirse con Blastacystis hominis, Endolimax nana, Cryptosporidium y levaduras. La técnica de coloración nos permitió identificarlos como Cyclospora, por su tamaño, por la morfología típica descrita en la bibliografía y además porque el cuadro clínico cedía en forma dramática con el tratamiento específico recomendado para esta parasitosis (12). En las fotos que presentamos, podemos apreciar la gran cantidad de ooquistes que se observan, así como la nitidez y variabilidad de su morfología. Se observa con mucha frecuencia que se está informando Blastocystis hominis en patología digestiva. Hemos constatado que este parásito coexiste con la Cyclospora en más del 90% de los casos. No sabemos si esto es casual o existe alguna relación entre ambos. Cuando sólo se efectúa examen «en fresco», es posible confundirlos porque ambos se ven como elementos redondeados, siendo la Cyclospora tan pequeña, que puede pasar desapercibida. Tenemos inclusive pacientes en los cuales el Blastocystis es tan abundante y su morfología tan perfecta, que opaca la presencia de la Cyclospora. Con esta coloración, la diferencia entre ambos es marcada (Figura 4), ya que el B. hominis es más grande, se colorea débilmente y puede presentar vacuolas en su citoplasma. En algunas oportunidades, al examen directo «en fresco», sólo hemos visto Blastocystis, que como insistimos se visualiza con mayor facilidad, sin embargo en la lámina coloreada siempre hemos encontrado además, quistes de Cyclospora. Todo esto nos lleva a tener mucho cuidado con el diagnóstico clínico-microbiológico de Cyclospora, que a diferencia del Blastocystis, es causante de un cuadro de patogenicidad reconocida, y en algunos casos muy severo, pero que tiene tratamiento específico y efectivo, completamente diferente al de otras parasitosis. En cambio, el rol patógeno del B. hominis, sigue causando grandes controversias (13,14). Mientras que algunos rechazan radicalmente su participación como causante de problemas digestivos, otros le atribuyen rol patógeno de procesos en los cuales se describen exactamente los mismos síntomas que corresponden a la ciclosporosis (15). La mayor confusión se crea cuando se administra tratamiento para el Blastocystis y el cuadro puede ceder aparentemente, dada la peculiaridad de la ciclosporosis de auto limitarse, pero en realidad el parásito permanece latente hasta provocar una reactivación o pasar a la cronicidad. Nosotros hemos encontrado Cyclospora tanto en pacientes no tratados, que vienen de otros laboratorios con el diagnóstico de B. hominis, como en pacientes tratados erróneamente por Blastocystis y que han recidivado. Además de su gran utilidad, el método que hemos presentado es sumamente sencillo y está al alcance de cualquier laboratorio. Recomendamos incluirlo rutinariamente en todos los exámenes de heces, pues como hemos visto, la prevalencia de Cyclospora es cada vez más elevada en nuestro medio. AGRADECIMIENTOS: Al Dr. Javier Arias Stella, Director del Instituto de Patología y Biología Molecular Arias Stella, por su gentil colaboración en la obtención de las microfotografías. BIBLIOGRAFÍA 1. ORTEGA YR, STERLING CR, GILMAN RH, CAMA VA, DÍAZ F. Cyclospora species. A new protozoan pathogen of humans. N England J Med 1993; 328(18):1308-12. [ Links ] 2. CONNOR BA, SHLIM DR, SHOLES JV, RAYBURN JL, REIDY J, RAJAH R. Pathologic changes in the small bowel in nine patients with diarrhea associated with a coccidia-like body. Ann Int Med 1993; 119:377-82. [ Links ] 3. EBERHARD ML, PIENIAZEK NJ, ARROWOOD MJ. Laboratory Diagnosis of Cyclospora Infections. Arch Pathol Lab Med 1997; 121:792-7. [ Links ] 4. HERWALDT BL. Cyclospora cayetanensis: a review, focusing on the outbreaks of Cyclosporiasis in the 1990s. Clin Infect Dis 2000; 31:1040-57. [ Links ] 5. SHIELDS JM, OLSON BH. PCR-Restriction fragment length polymorphism method for detection of Cyclospora cayetanensis in environmental waters without microscopic confirmation. Applied and Environmental Microbiology 2003 Aug; 69(8):4662-9. [ Links ] 6. DIXON BR, BUSSEY JM, PARRINGTON LJ, PARENTEAU M. Detection of Cyclospora cayetanensis oocyst in human fecal specimens by flow cytometry. J Clin Microbiol 2005 May; 43(5):2375-9. [ Links ] 7. HENRIKSEN SA, POHLENZ JFL. Staining of cryptosporidia by a modified Ziehl-Neelsen technique. Acta Vet Scand 1981; 22:594-6. [ Links ] 8. SOAVE R, DUBEY JP, RAMOS LJ, TUMMINGS M. A new intestinal pathogen? (Abstract) Clin Res 1986; 34:533A. [ Links ] 9. NARANJO J, STERLING CR, GILMAN RH. et al. Cryptosporidium muris-like objects from fecal samples of Peruvians (abstract 324). In: Program and abstracts of the 38th Annual Meeting of the American Society of Tropical Medicine and Hygiene (Honolulu) December 10-14, 1989:243. [ Links ] 10. VISVESVARA GS, MOURA H, KOVACS-NACE E, WALLACE S, EBERHARD ML. Uniform staining of Cyclospora oocysts in fecal smears by a modified safranin technique with microwave heating. J Clin Microbiol 1997 Mar; 35(3):730-3. [ Links ] 11. ZERPA R. Rompiendo paradigmas en la observación microscópica. Comunicación preliminar. An Fc Med (Lima-Perú) 2003; 64(4):267-73. [ Links ] 12. HOGE CW, SHLIM DR, GHIMIRE M, et al. Placebo-controlled trial of cotrimoxazole for Cyclospora infections among travellers and foreign residents in Nepal. Lancet 1995; 345:691-3. [ Links ] 13. BABCOCK D, HOUSTON R, KUMASKI D, SCHLIM D. Blastocystis hominis in Kathmandu, Nepal (letter). N Engl J Med 1985; 313:1419. [ Links ] 14. MARKELL EK, UDKOW MP. Blastocystis hominis: pathogen or fellow traveler? Am J Trop Med Hyg 1986 Sep; 35(5):1023-6. [ Links ] 15. BARAHONA L, MAGUIÑA C, NÁQUIRA C, et al. Blastocystis humana: estudio prospectivo, sintomatología y factores epidemiológicos asociados. Rev Gastroenterol Perú 2003 Jan-Mar; 23(1):29-35.
PALABRAS CLAVE: Cyclospora; Coloración; Blastocystis hominis; Lima, Perú.
KEYWORDS: Cyclospora; Staining; Blastocystis hominis; Lima, Peru.