Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Gastroenterología del Perú
versão impressa ISSN 1022-5129
Rev. gastroenterol. Perú v.27 n.2 Lima abr.-jun. 2007
ARTÍCULOS ORIGINALES
Presencia de Citomegalovirus en Colitis Ulcerativa en el Hospital Nacional 2 de Mayo
F. Arévalo Suárez1; G. Cerrillo Sánchez2; J. Sandoval Campos3
1 Médico Residente 3º año. Servicio de Anatomía Patológica. Hospital Nacional Dos de Mayo.
2 Médico Asistente. Jefe del Servicio de Anatomía Patológica. Hospital Nacional Dos Mayo
3 Tecnólogo Médico. Servicio de Anatomía Patológica Hospital Nacional Dos de Mayo.
RESUMEN
La asociación entre citomegalovirus y colitis ulcerativa ha sido reportada por muchos autores , pero la explicación fisiopatología de esta relación aún es incierta. Revisamos los casos diagnosticados como Colitis ulcerativa por el Servicio de Anatomía Patológica del Hospital Dos de Mayo, durante los años 2000 a 2005; en ellos se determinó la presencia de Citomegalovirus mediante técnicas de inmunohistoquímica, y se describió las características histológicas de nuestros casos. CMV fue identificado en 22,2% de los casos, ninguno de los cuales había recibido tratamiento inmunosupresor previo, la actividad histológica de la enfermedad se reportó en todos los casos positivos para CMV y en 42,8% de los casos negativos para CMV. La distorsión arquitectural críptica fue la característica histológica más frecuente de CU y se midió una frecuencia de colitis ulcerativa de 1,5 por año. Nuestros hallazgos son similares a los reportados por otros autores extranjeros, y se corresponden con la teoría que sostiene que los cambios inflamatorios propios de CU, facilitarían la activación de CMV sin la necesidad de uso inmunosupresores.
PALABRAS CLAVES: Colitis ulcerativa, citomegalovirus, inmunosupresores, actividad histológica
SUMMARY
The association between cytomegalovirus and ulcerative colitis has been reported by many authors, but the exact pathogenesis of this relationship remains unclear. We reviewed all ulcerative colitis cases whose diagnosis were made in Hospital dos de Mayo, during period 2000-2005, these cases were evaluated for Cytomegalovirus using inmunohistochemistry, also we described histological features of our cases. CMV was identified in 22,2% of all cases, none of them had been treated with inmunosuppressants previously, histological activity was reported in all positive cases and 42,8% negative cases for CMV; Crypt architectural abnormality was the most often histological finding, and the frequency of ulcerative colitis was 1,5 per year. Our findings are similar to those reported by foreign authors and is consistent with theory which maintains inflammatory changes of UC would help CMV´s activation without using inmunosuppressants.
KEY WORDS: Ulcerative colitis, Cytomegalovirus, inmunosuppresants, histological activity.
INTRODUCCIÓN
La asociación entre Colitis Ulcerativa y Citomegalovirus ha sido descrita en muchos trabajos pero la fisiopatología de esta asociación aún es poco clara(1). Powellet al. fueron los primeros en señalar dicha asociación en 1961,(2) y durante los últimos 40 años se han incrementado los reportes que informan sobre la presencia de CMV en pacientes con Colitis ulcerativa (CU), mas aún, la presencia de CMV parece asociarse a mayor severidad clínica o a refractariedad al tratamiento corticoide, según Manconiet al.(3) aproximadamente el 30% de pacientes con Colitis Ulcerativa Refractaria a corticoides son positivos para CMV; similares hallazgos respecto a la colitis ulcerativa refractaria han sido reportados por Kambhan(4). Asimismo Kishore et al.(5) demostraron que los pacientes diagnosticados de CU y que simultáneamente presentan infección por CMV requieren con más frecuencia de tratamiento quirúrgico, que aquellos con CU pero sin la presencia de CMV, siendo esta diferencia estadísticamente significativa (4 de 10 vs. 4 de 53, p =0,04),en ese sentido Begos et al. concluyó que los pacientes con enfermedad inflamatoria intestinal y coinfección por CMV presentan una mayor tasa de colectomía y mayor mortalidad (del 67 % y del 33% respectivamente)(6). Basados en estos hallazgos, algunos autores consideran que la reactivación de CMV en los tejidos afectados por CU, actuaría como un factor exacerbante o activador de esta enfermedad, empeorando el curso de la misma.
No obstante la probada asociación de CMV a un curso clínico más severo de CU, aún queda la pregunta sobre si la reactivación de CMV es causada por el tratamiento esteroideo o es causada por la misma respuesta inflamatoria presente en CU; parece claro entender esta asociación cuando este virus ADN es detectado en un contexto de inmunosupresión, es decir en pacientes con CU que reciben altas dosis de corticoesteroides, pero al menos una tercera parte de los pacientes positivos para CMV no tienen historia de tratamiento esteroideo previo(1), así como también se reportan casos de asociación entre infección por citomegalovirus y colitis ulcerativa de debut.(7), y por consiguiente sin ningún tratamiento inmunosupresor farmacológico anterior; además trabajos experimentales en modelos animales con infección latente conocida para CMV, han probado que la inmunosupresión logra la activación del virus, pero esta activación se logra con irradiación corporal total, o usando drogas citotóxicas como ciclofosfamida, métodos de inmunosupresión, por lo general, no usados en el manejo de CU.(8,9,10).
El objetivo de este trabajo es determinar cual es la frecuencia de CMV mediante técnicas de inmunohistoquímica, en casos con diagnóstico debut de CU, y por lo tanto sin un tratamiento inmunosupresor previo. La inmunohistoquímica nos ayudará a determinar con mayor sensibilidad la presencia del virus, ya que los efectos histológicos no se producen en todas las células infectadas., además describiremos algunas características del comportamiento biológico de colitis ulcerativa en el Hospital Dos de Mayo. Consideramos que los resultados que obtengamos serán de utilidad, especialmente en lograr un conocimiento más completo sobre el comportamiento de esta compleja y poco documentada patología en el Perú.
MATERIAL Y MÉTODOS
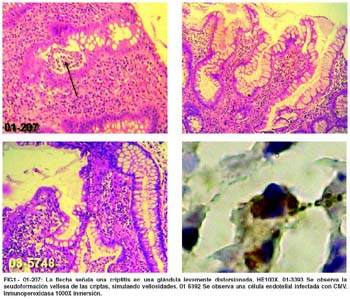
El presente trabajo es de tipo retrospectivo descriptivo. Se revisaron todos los casos de colitis diagnosticados en biopsias colónicas durante los años 2000 al 2005, de este grupo se seleccionaron a aquellos con diagnóstico de colitis ulcerativa. Se excluyeron a todos aquellos casos caso que hubieran recibido tratamiento inmunosupresor previo o sulfasalazina. Se definió como caso de Colitis Ulcerativa a aquel con sospecha clínica de colitis ulcerativa y cuya biopsia mostrara 2 de los 3 criterios histopatológicos que propone la Sociedad Británica Gastroenterológica(11) como de mayor valor diagnóstico para colitis ulcerativa: Distorsión arquitectural, disminución en la densidad de las criptas y superficie vellosa de la mucosa colónica. Distorsión arquitectural críptica fue definida como la presencia de criptas no paralelas, de diámetro variable o quísticamente dilatadas, o ramificadas. Disminución de la densidad críptica fue definida como 5 a 7 criptas por milímetro o como la separación entre las criptas por un espacio mayor al grosor de una cripta, Superficie pseudovellosa fue definida como la pérdida de la horizontalidad característica de la superficie colónica, exceptuando aquellos en que la distorsión se da sobre un folículo linfoide hiperplásico. También se midió otras características señaladas como signos de actividad: criptitis, úlcera y depleción mucinosa(12), definiéndose como actividad histológica presente a aquel caso que presentara al menos 2 de las 3 características mencionadas. La presencia de Citomegalovirus se midió usando técnicas de inmunohistoquímica con anticuerpos monoclonales, catalogándose como positivo a la presencia de coloración dorada perinuclear o citoplasmática de cualquier célula en 2 o más cortes de parafina.
Las láminas, y bloques de parafina se obtuvieron del archivo del servicio de Anatomía Patológica. Los datos no histológicos se obtuvieron del archivo del sistema del servicio de Anatomía Patológica y de las historias clínicas. Los resultados se midieron en porcentajes y fueron analizados con ayuda del programa Excel.
RESULTADOS
Se encontraron 9 casos, 4 hombres y 5 mujeres, siendo la frecuencia de 1,5 casos por año. El rango de edades fue de 15 a 53 años, siendo el promedio de 37 años.
De 9 pacientes con diagnóstico de colitis ulcerativa, 2 presentaron positividad para citomegalovirus, (22,2%), la frecuencia de las variables histológicas se presentan en porcentajes en la tabla siguiente:
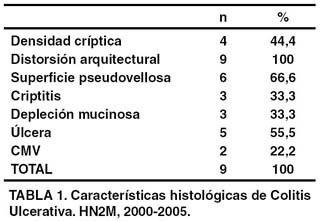
Se relaciono la actividad de colitis ulcerativa con la presencia de CMV en una tabla de contingencia (tabla 2). Se encontro actividad en todos los casos positivos para CMV y en 42,8% de los casos negativos para CMV.

DISCUSIÓN
La frecuencia de colitis ulcerativa fue de aproximadamente 1,5 por año, hallazgo similar al reportado por otros autores peruanos; así en el trabajado realizado por Illescas y col.(13) en el Hospital Almenara, se reportaron 74 casos en 51 años, o sea aproximadamente 1,5 casos por año, del mismo modo Vera y col.(14) en el Hospital Rebagliati reportó una incidencia de 2,1 casos por año. El promedio de edad en nuestros casos fue de 37 años, siendo el rango de 15 a 53 años; se conoce que la colitis ulcerativa afecta mas a pacientes jóvenes entre 20 y 40 años. Vera, encontró un promedio de 45 años, mientras que Illescas, menciona una mayor frecuencia entre la tercera y cuarta década en sus 74 casos.
La presencia de CMV fue demostrado por inmunohistoquímica en el 22,2% de nuestros casos, Criscuoli, el año 2004(15), encontró un 21% de casos positivos para CMV en 42 pacientes diagnosticados como enfermedad inflamatoria intestinal, pero esta frecuencia fue mayor en los casos de CU refractaria a tratamiento esteroideo; asimismo Cottone(16) reportó una incidencia de 31% en 16 casos de colitis ulcerativa refractaria a tratamiento; ninguno de nuestros casos de colitis ulcerativa presentaba historia de tratamiento esteroideo previo, por ser diagnósticos de debut, incluso uno de los casos curiosamente tuvo una biopsia al año siguiente del diagnóstico, por lo que recibió prednisona y sulfasalazina, esta biopsia resultó negativa para CMV, a pesar de ser posterior al tratamiento inmunosupresor. Consideramos que la presencia de citomegalovirus en pacientes con colitis ulcerativa pero sin tratamiento inmunosupresor, se explicaría muy bien con la teoría que sostiene, que la enfermedad inflamatoria intestinal se, facilitaría la activación de CMV. Respecto a que si las alteraciones inflamatorias propias de CU favorecen la reactivación de CMV, existen interesantes teorías; se sabe que pacientes con colitis ulcerativa presentan niveles séricos elevados de, INFγ y FNTα, estas citoquinas han sido señaladas por algunos autores como causantes de la reactivación de una infección por citomegalovirus latente(9,17,18), al parecer tanto INFγ y FNTα, estimulan a los linfocitos a liberar citoquinas y moléculas de adhesión, de esta manera, estimulados por las citoquinas, llegarían al lugar de mayor actividad inflamatoria, monocitos y células dendríticas con infección latente a CMV, infección que se activaría en el lugar de la lesión, a su vez las células endoteliales actuarían como células reservorio para CMV, las que alojarían al virus permitiendo su replicación activa, las mismas células endoteliales estimularían a los linfocitos a producir nuevamente INFγ y FNTα, los que agravarían aún más la enfermedad, en una especie de círculo vicioso, este dato también fue corroborado en el presente trabajo, ya que todas las células que marcaron positivamente para CMV fueron células endoteliales. Esta teoría nos habla de una reactivación mas que de una infección, afirmación que encuentra sustento en el hecho de que en la evaluación serología TABLA 2. Actividad inflamatoria y CMV en CU. HN2M, 2000-2005. efectuada a pacientes con CU positivos para CMV, sólo un pequeño porcentaje presentan anticuerpos IGM (+) para CMV (18). Las células infectadas por citomegalovirus, no mostraron efectos citopáticos. Se sabe que la histología con Hematoxilina- Eosina tiene una muy baja sensibilidad, probablemente porque los cuerpos de inclusión no siempre son visibles y porque las células infectadas no siempre son citomegálicas(19), lo que hace aún más difícil su diagnóstico sin inmunohistoquímica. En el presente estudio utilizamos anticuerpos dirigidos contra antígenos específicos de citomegalovirus, la confiabilidad diagnóstica de este método es alta debido a la ausencia de reacción cruzada con otros herpes virus. Los pacientes con citomegalovirus presentaron con más frecuencia actividad in- fl amatoria que aquellos con negatividad para CMV, hallazgo compatible con los trabajos que reportan mayor agresividad en los casos de CU asociados a CMV, sin embargo el pequeño tamaño de nuestra población limita el valor estadístico de nuestros resultados.
El hallazgo histológico que siempre estuvo presente fue la distorsión arquitectural de las criptas, incluida la ramificación críptica, esta alteración representa la regeneración críptica que se produce después de un daño inflamatorio, y se considera junto con la superficie pseudovellosa indicadores de una fase resolutiva de la enfermedad, por otro lado la disminución de la densidad críptica sólo fue encontrada en un 44,4%, también especialmente presente en la fase quiescente de la enfermedad. Por otro lado, características histológicas como metaplasia de células de Paneth, hiperplasia de células neuroendocrinas, que son asociadas a historia de colitis ulcerativa de larga data, no fueron evidenciados, lo cual es compatible con la situación de diagnóstico de debut de nuestros casos, es decir con una enfermedad de pocos años de evolución.
En conclusión la frecuencia hallada para CMV en nuestros casos de CU fue de 22,2%, ninguno de los cuales había recibido tratamiento inmunosupresor previo o sulfasalazina, encontrándose mayor frecuencia de actividad histológica en los casos positivos para CMV que en los negativos al mismo (100% vs 42,8%). Estos hallazgos podrían tener importancia en el enfoque diagnóstico y podría introducir nuevas herramientas terapéuticas en el manejo de esta enfermedad, por lo que hace falta mayores estudios que respalden los hallazgos aquí presentados.
REFERENCIAS
1. YK YEE, SW WONG, ML SZETO Ulcerative colitis exacerbation associated with cytomegalovirus infection. HKMJ.1998; 4 : 4 [ Links ]
2. POWELL RD, WARNER NE, LEVINE RS, KIRSNER JB. Cytomegalic inclusion disease and ulcerative colitis: report of a case in a young adult. Am J Med 1961;30:334-40. [ Links ]
3. MACONI G, COLOMBO E, ZERBI P,et al. Prevalence, detection rate and outcome of cytomegalovirus infection in ulcerative colitis patients requiring colonic resection. Dig Liver Dis 2005; 37(6):418-23. [ Links ]
4. KAMBHAM N, VIJ R, CARTWRIGHT CA, LONGACRE T. Cytomegalovirus infection in steroid-refractory ulcerative colitis: a case-control study.Am J Surg Pathol 2004; 28(3):365-73. [ Links ]
5. KISHORE J, GHOSHAL U, GHOSHAL UC, et al. Infection with cytomegalovirus in patients with inflammatory bowel disease: prevalence, clinical significance and outcome. J Med Microbiol 2004; 53:1155-60. [ Links ]
6. BEGOS DG, RAPPAPORT R, JAIN D. Cytomegalovirus infection masquerading as an ulcerative colitis flareup: case report and review of the literature. Yale J Biol Med 1996; 69:323–8. [ Links ]
7. TÁRRAGA RI, FERRERAS FP, VICENTE GM, y col. Colitis ulcerosa e infección por citomegalovirus. An Med Inter 2003; 20: 85-87. [ Links ]
8. MAYO D, ARMSTRONG JA, HO M. Activation of latent murine cytomegalovirusinfection: cocultivation, cell transfer, and the effect of immunosuppression .J Infect Dis 1978;138:890–896 [ Links ]
9. HOMES et al. The Pathogenicity of Cytomegalovirus in Inflammatory Bowel Disease A Systematic Review and Evidence-based Recommendations for Future Research. Inflamm Bowel Dis 2004;10:245–250. [ Links ]
10. MAYO DR, ARMSTRONG JA, HO M. Reactivation of murine cytomegalovirus by cyclophosphamide. Nature 1977;267:721–723. [ Links ]
11. D JENKINS, M BALSITIS, S GALLIVAN, et al. Guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. The British Society of Gastroenterology Iniltiative. J ClinPathol 1997; 50:93-105. [ Links ]
12. FENOGLIO-PREISER: Gastrointestinal Pathology: An Atlas & Text, , 1998 [ Links ]
13. ILLESCAS C, GARCIA C L, FAGIONI F. Colitis ulcerosa : estudio retrospectivo en 52 años. Rev de Gatroenter Peru 19:2;116-123. [ Links ]
14. VERA CA, FRISANCHO VO, YOZA YM, y col Perfil clínico y epidemiológico de la colitis ulcerativa en un Hospital de Lima. Rev Gastroenterol Perú 2004; 24:135-142. [ Links ]
15. CRISCUOLI V, CASA A, ORLANDO A et al. Severe acute colitis associated with CMV: a prevalence study. Dig Liver Dis. 2004; 36(12):818-20. [ Links ]
16. COTTONE M, PIETROSI G, MARTORANA G, et al Prevalence of cytomegalovirus infection in severe refractory ulcerative and Crohns colitis. Am J Gastroenterol 2001; 96: 773-775 [ Links ]
17. SODERBERG-NAUCLER, C., FISH, K. N. & NELSON, J. A. Interferon gamma and tumor necrosis factoralpha specifically induce formation of cytomegaloviruspermissive monocyte-derived macrophages that are refractory to the antiviral activity of these cytokines. J Clin Invest 1997 ;100,3154–3163. [ Links ]
18. .QUERA PR., LANAS M.A, MUÑOZ CL Infección por Citomegalovirus en paciente con colitisulcerosa sin tratamiento inmunosupresor. Gastr Latinoam 2006;17 : 66-72 [ Links ]
19. BEAUGERIE, L., CYWINER-GOLENZER, C., MONFORT, L. Definition and diagnosis of cytomegalovirus colitis in patients infected by human immunodeficiency virus. J Acquir Immune Defic Syndr Hum Retrovirol 1997;14: 423–429 [ Links ]