Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.28 n.2 Lima abr./jun. 2008
ARTÍCULO ORIGINAL
Gastrectomía Distal Laparoscópica por Cáncer Gástrico. Experiencia inicial.
Laparoscopic distal gastrectomy for gastric cancer. Iinitial experience.
Francisco Berrospi1, Juan Celis1, Eloy Ruíz1, Eduardo Payet1, Iván Chávez1, Frank Young1
1 Departamento de Abdomen Instituto de Enfermedades Neoplásicas Av. Angamos Este 2520 Lima 34 Perú
RESUMEN
OBJETIVO. Presentar la experiencia inicial con la gastrectomía distal asistida por laparoscopía (GDAL) analizando la morbilidad y mortalidad peri operatoria y la radicalidad del procedimiento.
PACIENTES Y MÉTODOS. La serie comprende 29 pacientes con cáncer gástrico candidatos a gastrectomía radical operados entre mayo 2006 y marzo 2008. La operación consistió la movilización del estómago distal y la linfadenectomía D2 por vía laparoscópica y una mini laparotomía para la extirpación de la pieza operatoria y la confección de las anastomosis respectivas.
RESULTADOS. 29 pacientes tuvieron GDAL con linfadenectomía D2. Doce pacientes tuvieron cáncer gástrico precoz y 19 tuvieron cáncer gástrico avanzado. El tiempo operatorio promedio fue 287.4 min. El promedio de ganglios resecados fue 42.6. Los márgenes quirúrgicos proximal y distal fueron de 5.8 cm. y 3.5 cm., respectivamente. Histológicamente, todos los márgenes fueron negativos. La morbilidad post operatoria fue 10.3 %. Ningún paciente falleció en el post operatorio.
CONCLUSION. Los resultados a corto plazo de nuestra serie inicial demuestran que la GDAL para el tratamiento del cáncer gástrico es un procedimiento que puede realizarse con criterio oncológico y con baja morbilidad.
PALABRAS CLAVE: Laparoscopía, gastrectomía, cáncer gástrico
ABSTRACT
OBJECTIVE. To report the initial experience with the laparoscopy-assisted distal gastrectomy (LADG) with D2 lymphadenectomy for gastric cancer
PATIENTS AND METHODS. Between May 2006 and May 2007, 29 consecutive GC patients with gastric cancer underwent LADG with D2 lymphadenectomy. The operation consisted in a laparoscopic time to perform lymphadenectomy and mobilization of the distal stomach, followed by a minilaparotomy for exteriorization of the specimen and construction of a hand sewn anastomosis.
RESULTS. Twenty-nine patients underwent LADG with D2 lymphadenectomy for gastric cancer. Mean age was 58.2 years. Mean operative time was 287.4 min. Mean number of lymph nodes resected was 42.6. Twelve patients were early gastric cancer, and seventeen were advanced gastric cancer. Mean proximal and distal resection margin were 5.8 cm and 3.5 cm, respectively. Resection margins were negative in all cases. Mean number of lymph nodes resected was 42.6. Thirty-day morbidity rate was 10.3 %. There were no postoperative deaths.
CONCLUSION. The short-term results of our LADG with D2 lymphadenectomy for the treatment of gastric cancer shows that a radical surgery, in terms of resection margins and lymphadenectomy, can be done with low morbidity.
KEY WORDS: Laparoscopía, gastrectomía, cáncer gástrico
INTRODUCCIÓN
La era de la gastrectomía laparoscópica para el tratamiento del cáncer gástrico (CG) comienza con el primer reporte de Kitano y cols(1). La operación consistió en un tiempo laparoscópico para la movilización del estómago distal y la realización de una linfadenectomía limitada y un tiempo abierto a través de una mini laparotomía para la extracción de la pieza operatoria y la anastomosis tipo Billroth I(1), lo que se conoce ahora como gastrectomía distal asistida por laparoscopía (GDAL). Desde entonces, muchos cirujanos de todo el mundo se fueron sumando en la investigación de este nuevo abordaje y rápidamente se fueron desarrollando todos los tipos de gastrectomía como gastrectomía distal con anastomosis Billroth II(2,3), linfadenectomía D2(4), gastrectomía total(5), gastrectomía con preservación pilórica(6) entre otros procedimientos.
El nuevo abordaje laparoscópico tuvo una gran aceptación especialmente en Japón(7) y fi nalmente fue incluido en sus guías de tratamiento del cáncer gástrico específi camente para el cáncer gástrico precoz(8).
Las ventajas de la gastrectomía laparoscópica sobre la operación convencional como menor dolor post operatorio, rápida recuperación, corta estancia hospitalaria, etc., son aspectos muy bien documentados en la literatura(9-11). Desde el punto de vista oncológico, los resultados a largo plazo son los más importantes y al respecto diversas publicaciones han demostrado que es factible realizar gastrectomía con intención curativa y buenos resultados de sobrevida a 5 años (12-14). Similar experiencia ha sido reportada para el cáncer gástrico avanzado pero las series son limitadas(15,16).
Desde la década del 80, en el Instituto de Enfermedades Neoplásicas, el tratamiento estándar del cáncer gástrico es la gastrectomía radical con linfadenectomía D2 según lo recomendado por la Japanese Gastric Cancer Association (17). La experiencia institucional con la gastrectomía radical convencional y la evidencia acumulada hasta la fecha sobre los posibles benefi cios de la GDAL nos animaron a utilizar este Nuevo abordaje en un grupo seleccionado de pacientes con cáncer gástrico. El objetivo del presente artículo es presentar la experiencia inicial con la gastrectomía distal asistida por laparoscopía (GDAL) analizando la morbilidad y mortalidad peri operatoria y la radicalidad del procedimiento.
PACIENTES Y MÉTODOS
Pacientes
Entre mayo 2006 y marzo 2008, 29 pacientes con cáncer gástrico clínicamente resecable fueron operados mediante abordaje laparoscópico. Los criterios de inclusión fueron: edad mayor de 18 años, riesgo quirúrgico ASA I o II ( American Society of Anesthesiology), tumor ≤ 5 cm., localización en tercio medio o distal del estómago, cT1-3, y cN0-1, adenomegalias ≤ 2 cm. en la tomografía computada, ausencia de metástasis peritoneal o hepática. Todos los pacientes firmaron el consentimiento informado. Los criterios de exclusión fueron: cT4, adenomegalias > 2 cm., enfermedades asociadas que contraindiquen la cirugía, hernia incisional, hipertensión portal, embarazo, antecedentes de cirugía gástrica, operaciones de emergencia.
Técnica operatoria
De manera general la operación consistió en un tiempo asistido por laparoscopía para realizar la disección ganglionar y la movilización del estómago distal seguido de un tiempo abierto en el que a través de una laparotomía de 5 cm. se exterioriza la pieza operatoria y se realiza la reconstrucción del tracto digestivo. La hemostasia y el control de los vasos perigástricos se realizó con electrocoagulación monopolar, clips metálicos, o el dispositivo sellador de vasos. La pieza operatoria consistió en los 2/3 distales del estómago y una disección linfática D2. Desde el punto de vista oncológico, durante la operación nos esforzamos en seguir los mismos reparos anatómicos que utilizamos en el procedimiento convencional. La linfadenectomía D2 ha sido definida por la Japanese Classifi cation of Gastric Carcinoma(17).
El tiempo laparoscópico fue realizado con el paciente en posición supina con las piernas abiertas (posición francesa), el cirujano principal en el lado derecho del paciente, el primer ayudante en el lado izquierdo del paciente y el operador del laparoscopio entre las piernas del paciente. Se utilizaron 5 trocares: T1, 5mm, en el ombligo, para la óptica de 30 º; T2,12 mm, flanco derecho; T3, 5 mm, subcostal derecho; T4, 5 mm, subxifoideo, y T5, 10 mm, flanco izquierdo. El cirujano principal opera utilizando ambas manos en la que T2 se convierte en el trocar operador para las tijeras, electrobisturí y sutura automática. La mini laparotomía se realiza ampliando T4.
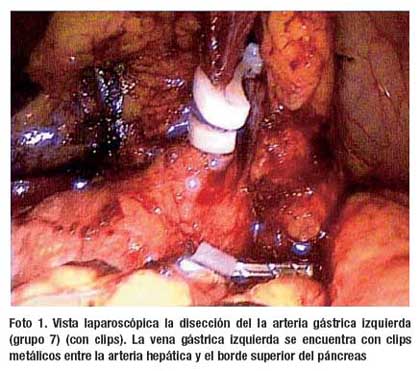
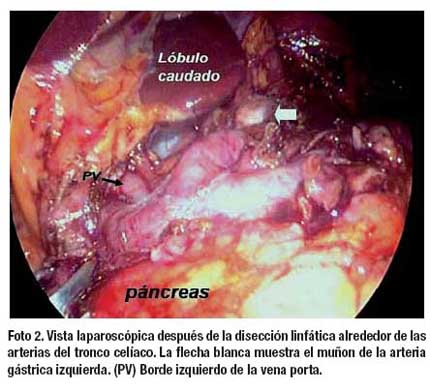
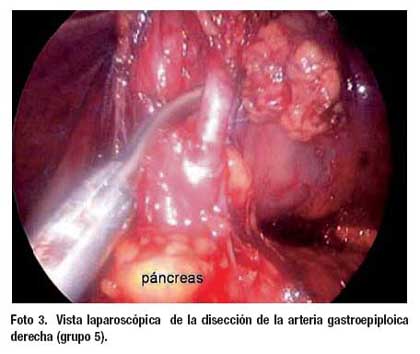
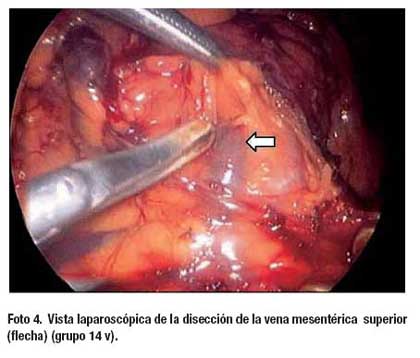
La operación comienza con la sección del epiplón menor lo más cerca de su inserción en el ligamento venoso de Arancio, desde ligamento hepatoduodenal hasta el pilar diafragmático derecho. La linfadenectomía empieza con la disección de los vasos suprapilóricos (nº 5), luego se diseca el borde izquierdo del ligamento hepatoduodenal exponiendo la vena porta (nº 12a), siguiendo la arteria hepática común (nº 8ª) hacia la línea media se encuentran la vena y arteria gástrica izquierdas, esta última (nº 7) se diseca en su raíz extirpando en bloque los ganglios del tronco celíaco (nº 9) (Foto 1). La linfadenectomía continúa sobre la arteria esplénica hasta el nacimiento de la arteria gástrica posterior (nº 11p) (Foto 2). A continuación se realiza la disección de la curvatura menor a nivel de lo que será el borde de sección proximal hasta alcanzar los ganglios paracardiales derechos (nº 1). En este momento, la operación se desplaza hacia la curvatura mayor del estómago empezando con los ganglios de la arteria gastroepiploica izquierda (nº 4sb) y dirigiéndose hacia el ángulo esplénico del colon y desde allí, en forma retrógrada hasta el ángulo hepático, seccionado el ligamento gastrocólico de tal manera que se realiza una omentectomía total. Finalmente se realiza la disección de los ganglios infrapilóricos (nº 6) (Foto 3). Para los tumores del tercio distal se agregó la disección de los ganglios de la vena mesentérica superior (nº 14v) (Foto 4). El tiempo laparoscópico termina con la sección del duodeno utilizando sutura automática. En los casos en que se consideró realizar una anastomosis Billroth I y en los que no se dispuso de este instrumento la sección del duodeno se realizó a través de la mini laparotomía.
En el post operatorio los pacientes fueron manejados de la manera habitual utilizada para la gastrectomía convencional: antibiótico profilaxis, inicio de la vía oral en forma progresiva a partir del 3º día y alta al 6º ó 7º día.
Para el estudio anatomopatológico de la pieza operatoria se utilizó la Clasificación TNM para los Tumores Malignos (18).
RESULTADOS
La serie consta de 29 pacientes con cáncer gástrico (10 varones y 19 mujeres) que tuvieron GDAL con linfadenectomía D2. La edad promedio fue 58.2 años (DE 12.2 años) (mediana 59, rango 24 – 82 años). El índice de masa corporal (IMC) promedio fue 24.8 (DE 4.0) (mediana 23.9, rango 19.3 – 34.2). Nueve pacientes (31%) tuvieron cirugía abdominal previa que no contraindicó el abordaje laparoscópico: 4 colecistectomías, 3 histerectomías, 3 cesáreas, y 1 laparoscopía. Dos pacientes habían tenido más de una operación abdominal. En un caso el tumor estuvo adherido a la cabeza del páncreas por lo que la resección debió completarse a través de la mini laparotomía sin dejar enfermedad residual. Durante los primeros 5 casos la linfadenectomía se realizó parcialmente vía laparoscópica pero fue completada a través de la incisión abdominal. En los demás casos la movilización del estómago y la linfadenectomía fueron realizados completamente por vía laparoscópica.
La reconstrucción del tracto digestivo fue realizada en forma extracorpórea mediante anastomosis manual: 1, paciente tuvo anastomosis en Y de Roux, 2 pacientes tuvieron anastomosis Billroth I y los restantes tuvieron anastomosis Billroth II. Los hallazgos operatorios se muestran en la Tabla 1.
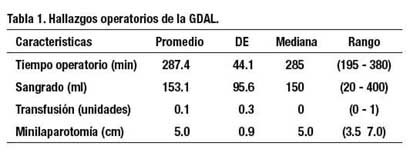
Durante la operación hubieron 3 complicaciones: un sangrado por desgarro esplénico que cedió espontáneamente, un clipado inadvertido de la arteria hepática propia que produjo isquemia hepática transitoria que revertió después de retirar el clip, una lesión colónica con el electrocauterio que se trató preventivamente colocando un punto de sutura cubriendo la lesión. En ningún caso se convirtió a gastrectomía abierta.
Solo tres pacientes (10.3 %) presentaron complicaciones post operatorias: una fístula pancreática, un a isquemia cerebrovascular transitoria y una obstrucción intestinal. Este último paciente fue reoperado encontrándose un proceso infl amatorio severo a nivel del mesocolon que no pudo resolverse, la paciente evolucionó con un absceso intraabdominal que fue resuelto mediante drenaje percutáneo y antibiótico terapia. No hubieron muertes post operatorias.
La estancia hospitalaria promedio fue de 7.3 días (DE 3.6 días; mediana 7 días, rango 5 – 25 días).
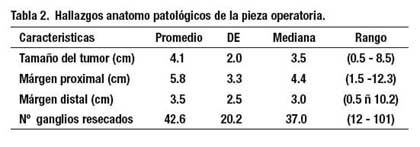
El estudio anatomopatológico de la pieza operatoria demostró que el tumor estuvo localizado en el tercio medio e inferior en 24 casos y 5 casos, respectivamente. De acuerdo a la clasifi cación TNM 12 pacientes fueron T1, 6 pacientes fueron T2, y 11 pacientes fueron T3. Diecisiete pacientes fueron N0, 7 fueron N1, 1 fue N2 y 4 fueron N3. Catorce pacientes fueron estadio clínico (EC) I, 4 fueron EC II, 7 fueron EC III y 4 pacientes fueron EC IV. El número promedio de ganglios resecados fue 42.6 (DE 20.2).
DISCUSIÓN
Desde el punto de vista quirúrgico nuestra serie de GDAL demuestra que este procedimiento se puede realizar siguiendo los criterios oncológicos de radicalidad, con baja morbilidad peri operatoria. El abordaje laparoscópico nos permite realizar una adecuada linfadenectomía D2 y la liberación y movilización de los dos tercios dístales del estómago a resecar y dejarlo listo para ser extraído a través de la incisión abdominal. La operación se completa con la anastomosis extracorpórea. Aunque la idea inicial era seguir estrictamente todos los pasos de la gastrectomía abierta en la que se comienza con la liberación del ligamento gastrocólico y la disección del los ganglios los grupos 6 y 14v, el orden fue cambiado para dedicar la primera hora de la operación a la disección ganglionar alrededor de las arterias del tronco celíaco. Sin tener en cuenta esta variación en el orden de los diferentes pasos, tanto la disección ganglionar y resección gástrica como la reconstrucción son similares a nuestra gastrectomía convencional.
Ibañez y cols. reportaron 4 casos (4.4 %) conversión a cirugía abierta, dos de ellos debido a sangrado durante la linfadenectomía de la arteria gástrica izquierda, un caso por perforación intestinal y el último por un tumor que invadía el colon transverso (T4)(15). Ballesta y cols. presentaron un mayor índice de conversión (5 de 58 pacientes, 20 %) siendo nuevamente la principal causa el sangrado de la arteria gástrica izquierda(19). Recientemente, en el estudio multicéntrico publicado por el Japanese Laparoscopic Surgery Study Group, donde se reúne una gran experiencia de 1294 gastrectomías laparóscopicas por cáncer gástrico precoz, se muestra una tasa de conversión del 1.1 % (20). La principal causa de conversión fue el sangrado incontrolable durante la disección de la arteria gástrica izquierda. En nuestra serie inicial hemos sido muy cuidadosos con la linfadenectomía alrededor del tronco celíaco y conociendo que se trataba de la parte más importante y la más delicada de la operación decidimos dedicar la primera parte del tiempo laparoscópico a la disección de dicha zona. El control de la a. gástrica izquierda lo hemos realizado con clips metálicos o con el sellador de vasos sin presentar complicaciones semejantes. Si bien es cierto hemos tenido algunos inconvenientes intra operatorios, estos han sido resueltos sin tener que convertir a una laparotomía.
Con respecto a las complicaciones post operatorias se ha reportado una morbilidad de 4 % a 12 % con mortalidad cero(7,21,22). El estudio multicéntrico japonés mencionado anteriormente reveló una morbilidad del 12.7 % con mortalidad cero(20). En los trabajos que comparan GADL con la gastrectomía convencional, se ha reportado una morbilidad y mortalidad similares que van de 6.7 % a 17 % y de 0 % a 4 %, respectivamente(9-11,23). Es preciso remarcar que la mayoría de los pacientes de estas series tuvieron cáncer gástrico precoz y les correspondió una linfadenectomía menor que una D2. En un reciente meta análisis sobre los resultados a corto plazo en 1611 pacientes reportados en 4 ensayos prospectivos randomizados y 12 estudios retrospectivos se encontró que la GDAL presentó menor morbilidad post operatoria y similar mortalidad que la gastrectomía convencional (24). Nuestra serie con 10.3 % de morbilidad post operatoria y mortalidad 0 % es bastante alentador y es probablemente el resultado de la experiencia acumulada con la gastrectomía D2 durante más de 20 años, más aún si la comparamos con la serie institucional publicada anteriormente en la que la morbilidad y mortalidad de la gastrectomía distal convencional fueron 7.4 % y 2.2 %, respectivamente(25).
La GDAL es una operación técnicamente más complicada que la convencional debido a que se necesita un entrenamiento adicional y una curva de aprendizaje lo que se refleja en un tiempo operatorio mayor en 54 minutos(24). Los tiempos operatorios pueden oscilar entre 156 minutos a 409 minutos(3,4,9-16,21-23,26,) lográndose una importante reducción después de 50 operaciones(26). En la serie japonesa que colecta 1185 GDAL el tiempo operatorio promedio fue de 253 minutos, pero la mayoría de los pacientes tuvieron una disección ganglionar menos que D2(20). En nuestra serie la GDAL nos tomó 286.5 minutos, el cual nos parece un tiempo operatorio adecuado si consideramos que todos nuestros pacientes tuvieron una gastrectomía D2 y además, aún no se ha alcanzado la curva de aprendizaje estimada en 50 operaciones( 27). A pesar de la complejidad del procedimiento la GDAL está asociada a un menor sangrado intra operatorio que la gastrectomía convencional(26) probablemente debido a una mejor visión del campo operatorio y a los dispositivos para el control de la hemostasia que se utilizan durante la laparoscopía. Nuestros resultados también demuestran que la GDAL puede realizarse con sangrado mínimo y sin necesidad de transfusión.
Desde el punto de vista oncológico una resección radical, márgenes quirúrgicos libres de neoplasia y linfadenectomía, es de vital importancia para obtener buenos resultados a largo plazo. De la misma manera que se reporta en otros estudios(3,9,11,23), en el presente estudio se obtuvieron márgenes proximales y dístales adecuados (5.8 cm. y 3.5 cm., respectivamente). Teniendo en cuenta que el número de ganglios resecados ha sido relacionado con la radicalidad de la gastrectomía(28), la gastrectomía laparoscópica no ha escapado a esta observación. El meta análisis antes mencionado encontró un número significativamente mayor de ganglios resecados a favor de la gastrectomía convencional, pero la información aún es escasa debido a que la mayoría de los estudios son retrospectivos y que en los 4 trabajos prospectivos randomizados el número de pacientes incluidos en cada brazo de tratamiento es pequeño(24).
Aunque la superioridad en la sobrevida a 5 años de la D2 sobre la D1 aún es motivo de debate(28-31), en nuestra institución el tratamiento estándar del cáncer gástrico durantes las últimas décadas ha sido la gastrectomía radical con disección linfática D2 tal como la propuso la escuela japonesa. Por lo tanto, los pacientes de la presente serie de GDAL también fueron tratados siguiendo los mismos principios oncológicos. Utilizando esta misma técnica se obtuvo un promedio de 43 ganglios con resultados similares a una serie de gastrectomía convencional reportada previamente (25) y concuerda con publicaciones recientes sobre GADL con linfadenectomía D2 (32,33).
En conclusión, los resultados a corto plazo de la presente serie demuestran que la GDAL para el tratamiento del cáncer gástrico es un procedimiento que puede realizarse con criterio oncológico y con baja morbilidad.
BIBLIOGRAFÍA
1. KITANO S, ISO Y, MORIYAMA M, SUGIMACHI K. Laparoscopic-assisted Billroth I gastrectomy. Surg Laparosc Endosc 1994; 2:146-8
2. WATSON DI, DEVITT PG, GAME PA. Laparoscopic Billroth II gastrectomy for early gastric cancer.Br J Surg. 1995; 82:661-2
3. BALLESTA-LOPEZ C, BASTIDA-VILA X, CATARCI M, MATO R, RUGGIERO R. Laparoscopic Billroth II distal subtotal gastrectomy with gastric stump suspension for gastric malignancies. Am J Surg. 1996;171:289-92
4. UYAMA I, SUGIOKA A, FUJITA J, KOMORI Y, MATSUI H, SOGA R ET al. Completely laparoscopic extraperigastric lymph node dissection for gastric maligancies located in the middle or lower third of the stomach. Gastric Cancer 1999; 2:186-190
5. UYAMA I, SUGIOKA A, FUJITA J, KOMORI Y, MATSUI H, HASUMI A. Laparoscopic total gastrectomy with distal pancreatosplenectomy and D2 lymphadenectomy for advanced gastric cancer. Gastric Cancer 1999; 2:230-234
6. TANIGUCHI S, KOGA K, IBUSUKI K, SUGIO K, UCHIMURA Y. Laparoscopic pylorus-preserving gastrectomy with intracorporeal hand-sewn anastomosis. Surg Laparosc Endosc 1997; 7:354-6
7. KITANO S, BANDOH T, KAWANO K. Endoscopic Surgery in Japan. Min Invas Ther & Allied Tech 2002; 10:215-9
8. NAKAJIMA T. Gastric cancer treatment guidelines in Japan. Gastric Cancer 2002;5:1-5
9. ADACHI Y, SHIRAISHI N, SHIROMIZU A, BANDOH T, ARAMAKI M, KITANO S. Laparoscopy-assisted Billroth I gastrectomy compared with conventional open gastrectomy. Arch Surg 2000;135:806-10
10. LEE SI, CHOI YS, PARK DJ, KIM HH, YANG HK, KIM MC. Comparative study of laparoscopy-assisted distal gastrectomy and open distal gastrectomy. J Am Coll Surg. 2006; 202:874-80
11. KIM MC, KIM KH, KIM HH, JUNG GJ. Comparison of laparoscopy-assisted by conventional open distal gastrectomy and extraperigastric lymph node dissection in early gastric cancer. J Surg Oncol 2005;91:90-94
12. KITANO S, SHIRAISHI N, KAKISAKO K, YASUDA K, INOMATA M, ADACHI Y. Laparoscopy-assisted Billroth I distal gastrectomy for cancer. Our 10 years experience. Surg Laparosc Endosc Percutan Tech 2002;3:204-207
13. TANIMURA S, HIGASHINO M, FUKUNAGA Y, KISHIDA S, NISHIKAWA M, OGATA A, et al. Laparoscopic distal gastrectomy with regional lymph node dissection for gastric cancer. Surg Endosc 2005;19:1177-1181
14. MOCHIKI E, KAMIYAMA Y, AIHARA R, NAKABAYASHI T, ASAO T, KUWANO H. Laparoscopic assisted distal gastrectomy for early gastric cancer: Five years' experience. Surgery. 2005,137:317-22.
15. IBAÑEZ F, AZAGRA J, GOERGEN M, BORDAS J, ALMENDRAL M, ERRO J. Laparoscopic sugery of gastric cancer. An Sist Sanit Navar 2005; 28:21-31.
16. HUSCHER C, MINGOLI A, SGARZINI G, SANSONETTI A, DI PAOLA M, RECHER A, et al. Laparoscopic versus open subtotal gastrectomy for distal gastric cancer. Five-year results of a randomized prospective trial. Ann Surg 2005; 241:232-237.
17. JAPANESE GASTRIC CANCER ASSOCIATION. Japanese Classifi cation of gastric carcinoma. 2nd english ed. Gastric Cancer 1998;1:10-24
18. SOBIN LH, WITTEKIND C. TNM classifi cation for malignant tumors. 5th ed. New York: Wiley; 1997. p. 59-62
19. BALLESTA LOPEZ C, RUGGIERO R, POVES I, BETTONICA C, PROCACCINI E. The contribution of laparoscopy to the treatment of gastric cancer. Oncological gastrectomy (D2) by laparoscopy. Surg Endosc 2002; 16:616-619
20. KITANO S, SHIRAISHI N, UYAMA I, SUGIHARA K, TANIGAWA N. A multicenter Study on oncologic outcome of laparoscopic gastrectomy for early gastric cancer. Ann Surg 2007; 245: 68-72.
21. FUJIWARA M, KODERA Y, MIURA S, KANYAMA Y, YOKOYAMA H, OHASHI N. Laparoscopy-assisted distal gastrectomy with systemic lymph node dissection: A phase II study following the learning curve. J Surg Oncol 2005; 91:26-32.
22. SAKURAMOTO S, KIKUCHI S, KUROYAMA S, FUTAWATARI N, KATADA N, KOBAYASHI N, et al. Laparoscopy-assisted distal gastrectomy for early gastric cancer. Experience with 111 consecutive patients. Surg Endosc 2006; 20:55-60.
23. ZIQIANG W, FENG Q, ZHIMIN C, MIAO W, LIAN Q, HUAXING L, et al. Comparison of laparoscopically assisted and open radical distal gastrectomy with extended lymphadenectomy for gastric cancer management. Surg Endosc 2006; 20:1738-1743.
24. HOSONO S, ARIMOTO Y, OHTANI H, KANAMIYA Y. Meta-analysis of short-term outcomes after laparoscopy-assisted distal gastrectomy. W J Gastroenterol 2006; 12:7676-7683.
25. RUIZ E, PAYET C, MONTALBETTI JA, CELIS, PAYET E, BERROSPI F, et al. Morbilidad post operatoria y mortalidad intra hospitalaria de la gastrectomía por adenocarcinoma: análisis reporte de 50 años. Rev Gastroenterol Perú 2004; 3:197-210.
26. KITANO S, SHIRAISHI N, FUJII K, YASUDA K, INOMATA M, ADACHI Y. A randomized controlled trial comparing open vs. laparoscopy-assisted distal gastrectomy for the treatment of early gastric cancer: An interim report. Endosc Surg 2002; 13:S306-311.
27. KIM MC, JUNG GJ, KIM HH. Learning curve of laparoscopy-assisted distal gastrectomy with systemic lymphadenectomy for early gastric cancer. World J Gastroenterol 2005; 11:7508-7511.
28. BONENKAMP JJ, SONGUN I, HERMANS J, SASAKO M, WELVAART K, PLUKKER JT, et al. Randomized comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995; 345:745-748.
29. CUSCHIERI A, WEEDEN S, FIELDING J, BANCEWICZ J, CRAVEN J, JOYPAUL V, et al. Patient survival after D1 and D2 resection for gastric cancer: long-term results of the MRC randomized surgical trial. Br J Cancer 1999; 79:1522-1530.
30. DEGIULI M, SASAKO M, PONTI A, CALVO F. Survival results of a multicentre phase II study to evaluate D2 gastrectomy for gastric cancer. Br J Cancer 2004; 90:1727-32.
31. WU CW, HSIUNG SA, LO, et al. Nodal dissection for patients with gastric cancer: a randomised trial. Lancet Oncol 2006; 7:309-15.
32. NOSHIRO H, NAGAI E SHIMIZU S, UCHIYAMA A, TANAKA M. Laparoscopically assisted distal gastrectomy with Standard radical lymph node dissection for gastric cancer. Surg Endosc 2005; 19:1592-1596.
33. . Laparoscopy-assisted distal gastrectomy with D2 lymph node dissection for gastric cancer: technical and oncological aspects. Surg Endosc. Epub 2007 June 26
Correspondencia:
Francisco Berrospi
Av. Angamos Este 2520, Lima 34, Perú
Tel: 511 7106900 anexo 2249
Fax: 511 7106900 anexo 2258
Email: fberrospi@inen.sld.pe













