Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.28 n.4 Lima oct./dic 2008
ARTÍCULOS ORIGINALES
Disección submucosa y mucosectomía en el tratamiento de las neoplasias intraepiteliales y del cáncer gástrico temprano
Endoscopic submucosal disection and mucosectomy for the treatment of the epithelial neoplasia and early gastric cancer
Fernando Barreda B.1 ; Juvenal Sánchez L.2
1. Médico Asistente del Servicio de Gastroenterología – INEN.
2. Médico Asistente del Departamento de Patología – INEN.
RESUMEN
Introducción: La resección endoscópica llamada mucosectomía y la disección submucosa del cáncer gástrico temprano, han permitido en el Japón, el tratamiento de variedades de cáncer con preservación del órgano y con intención curativa, específicamente para aquellos pacientes que tienen posibilidad nula o remota de compromiso con metástasis ganglionar.
Objetivos: Determinar en nuestro medio la efectividad de la mucosectomía para el tratamiento del cáncer gástrico temprano y evaluar la extensión de la indicación para las neoplasias intraepiteliales de alto y bajo grado (adenomas/displasias de alto y bajo grado), así como la pertinencia de su indicación para las lesiones tipo 0, sin neoplasia epitelial. Valorar la utilidad y factibilidad de la disección submucosa con el needle knife.
Material y Métodos: El presente estudio es de tipo prospectivo, observacional (no experimental), analítico y de corte longitudinal. Se realizó en 96 pacientes incidentes con diagnóstico de lesiones gástricas tipo 0 elevadas, planas y deprimidas que fueron atendidos en el Servicio de Gastroenterología del Instituto Nacional de Enfermedades Neoplásicas (INEN), desde enero de 1996 hasta octubre de 2008. Se utilizó la clasificación modificada de Viena para las neoplasias epiteliales gastrointestinales dentro de la evaluación y manejo de las lesiones tipo 0. Se utilizó la clasificación proveída por el Comité de Endoscopía Quirúrgica de la Sociedad Japonesa para la investigación del Cáncer Gástrico para definir la indicación de la resección endoscópica de la mucosa como tratamiento radical del Cáncer Gástrico Temprano. Las lesiones fueron resecadas con el asa simple de polipectomía, la utilización del cap de Olympus y el needle knife para la disección submucosa. La combinación empleada para lograr el habón en la submucosa fue de solución salina y adrenalina o de solución salina y agua destilada. En el análisis estadístico se utilizó el programa SPPS-12 para la obtención de los cuadros y gráficos presentados.
Resultados: Fueron 96pacientessometidosamucosectomíaydisecciónsubmucosaenel periodo 1996-2008, la mayor frecuencia de presentación se encuentra en el grupo etareo mayor de 50 años, con los índices mayores entre los 60 y 70 años. Hay predominancia del sexo femenino. De los 96 pacientes, un total de 55 pertenecen a la categoría 1 modificada de Viena, 9 pacientes para la categoría 3, un total de 31 pacientes para la categoría 4 (20 con adenoma/displasia de alto grado y 11 con carcinoma intramucoso) y sólo 01 para la categoría 5. Si bien son 96 pacientes los sometidos a la mucosectomía, en total se han resecado 305 lesiones tipo 0, de las cuales 85 son neoplasias intraepiteliales de bajo (43) y alto grado (31 con adenoma/displasia de alto grado en 20 pacientes y 11 con carcinomas intramucosos que coinciden en 11 pacientes), un carcinoma submucoso y 219 lesiones negativas para neoplasia intraepitelial. Alrededor de 200 lesiones fueron resecadas con la técnica de mucosectomía. La disección submucosa fue realizada en 03 pacientes con técnica mixta complementaria de mucosectomía. Las complicaciones en general fueron de sangrado, que se resolvieron durante el tratamiento endoscópico, no hubo perforaciones en la presente serie. La recurrencia local de 02 adenomas (uno con displasia de alto grado y el otro con displasia de bajo grado), tuvo resolución efectiva con el Argón Plasma. No tenemos evidencia de recurrencia local ni a distancia de los pacientes con carcinoma intramucoso a seguimiento de 5 y 10 años. El único paciente con mucosectomía y compromiso de submucosa fue tratado con cirugía radical y linfadenectomía, con una sobrevida actual de 6 años y 7 meses.
Conclusiones: La mucosectomía es efectiva para formas precisas de cáncer gástrico temprano con tasas de sobrevida a 5 y 10 años en nuestros primeros pacientes y ofrece además una adecuada calidad de vida con preservación del órgano. La mucosectomía es también apropiada para el manejo de neoplasias intraepiteliales tipo adenomas o displasias de alto o bajo grado, pudiéndose manejar la eventualidad de una recurrencia local, con el uso endoscópico del Argón Plasma. Dicha técnica también puede extenderse para las lesiones no neoplásicas que así lo requiriesen. La disección submucosa sólo debe realizarse en centros referenciales capacitados para ello.
Palabras claves: Mucosectomía, Cáncer Gástrico Temprano, Disección Submucosa, Neoplasias Intraepiteliales.
SUMMARY
Introduction: In Japan, endoscopic mucosal resection and endoscopic submucosal dissection of early gastric cancer are accepted as a treatment options for cases of early gastric cancer where the probability of lymph node metastasis is nil or low.
Objectives: To establish the effectiveness of mucosectomy for the treatment of early gastric cancer and evaluate the extended indications for dysplasia lesions, also, we want to determine if the mucosectomy is relevant for lesions negative for neoplasia at the National Institute for Neoplastic Diseases (INEN), Lima, Peru. We call for estimating the utility and factibility of the endoscopic submucosa dissection with the needle knife.
Materials and Methods: The study is an observational, prospective, analytical and cross longitudinal. The study was performed in 96 patients with Type 0 Neoplastic lesions at INEN from 1996 to 2008. The revised Vienna classification of gastrointestinal epithelial neoplasia was utilized. The indication for endoscopic mucosal resection as a radical treatment of early gastric cancer is according to the treatment guidelines for gastric cancer in Japan. The lesions were resected with a simple endoscopic snare, with the Olympus cap for some depressed lesions and the needle knife during the submucosal dissection. Lifting of the lesion with submucosal injection was done with saline solution with epinephrine or saline with distillate water. The statistical analysis included the SPPS-12 programme.
Results: 96 patients were treated by mucosectomy and endoscopic submucosal dissection from 1996 to 2008. The sample represents patients with a mean age over 50 years old and predominance of female. 55 patients belongs to category 1 of revised Vienna Classification, 9 patients are in the category 3, 31 patients are suitable in category 4 (20 with high grade adenoma/dysplasia and 11 with intramucosal carcinoma) and just 1 patient for the category 5. We resected 305 Type 0 lesions, 85 mucosal neoplasia, low grade (43) and high grade (31 adenoma/dysplasia in 20 patients and 11 intramucosal carcinoma in 11 patients), and 219 lesions negatives for neoplasia. Approximately 200 lesions were resected by mucosectomy. The endoscopic submucosal dissection was done in 03 patients with additional mucosectomy. In general, the complications were bleeding resolved during the same procedure; there were no perforations in the current series. The local recurrence of 2 adenomas (high and low dysplasia), were resolved with Plasma Argon. We have no evidence of neither local nor distant recurrence in patients with intramucosal carcinoma in 5-10 years follow up. The patient treated by mucosectomy and submucosal invasion was operated and his actual survival is 6 years and 7 months.
Conclusions: Mucosectomy is effective for precise variety of early gastric cancer with a median follow up period of 5-10 years in ours first patients, preserve the organ and maintain a high quality of life. Mucosectomy is appropriated for mucosal low and high grade adenoma/dysplasia, the local recurrence can be treated by Plasma Argon. The procedure can extend the indications eventually for lesions that are non-neoplasia. The endoscopic submucosal dissection must be done only in trained centres.
Key words: Mucosectomy, Early Gastric Cancer, Submucosal Dissection, Epithelial Neoplasia.
INTRODUCCIÓN
El registro de Cáncer de Lima Metropolitana es un registro de base poblacional (1,2). Fue establecido originalmente en 1968 como una función del INEN. El registro ha publicado 3 informes de incidencia y mortalidad para los años 1990-1991, 1990-1993 y 1994-1997. El registro abarca el área de Lima Metropolitana comprendiendo dos provincias: Lima con sus 43 distritos y Callao, con sus 6 distritos. El Cáncer Gástrico en Lima Metropolitana (con una población estimada al 31 de diciembre de 1995 de 6879815 habitantes, 3399523 hombres y 3480292 mujeres, equivalente aproximadamente al tercio de la población del país), representa la primera causa de mortandad por Neoplasia cuando se considera ambos sexos, en hombres es la primera causa y la segunda en mujeres (periodo 1994-1997, data publicada en diciembre del 2004), por lo que el conocimiento de la historia natural de la enfermedad y su adecuado manejo es de vital importancia en nuestro país. A nivel mundial, el Cáncer Gástrico figura cuarto en orden de frecuencia y segundo como causa de muerte por Cáncer con 835,000 muertes anuales, ocurriendo 2/3 de los casos en países en desarrollo, y las áreas de alto riesgo incluyen: Latinoamérica, el Este Asiático y Japón (3).
Cuando queremos tener una expresión real acerca de la tendencia de la incidencia del cáncer gástrico en nuestro medio, lamentablemente no se tiene la estadística a nivel nacional, pero si se cuenta con la data publicada por el registro de cáncer de Lima metropolitana a través del centro de investigación en cáncer "Maes-Helller", que revela que dicha tendencia dentro del periodo 1968-1970 hasta el periodo 1994-1997, muestra una disminución de la incidencia de cáncer de estómago del 30% para varones y del 9% para mujeres. Estas cifras están en consonancia con la tendencia mundial que se aprecia en la curva de disminución de la incidencia de esta entidad (4). La tendencia a la disminución es a predominio de la variedad del carcinoma diferenciado con sustento en la metaplasia intestinal, al respecto, no sólo hay reportes de estudios, como el estudio nacional de Holanda, que revela que la incidencia de lesiones pre-malignas como la gastritis atrófica y la metaplasia intestinal está declinando, sino que permite anticipar que la incidencia del cáncer gástrico disminuirá sin intervención específica (5); en Lima, un reporte reciente ha mostrado que en una muestra de 3 nosocomios de diferentes niveles socioeconómicos, se verifica también que la prevalencia del cáncer gástrico ha disminuido las últimas décadas y de manera interesante se muestra además, que esto sucede de forma paralela a la disminución de la metaplasia intestinal (6).
Las indicaciones aceptadas de mucosectomía son: (A) neoplasias bien diferenciadas hasta de 2 centímetros de diámetro y (B) lesiones deprimidas no mayores de 10 milímetros y sin ulceración, además que deberán estar confinadas a la mucosa y no tener componente linfático o vascular (7,8). Existen además otras lesiones en las cuales se ha definido también el riesgo de desarrollar metástasis ganglionar y en dichos grupos el riesgo es mínimo o también nulo, semejante al riesgo de mortalidad por cirugía, esto ha llevado por lo tanto a la ampliación de las indicaciones de la resección endoscópica. Como dichas lesiones son mayores de 2 centímetros, la técnica empleada en la resección de lesiones mayores es la disección submucosa. Takuji Gotoda y colaboradores del National Cancer Center Hospital de Tokyo-Japón, han definido que las lesiones con adenocarcinoma diferenciado, sin componente ulceroso, carcinoma intramucoso e independientemente del tamaño, son susceptibles de tener resección endoscópica. De la misma manera, las lesiones con adenocarcinoma diferenciado, con componente ulceroso, carcinoma intramucoso y de tamaño menor de 3 centímetros, también son candidatas a la resección endoscópica. Inclusive, las lesiones submucosas con penetración mínima (SM 1), con adenocarcinoma diferenciado y no mayores de 3 centímetros, también son elegibles para la disección submucosa (9,10).
Nosotros en nuestro reporte del año 98, afirmábamos que el hecho de no contar con equipos de eco endoscopia no debía inhibir el desarrollo de la técnica de mucosectomía, ya que la técnica de resección endoscópica basa su evaluación en el examen del tejido resecado (11). Para aquel entonces, se sabía que la precisión media para determinar la profundidad de la lesión con la eco endoscopia era del 77% y para la evaluación de la metástasis ganglionar alcanzaba al 69%(12,13). Estudios recientes revelan que la certeza diagnóstica en profundidad de la eco endoscopia es posible en el 80 a 90% de los casos evaluados, de allí que si uno se basa para la toma de decisiones en los diagnósticos de la eco endoscopia, significa que potencialmente existiría un 10 a 20% de casos que tendrían un tratamiento quirúrgico innecesario (9,14). Es por ello que en los principales centros de referencia de Japón, la eco endoscopia no es un pre-requisito indispensable antes de la realización de la mucosectomía. Sin embargo, todo centro que se dedique a la realización de técnicas endoscópicas complejas, deberá contar con el soporte de la eco endoscopia como parte de la ayuda diagnóstica.
La clasificación modificada de Viena (adoptada en su totalidad por la clasificación de París), para la neoplasia epitelial gastrointestinal logró un consenso mayoritario para ordenar las neoplasias a lo largo de todo el trayecto gastrointestinal (es decir que comprende a esófago, estómago y colon), de la siguiente manera: Categoría 1, negativa para displasia o neoplasia. Categoría 2, indefinida para neoplasia o displasia. Categoría 3, neoplasia de bajo grado no invasiva (adenoma/displasia de bajo grado). Categoría 4, neoplasia de alto grado intraepitelial o intramucosa (adenoma/ displasia de alto grado, carcinoma no invasivo, sospecha de carcinoma invasivo y carcinoma intramucoso). Categoría 5, carcinoma submucoso (15). Hay que remarcar que la presente clasificación tiene su sustento en el hallazgo de la severidad de la arquitectura del tejido y del aspecto citológico, así como también de la profundidad de la lesión.
La primera oportunidad en que se toma la decisión en el INEN de tener únicamente un tratamiento de resección endoscópica de polipectomía (no mucosectomía), para un carcinoma gástrico polipoideo, sin tratamiento complementario de cirugía radical y linfadenectomía, fue en 1992, dicha lesión tenía un compromiso únicamente de la mucosa, menor de 20 milímetros, histológicamente correspondía a un carcinoma bien diferenciado y tenía los márgenes libres de resección. La sobrevida fue mayor a los 10 años sin evidencia de recurrencia local ni sistémica de enfermedad. La decisión de aquella conducta durante la consulta ambulatoria fue del entonces jefe del Departamento de Abdomen Doctor Juan Antonio Montalbetti Catanzaro, como consta en los archivos del INEN.
La presente serie incluye pacientes del periodo 1996-2008 con la técnica de mucosectomía y evalúa la bondad del procedimiento endoscópico principalmente para las lesiones tipo 0 que comprenden a las neoplasias de alto grado, pero también extiende su indicación para las demás categorías de la clasificación de Viena modificada.
MATERIAL Y MÉTODOS
Definición de la población de estudio:
Criterios de inclusión: Pacientes con diagnóstico de neoplasia maligna gástrica admitidos en el INEN. Diagnóstico histológico y endoscópico confirmado de lesiones tipo 0 elevadas, planas y deprimidas tipo adenocarcinoma gástrico, displasia de alto y bajo grado y también lesiones gástricas tipo 0 negativas para neoplasia intraepitelial. Pacientes incidentes, sin tratamiento quirúrgico o adyuvante previo (pacientes nuevos). Pacientes con exámenes endoscópicos realizados en la institución. Criterios de exclusión: Pacientes que se perdieran de vista sin exámenes hematológicos y/o, radiografías de esófago, estómago y duodeno y endoscopías. Pacientes sin confirmación histológica. Pacientes tratados en otros hospitales. Ubicación en el tiempo y espacio: pacientes diagnosticados y tratados con mucosectomía gástrica en el INEN, Lima – Perú, entre Enero de 1996 y Octubre de 2008. El presente estudio es de tipo prospectivo, observacional (no experimental), analítico y de corte longitudinal. Se realizó en 96 pacientes con diagnóstico de lesiones tipo 0 elevadas, planas o deprimidas. Se evaluó la distribución etárea y edad promedio al momento del diagnóstico. Proporción de hombres y mujeres. Lugar de nacimiento y procedencia. Signos y síntomas. Metástasis a distancia. Exámenes hematológicos y bioquímicos pre-operatorios. Localización del tumor. Tipos de cáncer precoz. Tipos y subtipos histológicos. Tasa de tratamiento endoscópico. Sobrevida de pacientes tratados endoscópicamente. Se utilizó la clasificación proveída por el Comité de Endoscopía Quirúrgica de la Sociedad Japonesa para la investigación del Cáncer Gástrico para definir la indicación de la resección endoscópica de la mucosa como tratamiento radical del Cáncer Gástrico Temprano. Se utilizó la clasificación modificada de Viena para la evaluación y manejo de las lesiones tipo 0. Las lesiones fueron resecadas con el asa simple de polipectomía, la utilización del cap de Olympus y el needle knife para la disección submucosa. La combinación empleada para lograr el habón en la submucosa fue de solución salina y adrenalina o de solución salina y agua destilada. Se utilizó la terapia con Argón Plasma para los casos de recurrencia local de las displasias de alto y bajo grado. También se utilizó de manera eventual, los endoclips. La pinza fría y la pinza caliente fueron utilizadas dentro de la remoción de pólipos menores de 8 milímetros en general. En el sangrado de algunos casos, se utilizó la punta cerrada del asa de polipectomía para inhibir con buen efecto los mismos, además de la utilización del APC para otros casos que así lo requirieron. Todo paciente antes del procedimiento, firmó el acta de consentimiento informado y vino acompañado de un familiar para el procedimiento. Se utilizó sedación a base de midazolan y petidina por vía endovenosa, eventualmente se utilizó hioscina para la disminución del peristaltismo. Todos los pacientes tuvieron monitoreo constante de funciones vitales y uso permanente de oxígeno. Se trabajó exclusivamente con enfermeras especializadas y con personal auxiliar técnico complementario. Se realizaron todos los procedimientos en los pacientes con vía endovenosa e hidratación, además, durante los procedimientos prolongados o mayores de mucosectomía, se administraron también por vía endovenosa inhibidores de la bomba de protones y luego del evento, la administración inmediata de sucralfato, sea por una cánula directamente al lecho trabajado o por vía oral luego del efecto de la sedación. Todos los pacientes tuvieron permanencia en clínica de día la fecha del procedimiento, de otro lado, los pacientes que tuvieron lesiones mayores de 20 milímetros, lesiones múltiples o lesiones tipo carcinoma o displasia de alto grado, éstos tuvieron en la casi totalidad de los casos, una hospitalización en Emergencia por 48-72 horas o en Clínica para los pacientes privados, y luego dados de alta cuando no se objetivaron complicaciones inmediatas y hubo tolerancia oral. Finalmente, en el análisis estadístico se utilizó el programa SPPS-12 para la obtención de los cuadros y gráficos presentados.
RESULTADOS
La frecuencia de mucosectomías se incrementa a partir del quinquenio 2000-2005, triplicando prácticamente el número de procedimientos por año, esto con relación directa a la ampliación de las indicaciones, ya no circunscritas al cancer gástrico temprano sino extendida a las lesiones de las diferentes categorías de la clasificación de Viena modificada, tal como se aprecia en el gráfico 01.
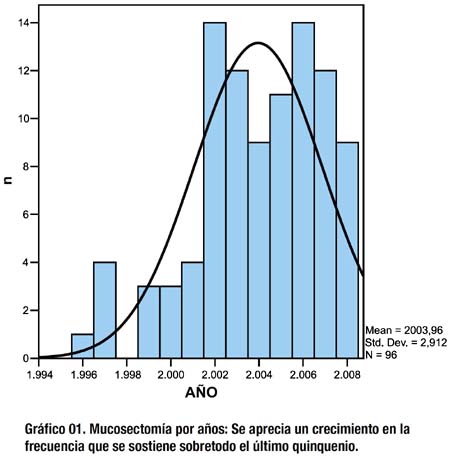
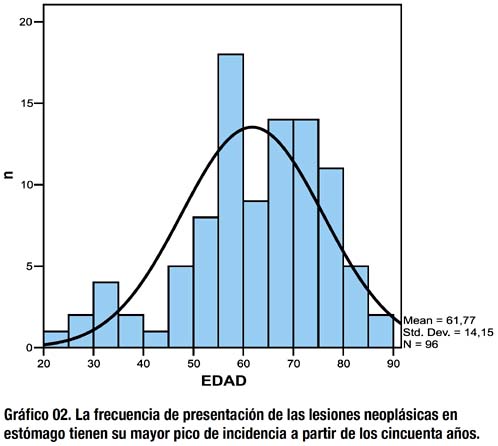
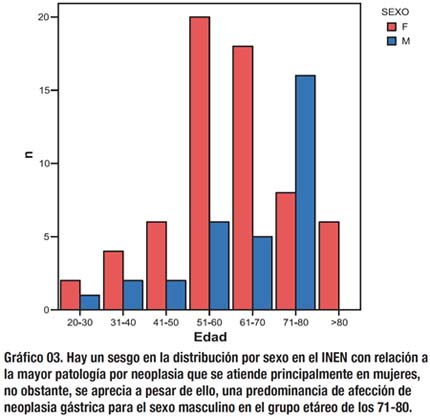
El pico de compromiso máximo respecto a la edad de pacientes con cáncer gástrico en el INEN es de 60 años, la curva de afección al sexo femenino predomina respecto al masculino hasta los 55 años, a partir de lo cual la curva de afección al sexo masculino es predominante, al respecto, los gráficos 02 y 03 están situados dentro de dicha tendencia.
Nosotros hemos utilizado la Clasificación modificada de Viena para la valoración y manejo de nuestros pacientes, ciertamente la precisión más destacada de dicha clasificación se da en la categoría 4, esto implica que tanto las lesiones con carcinoma intramucoso como los adenomas/displasias de alto grado comparten el propósito básico de una clasificación que es, el de proveer una guía para el manejo clínico de los pacientes, esto es, deberá definir grupos que sean relativamente homogéneos respecto a la respuesta al tratamiento y al pronóstico. Tenemos entonces, 31 pacientes en dicha categoría, 20 de ellos con diagnóstico de adenoma/displasia de alto grado y 11 pacientes con diagnóstico de carcinoma intramucoso, esto se aprecia en la tabla 01.
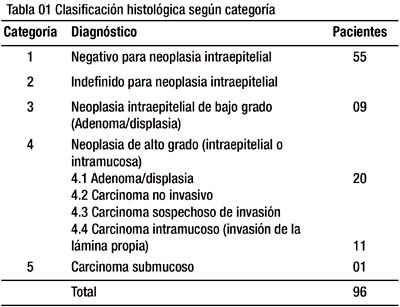
En la tabla 02, ha sido difícil decidir donde colocar algunos pacientes (ejemplo: 35 y 125 pólipos), con tantos y tan variados pólipos, nosotros los hemos clasificado en la tabla donde van los 96 pacientes con el análisis de la categoría y el número de lesiones tipo 0, dentro de la categoría 1 (tabla 01), por la mayor presencia de lesiones de éste tipo. Sin embargo, en la tabla donde se analiza el tipo histológico con relación al número de lesiones tipo 0, los colocamos dentro de las categorías 1 y 3 (tabla 02), por tener ambos tipos de lesiones y por el mayor riesgo de los adenomas a desarrollar posteriormente neoplasias gástricas. Y hemos optado de esta manera, puesto que tenemos que reconocer la mixtura de cada paciente sea por el número de lesiones o por la histología y no colocarlos en uno u otro ítem exclusivo, precisamente porque toda la combinación de lesiones indicada se da en los mismos pacientes, por ello es que hemos señalado en la tabla 02, que las lesiones desde el punto de vista histológico, tienen los 03 tipos, tanto fúndicos, hiperplásicos como de adenomas/displasias de bajo grado. En la tabla se puede apreciar además que si bien son 96 pacientes tratados, hay un total de 305 lesiones tipo 0 resecadas, y esto tiene su explicación en que hay pacientes que han tenido 2, 3, 4, 5, 6, 17, 35 y hasta 125 lesiones extirpadas, de las cuales 85 son neoplasias intraepiteliales de bajo (43) y alto grado (31 con adenoma/displasia de alto grado en 20 pacientes y 11 con carcinomas intramucosos que coinciden en 11 pacientes), un carcinoma submucoso y 219 lesiones negativas para neoplasia intraepitelial.
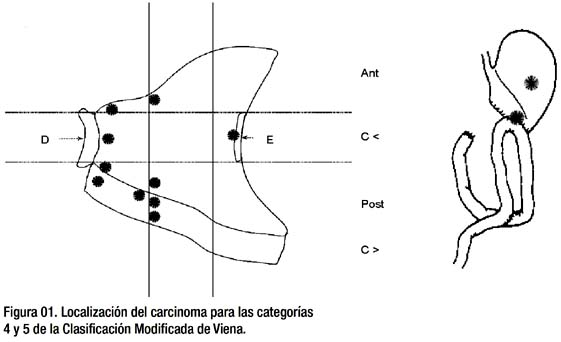
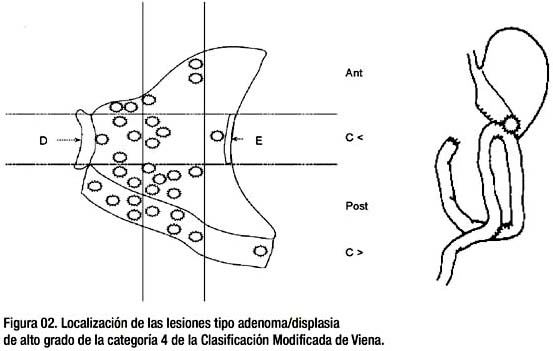
La tabla 03 y las figuras 01 y 02 son complementarias, allí se detallan los aspectos básicos de las particularidades de los pacientes intervenidos, así como la terapia utilizada para cada caso. Para el carcinoma intramucoso, hay 06 pacientes que tienen una sobrevida mayor de 5 años, siendo la de mayor tiempo de sobrevida aquella paciente operada luego de la mucosectomía, donde los hallazgos quirúrgicos demostraron que el tratamiento endoscópico había sido suficiente y se precisa además, que la sobrevida de dicha paciente actualmente llega a los 10 años y 4 meses. Otro paciente operado fue aquel que luego de la mucosectomía se demostró compromiso de la submucosa, la terapia quirúrgica reveló brevida actual del paciente alcanza los 6 años y 7 meses. La lesión de menor tamaño entre los pacientes con carcinoma intramucoso alcanza los 10 milímetros y la mayor no excede de los 25 milímetros. La lesión mayor de los adenomas de alto grado alcanza los 40 milímetros de diámetro y la menor los 3 milímetros. No apreciamos recurrencia de enfermedad en los pacientes tratados con mucosectomía y carcinoma intramucoso. En general, se puede objetivar que la localización de las lesiones tiene preferencia por antro y cuerpo, muy raramente por cardias y fondo. De la misma manera, el estómago operado, sobretodo la boca anastomótica, si bien de compromiso infrecuente, no está exenta de patología sea de carcinoma o de adenoma/displasia de alto grado. Es de remarcar que el tratamiento mixto de disección submucosa ha sido realizado en 02 pacientes con adenomas/displasia de alto grado, en un paciente con 40 milímetros de diámetro y en otro con 10 milímetros, pero de localización con acceso complejo. La recurrencia local en un paciente con adenoma/ displasia de alto grado fue resuelta con la aplicación local del Argón Plasma. Las complicaciones del sangrado digestivo fueron resueltas durante el mismo procedimiento de endoscopía y no se objetivaron complicaciones tipo perforación de la pared gástrica. Es de resaltar las formas de presentación de las lesiones tipo 0 en este grupo, si bien predominan las lesiones elevadas tipo 0-Is, se ha resecado 03 lesiones de carcinoma temprano intramucoso tipo 0_IIc de entre 12 y 10 milímetros de diámetro, pero lo más interesante es el hallazgo de una lesión deprimida tipo 0-IIc de 16 milímetros de diámetro con sustento exclusivo de adenoma/displasia de alto grado, puesto que dicha forma de presentación es mas bien infrecuente.
En la tabla 04 se aprecia la indicación de la mucosectomía no sólo para las lesiones tipo 0 con sustento histológico de adenomas/displasias de bajo grado, sino también para las lesiones tipo 0 con soporte de pólipos fúndicos o hiperplásicos. La verdad es que hay pacientes que presentan las 03 variedades al mismo tiempo, por ejemplo en la paciente con 125 pólipos, un total de 25 fueron adenomas/ displasias de bajo grado y el resto, una mixtura de fúndicos e hiperplásicos. De la misma manera, la paciente con 35 pólipos presentó 25 pólipos entre fúndicos e hiperplásicos y 10 con presencia de adenomas/displasia de bajo grado. Los tamaños van desde los 3 milímetros de diámetro hasta los 45 milímetros, ésta última lesión fue un pólipo hiperplásico con aspecto de tridente y con sangrado digestivo previo, ésta lesión es la de mayor tamaño de la presente serie.
Una paciente con adenoma/displasia de bajo grado no sólo tuvo resección con disección submucosa y mucosectomía, sino que también requirió tratamiento complementario con Argón Plasma ante la recurrencia local del adenoma, que fue manejado con éxito en una sola sesión de cauterización. De la misma manera que en los pacientes con categoría 4, las complicaciones de sangrado menor fueron manejadas durante el mismo procedimiento tanto con la punta del asa como con la utilización del APC. Las lesiones pequeñas menores de 8 milímetros han solido requerir de extracción con pinza fría o caliente. En este grupo de la tabla 04, todas las lesiones tipo 0 son elevadas, a diferencia de la tabla 03 donde pudimos evaluar lesiones deprimidas. La mayoría de las lesiones elevadas son tipo 0-Is y sólo encontramos 08 lesiones pedunculadas tipo 0-Ip (en el grupo exclusivo de pólipos hiperplásicos). Naturalmente, en este grupo se da también la localización con predominio de antro y cuerpo, sin embargo las lesiones polipoideas fúndicas tienen su querencia por el polo superior gástrico.
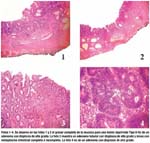
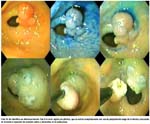
Las fotos 1 y 2 muestran en diferentes acercamientos una lesión infrecuente de adenoma/displasia de alto grado tipo 0-IIc, la foto 3 revela la mixtura de la presencia de metaplasia intestinal asociada al adenoma/displasia de alto grado y la foto 4 muestra una aproximación de un adenoma/displasia de alto grado.
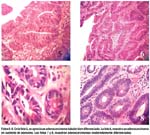
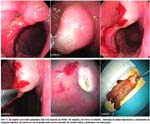
Las fotos 5-8 muestran diferentes acercamientos para lesiones de adenocarcinoma y el soporte de un carcinoma con base de un adenoma.
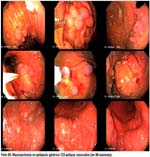
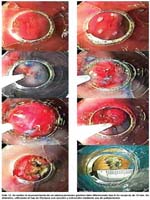
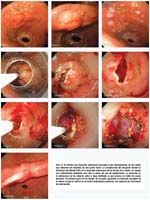
Las fotos 09-13, han sido seleccionadas como representativas de la técnica de mucosectomía realizada en diferentes pacientes y con estirpes histológicas disímiles, con la utilización de diferentes aditamentos según el caso. La apreciación sobretodo de estos casos particulares, se hace con algún detalle en la discusión.
DISCUSIÓN
En diferentes series que evalúan el Cáncer Gástrico Temprano con relación al compromiso de la profundidad de la lesión y la presencia de metástasis ganglionar, se reporta para el Cáncer Gástrico Temprano Intramucoso una incidencia del 1.9 al 4% de metástasis ganglionar y para el Cáncer Gástrico Submucoso una incidencia que va del 12 al 23.5% de compromiso ganglionar metastásico (16-22). En el INEN (2004), de acuerdo al estudio sobre 204 pacientes con diagnóstico de Cáncer Gástrico Temprano, de 94 pacientes con Cáncer Gástrico Intramucoso la incidencia de metástasis ganglionar fue de 2.2% y en los 110 pacientes con Cáncer Gástrico Submucoso, la incidencia de compromiso ganglionar fue del 24.6%; debiéndose precisar que los dos pacientes con compromiso intramucoso y metástasis ganglionar, presentaron ambos la variedad del tipo IIC y con diámetros de 6 y 14 centímetros (23). De acuerdo a este mejor conocimiento de la enfermedad, se hace evidente que aquellos pacientes con compromiso de la submucosa, deberán tener tratamiento quirúrgico necesariamente por la alta incidencia de compromiso metastásico ganglionar (con excepción de la variedad SM 1). Sin embargo, los pacientes con compromiso limitado a la mucosa, al tener una incidencia sumamente baja de metástasis ganglionar, de tratamiento local de resección endoscópica de la lesión, siempre y cuando se identifiquen a aquellos pacientes cuya posibilidad de metástasis ganglionar sea nula o ínfima.
La historia natural del cáncer gástrico muestra que a medida que se va comprometiendo la pared en profundidad, crece proporcionalmente la probabilidad de compromiso tanto local como a distancia, esto es, el compromiso en profundidad de la pared se cataloga dentro del sistema TNM como T, el compromiso de los vasos linfáticos como N y el compromiso hematógeno como M. De los 2,034 pacientes resecados en un periodo de 50 años en el INEN (1950-1999), pertenecen al T1 o cáncer gástrico temprano únicamente el 9% que representa a 183 pacientes, 82 de ellos con compromiso de la mucosa (4%) y 101 con compromiso de la submocosa (5%). Esto significaría que en 50 años se han manejado unos 3 pacientes con cáncer gástrico temprano por año, sin embargo en un gráfico puntual por décadas, se denota la mayor frecuencia de presentación en las últimas dos décadas valoradas. Cuando se expresan estas cifras según la clasificación de la UICC, se encuentra que la sobrevida según los estadios IA, IB, II, IIIA, IIIB y IV es de 85%, 81%, 63%, 40%, 22% y 18% respectivamente (24), cifras semejantes a las reportadas en la literatura mundial, a ello precisamente debe aspirar todo equipo que trabaje en mucosectomía, esto es, a equiparar las cifras logradas por la cirugía para los casos de cáncer gástrico temprano, al respecto, hay reportes que han logrado cifras de sobrevida a 5 años similares, tanto para la resección endoscópica como para la cirugía radical (25).
Un primer parámetro de evaluación que tenemos los gastroenterólogos en la apreciación de las lesiones gástricas ciertamente es el de la biopsia gástrica y de acuerdo a ese resultado y al aspecto endoscópico de la lesión descrita, así como a su ubicación y tamaño, es que se decide una conducta terapéutica. Sin duda alguna, el informe de patología es pieza fundamental en la adecuada toma de decisiones. Se conoce que lo que suele ser interpretado por la escuela japonesa como carcinoma no invasivo o in situ, es reportado por la escuela occidental como formas de displasia, específicamente de alto grado (26). Esta controversia ha requerido reuniones de expertos para lograr elementos de consenso y poder tabular e interpretar mejor los resultados de trabajos de investigación, que de otra manera no podrían manejar un idioma en común y sobretodo, hallar el adecuado significado den resección combinada de mucosectomía y disección submucosa) para 20 pacientes con diagnóstico de displasia de alto grado, está claro que esta interpretación es así, si seguimos la escuela occidental. Pero si seguimos la escuela japonesa, entonces hemos resecado con dicha técnica un total de 40 lesiones de carcinoma gástrico, independientemente de su profundidad.
La clasificación de Viena para la neoplasia epitelial gastrointestinal (27), logró un consenso mayoritario para ordenar las neoplasias a lo largo de todo el trayecto gastrointestinal (es decir que comprende a esófago, estómago y colon), de la siguiente manera: Categoría 1, negativa para displasia o neoplasia. Categoría 2, indefinida para neoplasia o displasia. Categoría 3, neoplasia de bajo grado no invasiva (adenoma/ displasia de bajo grado). Categoría 4, neoplasia de alto grado no invasiva (adenoma/displasia de alto grado, carcinoma no invasivo o carcinoma in situ, sospecha de carcinoma). Categoría 5, neoplasia invasiva (carcinoma intramucoso, carcinoma submucoso y demás). Por lo tanto, si nos adecuamos al consenso de Viena, tendremos dentro de nuestra casuística a 20 pacientes (28 lesiones), dentro de la categoría 4 o de neoplasia de alto grado no invasiva y 12 pacientes (12 lesiones), dentro de la categoría 5 o de neoplasia invasiva.
La clasificación de Viena ha sido tomada como sustento junto a la clasificación de Padova por la OMS., para la clasificación de los tumores digestivos y posteriormente ha sido ligeramente modificada para mejorar aspectos clínicos de relevancia terapéutica. Dicha modificación ha sido hecha para las categorías 4 y 5, de modo tal que las categorías 1-3, permanecen sin cambio alguno. La clasificación de Viena revisada o modificada (15) ha sido adoptada en su totalidad por la clasificación de Paris (28), para las lesiones neoplásicas superficiales endoscópicas del esófago, estómago y colon. Siendo así, el cambio fundamental en la categoría 4 radica en la incorporación a la misma, como un subtipo, al carcinoma intramucoso (con invasión de la lámina propia) y deja sólo en la categoría 5 al carcinoma submucoso. Ello tiene connotaciones de manejo terapéutico, a saber: en los pacientes de la categoría 1, se recomienda un seguimiento opcional; en la categoría 2, básicamente seguimiento; en la categoría 3, la conducta debería ser de resección endoscópica o de seguimiento; en la categoría 4, la conducta es de resección, sea endoscópica o quirúrgica y en la categoría 5, la recomendación es el tratamiento quirúrgico. Entonces, en nuestra casuística tenemos ahora un total de 31 pacientes en la categoría 4 o de neoplasia de la mucosa de alto grado (20 pacientes con adenomas/displasias de alto grado con 28 lesiones y 11 pacientes para 11 lesiones de carcinoma intramucoso), y el restante paciente en la categoría 5,l paciente deba tener que decidir entre una conducta de observación cercana o de resección. Sin embargo en la categoría 4, el riesgo de invasión y de desarrollo de metástasis está incrementado, por lo que se indica una mucosectomía o tratamiento quirúrgico local. En el otro extremo, en la categoría 1, están los casos de pólipos hiperplásicos o negativos para neoplasia o displasia. Si nosotros hemos resecado con la técnica de mucosectomía a la totalidad de la serie reportada y en algunos casos inclusive con disección submucosa y mucosectomía, debemos analizar entonces los elementos sustentatorios de dicho proceder para todos los casos de las categorías en mención, sobretodo para las categorías 1, 3 y 4, porque la categoría 5 no admite dudas de lo perentorio del tratamiento quirúrgico por la alta tasa de presentación de metástasis ganglionar.
Empecemos por la categoría 1, si el pólipo es hiperplásico de acuerdo a la biopsia tomada, la pregunta es la siguiente: ¿Cuál es el riesgo potencial de desarrollar cáncer?, y ¿Cuál es la frecuencia de encontrar pólipos en un centro de endoscopía hospitalario?, al respecto, en el Hospital Edgardo Rebagliati Martins de 6,603 pacientes estudiados con endoscopía digestiva alta detectaron 115 pólipos gástricos o 1.74% (29). En el mismo centro, se reportaron malignización en 0.8% de 876 pólipos hiperplásicos y 18% de 284 adenomas gástricos en una de las series más grandes evaluadas a nivel nacional (30). En el INEN, se ha encontrado sobre 67 pacientes con pólipos hiperplásicos una presencia de carcinoma del 5.9% y en 55 casos de adenomas una presencia de carcinoma del 27.8% (31,32). Hay reportes más específicos que muestran que la degeneración potencial maligna de los adenomas de bajo grado oscila entre el 0 al 23% y de los adenomas de alto grado del 60 al 85% (33-39). En consecuencia, si bien el riesgo es nulo o mínimo para la categoría 1 y poco frecuente para la categoría 3, existe de todas maneras la posibilidad de la presencia de carcinoma, y dado que la biopsia de por sí es insuficiente para apreciar todo el pólipo y que la realidad de nuestros hospitales de salud es que el porcentaje de pérdida de vista de los pacientes es muy alto, ello conllevaría a un escenario no deseable o inaceptable, esto es, el que algunos pacientes puedan eventualmente ser portadores de carcinomas en pólipos, que de otro lado, pudieron haber sido resecados. Es en esa línea de conducta precisamente por la cual nosotros hemos extendido la indicación de la mucosectomía no sólo para los pacientes con cáncer gástrico temprano sino también para todos los pacientes portadores de pólipos dables para la resección endoscópica, puesto que, justamente con dicha técnica se disminuye y se aleja el o los riesgos potenciales que de por sí son inherentes a toda polipectomía, como son principalmente la perforación y el sangrado.
Las lesiones que están comprendidas dentro de la categoría 4, a saber, las displasias de alto grado y el carcinoma mucoso, comparten la posibilidad de cura definitiva con la resección local endoscópica o quirúrgica. El tratamiento de resección es perentorio para las distintas lesiones que están dentro de esta categoría. En el primer caso, para las displasias de alto grado, por su eminente riesgo y probabilidad de desarrollar carcinoma, por ello es que su resección precoz cura definitivamente dicha entidad y previne su camino al cáncer. En el caso de los carcinomas mucosos, hay un grupo importante y selecto que tiene la posibilidad nula o ínfima de desarrollar metástasis ganglionar, de allí que la resección local con intención curativa, sea suficiente para la erradicación definitiva de la enfermedad (40). Son las razones descritas las que llevaron a agrupar en una misma categoría a las displasias de alto grado y a las variedades de carcinoma mucoso, ello significa que las lesiones que pertenecen a la categoría 4, no pueden tener una conducta de observación ni de cirugía radical, sino en principio, una de tratamiento endoscópico o de resección local. La verdad es que ambas conllevan un riesgo similar y con un tratamiento endoscópico de resección, el pronóstico es excelente. Otro factor a tener en consideración dentro del manejo de resección endoscópica de estas lesiones, es que se logra la preservación del órgano al no requerirse una cirugía radical de gastrectomía con linfadenectomía, con lo que ello significa en la disminución de la morbi-mortalidad de los pacientes, la disminución de los costos dentro de la economía de la institución y de los propios pacientes, y además, se presenta una mejor calidad de vida para los mismos.
Debemos reiterar que la mucosectomía no es sino una polipectomía asistida con inyección en la submucosa de solución salina y adrenalina (por ejemplo), de modo tal que al alejar al momento del corte, el asa de polipectomía de la capa muscular y de la serosa (por efecto del habón producido), se disminuye la posibilidad de complicaciones tipo perforación y sangrado por efecto del cauterio (41). El tamaño del asa de polipectomía convencional es ideal para lesiones menores de 3 centímetros de diámetro y excepcionalmente sirven para lesiones de alrededor de 4 centímetros. Ciertamente, a mayor tamaño de la lesión, mayor riesgo de complicación con la resección. Es por ello que, para las lesiones neoplásicas epiteliales y neoplásicas de la mucosa menores de 2-3 centímetros de diámetro, (dentro de las indicaciones primigenias de resección dadas en Kyoto en 1995), la polipectomía asistida es ideal, de la misma manera, la tapita que se coloca en la punta del endoscopio (el cap de Olympus por ejemplo), diseñada para succionar las lesiones, sobretodo las aplanadas y deprimidas y poder resecarlas luego con asa, está bosquejada para lesiones no mayores de 20 milímetros(42). Se entiende que el objetivo es la resección de la lesión en una sola unidad o de manera completa en un solo tiempo. Esto naturalmente siendo ideal para las lesiones descritas, a su vez, trae problemas para aquellas lesiones epiteliales o neoplásicas de la mucosa con diámetros mayores a los referidos y que también sean susceptibles de resección endoscópica.
Es aquí donde entra a tallar la disección submucosa para la remoción de lesiones neoplásicas epiteliales y de la mucosa (e inclusive se acepta de la submucosa, hasta la subcapa del tercio superior, SM 1), con la posibilidad de resección completa de la lesión, puesto que se trata de evitar en lo posible la resección fragmentada de la misma por lo que esto implica para la adecuada interpretación de la pieza por el patólogo y para no tener que enfrentarse al evento de recurrencia local (43). La disección submucosa requiere la utilización de una aguja de disección o corte (neddle-Knife, que utilizamos con cierta frecuencia y desde hace años para realizar cortes en la papila duodenal con fines terapéuticos), que sale a su vez a través de una tapita adosada a la punta del endoscopio (cap de Olympus o ST hood de Fujinon), lo que permite una adecuada maniobrabilidad durante la disección. Realmente lo que se hace es pelar la mucosa afectada por la neoplasia, y la tapita en cuestión ayuda en la disección focalizando el campo y actuando prácticamente como un fórceps durante el procedimiento. Uno va pelando la mucosa paso a paso y en vista que la aguja del neddle-Knife es más propensa a complicaciones de perforación, se ha diseñado inclusive una especie de pequeñas cerámicas redondeadas adosadas a la punta de la aguja (IT-knife), lo que aleja la punta de la misma de las capas más profundas de la pared gástrica. El procedimiento de disección submucosa con aguja tiene una antigüedad de por lo menos 20 años en Japón, con múltiples incidentes y complicaciones al inicio como toda suerte de procedimiento nuevo (44), pero los últimos 10 años, prácticamente es una rutina en centros de referencia de Japón y de algunos centros de referencia en contados países, puesto que como se entenderá, se requiere no solo de los accesorios adecuados sino también de un entrenamiento apropiado por lo complejo del procedimiento y las serias complicaciones que podrían producirse como la perforación o el sangrado, y que además, puede llevar a horas de disección cuando la lesión es grande y compleja. Es bueno saber asimismo que en Japón, algunos endoscopistas están entrenados y dedican su práctica a un solo órgano.
Cuando empezamos a realizar las mucosectomías en el quinquenio 95-2000, la frecuencia de realización de estos procedimientos era baja porque inicialmente estaba circunscrita al cáncer gástrico temprano y principiábamos con algunas lesiones de displasia de alto grado, tan es así, que en nuestra primera publicación al respecto (11), de las 05 lesiones resecadas con mucosectomía, 04 fueron lesiones de carcinoma mucoso y sólo 01 correspondió a un adenoma con displasia de alto grado. La frecuencia de mucosectomías se incrementa a partir del quinquenio 2000-2005, triplicando prácticamente el número de procedimientos por año, esto con relación directa a la ampliación de las indicaciones, ya no circunscritas al cancer gástrico temprano sino extendida a las lesiones de las diferentes categorías de la clasificación de Viena modificada, como ya hemos referido en párrafos precedentes. Es menester referir suplementariamente lo siguiente, los procedimientos de mucosectomía no son frecuentes en nuestro medio, salvo en algunos centros de referencia y con algunos endoscopistas calificados para ello, y como toda técnica en medicina, para que esta se realice con éxito, se requiere de un equipo entrenado con regularidad, una curva de aprendizaje y seguir pautas estrictas de protocolo, de manera tal que la contingencia de errores disminuya al mínimo, esto se logra precisamente con la ampliación de las indicaciones de la mucosectomía y posteriormente de la disección submucosa. Esto explica que mientras para el periodo 19962000, hayamos realizado una decena de mucosectomías, se objetiva que para fines del 2008 ya tengamos 95 pacientes tratados con dicha técnica (305 lesiones con unas 200 mucosectomías) y en 03 de ellos inclusive, como ya reseñamos, con ampliación mixta de la disección submucosa. El resto de las lesiones han sido resecadas con el complemento de la pinza fría como de la pinza caliente. Naturalmente, cuando se ha realizado la extirpación con la pinza fría, no ha habido necesidad de producir el habón en la submucosa, pero de manera casi rutinaria, cuando hacemos resección con la pinza caliente, sí utilizamos el habón complementario como un elemento adicional de mayor seguridad. La utilización de la pinza fría o caliente tiene relación directa con el tamaño, esto es, se han utilizado para la mayoría de las lesiones iguales o menores de 8 milímetros.
Cuando uno revisa la tabla (con las categorías 1 y 3) que resume los principales datos de cada paciente según la categoría de Viena modificada, automáticamente llama la atención los pacientes que tienen respectivamente 17, 35 y 125 lesiones tipo 0. Al respecto, la paciente con 17 lesiones pertenece a la categoría 1 y requirió sólo una sesión para la extirpación completa de todas las lesiones (de 5 hasta 15 milímetros). La paciente con menor edad de nuestro grupo de trabajo (24 años), presentó 35 pólipos que requirieron 02 sesiones y las lesiones pertenecían a la categoría 1 y 3, ello significa un hallazgo mixto desde el punto de vista histológico. La otra paciente (como se ve, todas mujeres), de 33 años, médico de profesión, fue evaluada previamente en otros nosocomios y ya venía con diagnóstico de poliposis gástrica (resecamos 125 pólipos), con patología de adenomas múltiples, motivo por el cual se le había recomendado la gastrectomía total por los hallazgos y por el alto riesgo a desarrollar cáncer gástrico en el futuro. Luego de discutirlo ampliamente, por el alto riesgo de potenciales complicaciones , esto es, a mayor número de resecciones, se incrementa dicha posibilidad, se decidió optar por el tratamiento endoscópico y se planificó finalmente un total de 06 sesiones que conllevaron a no menos de 5 horas de trabajo en total, sin complicaciones (salvo las intensas nauseas y vómitos por la petidina), y los controles posteriores fueron negativos para recurrencia de adenomas, esto se grafica en las fotos respectivas y la histología expuso además la mixtura de los componentes de los pólipos, esto es, adenomas con displasia de bajo grado, hiperplásicos y fúndicos.
Los 09 pacientes con adenoma de bajo grado, tuvieron lesiones en general menores de 20 milímetros de diámetro, todas fueron sésiles, con localización en 7 de 9 pacientes en cuerpo y fondo, 3 de ellas requirieron tratamiento complementario con APC (Argón Plasma) para los márgenes de sección y sólo una de ellas presentó un sangrado leve que se corrigió con APC. De la misma manera, se encontró en el seguimiento de uno de los pacientes, recurrencia de lesión, que se trató exitosamente con aplicación de APC. En este grupo de pacientes, se empleó en uno de ellos, la técnica mixta de disección submucosa y mucosectomía para la resección completa de la lesión de 18 milímetros localizada en tercio distal de la curvatura menor corporal por encima del ángulo y que requirió además la aplicación de APC a uno de los bordes, sin recurrencia en el seguimiento de la paciente. Empleamos esta técnica de disección submucosa por la localización difícil para la extracción de la lesión y por la característica de la misma, de ser más bien elevada y aplanada.
De los 55 pacientes con lesiones de pólipos hiperplásicos que pertenecen a la categoría 1, hay algunos de ellos que presentan tamaños de 25, 30, 40 y hasta 45 milímetros de diámetro, si bien la mayoría de los aquí reportados, tienen un diámetro menor de 25 milímetros. De la misma manera, se muestra que hay 08 pacientes con lesiones pedunculadas, pero el resto tiene formas sésiles. En tres de los pacientes se requirió tratamiento complementario con APC por sangrado leve, que fue resuelto durante el mismo procedimiento. En el mismo sentido, también se requirió tratamiento complementario de los bordes con APC, en 02 pacientes.
Vale la pena hacer un comentario acerca de la localización de las lesiones en los estómagos operados y de las localizaciones en cardias. Ambas ofrecen problemas particulares independientemente de la naturaleza histológica de la misma. Esto es, la localización cardial tiene la potencial complicación de perforarse hacia el mediastino con lo que ello implica para la salud del paciente y por los problemas médico legales que una complicación en esta área ocasionaría. Tiene además el problema técnico de enfrentarse con un zona particularmente difícil por la contractilidad del esfínter esofágico inferior y por que contingentemente uno tiene que trabajar en maniobra de retroversión para lo cual dependemos ciertamente de equipos en perfectas condiciones. No tengo muchas dudas de que en esta región la resección de lesiones tipo 0 debe realizarse con la técnica de la mucosectomía, lo que ayudaría en la disminución de las potenciales complicaciones. De la misma manera, el área de las anastomosis en general y en particular de la anastomosis gastroentérica, tiene la doble característica de ser una región friable y que además no permite la formación de un adecuado habón. Sin embargo, es preferible aplicar de todas maneras la solución salina y agua destilada o epinefrina en la submucosa, porque ayudará durante la resección de una lesión en dicha región, comprimiendo parcialmente las estructuras vasculares y dando cierto "colchón" en la eventualidad de un tratamiento complementario con APC.
En el análisis y discusión de los pacientes de la categoría 4, destaca que los pacientes con menor y mayor edad están en el grupo de los adenomas de alto grado, con 35 y 87 años respectivamente, los pacientes con carcinoma están por encima de los 55 años de edad. Hemos realizado un total de 11 mucosectomías para 11 pacientes con carcinoma gástrico temprano intramucoso. Al inicio, una de nuestras primeras pacientes, mujer de 55 años de edad, fue sometida a una mucosectomía por la presencia de un carcinoma gástrico de 25 milímetros. de diámetro, sésil, localizado en la curvatura mayor del tercio distal de antro, la resección fue completa y cumplía con los criterios de resección endoscópica, la histología mostraba un compromiso sólo de la mucosa, carcinoma bien diferenciado, márgenes libres de compromiso. Sin embargo, fue sometida a tratamiento quirúrgico complementario, no encontrándose lesión neoplásica en la pieza resecada ni compromiso ganglionar. El criterio de so-meter a la paciente a una cirugía complementaria fue de los cirujanos, pero nos permitió obtener información valiosa del éxito de la terapia endoscópica con eliminación completa de la enfermedad y además permitió que los cirujanos empezaran a creer y confiar en las indicaciones del manejo endoscópico para determinados pacientes. Ciertamente, la paciente está actualmente libre de enfermedad con más de 10 años de sobrevida.
De los 11 pacientes con carcinoma gástrico intramucoso, un total de 6 pacientes han tenido una sobrevida mayor a los 5 años, 2 de ellos han fallecido con seguimiento por encima de los 8 y 9 años (IMA y ACV), sin evidencia de enfermedad. Tenemos una paciente con seguimiento de alrededor de 5 años sin evidencia de enfermedad y el grupo restante está comprendido en el manejo y control del último quinquenio. Si bien el grupo de 11 pacientes es pequeño, no tenemos evidencia de recurrencia local ni a distancia de enfermedad. Tampoco hemos tenido complicaciones tipo perforación o sangrado. Los 10 pacientes restantes no han tenido necesidad de tratamiento quirúrgico complementario. El diámetro mayor de las lesiones ha sido de 25 milímetros y el menor de 10 milímetros, lo que ha permitido la resección de las lesiones "in toto" y en un solo tiempo a excepción de una paciente con diámetro de 20 milímetros que requirió resección en un solo tiempo pero en 2 fragmentos y además se aplicó pinza caliente a un pequeño borde residual, con seguimiento y controles sin evidencia de enfermedad en 8 años y 6 meses.
Las formas de las lesiones del carcinoma gástrico intramucoso fueron predominantemente elevadas, 6 lesiones fueron del tipo 0-Is y allí estuvieron concentradas las de mayor diámetro, con una de 12 milímetros otra de 15 milímetros y el resto igual o por encima de los 20 milímetros. Una lesión pedunculada tipo 0-Ip tuvo un diámetro de 15 milímetros y la otra lesión elevada tipo 0-IIa, tuvo diámetro similar. Las 3 lesiones restantes fueron lesiones deprimidas tipo 0-IIc, una de ellas con diámetro de 12 milímetros y las otras restantes con diámetros de 10 milímetros. En general, la localización de todas las lesiones fue en antro y cuerpo, no hemos tenido ninguna lesión localizada en fondo ni en cardias. Las lesiones elevadas tuvieron cierta tendencia a localizarse en antro y las deprimidas a localizarse en cuerpo. De la misma manera, hay cierta tendencia a localizarse entre la curvatura mayor y cara posterior de antro y cuerpo. De manera interesante, 2 de las 3 lesiones deprimidas tipo 0-IIc, estuvieron localizadas hacia la cara anterior. De las 11 lesiones, sólo 2 de ellas fueron encontradas y resecadas en pacientes con estómagos operados, una de ellas de 22 milímetros de diámetro, estuvo localizada en la boca anastomótica de un paciente operado con gastrectomía subtotal tipo Billroth II hacía 18 años de úlcera gástrica péptica, benigna y que desarrolló carcinoma intramucoso en la boca anastomótica, la otra lesión estuvo mas bien localizada en el muñón gástrico hacia el tercio medio de la curvatura mayor del estómago residual, con un diámetro de 15 milímetros. El primer paciente de los mencionados tuvo un seguimiento de 9 años y 7 meses libre de enfermedad, falleciendo a causa de un ACV (mencionado en párrafo previo) y el otro paciente es de reciente resección con controles iniciales negativos a enfermedad.
La mucosectomía practicada en los 11 pacientes con carcinoma intramucoso ha sido realizada en 02 de ellos con el uso del cap de Olympus (42) y en el grupo restante, con un asa simple de cauterio. En ninguno de los pacientes ha habido necesidad de realizar la disección submucosa complementaria. En primer término, se ha preferido utilizar el cap de olympus para 02 pacientes con lesiones de 10 milímetros, ambas tipo 0-IIc, con excelentes resultados. El compromiso en ambos casos fue intramucoso, carcinoma bien diferenciado y márgenes libres de neoplasia. El primero de los casos tiene un seguimiento libre de enfermedad de 5 años y 5 meses, el segundo de ellos es de realización en el presente año con muy buen pronóstico. Precisamente, se ha preferido utilizar dicho aditamento porque las lesiones deprimidas son muy difíciles de ser calzadas con el asa simple y sobretodo luego de la aplicación de la solución en la submucosa, es por ello que, luego de la aplicación y logro de un buen habón, la succión que permite la tapita adosada a la punta del endoscopio, permite capturar y resecar toda la lesión en un solo bloque, recuperándose la muestra con succión y dentro del mismo cap. Además que, el diámetro de ambas lesiones es ideal para el uso de tal accesorio. De otro lado, vale la pena mencionar, que en las lesiones deprimidas o superficialmente elevadas, es imprescindible realizar la tinción y el marcaje de los bordes, porque suele ocurrir que luego de la formación del habón, la estructura se deforma groseramente y es bastante difícil sino imposible ubicar los bordes adecuados en caso no se haya realizado un marcaje y tinción previos. Dentro de la técnica de resección de dichas lesiones, hay que recordar que cuando la estructura está deformada por el habón y prácticamente la lesión que previamente era elevada, se torna mas bien aplanada y difícil de calzar con el asa de polipectomía, entonces la aplicación de la succión del aire de la cámara gástrica ayuda en la resección de la siguiente manera: se localiza la lesión previamente marcada y se la circunscribe con el asa abierta, luego se realiza la succión del aire y de modo paralelo se procede al cierre progresivo del asa que a su vez contiene a la mucosa con la lesión que se va corrugando gradualmente dentro del asa, hasta que finalmente uno atrapa la lesión y se reseca como una polipectomía convencional (45).
De las 11 lesiones con carcinoma gástrico intramucoso resecadas con la técnica de mucosectomía, hemos encontrado en 5 de ellas un sustento de lesiones sea tipo adenoma con displasia de alto grado o de pólipos hiperplásicos. Las 2 lesiones de mayor tamaño de la presente serie (22 y 25 milímetros), han tenido el soporte hiperplásico en su estructura y han sido de la variedad tipo 0-Is, mientras que las 3 lesiones restantes, han tenido un sustento de adenoma con displasia de alto grado y las variedades han sido también del tipo 0-Is en 2 de ellas, pero de manera interesante, la lesión restante ha sido de la variedad deprimida tipo 0-IIc. Esto hallazgos nos reafirman en el concepto de la necesidad perentoria de la resección completa de las lesiones tipo 0, particularmente de la variedad polipoidea, puesto que en ocasiones como las descritas, la biopsia de algunas partes del pólipo como ya se dijo, es insuficiente en dar la información completa de todo su universo, pudiendo de esta manera perderse una lesión neoplásica maligna, dentro de esta variedad de presentación.
Los pacientes de la categoría 4 con presencia de los adenomas de alto grado o displasias de alto grado, tienen de acuerdo a la clasificación modificada de Viena, la misma implicancia que los carcinomas intramucosos, tanto de diagnóstico como de manejo definitivo y por ende de pronóstico. Hemos realizado en 20 pacientes con displasia de alto grado un total de 28 mucosectomías (3 lesiones menores de 8 milímetros, se resecaron con pinza caliente) y en dos de los pacientes se ha utilizado adicionalmente la técnica de disección submucosa. La localización de las lesiones ha tenido predilección por el antro y el cuerpo. De otro lado, hay una cierta tendencia a tener preferencia por la cara posterior y curvatura mayor (16 lesiones) respecto a la localización de la cara anterior y curvatura menor (12 lesiones), de la misma manera, hay una cierta tendencia a la localización corporal (16 lesiones) respecto a la localización antral (12 lesiones); la localización fúndica, cardial y de boca anastomótica, son mas bien poco frecuentes (una lesión por cada localización, en el presente reporte). Si dividimos al antro y el cuerpo respectivamente en tercios, veríamos que la mayor frecuencia de localización de las lesiones está en los dos tercios proximales del antro y en los dos tercios distales del cuerpo, esto es, las lesiones tendrían cierta afinidad en torno al ángulo gástrico (22/31 lesiones).
Dentro del tamaño de las lesiones con adenomas o displasias de alto grado, tenemos por contraste 3 lesiones menores de 5 milímetros y 4 lesiones de mayor diámetro: una de 20, otra de 22, una tercera de 35 y la mayor de 40 milímetros de diámetro. La forma predominante de las lesiones es la del tipo 0-Is (27 lesiones), luego la del tipo 0-IIa (02 lesiones) y la forma deprimida (tipo 0-IIc) y pedunculada (tipo 0-Ip), con una lesión cada una. Es de remarcar la presentación de la variedad deprimida tipo 0-IIc para las lesiones tipo adenomas con displasia de alto grado, que no es precisamente una forma frecuente de manifestación de dichas lesiones. En el seguimiento de los pacientes hemos tenido a 3 de ellos perdidos de vista sin enfermedad, hemos encontrado recurrencia de adenoma en un paciente, que se trató de manera semejante al paciente con recurrencia local y adenoma de bajo grado, esto es, con APC y en los controles posteriores no se objetivó enfermedad residual. En los registros periódicos de los pacientes hemos apreciado 3 pacientes fallecidos por entidades sin relación a los adenomas con displasia de alto grado resecado, esto es, patología tipo cáncer de páncreas, fibrohistiocitoma maligno y carcinomatosis abdominal. Una gran ayuda en el manejo de la recurrencia local de los adenomas es la utilización del Argón Plasma, puesto que en la eventualidad de intentar una resección complementaria con asa de polipectomía, esta no podría realizarse en razón a que la recurrencia se da en una mucosa que previamente ha sido sometida a resección con asa de cauterio y la consiguiente formación de la cicatriz que no permitiría elevar la mucosa nuevamente y es por ello que la terapia ideal para estos casos de recurrencia local, es el manejo endoscópico complementario con Argón Plasma, de la misma manera, tenemos una conducta semejante para el manejo de los adenomas aplanados de recto y colon, con diámetros mayores a los 3 y 4 centímetros, que los manejamos con técnica de mucosectomía y el Argón Plasma lo utilizamos tanto para la aplicación en los bordes de la lesión como para los casos que eventualmente presenten recurrencia local de enfermedad, con buenos resultados, sobretodo para las lesiones que están adyacentes a la línea pectínea, con lo que se puede evitar la intervención quirúrgica de esta zona, que es de manejo complejo.
Las complicaciones que hemos tenido básicamente han sido de sangrado en 4 de los 20 pacientes del grupo con displasia de alto grado. En 3 de ellos, la resolución fue con aplicación del APC y los sangrados fueron más bien leves, en el paciente restante con una lesión de 40 milímetros y a quien se realizaba la disección submucosa, presentó un sangrado arteriolar que se cohibió con la misma punta cerrada del asa de polipectomía con resolución inmediata del sangrado. No hemos tenido perforaciones en la presente serie, sin embargo, en 2 pacientes hemos tenido que aplicar clips por la profundidad de la mucosectomía que mostraba ya, la capa muscular y por razones de mayor seguridad se prefirió mantener selladas dichas zonas. En otro paciente, con una lesión pedunculada de 35 milímetros, se utilizó el APC para completar el lacrado del tallo residual.
Nosotros hemos practicado la disección submucosa con el needle knife (aguja de disección) que solemos utilizar en la disección de la ampolla de Vater durante los procedimientos de la PCRE (46) y que también utilizamos para resolver problemas de estenosis en esófago y recto. Los casos seleccionados se presentaron al azar y durante el procedimiento, esto significa que la decisión de utilizar dicho aditamento se tomó sobre la marcha y en pleno procedimiento. La razón en el primero de los casos fue el de una lesión tipo 0-IIa de 10 milímetros, discretamente elevada, localizada sobre la curvatura menor y proximal al ángulo gástrico hacia el cuerpo medio y distal, lo que tornó el acercamiento difícil y se tuvo que realizar la maniobra en retroversión, lo que a su vez hizo mas complicada la captura adecuada de la displasia de alto grado. Es por ello que se decidió (y luego de provocarse un generoso habón), la disección submucosa de los bordes de la lesión, de modo tal que se formara como "unas alas de mariposa" que posteriormente pudieran ser enlazadas (luego) por el asa de polipectomía, tal como sucedió, con la consiguiente extracción de toda la lesión en un solo tiempo(47). Este es el caso al cual hubo que aplicarle los clips en uno de los extremos. El siguiente caso se trató de un paciente con una lesión de 40 milímetros localizada en la curvatura menor antral que iba desde el ángulo hasta la región prepilórica, por lo que se decidió de manera semejante al caso precedente, la disección submucosa de los bordes (este es el caso con sangrado arteriolar cohibido con la punta del asa), y luego la mucosectomía de toda la lesión por fragmentos, los controles posteriores han mostrado ausencia de recurrencia y resolución completa de la displasia de alto grado. Este último procedimiento duró alrededor de 2 horas, y una parte importante que debe remarcarse es la infusión constante y recurrente de la solución a la submucosa (en este caso fue de solución salina y agua destilada), no solo por la profundidad que puede alcanzar el needle knife al momento del corte, sino que también por la mucosectomía posterior de la lesión misma, por ello es que hay que aplicar la solución tanto a los bordes de disección como al centro de la lesión, en tiempos sucesivos de trabajo.
En la categoría 5 modificada de Viena tenemos un paciente con una lesión localizada en cardias, de 15 milímetros de diámetro, que se resecó con la técnica de mucosectomía y en la evaluación del espécimen por patología se demostró un compromiso de la submucosa, por lo cual el paciente varón de 72 años, fue derivado para el tratamiento quirúrgico complementario, practicándose una gastrectomía proximal y esofagectomía distal con linfadenectomía, que mostró en el análisis posterior histológico un compromiso ganglionar metastático por el carcinoma, el paciente actualmente luego de dicho tratamiento está vivo sin enfermedad por un periodo de 6 años y 7 meses. Este caso valga para reiterar que la valoración de nuestros pacientes luego de la mucosectomía(48), se da con la pieza resecada y analizada por el Departamento de Patología, de ello dependerá una conducta complementaria endoscópica o de tratamiento quirúrgico, como en el presente caso. Finalmente, recién el último año contamos en el INEN con un equipo de eco endoscopia, el que nos permitirá en un futuro próximo la valoración y utilidad del mismo, dentro del manejo de pacientes seleccionados para resección endoscópica.
CONCLUSIONES
-
Se demuestra de acuerdo a nuestros resultados, que el tratamiento endoscópico de resección o mucosectomía para formas precisas de cáncer gástrico temprano, es apropiado al tener tasas de sobrevida a 5 y 10 años en nuestros primeros pacientes y que dicho procedimiento ofrece además una adecuada calidad de vida, presenta costos accesibles para los hospitales de nuestro medio y existe además la factibilidad de hacerlo, siempre y cuando se seleccione a los pacientes que se puedan beneficiar del mismo.
-
Se demuestra además y en concordancia con lo anterior, que la mucosectomía es también efectiva para el manejo de las lesiones tipo adenomas o displasias de alto grado, que comparten la categoría 4 de la clasificación modificada de Viena con el carcinoma intramucoso, pudiéndose de otro lado, manejarse la eventualidad de una recurrencia local, con el uso endoscópico del Argón Plasma.
-
Así como la mucosectomía es adecuada para las lesiones tipo carcinoma intramucoso o adenomas/displasias de alto grado, dicho procedimiento también es apropiado para la resección de lesiones tipo adenomas/displasias de bajo grado y eventualmente para lesiones no neoplásicas que así lo requiriesen.
-
Confirmamos que la mucosectomía puede ser realizada con un grado adecuado de confianza para los pacientes con carcinoma intramucoso tipo adenocarcinoma bien diferenciado, no mayor de 30 milímetros, sin extensión a la submucosa ni compromiso ulcerado y con márgenes libres de resección.
-
La técnica mixta de disección submucosa complementada con mucosectomía, puede ser utilizada para lesiones de mayor diámetro o de localización compleja, nuestra experiencia inicial es con adenomas/displasias de alto grado, con resultados alentadores.
-
La estrategia posterior a la mucosectomía basará su valoración en el examen del tejido resecado y según ello, se tendrá una conducta de seguimiento o de tratamiento endoscópico o quirúrgico complementario.
RECOMENDACIONES
Si bien la mucosectomía es un procedimiento que viene siendo realizado en nuestro medio, se recomienda que a) se cuente con los aditamentos básicos de asa de polipectomía, aguja de inyecto terapia, la tapita o cap que se adosa al endoscopio y el needle-knife o el IT-knife, idealmente se debería contar también con el equipo de Argón Plasma, tanto para el manejo de complicaciones como para el tratamiento de la recurrencia local; b) de la misma manera se requiere un entrenamiento riguroso en el procedimiento por la posibilidad de presentarse complicaciones serias tipo perforación o sangrado y c) tener necesariamente un manejo del paciente dentro de un equipo con criterio oncológico.
BIBLIOGRAFÍA
1. REGISTRO DE CÁNCER LIMA METROPOLITANA 1990-1991, Centro de Investigación en Cáncer «Maes Heller», Instituto de Enfermedades Neoplásicas, Lima, Abril 1995.
2. REGISTRO DE CÁNCER DE LIMA METROPOLITANA 1994-1997, Centro de investigación en Cáncer "Maes Heller", Instituto de Enfermedades Neoplásicas, Lima, Diciembre 2004.
3. FERLAY J., BRAY F., PISSANI P. et al. GLOBOCAN 2002: Cancer Incidence, mortality and prevalence worldwide. IARC cancer Base No 5 version 2.0. Lyon: IARC Press, 2004.
4. MUIR C.S., HARVEY J.C. Cancer of the stomach: overview. In T. Sugimura, M. Sasako Eds., Gastric Cancer, Oxford Medical publications, 1997: Chapter 1:3-21.
5. VRIES AC DE., MEIJER GA., LOOMAN CWN., et al. Epidemiological trends of pre-malignant gastric lesions: a long-term nationwide study in the Netherlands. Gut 2007; 56:1665-1670.
6. MENDOZA D., HERRERA P., GILMAN RH., et al. Variation in the prevalence of gastric cancer in Peru. Int. J. Cancer 2008; 123:414-420.
7. FUJII M., SASAKI J. AND NAKAJIMA T. State of the art in the treatment of gastric cancer: from the 71st Japanese Gastric Cancer Congress. Gastric Cancer 1999; 2: 151-157.
8. OSHIBA S. The Indication for Endoscopic Mucosal Resection as a Radical Treatment of Early Gastric Cancer. First International Gastric Cancer Congress. Abstracts. Kyoto-Japan, 1995; 12.
9. GOTODA T. Endoscopic resection of early gastric cancer. Gastric Cancer 2007, 10:1-11.
10. ISHIKAWA S., TOGASHI A., INOUE M., et al. Indications for EMR/ESD in cases of early gastric cancer: relationship between histological type, depth of wall invasion, and lymph node metastasis. Gastric Cancer 2007; 10: 35-38.
11. BARREDA F., SANCHEZ J. Tratamiento endoscópico del cáncer gástrico temprano y lesiones pre-malignas mediante mucosectomía. Rev. Gastroent. Perú 18:214-226, 1998.
12. POLLACK B., CHAK A., SIVAK M.: Endoscopic Ultrasonography Seminars in Oncology 1996; 23:336-346.
13. RÓSCH T. Endosonographic staging of gastric cancer: A review of literature results. Gastrointest Endosc Clin of North Am 1995; 5: 549-557.
14. SANO T., OKUYAMA Y., KOBORI O., et al. Early gastric cancer; Endoscopic diagnosis of depth of invasion. Dig. Dis. Sci. 1990; 35: 1340-35.
15. DIXON MF. Gastrointestinal epithelial neoplasia: Viena revisited. Gut 2002; 51: 130-131.
16. ENDO M., HABU H.: Clinical Studies of Early Gastric Cancer. Hepato-gastroenterol 1990; 37:408-410.
17. FUKUTOMI H., SAKITA T. Analysis of Early Gastric Cancer Cases Collected from Major Hospitals and Institutes in Japan. Jpn J Clin Oncol 1984; 14: 169-179.
18. KORENAGA D., HARAGUCHI M., TSUJITANI S., et al. Clinic pathological features of mucosal carcinoma of the stomach with lymph node metastasis in eleven patients. Br J Surg 1986; 73:431
19. NAMIENO T., KOITO K., HIGASHI T., et al. General Pattern of Lymph Node Metastasis in Early Gastric Carcinoma World J Surg 1996; 20: 996-1000.
20. SANO T., KOBORI O., MUTO T. Lymph node metastasis from early gastric cancer: Endoscopic resection of tumor. Br J Surg 1992; 79:241
21. TORII A., SAKAI M., INOUE K., et al. A ClinicopathologicaI Analysis of Early Gastric Cancer: Retrospective Study with Special Reference to Lymph Node Metastasis Cancer Detect Prev 1994; 18:437-441.
22. YAMAO T., SHIRAO K., ONO H., et al. Risk Factors for Lymph Node Metastasis from Intramucosa Gastric Carcinoma Cancer 1996; 77:602-606.
23. PAYET E.: Cáncer gástrico precoz. Tesis para optar el grado de Maestría en Medicina. Universidad Peruana Cayetano Heredia. Lima-Perú, 2004.
24. RUIZ E, BARREDA F, CELIS J. y col. Cáncer gástrico: historia natural, diagnóstico y resultados de tratamiento. INEN 1950-1999. Informe final del proyecto de investigación financiado por Concytec, Lima-Perú, 2002.
25. TADA M., MURAKAMI A., KARITA M., et al. Endoscopic Resection of Early Gastric Cancer Endoscopy 1993; 25:445-450.
26. SCHLEMPER RJ., ITABASHI M., KATO Y., et al. Differences in diagnostic criteria for gastric carcinoma between Japanese and Western pathologists. Lancet 1997; 349: 1725-9.
27. SCHLEMPER RJ. RIDDELL RH. KATO Y., et al. The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47: 251-5.
28. PARTICIPANTS IN THE PARIS WORKSHOP. The Paris Endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon. November 30 to December 1, 2002. Gastrointestinal Endoscopy 2003; vol 58, No. 6 (suppl), S3-S27.
29. PALACIOS F., FRISANCHO O., PALOMINO E. Pólipos gástricos y cambios histológicos en la mucosa circundante. Rev. Gastroenterol Perú 2003; 23(4): 245-253.
30. ESPEJO H., NAVARRETE J., Pólipos epiteliales gástricos. Rev. Gastroenterol Perú 2004; 24(1): 50-74.
31. SANCHEZ J. Pólipos y carcinoma gástrico. Rev. gastroenterol Perú 2003; 23: 4.
32. SANCHEZ J. Pólipos hiperplásicos del estómago con transformación maligna en adenocarcinoma. Consideraciones sobre la histogénesis. Acta Cancerológica 2002; 31:7-14.
33. DAIBO M., ITABASHI M., HIROTA T. Malignant Transformation of Gastric Hyperplasic Polyps. The American Journal of Gastroenterology 1987; 82:10161024.
34. GINSBERG G., AL-KAWAS F., FLEISCHER D., et al. Gastric Polyps: Relationship of Size and Histology to Cancer-Risk, the American Journal of Gastroenterology 1996; 91: 714-717.
35. MING S.-C.: Malignant Potential of Epithelial Polyps of the Stomach. In Si-Chun Ming Eds., Precursors of Gastric Cancer, Praeger Publishers 1984; Chapter V
18: 219-222.
36. MORSON B., SOBIN L., GRUNDIVIANN E., et al. Precancerous conditions and epithelial dysplasia in the stomach, J Clin Pathol 1980; 33: 711-721.
37. OEHLERT W. Preneoplastic Lesions of the Stomach. In Si-Chun Ming Eds., Precursors of Gastric Cancer, Praeger Publishers 1984; Chapter II-6: 73-82.
38. SCHMITZ J., STOLTE M. Gastric Polyps as Precancerous Lesions Gastrointestinal Endoscopy Clinics of North America 1997; 7:29-46.
39. ZHANG Y. Epithelial Dysplasia in the Stomach and Its Relationship with Gastric Cancer. In Si-Chun Ming Eds., Precursors of Gastric Cancer, Praeger Publishers 1984; Chapter II-4: 41-52.
40. GOTODA T., YANAGISAWA A., SASAKO M., et al. Incidence of lymph node metastasis from early gastric cancer; estimation with a large number of cases at two large centers. Gastric Cancer 2000; 3: 219-25.
41. HIKI Y. Endoscopic Mucosal Resection (EMR) for Early Gastric Cancer, Nippon Geka Gakkai Zasshi 1996; 97: 273-278.
42. TAKIESHITA K., TANI M., INOUE H., et al. A New Method of Endoscopic Mucosal Resection of Neoplastic Lesions in the Stomach: Its Technical Features and Results Hepatogastroenterology 1997; 44: 1602-1611.
43. GOTODA T., KONDO H., ONO H., et al. A new Endoscopic mucosal resection (EMR) procedure using an insulation-tipped diathermic (IT) knife for rectal flat lesions. Gastrointestinal Endosc 1999; 50: 560-3.
44. ONO H., KONDO H., GOTODA T., et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001; 48: 225-229.
45. SOEHENDRA N., BINMOELLER K., BOHNACKER S., et al. Endoscopic Snare Mucosectomy in the Esophagus without Any Additional Equipment: A Simple Technique for Resection of Flat Early Cancer Endoscopy 1997; 29: 380-383.
46. HIRAO M., MASUDA K., ANANUMA T. et al. Endoscopic resection of early gastric cancer and other tumours with local injection of hypertonic saline-epinephrine. Gastrointest Endosc 1988; 34:264-269.
47. SOEHENDRA N., BINMOELLER K., SEIFERT H. Et al. Therapeutic Endoscopy: Resection of early cancer (Mucosectomy). 2005. Georg Thieme Verlag. Chapter 16: 198-199.
48. MALUFF FF., SAKAI P., IRYIA K., et al. Should we perform endoscopic resection of early digestive cancers without previous echoendoscopy? In Sivak MV Eds.: 10th International Symposium on Endoscopic Ultrasonography, Cleveland, OH, October 1995, Gastrointestinal Endoscopy 1996; 43 (suppl 2): 23.