Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.29 n.1 supl.1 Lima ene./mar. 2009
ARTICULO ORIGINAL
Prevalencia, características clínico-endoscópicas y factores predictivos de esófago de Barrett
Prevalence, clinical-endoscopic characteristics and predictive factors of Barretts esophagus in endoscopic screening for gastric cancer
Alfonso Chacaltana1 ; Carlos Urday ; Walter Ramon2 ; Carlos Rodríguez2 ; Julio Espinoza2 ; Héctor Velarde2 ; Ivan Rodríguez2 ; Elizabeth Lucho2 ; Erick Rauch3
1 Médico Gastroenterólogo Hospital General de Huacho
2 Staff Servicio de Gastroenterología Hospital Central FAP
3 Médico Gastroenterólogo Clínica Endocenter y Clínica San Vicente
RESUMEN
Objetivo: Determinar la prevalencia, características clínico-epidemiológicas y factores predictivos para Esófago de Barrett (EB).
Método: Se realizó un estudio analítico y transversal, seguido de un estudio casos y controles anidado en una población participante en una campaña de despistaje de cáncer gástrico, desde enero a junio del 2008 en el Hospital Central de la FAP. Se definió caso de EB a la presencia endoscópica de mucosa de apariencia columnar en esófago distal confirmada con metaplasia intestinal en la biopsia. Se evaluaron variables demográficas, clínicas y endoscópicas, y se realizó estudio bivariado y multivariado para identificar factores de riesgo predictivos, teniendo como grupos controles a pacientes con reflujo gastroesofágico y a pacientes controles de la población estudiada.
Resultados: De 2273 pacientes estudiados, 11 (0.48%) presentaron EB, con una edad promedio de 52.2 ± 7.7 años (rango 43-69 años), de los cuales 81.8% fueron varones. El 81.8% fueron sintomáticos con dispepsia en 54.5% y reflujo en 27.3%, mientras que el 18.2% fueron asintomáticos. La variedad de EB segmento corto fue más frecuente que el segmento largo (72.7% vs 27.3%). Los factores predictivos encontrados luego del análisis bivariado y multivariado (comparando casos vs grupo control Población) fueron: hernia hiatal [OR= 12.1, IC 95% 2.25-64.75], consumo de AINES [OR= 6.72, IC 95% 1.6-29.1] y el consumo de alcohol [OR= 4.22, IC 95% 1.1-16.91].
Conclusiones: La prevalencia del EB en nuestro estudio fue baja. La presencia de hernia hiatal, consumo de AINES y de alcohol fueron factores de riesgo predictivos para presentar EB en nuestro estudio.
Palabras clave: esófago de barrett, metaplasia intestinal, factores predictivos.
SUMMARY
Purpose: Determine the prevalence, clinical-epidemiological characteristics and predictive factors for Barrets Esophagus (BE).
Method: An analytical and transversal study was conducted, followed by a case-control study nested in a population participating in a gastric cancer screening campaign, from January to June 2008 at the Central Hospital of the Peruvian Air Force (FAP). A BE case was defined due to the endoscopic presence of columnar-appearing mucosa confirmed by intestinal metaplasia at biopsy. Demographic, clinical and endoscopic variables were evaluated, and bivariate and multivariate studies were conducted to identify predictive risk factors, using patients with gastroesophagic reflux and control patients of the study population as control groups.
Results: Out of 2273 patients studied, 11 (0.48%) patients with an average age of 52.2 ± 7.7 years (43-69 year range) suffered from BE, out of which 81.8% were male. The 81.8% were symptomatic, with dyspepsia in 54.5% and with reflux in 27.3%, while 18.2% were asymptomatic. The short-segment BE was more common than the long-segment BE (72.7% versus 27.3%). The predictive factors found after the bivariate and multivariate analysis (comparing cases versus population control group) were: hiatal hernia [OR= 12.1, CI 95% 2.25 – 64.75], consumption of AINES [OR = 6.72, CI 95% 1.6-29.1] and consumption of alcohol [OR = 4.22, CI 95% 1.1-16.91].
Conclusions: BE prevalence in the study was low. The presence of hiatal hernia, consumption of AINES, and consumption of alcohol were predictive risk factors to develop BE in the study.
Key words: Barrets esophagus, intestinal metaplasia, predictive factors.
INTRODUCCIÓN
El Esófago de Barrett (EB) es definido como el cambio en el epitelio esofágico distal de cualquier extensión reconocido endoscópicamente como una mucosa de tipo columnar y confirmada por la presencia de metaplasia intestinal en la biopsia del esófago tubular(1). Esta definición está estrechamente relacionada con su conocida potencialidad de desarrollo a adenocarcinoma esofágico (2,3), estimándose que los pacientes con EB tienen un riesgo de 30 a 40 veces más que la población general para desarrollar esta neoplasia, con una tasa de incidencia anual de aproximadamente 0.5% (4), siendo por tanto, considerado como una probable condición preneoplásica (5,6). Los reportes del incremento en la incidencia de adenocarcinoma esofágico en países como EEUU y de Europa en las últimas décadas (1,7-10,11) han motivado y motivan la realización de múltiples estudios epidemiológicos y clínicos en pacientes con EB con el objetivo de conocer el comportamiento de esta entidad.
En nuestro medio, a diferencia de lo que ocurre en otros países del mundo, el cáncer esofágico y en especial el adenocarcinoma esofágico son infrecuentes. Según el Registro de Cáncer de Lima Metropolitana entre 1994 y 1997 (12), el cáncer de esófago ocupa el lugar 25 de acuerdo al ranking de frecuencia de cáncer, con una tasa de incidencia por edad de 1.35 x 100 000 habitantes, siendo en la mayoría de los casos de tipo carcinoma epidermoide. Además, en base a datos del Departamento de Estadística del Instituto Nacional de Enfermedades Neoplásicas (INEN), sobre un total de 287 casos de cáncer esofágico en un período de 15 años (1985-1999) el adenocarcinoma se presentó con una frecuencia del 4%, sin advertirse algún incremento en la incidencia durante ese período de estudio (13). Todos estos datos explicarían los motivos por el cual no se realicen muchos trabajos de investigación acerca del EB, siendo poco lo que se conoce sobre la epidemiología de esta enfermedad en nuestro país.
Por tanto, el presente estudio busca aportar información acerca de la prevalencia, las características clínicoendoscópicas y los factores de riesgo asociados al EB en nuestro medio, en base a una población que acude a un programa de despistaje endoscópico de cáncer gástrico.
MATERIAL Y MÉTODOS
Contexto.- Se revisó la información recolectada en el Programa de despistaje de cáncer gástrico convocado por el Servicio de Gastroenterología del Hospital Central de la FAP (HCFAP) durante los meses de enero a junio del 2008, dirigida a todo el personal militar de la Fuerza Aérea del Perú con dependencia en la provincia de Lima, en actividad o en retiro, así como a sus familiares directos (cónyuges y padres) de 40 años a más.
A todas las personas participantes en esta campaña se les realizó un estudio de esofagogastroduodenoscopia. Previamente todos los participantes fueron evaluados mediante interrogatorio abierto (por 2 médicos de la Oficina de Epidemiología) quienes recolectaron los datos de filiación, antecedentes médicos, consumo actual o en las últimas 4 semanas de tabaco, alcohol y antiinflamatorios (AINES), así como la presencia actual y tipo de sintomatología digestiva, en una ficha clínica previamente confeccionada para este despistaje denominada Hoja de evaluación gastrointestinal. El mismo día de la entrevista y previo consentimiento informado se les practicó el estudio endoscópico en busca de lesiones sospechosas de malignidad o premalignas en el tracto digestivo superior, las cuales fueron detalladas en el respectiva hoja de evaluación, al igual que los demás hallazgos endoscópicos presentes. Ante toda lesión sospechosa de malignidad se le practicó la respectiva toma de biopsia para el subsiguiente estudio anatomopatológico. Además, en todos los pacientes se tomó 3 muestras de biopsia gástrica (2 de antro y 1 de cuerpo gástrico) para determinar la presencia de helicobacter pylori.
El estudio endoscópico fue realizado por el staff médico del Servicio de Gastroenterología del HCFAP, que cuenta con los videoendoscopios Olympus Evis Exera CLE-145 y Fujinon EVE Processor Epx-201, mientras que el estudio histopatológico se realizó en el Servicio de Anatomía Patológica del mismo hospital.
Metodología.- Se realizó un estudio observacional de tipo analítico y tranversal, seguido de un estudio de casos y controles anidado. La población de estudio estuvo conformada por todos los participantes del programa de despistaje de cáncer gástrico, el mismo que sirvió para determinar la prevalencia del Esófago de Barrett. Todos los datos fueron obtenidos en base a la información contenida en las respectivas Hojas de evaluación gastrointestinal de cada paciente.
Se definió caso de Esófago de Barrett (EB), al hallazgo endoscópico de sospecha de EB confirmado histológicamente con la presencia de metaplasia intestinal. No se consideró como EB a los pacientes con diagnóstico histológico de metaplasia intestinal obtenido de biopsias esofágicas tomados en hallazgos endoscópicos diferentes a la sospecha de EB. La sospecha endoscópica de EB se determinó en base a la presencia de epitelio de aspecto columnar de cualquier tamaño en esófago distal descrito en el informe endoscópico respectivo.
Los pacientes con datos incompletos o sin estudio histopatológico fueron excluídos del estudio.
Para el estudio de los factores de riesgo se consideró 2 grupos controles:
Grupo control ERGE: conformado por todos los pacientes con síntomas de reflujo (pirosis y/o regurgitación) y que a la vez cuenten con diagnóstico endoscópico de esofagitis erosiva.
Grupo control Población: conformado por todos los pacientes sin síntomas de reflujo ni esofagitis en el estudio endoscópico, excluyendo además a aquellos con patología péptica (Ulcera gástrica y/o duodenal, gastritis erosiva), atrofia gástrica, cirugía gástrica, pólipos y lesiones sospechosas de malignidad.
Las variables estudiadas fueron edad, sexo, consumo de alcohol, tabaco y anti-inflamatorios (AINES), reflujo duodenogástrico, hernia hiatal e infección por helicobacter pylori. Se utilizaron las siguientes definiciones en el estudio:
-
Dispepsia: presencia de al menos uno de los siguientes síntomas: dolor epigástrico, llenura precoz, balonamiento abdominal, flatulencia, eructos.
-
Reflujo: presencia de pirosis y/o regurgitación ácida en la boca o vinagrera.
-
Hernia hiatal: diferencia endoscópica de ≥2cm entre el hiato diafragmático y la unión escamocolumnar (UEC).
-
Reflujo duodenogástrico: presencia de bilis en estómago.
-
EB de segmento largo: presencia de ≥3cm en la longitud del epitelio columnar.
-
EB de segmento corto: presencia de una longitud del epitelio columnar <3cm.
La longitud del epitelio columnar se determinó en base a la información descrita en los informes endoscópicos, por la sustracción numérica del nivel de la unión esofagogástrica (UEG) determinada por el punto en donde se encuentran el extremo distal del esófago tubular con el margen proximal de los pliegues gástricos, menos el nivel de la unión escamo-columnar (UEC), niveles medidos usando la longitud del endoscopio tomando como referencia a la arcada dentaria del paciente. [Longitud del Epitelio columnar = UEG – UEC]. -
Presencia de Helicobacter pylori: determinada por estudio histológico mediante coloración de hematoxilina-eosina.
Análisis estadístico.- Se realizó estadística descriptiva en todos los grupos (casos y controles) reportándose las variables continuas como medias ± desviación estandar y las variables categóricas como porcentajes (%). El análisis bivariado se realizó mediante tablas de contingencia aplicándose la prueba de Chi cuadrado (X2) para el análisis de la asociación, obtuviéndose los Odd ratios (OR) con sus respectivos intervalos de confianza (IC) al 95%. La diferencia estadísticamente significativa fue definida con el valor de p de 0.05 o menos. Todos los análisis fueron realizados comparando los casos versus controles ERGE y casos versus controles Población. Las variables encontradas con significancia estadística fueron luego introducidas en el análisis multivariado, el cual se realizó mediante el método de regresión logística para evaluar los factores independientemente asociados con la variable dependiente (Esófago de Barrett) y determinar el efecto predictor de las variables. El análisis estadístico la realizamos con el paquete estadístico SPSS v. 15.0 versión para Windows.
RESULTADOS
La población total estudiada fue de 2273 pacientes, los cuales fueron evaluados mediante endoscopia alta y estudio anátomo-patológico durante los meses de enero a junio del 2008. Se encontró 44 pacientes con sospecha endoscópica de EB, de los cuales 11 fueron confirmados histológicamente con la presencia de metaplasia intestinal, resultando una prevalencia de EB de 0.48% (11/2273).
El grupo control ERGE estuvo conformado por 53 pacientes con síntomas de reflujo y diagnóstico endoscópico de Esofagitis erosiva, mientras que el grupo control Población lo conformaron 911 pacientes.
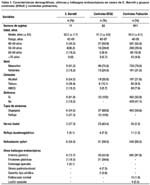
En los 11 casos de EB, la edad promedio fue de 52.2 años (DS ± 7.7) con un rango de 43 a 69 años, con el 45.5% en el grupo etáreo de 40-49 años, seguido de los grupos de 50-59 años (36.3%) y de 60-69 años (18.2%). En cuanto al género, 9 (81.2%) fueron varones y 2 (18.2%) mujeres.
Los pacientes con EB refirieron consumo de alcohol, tabaco y AINES, en el 54.5%, 36.4% y 18.2% del total de casos, respectivamente, presentando una mayor frecuencia de consumo comparativamente con los grupos controles (Tabla 1).
En cuanto a la sintomatología, el 81.8% de los casos de EB tuvieron algún síntoma al momento del estudio endoscópico, mientras que el restante 18.2% fueron asintomáticos. Los síntomas más frecuentes reportados fueron dispepsia (54.5%) y reflujo (27.3%).
Se observó también que del total de pacientes con EB, el 27.3% y el 9.1% presentaron hernia hiatal y reflujo duodenogástrico respectivamente. La presencia de la infección por helicobacter pylori se detectó en 54.5% (6 pacientes) en los casos de EB. Los demás hallazgos endoscópicos encontrados tanto en los casos como en los grupos controles se detallan en la Tabla 1.
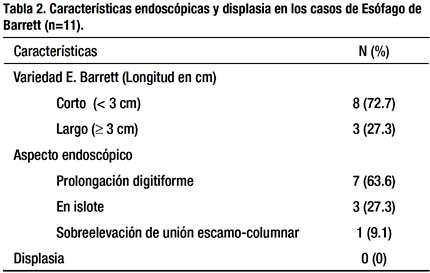
La variedad endoscópica predominante en los casos de EB, fue el esófago de barrett corto (< 3cm) con 72.7% (8 pacientes), mientras que el 27.3% (3), se presentó como esófago de barrett largo. Además, el aspecto endoscópico más frecuente fue la prolongación digitiforme (63.6%), seguido de la presentación en islote (27.3%) y sobreelevación de unión escamo-columnar (9.1%). No se encontró ningún caso de displasia.¡
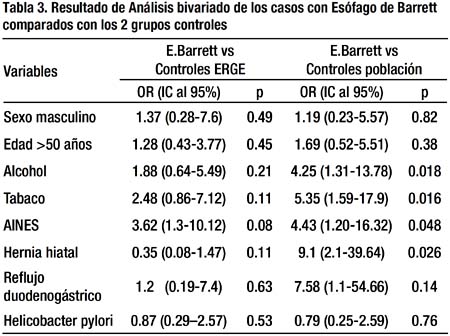
Al realizar el estudio bivariado de las variables entre los casos y controles ERGE, variables como el sexo masculino, la edad > 50 años, el consumo de alcohol, de tabaco y de AINES, presentaron un OR > 1, sin embargo no alcanzaron significancia estadística (Tabla 3). En cambio, al comparar las variables entre los casos y el grupo control población, se encontraron que la hernia hiatal [OR= 9.1, IC 95% 2.1-39.64], el consumo de tabaco [OR= 5.35, IC 95% 1.59-17.9], el consumo de alcohol [OR= 4.25, IC 95% 1.31-13.78] y el consumo de AINES [OR= 4.43, IC 95% 1.2-16.32] alcanzaron significancia estadística (p<0.05) para ser considerados como factores de riesgo para presentar EB (Tabla 3). La infección por Helicobacter pylori presentó un OR < 1 en ámbas comparaciones pero sin alcanzar significancia estadística.
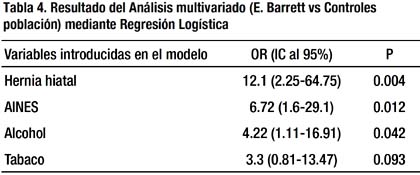
Posteriormente se realizó el análisis multivariado con los 4 factores de riesgo encontrados en el análisis bivariado anterior (casos comparados con grupo control población) mediante Regresión Logística, obteniéndose que la presencia de hernia hiatal [OR= 12.1, IC 95% 2.25-64.75; p=0.004], el consumo de AINES [OR= 6.72, IC 95% 1.629.1, p=0.012] y el consumo de alcohol [OR= 4.22, IC 95% 1.1-16.91, p=0.04] se comportan como factores de riesgo en forma independiente para presentar EB (Tabla 4).
DISCUSIÓN
Como ya se mencionó, los estudios sobre EB son escasos en nuestro medio. Así, luego de la búsqueda por medio de Medline, Lipecs y Scielo Perú, encontramos sólo 2 estudios en donde se mencionan la prevalencia del EB en nuestro país.
En la revisión de Barreda y cols(13) realizada en el INEN en 45 años de estudio, se encontró un total de 40 casos confirmados de EB que reúnen los requisitos de criterio endoscópico e histológico de metaplasia intestinal (15 casos entre 1956 y 1998, y 25 casos desde 1999 a julio del 2001), determinándose una prevalencia de 0.64% (25/3904 endoscopias realizadas en el período 1999-2001). En cambio, Tagle y cols (14), entre 1998 a 2001, encontró una prevalencia de EB de 5.8% (20 casos) en 345 pacientes ambulatorios de una clínica particular con pirosis a los cuales se les realizó estudio endoscópico. Sin embargo, éste trabajo no menciona los criterios diagnósticos empleados para la determinación del EB.
Nuestro estudio encuentra una prevalencia de EB de 0.48% en una población de la capital que concurrió a un programa de screening endoscópico para cáncer gástrico, aproximándose al valor encontrado por Barreda (0.64%), con lo que se reafirma lo poco frecuente de ésta entidad en nuestro medio.
Los datos publicados en el contexto internacional son diversos y varían en base al tipo de población estudiada, presencia o no de síntomas de ERGE, aspectos sociodemográficos y por la época en que fueron realizados. Sin embargo y a pesar de las grandes variaciones existentes en los estudios de prevalencia de EB, nuestro hallazgo fue similar a lo encontrado en la población general en otras latitudes como Wisconsin-EEUU 0.26% (9), México 0.26% (15), Brasil 0.53%(16), Turquía 0.4% (17), Corea 0.3% (18), Arabia Saudita 0.31%(19), Japón 0.3% (20), y China 0.06% (21).
La edad promedio hallada en los casos de EB en nuestro estudio fue de 52.2 años -mayor que en los grupos controles pero sin alcanzar diferencia estadística- lo cual coincide con lo reportado en la literatura mundial. Se ha determinado que la prevalencia del EB se incrementa con la edad, especialmente después de la edad de los 40 años (7,22), de tal forma que algunas guías recomiendan que el screening endoscópico de rutina para la detección del EB se debería realizar en los adultos mayores de 50 años de edad (1,3). Igual comentario merece la clara predominancia del sexo masculino en los casos de EB en nuestro estudio, con un 81.8% del total, haciendo una relación 4.5:1 respecto al femenino, semejante a lo hallado por Barreda (13) quien encontró una relación de 3:1 en nuestro país, y por otros estudios en el mundo (2,4,7,10,23,24).
Al evaluar la sintomatología en los casos de EB, encontramos que el 81.8% del total presentaron síntomas al momento del diagnóstico, siendo más frecuente la dispepsia (54.5%) que los síntomas de reflujo (27.3%), mientras que el 18.2% del total de casos fueron asintomáticos.
El EB ha sido reconocido como una complicación de la enfermedad por reflujo crónico, por lo que las tasas mas altas de prevalencia en EB fueron realizadas precisamente en poblaciones con síntomas de reflujo, estimándose que el EB está presente en el 10-20% de los pacientes con reflujo gastroesofágico de acuerdo a múltiples series (4,7,25). Además, la presencia de los síntomas de reflujo, en especial los de larga data (más de 5 años) en pacientes mayores de 50 años serían criterios para realizar un estudio de screening endoscópico para detectar EB (3). Sin embargo, es necesario indicar que no todos los pacientes con EB presentan síntomas de reflujo, considerándose incluso que su patrón clínico no es constante, no siendo infrecuente encontrar estudios descriptivos con una baja frecuencia de síntomas de reflujo (15,17,21,24). Algunos autores consideran que la baja frecuencia de presentación de pirosis en pacientes con EB, podría deberse a una menor sensibilidad del epitelio metaplásico a la acidez gástrica (26), mientras que otros estiman que un considerable numero de pacientes con EB pueden progresar sin síntomas de reflujo o presentar síntomas en una intensidad tan baja que no motivan consulta médica (27). Carneiro et al(27) en Brasil por ejemplo, encontró una prevalencia de EB de 3.8% en 104 pacientes con indicación para endoscopia alta sin síntomas de reflujo. Además, diversos estudios realizados en poblaciones asintomáticas revelan una prevalencia de EB que varía desde 5.6% a 25% (28,29,30).
Nuestros resultados en cuanto a la presencia de síntomas de reflujo en pacientes con EB (27.3%), sugeriría que el screening endoscópico basado en dicho síntoma podría ser inadecuado para detectar EB en nuestro medio, a diferencia de lo propugnado en la literatura (1,3).
En el aspecto endoscópico, la variedad de presentación más frecuente del EB en nuestro estudio, fue el de segmento corto (72.7%), mientras que el EB de segmento largo se presentó en 3 casos (27.3%). Estos hallazgos se aproximan a lo encontrado por Barreda y cols (13) en nuestro medio, con 68% y 32% de segmento corto y largo, respectivamente. El Esófago de Barret de segmento corto (EBSC) no fue ampliamente reconocido hasta el reporte de Spechler et al(31) en 1994, a partir del cual, múltiples estudios encuentran una mayor frecuencia de EBSC, como Gerson et al (28), Ward et al (32) y Rex et al(29) quienes documentaron una mayor proporción de EBSC en sus cohortes, con 70.3%, 81.5% y 92%, respectivamente. Se considera que esta mayor frecuencia de EBSC se debe a una mayor conciencia de la importancia del EB con el consiguiente incremento en la búsqueda y detección del EBSC en los últimos años (9). Además, la predominancia del EBSC frente al de segmento largo (EBSL) es independiente a la presencia de síntomas de reflujo, ya que aparece no sólo en las cohortes de pacientes con síntomas de reflujo sino también en las que no presentan reflujo. Así, Rex (29) en pacientes que asistieron a un programa de screening colonoscópico, encontró endoscópicamente una prevalencia de EB de 8.3% (EBSC 68.7% y EBSL 31.3%) en pacientes con síntomas de reflujo, y una prevalencia de EB de 5.6% (EBSC 93.6% y EBSL 6.4%) en pacientes sin síntomas de reflujo.
Nuestro estudio estadístico encontró factores de riesgo sólo al comparar las variables de estudio de los casos de EB con el grupo control población, no hallando diferencia estadística entre las variables de estudio de los pacientes con EB y pacientes con ERGE. Posteriormente el análisis multivariado encontró 3 factores de riesgo para EB, de los cuales la presencia de hernia hiatal fue el predictor más fuerte de EB, determinando que la presencia de hernia hiatal incrementa en 12.1 veces más la probabilidad de presentar EB en relación a los pacientes del grupo control población que no tienen hernia hiatal (p=0.004). Nuestro hallazgo coincide con múltiples referencias que asocian positivamente la hernia hiatal con el EB, tanto en estudios endoscópicos como radiológicos (7,33,34,35,36), siendo considerado como importante factor de riesgo predictor para EB, en sus formas de segmento corto y largo (36,37). Además, es conocido la asociación de la hernia hiatal con el incremento en el riesgo para presentar reflujo gastroesofágico (2,10,37), el cual conllevaría posteriormente a EB como complicación tardía del reflujo.
Es interesante comentar que el análisis estadístico en nuestra investigación considera al consumo de AINES como un factor de riesgo para presentar EB [OR= 6.72 (1.6-29.1) p=0.011], incrementando hasta en 6.72 veces más la posibilidad de presentar EB al compararlos con los pacientes del grupo control. Estos resultados difieren con lo reportado en otros estudios que consideran que el consumo de AINES y/o aspirina ejercería un papel protector al prevenir la aparición del EB y del adenocarcinoma esofágico (38,39,40), por medio de la inhibición de la enzima ciclooxigenasa COX-2, la cual luego de la activación de citocinas proinflamatorias como la interleucina-1B (IL-B) y factor de necrosis tumoral-α (TNF-α) causaría injuria de la mucosa (39). Sin embargo, encontramos en nuestro medio evidencia a favor del efecto del consumo de AINES en la enfermedad por reflujo gastroesofágico en el trabajo de Castelo y Cols (41) quienes encontraron una fuerte asociación entre AINES y ERGE, con un OR=19.36 (IC: 2.65-396.7 y p<0.05).
La asociación del consumo de alcohol con el EB han tenido resultados conflictivos en múltiples estudios, por lo que no se puede establecer una clara asociación de riesgo, de tal forma que varios trabajos consideran al consumo de alcohol como un factor de riesgo para EB (9,37,42,43), mientras que otros niegan esa relación (44,45). En nuestro estudio encontramos que el 54.5% de los pacientes con EB refirieron consumo de alcohol, siendo también considerado como un factor de riesgo predictivo para el desarrollo de la enfermedad, con un OR de 4.22 (1.1-16.91).
Algo semejante sucedió con el consumo de tabaco en nuestra investigación, hallado en el 36.4% de los pacientes con EB, siendo también considerado como factor de riesgo (sólo al compararlo con el grupo control población) en el análisis bivariado y multivariado, aunque en éste último no alcanzó significancia estadística. La historia de consumo de tabaco también ha sido asociado con la prevalencia de EB en otros estudios (9,37,38,44,46) que coinciden con nuestros resultados, aunque existen otros hallazgos conflictivos que no demuestran dicha asociación (35,42,47), por lo que posteriores estudios serán necesarios para aclarar estas controversias.
El rol de la infección por helicobacter pylori en la patogénesis de la enfermedad por reflujo gastroesofágico y sus complicaciones continúa siendo discutida (36). Hay evidencia que sugiere que el HP ejercería un papel protector frente al desarrollo de esofagitis erosiva (48,49), esófago de Barrett y adenocarcinoma esofágico (50-53). Muchos estudios además, muestran una asociación inversa entre la presencia del HP y el EB (43,54,55) y el adenocarcinoma esofágico (56,57). Se sugiere por ejemplo que la declinación en la prevalencia del HP en algunas poblaciones puede relacionarse con el incremento en la prevalencia del EB y viceversa (2,58,59), lo cual explicaría, al menos en parte, que la baja prevalencia del EB reportada en países como el nuestro estaría en relación a la alta prevalencia poblacional de la infección por helicobacter pylori. Sin embargo en nuestro estudio no encontramos asociación inversa entre el HP y el EB, determinándose una prevalencia de la infección por helicobacter pylori en pacientes con EB fue de 54.5% (similar a la encontrada en los grupos controles: 58.5% 60.2%) sin asociación estadística.
Por último, debemos mencionar algunas limitaciones que presenta nuestro estudio. En primer lugar, dada las características de la población estudiada (procedencia de institución militar con predominio masculino), los resultados de nuestra investigación no pueden ser extrapolados a la población general. Segundo, algunos de los factores de riesgo estudiados (alcohol, tabaco y AINES) sólo fueron evaluados en el aspecto cualitativo sin la adecuada investigación en la cantidad y el tiempo de consumo de los mismos, lo cual hubiera sido importante para relevar nuestros hallazgos, por lo que en posteriores estudios se debería incluir esta observación. A pesar de éstas limitaciones, nuestra investigación constituye uno de los pocos trabajos realizados en nuestro país sobre Esófago de Barrett, el cual puede y debe motivar la realización de otros estudios similares.
CONCLUSIONES
En conclusión, la prevalencia de Esófago de Barrett en la población estudiada fue baja (0.48%), presentándose con una edad media de 52.2 años, y siendo predominante en el género masculino con 81.8% de casos.
Los síntomas mas frecuentes fueron la dispepsia (54.5%) y luego los síntomas de reflujo (27.3%), encontrando la enfermedad del EB en 18.2% de pacientes sin sintomatología al momento del diagnóstico.
El EB se presentó con mayor frecuencia en la variedad de segmento corto (72.7%) en forma de prolongación digitiforme (63.6%) en el aspecto endoscópico. No se encontró ningún caso de displasia en los pacientes con EB.
La infección por helicobacter pylori se detectó en 54.5% de los pacientes con EB sin encontrarse asociación estadística.
Los factores de riesgo predictivos para EB en nuestro estudio fueron: hernia hiatal (OR= 12.1), consumo de AINES (OR= 6.72) y el consumo de alcohol (OR= 4.22).
REFERENCIAS
1. WANG KK, SAMPLINER RE. Updated Guidelines 2008 for the Diagnosis, Surveillance and Therapy of Barretts Esophagus. Am J Gastroenterol 2008;103:788–797.
2. FALK GW. Barretts Esophagus. Gastroenterology 2002;122:1569–1591.
3. SHARMA P, MCQUAID K, DENT J, FENNERTY B, SAMPLINER R et al. A Critical Review of the Diagnosis and Management of Barretts Esophagus: The AGA Chicago Workshop. Gastroenterology 2004;127:310– 330.
4. SHAHEEN NJ. Advances in Barretts esophagus and esophageal adenocarcinoma. Gastroenterology 2005;128:1554–1566.
5. FLEJOU JF, SVRCEK M. Barretts oesophagus - a pathologists view. Histopathology 2007, 50, 3–14.
6. FENNERTY MB. Endoscopic diagnosis and surveillance of Barretts esophagus. Gastrointest Endoscopy Clin N Am 2003; 13:257– 267.
7. TUTUIAN R, CASTELL DO. Barretts esophagus. Prevalence and epidemiology. Gastrointest Endoscopy Clin N Am 2003; 13:227– 232
8. SAMPLINER RE. Updated guidelines for the diagnosis, surveillance, and therapy of Barrett's esophagus. Am J Gastroenterol 2002;97:1888-95.
9. MUSANA AK, RESNICK JM,D TORBEY C, MUKESH B, et al. Barretts Esophagus: Incidence and Prevalence Estimates in a Rural Mid-Western Population. Am J Gastroenterol 2008;103:516–524.
10. ABRAMS JA, FIELDS S, LIGHTDALE C, NEUGUT A. Racial and Ethnic Disparities in the Prevalence of Barretts Esophagus Among Patients Who Undergo Upper Endoscopy. Clinical Gastroenterology and Hepatology 2008;6:30–34.
11. DALY JM, KARNELL LH, MENCK HR. National Cancer Data Base report on esophageal carcinoma. Cancer 1996;78:1820–1828.
12. Centro de Investigación en Cáncer Maes Heller. Instituto Nacional de Enfermedades Neoplásicas. Registro de Cáncer de Lima Metropolitana 1994-1997.Vol III, Dic. 2004.
13. BARREDA F, SÁNCHEZ J, MISAD O, COMBE J, AMORÍN E, ROJAS V, y col. Esófago de Barrett. Rev Gastroenterol Perú 2002;22(1): 46-68.
14. TAGLE M, AGUINAGA M, VÁSQUEZ G. Hernia hiatal como factor de riesgo para esofagitis erosiva: Experiencia y hallazgos endoscópicos de una población peruana con pirosis. Rev Gastroenterol Perú 2003; 23:36-40.
15. PENA NG, MANRIQUE MA, CHAVEZ MA, et al. Prevalence of Barretts esophagus in non-selected patients submitted to esophagogastro-duodenoscopy and associated risk factors. Rev Gastroenterol Mex. 2005;70:20–24.
16. ANDREOLLO NA, MICHELINO MU, BRANDALISE NA, LOPES LR, et al. Incidência e epidemiologia do epitélio de Barret no Gastrocentro – UNICAMP. Arq Gastroenterol 1997;34:22-6.
17. YILMAZ N, TUNCER K, TUNCYUREK M, et al. The prevalence of Barretts esophagus and erosive esophagitis in a tertiary referral center in Turkey. Turk J Gastroenterol 2006;17:79–83.
18. LEE JI, PARK H, JUNG HY, et al. Prevalence of Barretts esophagus in an urban Korean population: a multicenter study. J Gastroenterol. 2003;38:23–27.
19. GADOUR MO, AYOOLA EA. Barretts oesophagus and oesophageal cancer in Saudi Arabia. Trop Gastroenterol 1999;20:111–115.
20. AZUMA N, ENDO T, ARIMURA Y, MOTOYA S, ITOH F, HINODA Y. Prevalence of Barretts esophagus and expression of mucin antigens detected by a panel of monoclonal antibodies in Barretts esophagus and esophageal adenocarcinoma in Japan. J Gastroenterol. 2000;35:583-92.
21. TSENG PH, LEE Y, CHIU H, HUANG S. Prevalence and Clinical Characteristics of Barretts Esophagus in a Chinese General Population. J Clin Gastroenterol 2008;00:000–000.
22. VAN BLANKENSTEIN M. Barretts esophagus: so what! Dis Esophagus 2002;15:1– 4.
23. BYTZER P, CHRISTENSEN PB, DAMKIER P, et al. Adenocarcinoma of the esophagus and Barretts esophagus, a population based study. Am J Gastroenterol 1999;94:86 – 91.
24. MODIANO N, GERSON LB. Barretts esophagus: Incidence, etiology, pathophysiology, prevention and treatment. Therapeutics and Clinical Risk Management 2007:3(6) 1035–1045.
25. LOUIS H. Reflux disease and Barretts esophagus. Endoscopy 2007; 39: 969-973.
26. JOHNSTON DA, WINTERS C, SPURLING TJ, et al. Esophageal acid sensitivity in Barretts esophagus. J Clin Gastroenterol, 1987. 9:23-27.
27. CARNEIRO M, DIASL, COELHO GV. Prevalence of Barrett´s Esophagus in individuals without typical symptoms of gastroesophageal reflux disease. Arq Gastroenterol 2008;45(1):46-49.
28. GERSON LB, SHETLER K, TRIADAFILOPOULOS G. Prevalence of Barretts esophagus in asymptomatic individuals. Gastroenterology 2002;123:461–467.
29. REX DK, CUMMINGS OW, SHAW M, CUMINGS MD, et al. Screening for Barretts esophagus in colonoscopy patients with and without heartburn. Gastroenterology 2003;125:1670–1677.
30. DEVAULT KR, WARD EM, WOLFSEN HC, LOEB DS, KRISHNA M, HEMMINGER LL, et al. Barretts esophagus is common in older patients undergoing screening colonoscopy regardless of gastroesophageal reflux symptoms (abstr). Gastroenterology 2004;126(Suppl 2):680A.
31. SPECHLER SJ, ZEROOGIAN JM, ANTONIOLI DA, et al. Prevalence of metaplasia at the gastroesophageal junction. Lancet 1994;344:1533–6.
32. WARD EM, WOLFSEN HC, ACHEM SR, et al. Barretts esophagus is common in older men and women undergoing screening colonoscopy regardless of reflux symptoms. Am J Gastroenterol 2006;101:12–7.
33. CAMERON AJ. Barretts Esophagus: prevalence and size of hiatal hernia. Am J Gastroenterol 1999;94:2054-9.
34. ASTE H, BONELLI L, FERRARIS R, et al. Gastroesophageal reflux disease: relationships between clinical and histological features. Dig Dis Sci 1999:44:2412-8.
35. CONIO M, FILIBERTI R, BLANCHI S, FERRARIS R, MARCHI S, RAVELLI P, et al. Risk factors for Barretts esophagus: a case-control study. Int J Cancer 2002;/97:/225-9.
36. CAMPOS GM, DEMEESTER SR, PETERS JH, OBERG S, CROOKES PF, HAGEN JA. Predictive factors of Barrett esophagus: multivariate analysis of 502 patients with gastroesophageal reflux disease. Arch Surg. 2001;136:1267-73.
37. RONKAINEN J, ARO P, STORSKRUBB T, et al. Prevalence of Barretts esophagus in the general population: An endoscopic study. Gastroenterology 2005;129:1825–31.
38. SMITH KJ, OBRIEN S, SMITHERS B, GOTLEY D, WEBB P, et al. Interactions among Smoking, Obesity, and Symptoms of Acid Reflux in Barretts Esophagus. Cancer Epidemiol Biomarkers Prev 2005;14(11):2481–6.
39. ANDERSON LA, JOHNSTON BT, WATSON P, MURPHY SJ, et al. Nonsteroidal Anti-inflammatory Drugs and the Esophageal Inflammation-Metaplasia- Adenocarcinoma Sequence. Cancer Res 2006; 66(9): 4975-82.
40. CORLEY DA, KERLIKOWSKE K, VERMA R, BUFFLER P. Protective association of aspirin/NSAIDs and esophageal cancer: a systematic review and metaanalysis. Gastroenterology 2003;124:47 – 56.
41. CASTELO JM, OLIVERA R, PÁUCAR H, FLORES JC. Reflujo gastroesofágico: características clínicas y endoscópicas, y factores de riesgo asociados. Rev. Gastroenterol Perú 2003;23:41-48.
42. VEUGELERS PJ, PORTER GA, GUERNSEY DL, et al. Obesity and lifestyle risk factors for gastroesophageal reflux disease, Barrett esophagus and esophageal adenocarcinoma. Dis Esophagus. 2006;19:321–328.
43. HIROTA WK, LOUGHNEY TM, LAZAS DJ, MAYDONOVITCH CL, RHOLL V, WONG RK. Specialized intestinal metaplasia, dysplasia, and cancer of the esophagus and esophagogastric junction: prevalence and clinical data. Gastroenterology 1999;/116:/277-85.
44. JOHANSSON J, KANSSON H, MELLBLOM L, KEMPAS A, et al. Risk factors for Barretts oesophagus: A population-based approach. Scandinavian Journal of Gastroenterology, 2007; 42: 148-156.
45. WONG A, LOVAT LL, BURNHAM R et al. Large−scale prospective study reveals novel risk factors for Barretts oesophagus. Gastroenterology 2007; 132: A254.
46. LAM K, PHAN JT, GARCIA RT, TRINH H, et al. Low Proportion of Barretts Esophagus in Asian Americans. Am J Gastroenterol 2008;103:1625–1630.
47. ANDERSON LA, WATSON RG, MURPHY SJ, JOHNSTON BT, COMBER H, MC GUIGAN J, et al. Risk factors for Barretts oesophagus and oesophageal adenocarcinoma: Results from the FINBAR study. World J Gastroenterol 2007; 13(10): 1585-1594.
48. WERDMULLER BF, LOFFELD RJ. Helicobacter pylori infection has no role in the patogénesis of reflux esophagitis. Dig Dis Sci 1997;42:103-105.
49. RAGHUNATH A, HUNGIN AP, WOOFF D, CHILDS S. Prevalence of Helicobacter pylori in patients with gastro-oesophageal reflux disease: systematic review. Br Med J 2003;/326:/737.
50. VARANASI RV, FANTRY GT, WILSON KT. Protective role of Helicobacter pylori infection in gastroesophageal reflux disease [abstract]. Gastroenterology. 1998;114:322.
51. CHOW WH, BLASER MJ, BLOT WJ, et al. An inverse relation between cagA+ strains of Helicobacter pylori infection and risk of esophageal and gastric cardia adenocarcinoma. Cancer Res. 1998;58:588-590.
52. HENRIK SIMAN J, FORSGREN A, BERGLUND G, FLOREN CH. Helicobacter pylori infection is associated with a decreased risk of developing oesophageal neoplasms. Helicobacter 2001;/6:/310-6.
53. DE MARTEL C, LLOSA AE, FARR SM, FRIEDMAN GD, VOGELMAN JH, et al. Helicobacter pylori infection and the risk of development of esophageal adenocarcinoma. J Infect Dis 2005;/191:761-7.
54. VICARI JJ, PEEK RM, FALK GMW, GOLDBLUM JR, et al. The seroprevalence of cagA-positive Helicobacter pylori strains in the spectrum of gastroesophageal reflux disease. Gastroenterology 1998;115:50-57.
55. VOUNTILAINEN M, JUHOLA MT. The changing epidemiology of esophageal cancer in Finland and the impacto of the surveillance of Barrett´s esophagus in detecting esophageal adenocarcinoma. Dis Esophagus 2005;18:221-225.
56. YE W, HELD M, LAGERGREN J, et al. Helicobacter pylori infection and gastric atrophy: risk of adenocarcinoma and squamous-cell carcinoma of the esophagus and adenocarcinoma of the gastric cardia. J Natl Cancer Inst 2004;96:388–96.
57. WU AH, CRABTREE JE, BERNSTEIN L, et al. Role of Helicobacter pylori CagA+ strains and risk of adenocarcinoma of the stomach and esophagus. Int J Cancer 2003;103:815–21.
58. BANATVALA N, MAYO K, MEGRAUD F, JENNINGS R, DEEKS JJ, FELDMAN RA. The cohort effect and Helicobacter pylori. J Infect Dis 1993;68:219–221.
59. EL-SERAG HB, SONNENBERG A. Opposing time trends of peptic ulcer and reflux disease. Gut 1999;43:327–333.
Correspondencia
Dr Alfonso Chacaltana Mendoza
Dirección: Jr. Sanchez Cerro 1868
Dpto. 701 Jesús María-Lima.
2659969 – 992757163
dralfonso_al@yahoo.com