Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.29 no.2 Lima Apr./jun. 2009
ARTÍCULO ORIGINAL
Cáncer gástrico localizado: resultados quirúrgicos de 801 pacientes tratados con Linfadenectomia D2
Surgical outcome of 801 patients with localized gastric cancer treated with d2 lymphadenectomy
Eloy Ruiz1 ; Juvenal Sanchez2 ; Juan Celis1 ; Eduardo Payet1 ; Francisco Berrospi1 ; Ivan Chavez1 ; Frank Young1
1 Departamento de Abdomen del Instituto Nacional de Enfermedades Neoplasicas.
2 Departamento de Patología del Instituto Nacional de Enfermedades Neoplasicas. Email: eruiz@inen.sld.pe
RESUMEN
Antecedentes: La gastrectomía D2 es un procedimiento considerado inconveniente por la alta mortalidad y la falta de beneficio en la sobrevida. Sin embargo estudios recientes demuestran que también en occidente la D2 tiene baja mortalidad e impacto en la sobrevida.
En el instituto de enfermedades neoplasicas la gastrectomía D2 se realiza desde 1990 después del entrenamiento de algunos de los autores en el NCC de Tokio Japón. El objetivo de este estudio es evaluar la mortalidad peri operatoria y sobrevida en un grupo de pacientes quienes tuvieron una gastrectomía D2 (con preservación de páncreas) de acuerdo a las reglas de la Japanese Research Society for Gastric Cancer. Los datos fueron recolectados prospectivamente y los pacientes fueron seguidos por un mínimo de 7 años.
Métodos: Una serie de 938 pacientes con cáncer gástrico localizado fueron admitidos al INEN entre 1990 y 1999, de estos 801 pacientes tuvieron una reseccion curativa D2.
Se analizo la mortalidad post operatoria, tipo de gastrectomía, promedio de ganglios linfáticos resecados, estadios TNM y tiempo de sobrevida.
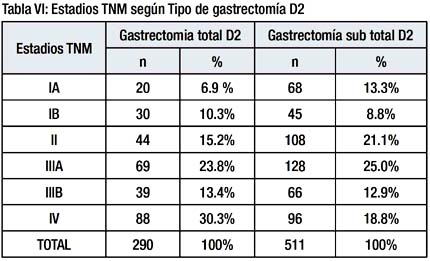
Resultados: Se realizo 511 gastrectomias sub total distal y 290 gastrectomias totales, el promedio de ganglios resecados fue de 46.8% (54.9 ganglios para total y 41.69 para sub total). La mortalidad hospitalaria fue de 2.9%. 11% fueron estadio TNM IA, 9.4% estadio IB, 24.6% estadio IIIA, 13.1% estadio IIIB y 23% estadio IV.
La sobrevida a5 años fue de 47.5%, la sobrevida a 5 años para los estadios IA, IB, II, IIIA, IIIB y IV fue de 85.8%, 79.4%, 60%, 46.7% 33% and 14.3% respectivamente.
Conclusiones: La gastrectomia con diseccion linfatica D2 puede ser realizada con baja morbilidad y mortalidad en centros especializados, con un estricto control de calidad y sin resecar la cola del páncreas a menos que este infiltrada.
La linfadenectomia D2 da una buena probabilidad de sobrevida a largo plazo, aun en pacientes con metástasis ganglionar regional.
Palabras clave: Cáncer gástrico, Linfadenectomia D2, Mortalidad hospitalaria, sobrevida.
SUMMARY
Background: D2 gastrectomy has been regarded as an inconvenient procedure with high morbidity and no survival benefit in the West. Recent studies, however, have shown low mortality and a survival benefit of D2 gastrectomy. In the Instituto de Enfermedades Neoplasicas (INEN) of Lima Peru D2 gastrectomy is performed since 1990 after training of some of the authors in the NCC of Tokio Japan. Distal Pancreatectomy was performed only if the pancreas was involved.
The aim of this study was to evaluate the peri operative mortality and survival in a group of patients who had a standard D2 lymphadenectomy according to the rules of the Japanese Research Society for Gastric Cancer. Data were collected prospectively, and patients were followed for more than 7 years.
Methods: Between 1990 and 1999, 938 patients with localized gastric cancer were registered at INEN. Of these, 801 patients underwent curative resection with extended lymphadenectomy (D2). Postoperative morbidity/mortality, type of gastrectomy, mean of lymph nodes removed, pTNM stages and Survival Time and were analyzed.
Results: Sub total distal gastrectomy was performed in 511 patients and total gastrectomy in 290 patients. The mean number of lymph nodes removed was 46.48 per patient (54.91 nodes for total and 41.69 for sub total distal gastrectomy). Hospital mortality was 2.9%. 11% were Stage (TNM) IA, 9.4% stage IB, 19% stage II, 24.6% stage IIIA, 13.1% stage IIIB and 23% stage IV. Five-year actuarial survival was 47.5%. Five-year survival of patients with TNM stages IA, IB, II, IIIA, IIIB and IV were 85.8%, 79.4%, 60%, 46.7% 33% and 14.3% respectively.
Conclusions: Gastrectomy with D2 lymphadenectomy may be performed with low morbidity and mortality if the operation is performed in specialized centers with a strict quality control system, and without removing the pancreas during total gastrectomy unless it is suspected to be involved. This procedure could provide a good probability of long-term survival, even for patients with invaded regional lymph nodes.
Key words: Gastric cancer, Gastrectomy, D2 Lymphadenectomy, Survival.
INTRODUCCIÓN
Para el Cáncer gástrico localizado, la gastrectomía es el único tratamiento potencialmente curativo siempre y cuando se realice una resección R0. Si bien hay consenso en relación a la distancia que debe existir entre el tumor y el borde de sección, la extensión de la disección ganglionar es aun controversial.
Mientras en oriente se realiza la disección linfática extendida D2 con extirpación de los ganglios de la primera y segunda estación (1) en occidente la disección ganglionar es limitada, en un estudio multicentrico que evalúa el rol de la terapia adyuvante por cáncer gástrico, el 54% de los pacientes tuvo una disección D0 mientras que solo el 10% de los pacientes tuvo una resección D2. (2)
En estudios retrospectivos se reporta que la disección ganglionar D2 incrementa la sobrevida (3) pero estudios clínicos controlados (4) (5) encuentran que la D2 no produce impacto en la sobrevida y tiene mayor mortalidad post operatoria (10% para D2, 4% para D1), los 3 meta análisis publicados hasta la fecha (6) (7) (8) en los que se analiza Disección linfática extendida vs D1 reportan resultados similares.
La mayor mortalidad de la D2 se atribuye al bajo volumen operatorio, a la falta de experiencia en disección ganglionar y a la pancreato esplenectomía realizada para los tumores localizados en el cuerpo y fondo del estomago. (9)(10)
A pesar de estos resultados el interés en la disección linfática extendida no ha disminuido y actualmente se realiza en muchos centros (11)
Se postula que la disección linfática D2 puede ser de beneficio en la sobrevida si se disminuye sus tasas de morbilidad y mortalidad. (12)
En estudios recientes (13) (14) (15) la mortalidad post operatoria de la D2 está alrededor del 3%, cifra comparable con las tasas de mortalidad de las disecciones D1 de los estudios de Holanda (4) y el Reino Unido. (5)
En el Instituto Nacional de Enfermedades Neoplasicas (INEN), luego de la capacitación de algunos de los autores (E.R., J.C., E.P., J.S) en el National Cancer Center de Tokio Japon se instituyo la gastrectomía con disección linfática D2 como el tratamiento estándar para el cáncer gástrico localizado.
El presente estudio tiene por finalidad evaluar los resultados a corto y largo plazo (Morbi-mortalidad y sobrevida respectivamente) de los pacientes sometidos a gastrectomía D2 con intención de cura entre enero de 1990 y diciembre de 1999.
MATERIAL Y MÉTODOS
En la base de datos prospectiva del departamento de Abdomen del INEN se identificaron las historias clínicas de todos los pacientes a los que se les realizo una gastrectomía entre enero de 1990 y diciembre de 1999.
Criterios de inclusión:
-
Diagnostico histológico confirmado de adeno carcinoma gástrico.
-
Gastrectomía con disección linfática extendida a primera y segunda estación (D2)
-
Resección R0 (Sin tumor residual microscópico o macroscópico).
-
Un mínimo de 15 ganglios para los pacientes con metástasis ganglionar regional.
Criterios de exclusión:
-
Historia clínica incompleta.
-
Pacientes con metástasis a distancia
-
Metástasis a ganglios para aórticos o retro pancreáticos
-
Invasión de esófago o duodeno
-
Neoplasia maligna previa a excepción de cáncer de piel
-
Cáncer gástrico del muñón residual
Tipo de gastrectomía no precisable
De las historias que cumplieron los criterios de inclusión se obtuvo información respecto a: edad, sexo, tipo de cirugía, evolución post operatoria, estancia hospitalaria, profundidad de invasión del tumor, metástasis ganglionar regional, estadio TNM, fecha de muerte o condición al último control y sobrevida.
Análisis estadístico
Los datos continuos fueron expresados como mediana o promedio (+ desviación estándar) y comparados con el t test para datos no apareados. La sobrevida global se calculo por el método de Kaplan Meir, para evaluar la diferencias entre grupos se uso el Log-rank test. Las muertes hospitalarias fueron incluidas en el análisis de sobrevida global. Las diferencias fueron consideradas significativas si el valor de p fue menor de 0.05. Todos los análisis estadísticos fueron hechos en SPSS (Versión 13.0, SPS inc, Chicago, IL).
DEFINICIÓN OPERACIONAL
Los grupos ganglionares fueron identificados de acuerdo a las reglas de la Sociedad Japonesa de Investigacion del cáncer Gastrico (JRSGC) (16) Tabla I.
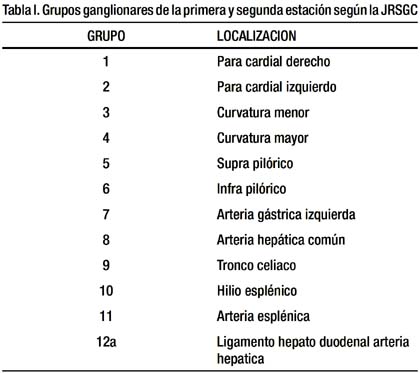
DISECCION GANGLIONAR
D0: no resección o resección incompleta de la primera estación.
D1: remoción completa de los ganglios de la primera y segunda estación
D2: remoción completa de los ganglios de la primera, segunda estación.
D3: remoción completa de los ganglios de la primera, segunda y tercera estación.
Los grupos ganglionares a resecar en una disección D2 según la localización del tumor se muestran en la Tabla II.
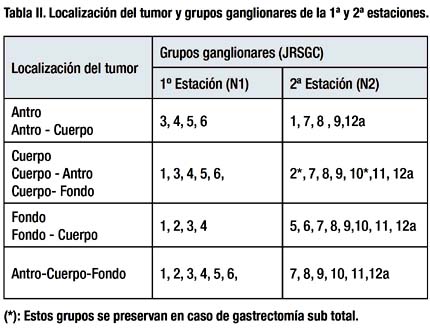
La distancia mínima entre el tumor y el borde se sección fue de 2 cm y 5 cm si el cáncer era precoz o avanzado respectivamente.
En caso de gastrectomía total se extirpo el bazo pero se preservo la cola del páncreas según la técnica descrita por Maruyama (17), la pancreatectomia distal solo se realizo cuando había infiltración tumoral de la cola del páncreas o invasión del páncreas por metástasis ganglionar macroscópica que ha penetrado o roto la capsula.
La pieza operatoria fue estudiada por un patólogo entrenado en Japón (JS), quien realizo una minuciosa descripción de los hallazgos macroscópicos, de las dimensiónes de la pieza operatoria y del tumor, del tipo de tumor y de la distancia al borde de sección.
Cada grupo ganglionar de la primera y segunda estación fue identificado, aislado y disecado meticulosamente, los ganglios encontrados fueron descritos y numerados antes de ser procesados.
En el informe anatomo patológico se consigno el tipo histológico, la profundidad de invasión, el compromiso de los bordes de sección, el número de ganglios resecado en cada grupo ganglionar (con y sin metástasis), y el número total de ganglios resecados.
La estadificación se realizo con la clasificación de la (JRSGC), para el presente trabajo los pacientes fueron re estadificados según la sexta edición de la UICC (18)
Los pacientes fueron seguidos a intervalos regulares de 3 meses durante el primer año y cuatro meses en los años siguientes; si un paciente no acudió a control en la fecha programada (perdido de vista) se trato de localizarlo a través de llamada telefónica, visita de asistenta social o búsqueda en la RENIEC.
RESULTADOS
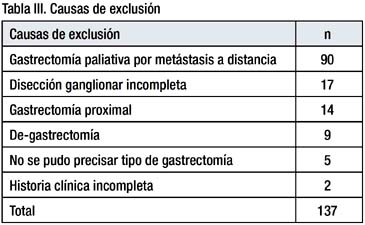
Entre enero de 1990 y diciembre de 1999, 938 pacientes tuvieron gastrectomía por cáncer gástrico, 801 pacientes cumplieron los criterios de inclusión y 137 pacientes fueron excluidos por las razones que se muestran en la tabla III.
Las características de los 801 pacientes seleccionados se exponen en la tabla IV.
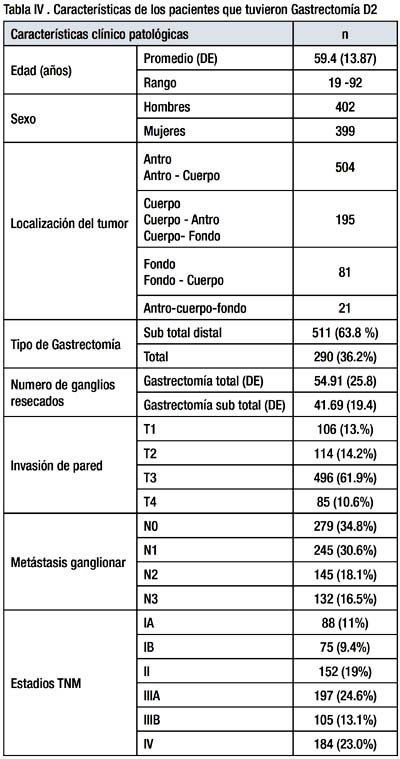
A mayor profundidad de invasión del tumor en la pared gástrica el compromiso ganglionar es mayor. Tabla V y Grafica 1.
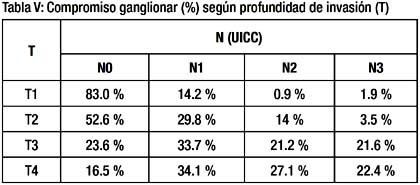
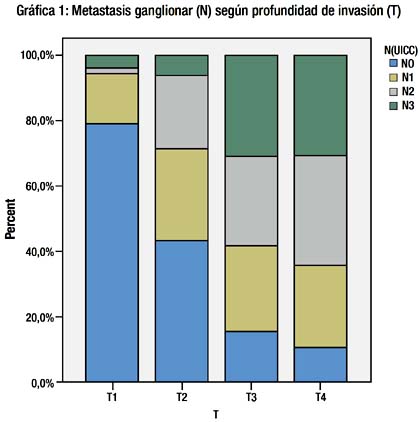
Los estadios TNM de los pacientes que tuvieron gastrectomía total D2 fueron significativamente más avanzados que los estadios de los pacientes a los que se les realizo una gastrectomía sub total D2 (p=0.01). Tabla V
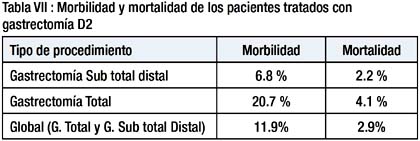
La morbilidad y mortalidad post operatoria de la gastrectomía D2 fue de 11.9% y 2.9% respectivamente, La morbilidad y mortalidad post operatoria de la gastrectomía total D2 fue significativamente mayor que la morbilidad y mortalidad post operatoria de la gastrectomía sub total D2 (p=0.00) Tabla VII
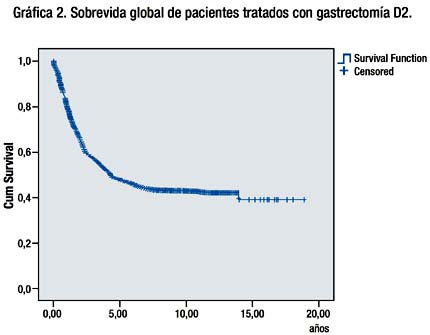
La sobrevida Global a 5 años, 10 y 15 años de los pacientes sometidos a gastrectomía D2 con intención curativa fue de 47.5%, 42.5% y 39.3% respectivamente. Grafica 2.
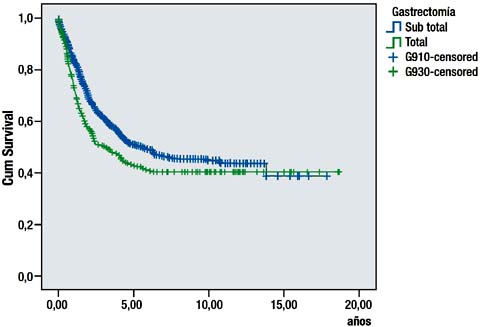
La sobrevida de los pacientes que tuvieron gastrectomía sub total D2 fue significativamente mayor que la sobrevida de los pacientes que tuvieron gastrectomía total D2. (P=0.011) Grafica 3.
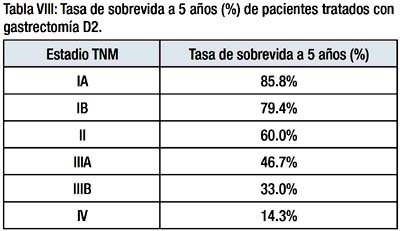
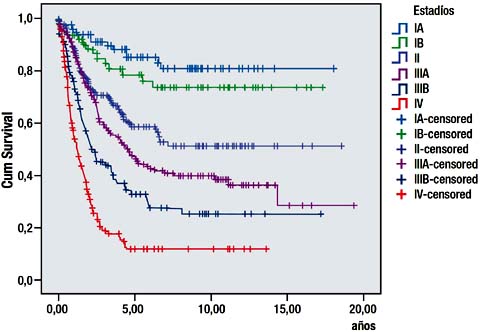
La sobrevida a 5 años de los pacientes tratados con gastrectomía D2 fue de 85.8%, 79.4%, 60%, 46.7%, 33% y 14.3% para los estadios TNM IA, IB, II, IIIA, IIIB y IV respectivamente Tabla VIII, Grafica 4.
DISCUSIÓN
El presente trabajo analiza los resultados a corto y largo plazo de 801 pacientes con cáncer gástrico localizado a quienes se les realizo una gastrectomía con disección ganglionar D2 entre 1990 y 1999, se selecciono este periodo de tiempo para que los pacientes tengan entre 7 y 15 años de seguimiento.
La disección ganglionar D2 y el estudio de la pieza operatoria se ajusto estrictamente a las reglas de la JSRGC (16) ya que miembros del equipo (cirujanos y patólogos) recibieron entrenamiento en el National Cancer Center de Tokio.
Solo el 13% de los pacientes tuvo un tumor pT1 correspondiendo el 87 % a cáncer avanzado T2-4, lo cual se debe al diagnostico tardío y a la falta de campañas de despistaje y detección precoz, esta cifra no ha variado ya que en un estudio previo (19) realizado en 2280 pacientes con cáncer gástrico admitidos al INEN entre 1980 y 1994 hallamos cáncer precoz solo en el 9.7% de los 758 pacientes que tuvieron gastrectomía. Por el contrario la prevalencia de tumores tempranos (T1) es de 50% en las series japonesas (1), 36% en el estudio del Reino Unido (5) y 26% en el estudio Holandés (4).
El promedio de ganglios resecados en una gastrectomía sub total y total (41.69 y 54.91 ganglios respectivamente), indica que la disección se ha realizado de manera sistemática y satisfactoria ya que estas cifras son superiores a los 26 ganglios sugeridos para considerar a una gastrectomía como radical.(20)
El promedio de ganglios resecados es similar al reportado por Sano (21), Siewert, (20) Wu (22), Deguili (13) y Portanova (15) quienes luego de una Gastrectomia ampliada obtienen 54,45,37,36 y 41 ganglios respectivamente.
La Mortalidad Post Operatoria (MPO) de nuestro estudio (2.9%) es:
-
Menor que la MPO para D2 y D1 de la serie de Bonenkamp(4) (10% y 4.1% ) y Cuschieri (5) (13%5 y 6.5%) respectivamente.
-
Similar a la MPO de centros de alta especialización. Siewert (20), Degiuli(13), Martin (23), Portanova (15) y
-
Mayor a la MPO reportada en Japon por Fujii (24) la cual varía entre el 0.4% y 2.7%. es necesario recalcar que Sano (21) Informa de 1000 gastrectomias consecutivas sin MPO.
La baja mortalidad de nuestra serie probablemente se debe al alto volumen operatorio de nuestro hospital, a la especialización de los cirujanos, al estricto control de calidad y manejo peri operatorio y a que resecamos la cola del páncreas solo si está infiltrada por la neoplasia o existe invasión del páncreas por metástasis ganglionar macroscópica que ha penetrado o roto la capsula.
Numerosos estudios sugieren una relación entre la mortalidad peri operatoria y el volumen hospitalario, según Enzinger(25) la MPO de la gastrectomía es menor en los hospitales de alto volumen operatorio (6.9% vs 8.7%). Hannan (26) reporta que la MPO luego de una gastrectomía es significativamente menor cuando la cirugía es realizada por cirujanos con alto volumen operatorio y Bachmann (27) encuentra que la MPO de la gastrectomía por cáncer gástrico disminuye en 41% (O.R. 0.59) por cada 10 gastrectomías adicionales que un cirujano realiza cada año.
En nuestro medio Portanova(15) encontró que la MPO de la gastrectomía por cáncer disminuye de 10.9% a 2.8% cuando esta operación se realiza una unidad quirúrgica especializada.
En la Tabla IX se comparan con nuestros resultados la MPO en relación al volumen hospitalario de algunas series (28) (4)(5)(15).
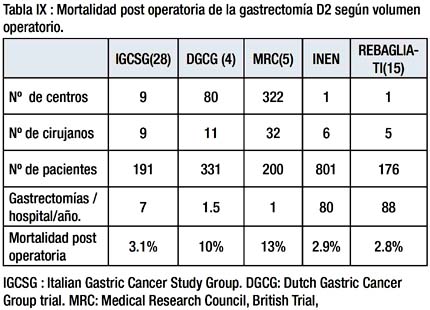
En los estudios Holandés (4) y Británico (5) se ha documentado que la alta MPO de la D2 se debe la pancreatectomia distal y esplenectomía. En 1987 Maruyama (29) demostró mediante linfografia y exámenes microscópicos que no existen en el parénquima pancreático vasos linfáticos que provengan del estomago y que era factible la remoción completa de los ganglios localizados a lo largo del borde superior del páncreas (Grupo 11) sin resecar la cola del páncreas, encontró así mismo que si después de preservar la cola del páncreas se resecaba el páncreas distal, en la pieza operatoria no se encontraba grasa ni tejido linfático.
Esto dio origen a la Gastrectomía con Preservación de Páncreas (GPP) para lo cual era necesario ligar la arteria esplénica en su nacimiento y extirparla en bloque con los ganglios y tejido graso que la rodean.- No obstante algunos pacientes presentaron necrosis pancreática probablemente por ligadura inadvertida de la arteria pancreático dorsal que irriga la cola del páncreas y que nace en el tercio proximal de la arteria esplénica.
Si se liga la arteria pancreático dorsal, la cola de páncreas se irriga a través del arco de Kirk que comunica a esta arteria con la arteria pancreático duodenal postero superior, pero el arco de Kirk solo existe en el 60% de los pacientes por lo que hay un 40% de riesgo de necrosis pancreática distal. Para evitar esta complicación se recomienda ligar a la arteria esplénica 5 cm después de su nacimiento con el fin de preservar a la arteria pancreático dorsal. (17) (30)(31)
Doglieto (30) con esta técnica reporta 180 pacientes sin necrosis pancreática y 0.6% de fistula pancreática.
Estudios posteriores como el de Furukawa (32) demostraron que entre una gastrectomía con pancreatectomia distal y una GPP no existe diferencia en el numero de ganglios resecados (4.6 ganglios vs 4.1 ganglios respectivamente) ni en la sobrevida a 5 años (76.5% vs 80%).
Postulamos que otro de los factores que explica nuestra baja MPO es que rutinariamente realizamos la Gastrectomia con preservación de páncreas limitando la esplenectomía para cuando había infiltración tumoral de la cola del páncreas o invasión del páncreas por metástasis ganglionar macroscópica que ha penetrado o roto la capsula.
Los resultados de sobrevida de nuestra serie se comparan con la sobrevida luego de disección D2 reportada por por Siewert (20), Pacelli (34), Bonenkamp (4). Sasako (1), Deguili (28) y Nakajima(33) Tabla X.
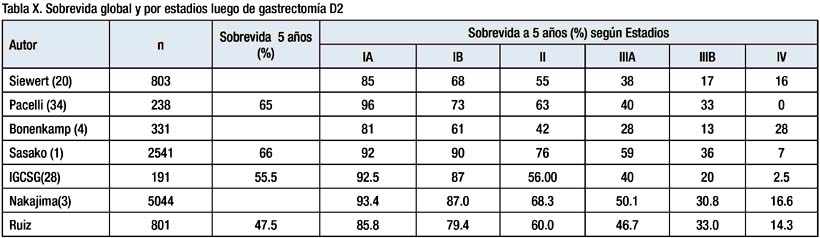
En dicha tabla se aprecia que para estadios avanzados nuestra sobrevida es similar a la reportada por Siewert (20), Deguili (28), Sasako (1) y Nakajima (33) y es superior a la sobrevida obtenida por los estudio de Holanda (4) y Reino Unido (5).
Sin embargo nuestra sobrevida para cáncer en estadios tempranos es menor que la de las series japonesas. Payet (35) en un análisis de 204 casos evaluados entre 1950 y diciembre 2000 reporta una sobrevida a 5 años (87.5%) similar a la nuestra.
En conclusión la gastrectomia con diseccion linfatica D2 puede ser realizada con baja morbilidad y mortalidad en centros especializados, con un estricto control de calidad y sin resecar la cola del páncreas a menos que este infiltrada.
La linfadenectomia D2 da una buena probabilidad de sobrevida a largo plazo, aun en pacientes con metástasis ganglionar regional.
BIBLIOGRAFÍA
1. SASAKO M, SANO T, KATAI H, MARUYAMA K (1997) Radical surgery. in: Gastric Cancer, Sugimura T, Sasako M (eds) Oxford: Oxford University Press pp 223–248
2. MACDONALD JS SAMLLEY SR, BENEDETT IJ, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001;345:725-730.
3. MARUYAMA K, OKABAYASHI K, KINOSHITA T. Progress in gastric cancer surgery in Japan and its limit of radicality. World J Surg 1987; 11: 418 – 25
4. BONENKAMP JJ, HERMANS J, SASAKO M, VAN DE VELDE CJH, for the Dutch Gastric Cancer Group Extended lymph-node dissection for gastric cancer. N Engl J Med. 1999;340: 908– 914
5. CUSCHIERI A, WEEDEN S, FIELDING J, BANCEWICZ J, CRAVEN J, JOYPAUL V, SYDES M, FAYERS P Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomised surgical trial. Br J Cancer.1999; 79(9/10): 1522–1530
6. YANG SH, ZHANG YC, YANG KH, LI YP, HE XD, TIAN JH, et al. An evidence-based medicine review of lymphadenectomy extent for gastric cancer. The American Journal of Surgery 2009; 197, 246–251
7. LUSTOSA SA, SACONATO H, ATALLAH AN, LOPES FILHO GDE J, MATOS D. Impact of extended lymphadenectomy on morbidity, mortality, recurrence and 5-year survival after gastrectomy for cancer. Meta-analysis of randomized clinical trials. Acta Cir Bras. 2008 Nov-Dec;23(6):520-30.
8. MCCULLOCH P, NITA ME, KAZI H, GAMA-RODRIGUES J.Extended versus limited lymph nodes dissection technique for adenocarcinoma of the stomach. Cochrane Database Syst Rev. 2004 Oct 18;(4):CD001964.
9. BONENKAMP JJ, SONGUN I, WELVAART K, VAN DE VELDE CJH, et al. Randomised comparison of morbidity after D1 and D2 dissection for gastric cancer in 996 Dutch patients. Lancet 1995; 345:745–748.
10. CUSCHIERI A, FAYERS P, FIELDING J, CRAVEN J, BANCEWICZ J, JOYPAUL V, COOK P Postoperative morbidity and mortality after R1 and R2 resection for gastric cancer: results of the MRC surgical trial. Lancet (1996); 347:995–999
11. MANSFIELD PF. Lymphadenectomy for gastric cancer, J Clin Oncol 2004;22:2759-2761.
12. HARTGRINK HH, VAN DE VELDE CJ, PUTTER H, BONENKAMP JJ, KLEIN KRANENBARG E, SONGUN I, et al. Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial. J Clin Oncol. 2004 Jun 1;22(11):2069-77
13. DEGIULI M, SASAKO M, CALGARO M, et al. Morbidity and mortality after D1 and D2 gastrectomy for cancer: Interim analysis of the Italian Gastric Cancer Study Group (IGCSG) randomized surgical trial EJSO Elsevier 2003: 1-6 (www. Sciencedirect.com)
14. RUIZ E, PAYET C, MONTALBETTI JA, CELIS J, PAYET E, BERROSPI F, CHAVEZ I, YOUNG F. Postoperative morbidity and in-hospital mortality of gastrectomy due to gastric adenocarcinoma: a report of 50 years. Rev Gastroenterol Peru. 2004 Jul-Sep;24(3):197-210.15. PORTANOVA M, VARGAS F, LOMBARDI E, MENA V, CARBAJAL R, PALACIOS N, ORREGO J. Results of specialization in the surgical treatment of gastric cancer in Peru. Gastric Cancer. 2007;10(2):92-7.
16. Japanese Research Society for Gastric Cancer Study in Surgery and Pathology. Jpn J Surg 1981; 11:127-139.
17. MARUYAMA K, SASAKO M, KINOSHITA T, SANO T, KATAI H, OKAJIMA K. Pancreas-preserving total gastrectomy for proximal gastric cancer. World J Surg. 1995 Jul-Aug;19(4):532-6.
18. SOBIN LH, WITTEKIND CH, editors. TNM classification of malignant tumors, 6th Ed. New York: Wiley-Liss:2002.
19. RUIZ E, BERROSPI F, MORANTE C, PAYET E, CELIS J, MONTALBETTI JA. Operabilidad y resecabilidad del cáncer gástrico: análisis de 2280 casos en 15 años Rev Gastroenterol Peru. 1997;17(2):135-142
20. SIEWERT JR, BÖTTCHER K, RODER JD, BUSCH R, HERMANEK P, MEYER HJ. Prognostic relevance of systematic lymph node dissection in gastric carcinoma. German Gastric Carcinoma Study Group. Br J Surg. 1993 Aug;80(8):1015-8.
21. SANO T, KATAI H, SASAKO M, MARUYAMA K. One thousand consecutive gastrectomies without operative mortality. B J Surg. 2002; 89: 122-123.
22. WU CW, HSIUNG CA, LO SS, HSICH MC, SHIA LT, WHANG-PENG J, et al. Randomized clinical trial of morbidity after D1 and D3 surgery for gastric cancer. Br J Surg 2004;91:283–7.
23. MARTIN R, JAQUES D, BRENNAN M, KARPEH M. Extended local resection for advanced gastric cancer. Increased survival versus increased morbidity. Ann Surg 2002;236:159–65
24. FUJII M, SASAKI J, NAKAJIMA T. State of the art in the treatment of gastric cancer: from the 71st Japanese Gastric Cancer Congress. Gastric Cancer 1999;2:151–7.
25. ENZINGER PC, BENEDETTI JK, MEYERHARDT JA, MCCOY S, HUNDAHL SA, MACDONALD JS, FUCHS CS. Impact of hospital volume on recurrence and survival after surgery for gastric cancer. Ann Surg. 2007 Mar;245(3):426-34.
26. HANNAN H, RADZYNER M, RUBIN D, DOUGHERTY J, BRENNAN MF. The influence of hospital and surgeon volumes on in-hospitalmortality for colectomy, gastrectomy, and lung lobectomy in patients with cancer. Surgery 2002;131:6–15.
27. BACHMANN MO, ALDERSON D, EDWARDS D, WOTTON S, BEDFORD C, PETERS TJ, HARVEY IM. Cohort study in South and West England of the influence of specialization on the management and outcome of patients with oesophageal and gastric cancers. Br J Surg. 2002 Jul;89(7):914-22
28. DEGIULI M, SASAKO M, PONTI A, CALVO F. Survival results of a multicentre phase II study to evaluate D2 gastrectomy for gastric cancer. Br J Cancer. 2004 May 4;90(9):1727-32
29. MARUYAMA K, OKABAYASHI K, KINOSHITA T. Progress in Gastric Cancer Surgery in Japan and Its Limits of Radicality World J. Surg. 1987;11:418425.
30. DOGLIETTO GB, PACELLI F, CAPRINO P, BOSSOLA M, DI STASI C. Pancreas-preserving total gastrectomy for gastric cancer. Arch Surg. 2000 Jan;135(1):89-94
31. PACELLI F, DOGLIETTO GB, ALFIERI S, CARRIERO C, MALERBA M, CRUCITTI P, CRUCITTI F. Avoiding pancreatic necrosis following pancreas-preserving D3 lymphadenectomy for gastric cancer. Br J Surg. 1998 Jan;85(1):125-6.
32. FURUKAWA H, HIRATSUKA M, ISHIKAWA O, IKEDA M, IMAMURA H, MASUTANI S, TATSUTA M, SATOMI T. Total gastrectomy with dissection of lymph nodes along the splenic artery: a pancreas-preserving method. Ann Surg Oncol. 2000 Oct;7(9):669-73.
33. NAKAJIMA T. Gastric cancer treatment guidelines in Japan. Gastric Cancer 2002;5:1-5.
34. PACELLI F, DOGLIETTO GB, BELLANTONE R, ALFIERI S, SGADARI A, CRUCITTI F Extensive versus limited lymph node dissection for gastric cancer: a comparative study of 320 patients. Br J Surg 1993; 80: 1153–1156
35. PAYET E. Cancer gastric precoz Tesis para optar el grado de maestria en Medicina Universidad Peruana Cayetno Heredia. Escuela de post Victor Alzamora Castro Lima Peru 2004.













