Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.29 n.2 Lima abr./jun. 2009
ARTÍCULOS DE REVISIÓN
Historia natural de la infección crónica por el virus Hepatitis B
Natural history of chronic Hepatitis B virus infection
Herman Vildózola Gonzales1 ; Jorge Luis Salinas1
1 Instituto de Medicina Tropical "Daniel A. Carrión". Universidad Nacional Mayor de San Marcos. Lima, Perú.
RESUMEN
En los últimos años se han dado notables pasos en el entendimiento de la biología del virus de la hepatitis B (VHB), su historia natural e inmunopatogénesis, mientras que se implementaron exitosos programas de vacunación universal en diferentes partes del mundo y se hicieron importantes avances en la terapéutica antiviral. Sin embargo, La infección por el VHB sigue siendo un problema de salud pública, con cerca de 350 millones de portadores a nivel mundial. La historia natural de la hepatitis B crónica y el espectro de sus formas clínicas son complejos y variables.
Revisamos la historia natural de la infección crónica por VHB describiendo las fases replicativa temprana y tardía o no-replicativa (portador inactivo) en los pacientes con adquisición del virus en la adultez y las fases Inmunotolerante, de Inmunoaclaramiento y la no-replicativa en los pacientes que adquirieron el virus en el periodo perinatal. También se pone énfasis en el curso de la hepatitis HBeAg negativa y la hepatitis B oculta. La complejidad de la historia natural del VHB depende de las características del virus, el comportamiento de los hepatocitos y la respuesta inmunitaria del paciente. Los factores intrínsecos y extrínsecos al VHB asociados en la progresión a la cirrosis y el carcinoma hepatocelular también son revisados.
Palabras clave: Hepatitis B, Historia natural, cirrosis hepática, carcinoma hepatocelular.
ABSTRACT
In the last years notable steps have been done towards the understanding of the biology of Hepatitis B Virus (HBV), its natural history and immunopathogenesis, while succesful universal vaccination programs were implemented around the world and important advances in antiviral therapeuthics occurred. Nevertheless, HBV infection remains a public health problem with nearly 350 million carriers worlwide. The natural history of chronic hepatitis B and the spectrum of its clinical forms are complex and variable.
We review the natural history of chronic HBV infection describing the early replicative phase and late or non-replicative (inactive carrier) in those patients who adquired the infection during adulthood and the immune tolerant phase, immune clearance and non-replicative in those who acquired the infection in the perinatal period. Emphasis is made in the course of HBeAg negative chronic hepatitis and occult hepatitis B. The complexity of the natural history of hepatitis B depends on viral features, hepatocyte behavior and patient immune response. The intrinsic and extrinsic HBV factors associated with the progression to cirrhosis and hepatocellular carcinoma are also reviewed.
Key words: Hepatitis B, Natural history, liver cirrhosis, hepatocellular carcinoma.
INTRODUCCIÓN
En las últimas décadas ha mejorado de manera notable nuestro conocimiento del virus, de la historia natural y la inmunopatogénesis de la infección crónica por el virus de hepatitis B (VHB); así mismo se ha incrementado el arsenal terapéutico con agentes antivirales efectivos(1); adicionalmente se implemento en mas de 160 países programas eficaces de vacunación universal; aun así todavía hay mas de 350 millones de personas con infección crónica en todo el mundo, 75% de los cuales se encuentran en la región Asia-Pacifico (2)
Los grandes aportes a la epidemiología y la clínica de la infección por el VHB incluye la diferenciación de estas variables de la infección entre las áreas de alta y baja endemicidad. En áreas de alta endemicidad, tales como el sudeste asiático, la infección ocurre predominantemente en el periodo perinatal o en la niñez temprana con una alta tasa de infección persistente (3); que puede llegar hasta el 90% en niños nacidos de madres altamente infecciosas con antígeno de superficie(HBsAg) y antígeno e (HBeAg) positivos y en aproximadamente 30% en niños infectados después del periodo neonatal, pero antes de los 5 años de edad(4,5) mientras en las áreas de baja endemicidad, como los países del oeste, la hepatitis B es una enfermedad primariamente de adolescentes y adultos como resultado del alto riesgo de la actividad sexual y el uso de drogas intravenosas (6) con una tasa de portadores crónicos entre 1 % y 5%(7). Vemos pues que la historia natural de la infección crónica por el VHB esta determinada por varios factores del huésped y del virus; respecto a este ultimo, en los pasado 20 años se ha identificado una variabilidad genética del VHB, que ha permitido clasificarlo en ocho genotipos (A-H), sobre la base de la diferencia de la secuencia de los nucleótidos, observándose que esos genotipos tienen una típica distribución geográfica, además de diferente patogenicidad y epidemiología (8)
El espectro clínico de la infección crónica varia de portadores inactivos del VHB a formas severas de enfermedad hepática crónica, las que pueden llegar a la cirrosis y el estadio final de la enfermedad en aproximadamente 14% a 40%(9), haciendo de este virus la cuarta causa de muerte por enfermedades infecciosa a nivel mundial(10)
La complejidad de esta enfermedad en sus diferentes aspectos y los nuevos conocimientos sobre el virus de hepatitis B, ameritan una revisión de su historia natural lo que nos permitirá comprender mejor la enfermedad y desarrollar estrategias terapéuticas más eficaces.
HISTORIA NATURAL DE LA INFECCIÓN CRÓNICA POR EL VHB
El espectro de la infección aguda por el VHB varía de infección asintomática y hepatitis auto limitada a hepatitis fulminante y depende de varios factores relacionados con el virus y el huésped. La hepatitis sintomática es rara en neonatos (menos de 1%) y ocurre en aproximadamente 10% de niños de 1 a 5 años de edad (2,4). La hepatitis fulminante es muy rara en pacientes pediátricos, y los casos reportados en su mayoría han sido en infantes nacidos de madres portadoras crónicas de HBsAg y HBeAg negativo(11). Por el contrario en los adultos la hepatitis sintomática se presenta en un tercio de los pacientes, mientras que el restante 65% lo hace en forma subclínica (4,12), y la hepatitis fulminante lo hace en menos del 1% de los casos con una mortalidad de 70% (1) La explicación para la forma fulminante en infantes y adultos es diferente; mientras que en los primeros se aduce que la ausencia de HBeAg en la sangre materna representa una falla para inducir una tolerancia inmunológica(13), permitiendo así un vigoroso aclaramiento inmune del VHB en el hígado del infante; en el adulto se relaciona a una respuesta inmune aumentada con un rápido aclaramiento viral, que significa que el HBsAg y el DNA HVB en el suero, pueden ser indetectables en el momento de la presentación clínica y el diagnostico se hace solo por la presencia de anti-HBc IgM (14)
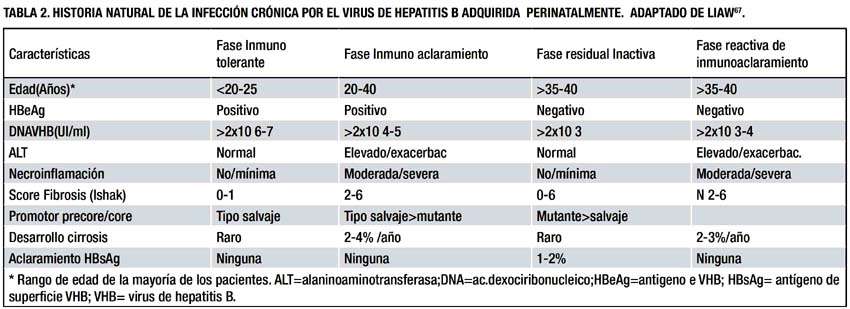
El VHB no es usualmente citopático por si mismo: la injuria hepática en la hepatitis crónica B se considera el resultado de la respuesta inmune del huésped contra el VHB, del tipo de un antígeno restringido de HLA-clase I, respuesta mediada de linfocitos citotóxicos contra antígenos del VHB, expresados sobre los hepatocitos con apoptosis y necrosis resultante(15); por lo que la infección crónica por el VHB es un estado dinámico de interacciones entre el VHB, los hepatocitos y el sistema inmune de los pacientes; por lo tanto el curso natural de la infección crónica del VHB, adquirida perinatalmente o en la fase temprana de la niñez tiene tres fases: Inmunotolerante, inmunoaclaramiento y residual inactiva (16); la infección crónica adquirida en la edad adulta tiene un curso clínico similar, excepto que no hay la fase inmunotolerante de manera obvia o es muy corta (17,18). Aparte de la biología molecular del VHB y los factores del huésped, la co-infección con otros virus de hepatitis, por ejemplo, el virus de hepatitis C, Delta, así como otros virus no primariamente hepatotrópicos como el virus de la inmunodeficiencia humana (VIH), pueden afectar el curso natural de la infección por el VHB, y también la eficacia de la estrategia antiviral (19).

Fase inmunotolerante
Es caracterizada por HBsAg y HBeAg circulante, y altos niveles de DNA-VHB en el suero (> 2x10 6-7 UI/mL o > 10 7-8 copias /ml); la infección adquirida perinatalmente o en la niñez temprana tiene una larga fase inmunotolerante, que puede durar varias décadas (1, 6,16, 18) y puede representar la fase mas temprana de la infección crónica(12); estos pacientes suelen estar asintomáticos, y tienen aminotransferasas normal o ligeramente elevadas, y mínima actividad histológica, lo que implica que hay una falta o muy débil respuesta inmune contra los hepatocitos infectados(6,16, 20,21); los mecanismos que facilitan la perdida de la fase inmunotolerante son desconocidos, pero la carga viral elevada de la madre parece aumentar el riesgo de infección persistente de los infantes; por otra parte los mutantes que no producen HBeAg fueron detectados en los infantes con hepatitis benigna y fulminante y en sus madres, indicando que la heterogenicidad genómica del VHB no juega un mayor rol en el resultado clínico de la infección perinatal (22-24).
En los países de alta endemicidad, como los países asiáticos, la tasa de seroconversión del HBeAg en niños es muy baja, menos del 2% durante los primeros 3 años de edad y entre 4-5% en niños mayores de 3 años (25). Un reciente estudio (20) en 57 pacientes en la fase inmunotolerante seguidos por 5 años demostró que los pacientes que permanecieron con aminotransferasas persistentemente normales son menos propensos a tener una progresión de la enfermedad. Los niveles de aminotranferasas al momento de la biopsia de seguimiento (5 años) se correlacionaron positivamente con un incremento de la tasa de progresión a la fibrosis, indicando que la tasa de progresión a la fibrosis aumenta una vez que esos pacientes progresan a la fase de inmunoaclaramiento. Otro importante hallazgo de este estudio es que los pacientes en la fase inmunotolerante que tengan sus niveles de aminotransferasa cercanos al límite normal alto, tienen más probabilidades de progresar a la fase de inmunoaclaramiento.
Fase de Inmunoaclaramiento o inmunoactiva
La transición de la fase inmunotolerante a la fase de Inmunoaclaramiento o inmunoactiva, hepatitis crónica B típica con activación de la enfermedad, puede ser abrupta y remedar una hepatitis aguda (26); esta fase usualmente se desarrolla durante la adolescencia o la adultez y se caracteriza por actividad continua o exacerbaciones agudas episódicas con elevaciones de las aminotransferasa por encima de 5 veces el valor normal alto, algunas veces complicado con descompensación hepática (15) el patrón serológico de estos pacientes es HBsAg y HBeAg positivos, bajos niveles de DNA VHB y niveles elevados o fluctuantes de aminotransferasa e histológicamente presentan fenómenos necroinflamatorios moderados o severos y una progresión mas rápida a la fibrosis(27,28).
Un evento clave en la historia natural de la hepatitis crónica B HBeAg positivo es la seroconversión del HBeAg. Varios estudios longitudinales conducidos en cohortes de pacientes con hepatitis crónica HBeAg positivo han mostrado que la seroconversión de HBeAg a anti-HBe con marcada reducción de la replicación de VHB esta asociado con regresión bioquímica e histológica de la actividad inflamatoria en la mayoría de pacientes (29-34). La mejoría histológica ocurre gradualmente meses a años después de la seroconversión del HBeAg (35). La incidencia anual de seroconversión espontánea del HBeAg esta en el rango de 2-15%, dependiendo de factores tales como la edad, el nivel de aminotransferasas y el genotipo de VHB (15, 36), así los niños asiáticos presentan las tasa mas bajas de seroconversión espontánea durante los primeros 3 años (menos de 2%), que se incrementa a 4-5% en niños mayores de 3 años (25). En general pacientes con genotipo A y B tienen seroconversión de HBeAg a menor edad, comparado con aquellos infectados con genotipo D y C del VHB (36-39). La seroconversión es seguida por la remisión clínica (infección VHB crónica inactiva) en la mayoría de pacientes; sin embargo, la hepatitis activa puede recurrir debido a HBeAg seroreversión u ocurrencia de hepatitis HBeAg negativa (40). La incidencia anual estimada de recurrencia de hepatitis fue 2.2-3.3%(34,41), siendo mas alta en hombres, infectados con genotipo C, y aquellos que tienen la seroconversión de HBeAg después de los 40 años de edad (42).
Un reciente estudio de seguimiento de "portadores inactivos" en quienes el inicio de la seroconversión de HBeAg fue desconocido, por un periodo largo (promedio 12.3 años) que incluyo 1,214 sujetos, demostró una incidencia anual de 1,5%, siendo significativamente mucho mas bajo (0.9%/año) en pacientes mas jóvenes, especialmente aquellos menores de 30 años (41). Todos estos hallazgos sugieren que la seroconversión HBeAg más temprana o una fase HBeAg positiva mas corta está asociada con una mayor chance de remisión sostenida. Otro estudio prospectivo en pacientes asiáticos demostró que aproximadamente el 70% de las exacerbaciones con cambios histológicos compatibles con necrosis en puente, algunas veces asociado a niveles elevados de alfa feto proteína, son seguidos por seroconversión de HBeAg,comparado con el 20 % de exacerbaciones agudas sin seroconversión(43). Estas exacerbaciones temporales de hepatitis son usualmente asintomáticas y frecuentemente no reconocidas, pero en algunas ocasiones se acompañan de síntomas de hepatitis aguda y muy raramente, principalmente en pacientes con enfermedad hepática crónica ligeramente compensada, puede llevar a descompensación hepática y aun muerte debido a necrosis masiva (44)
Fase inactiva residual o portador inactivo
Siguiente a la seroconversión de HBeAg la mayoría de los pacientes entran a la fase inactiva residual o portador inactivo con aminotransferasa sostenidamente normal, niveles bajos de DNA VHB (< 2000 UI/ml), HBsAg y anti-HBe positivos y ninguno o mínimos cambios histológicos necro-inflamatorios, aunque algunos de ellos pueden haber desarrollado fibrosis avanzada o cirrosis (16, 34, 45,46)
Seroaclaramiento espontáneo de HBsAg puede ocurrir después de la seroconversión de HBeAg. Un estudio reciente de 11 años de seguimiento en 1965 sujetos asintomáticos anti-HBe positivos (edad de 16 a 76 años; mediana de 34) demostró una tasa anual de seroaclamiento del HBsAg de 1.2%.que aumento a 1.8% en aquellos pacientes mayores de 50 años al entrar al estudio y una tasa de seroaclaramiento de HBsAg acumulado de 8% a los 10 años, que aumento a 25% a los 20 años y 45% a los 25 años de seguimiento (3).Sin embargo en áreas hiperendémicas la tasa de aclaramiento es mas baja, 0,05 a 0,8% por año, donde la infección es principalmente adquirida perinatalmente o en los primeros años de la vida(47-49); los portadores inactivos pueden tener hasta 20% de exacerbaciones de hepatitis con elevación de los niveles de aminotransferasas a 5-10 veces el limite superior normal, con o sin seroreversion a HBeAg(50-53). En general en esta fase se tiene el control inmunológico de la infección, lo que confiere un resultado favorable a largo plazo(54) El aclaramiento de HBsAg usualmente confiere excelente pronostico(55).
Fase de Hepatitis B Crónica HBeAg negativa
El estado de portador inactivo generalmente tiene un curso benigno, pero puede ser reactivado espontáneamente o por inmunosupresión (56-58). En realidad hasta un tercio de pacientes van a otra transición, con incremento del DNA VHB (100,000 a 1 millón de copias por mililitro) y elevación de las aminotransferasas y de la actividad de la enfermedad sin reaparición del HBeAg (34). Esta fase es referida como Fase de Hepatitis B Crónica HBeAg negativa y su consecuencia puede ser tan severa (o más) que la enfermedad HBeAg positiva(59).La base molecular para esta forma de la enfermedad parece ser el desarrollo de una variante del VHB que es incapaz o solo pobremente capaz de producir HBeAg(59-61). La mayoría de estos pacientes tienen una variante en la región precore o promotor del core (62-64). La mas común mutación precore es un cambio de G a A en el nucleótido 1896 (G1896A) que impide la producción de HBeAg (65); la forma de hepatitis crónica B HBeAg negativa es mas frecuente con los genotipos B, C y D y menos frecuentes con el genotipo A(61) y es caracterizada por marcadas fluctuaciones en los niveles séricos de DNA VHB y aminotransferasas (59,60).
La hepatitis crónica B HBeAg negativa esta asociada con bajas tasa de remisiones espontáneas prolongadas de la enfermedad. Es importante y algunas veces difícil de distinguir al verdadero portador inactivo de pacientes con hepatitis B HBeAg negativo. El primero tiene buen pronóstico y muy bajo riesgo de complicaciones, en cambio el segundo tiene enfermedad activa con alto riesgo de progresar a fibrosis avanzada, cirrosis y subsecuente complicaciones como cirrosis descompensada y carcinoma hepatocelular (54), la distinción de estas dos situaciones clínicas requiere un cuidadoso monitoreo como mínimo de un año de seguimiento con determinación de los niveles de aminotransferasas y DNA VHB cada tres meses, lo que permite detectar las fluctuaciones de actividad en pacientes con hepatitis crónica B HBeAg negativo activo(66); en este caso también es importante descartar otras causas concomitantes o sobre impuestas de enfermedad hepática como superinfección por otros virus de hepatitis, abuso de alcohol o uso de drogas hepatotóxicas o enfermedad hepática autoinmune o metabólica(7,50,66). Pacientes HBeAg negativos asintomáticos con DNA VHB > 2,000 UI/ml y aminotransferasa normales pueden desarrollar exacerbaciones de la hepatitis y progresión de la enfermedad similar a los HBeAg positivos (34,36, 68-70). Finalmente siendo la inmunopatogénesis de la hepatitis HBeAg negativa similar a la HBeAg positiva, esta fase se puede ver como una variante de la fase de inmunoaclaramiento (1) y es mas común en los países mediterráneos, medio este y Asia (7,66), pero se ha descrito en todo el mundo(71)
Fase HBsAg negativo o Hepatitis B oculta
El aclaramiento sérico del HBsAg usualmente confiere un excelente resultado a largo plazo si no hay cirrosis pre-existente o superinfección viral (55,72); sin embargo una pequeña cantidad de DNA VHB puede persistir constituyendo la Fase HBsAg negativo o Hepatitis B oculta (73). Biológicamente el aclaramiento del virus es clásicamente caracterizado por la emergencia del anticuerpo anti-HBs en el perfil serológico; sin embargo el virus puede perpetuarse debido a su peculiar ciclo de vida, que permite la conversión del genoma del VHB en un DNA circular cerrado covalentemente (cccDNA), un intermediario replicativo del VHB que persiste de por vida en el núcleo de las células como un episoma cromatinizado y que sirve como modelo para la trascripción del gen (74,75). La estabilidad y larga persistencia de las moléculas virales cccDNA (76,77) junto con la larga vida media de los hepatocitos implica que la infección con VHB, una vez que ha ocurrido podría continuar toda la vida (78).
Una pregunta que aun no tiene respuesta es porque los portadores de VHB oculta son HBsAg negativos a pesar de la presencia de episoma en el hígado, de genomas libres. Hay varias posibilidades, desde variantes del virus que producen una proteína S modificada, indetectable por los métodos actuales, o mutaciones capaces de inhibir la expresión del gen S y/o la replicación del virus (79-82). Lo mas aceptado actualmente es que la infección oculta parece ser principalmente debido a una fuerte supresión de la replicación viral y la expresión del gen que afecta a los virus cuya variabilidad genética es comparable a la de las cepas de VHB de individuos con infección crónica VHB "abierta"(83). Esta afirmación tiene algún respaldo en diferentes reportes que afirman que la infección oculta VHB puede ser transmitida experimentalmente a chimpancés y por transfusión de sangre o transplante de órganos a humanos, induciendo una hepatitis B aguda clásica en el recipiente (84-89), y los portadores de VHB oculta pueden mostrar una reactivación aguda de la infección con la reaparición del perfil serológico típico de hepatitis B, cuando reciben quimioterapia sistémica, radioterapia o inmunoterapia (90-95)Todas esta afirmaciones sobre la transmisibilidad y reactivación de la hepatitis B oculta son en parte aceptadas, por lo menos teóricamente, aunque requiere posterior evaluación, como concluyeron los expertos reunidos recientemente en Italia(95)
Es importante considerar en la génesis de la hepatitis B oculta, la llamada interferencia viral, como un factor que influencia negativamente la replicación del VHB y la expresión del gen. Esto se ha observado en la coinfección con otros virus, como es el caso de la coinfección con el virus de hepatitis C (VHC), donde se ha encontrado la mas alta prevalencia de HVB oculta y en estudios in Vitro donde se demostró claramente que la proteína core del VHC fuertemente inhibe la replicación del VHB (96-98); También se ha reportado alta prevalencia en drogadictos endovenosos(99), hemofílicos(100); por el contrario hay resultados divergentes en pacientes en hemodiálisis con prevalencias que van de 0 a 36% (101-106) y en pacientes con VIH(73,74). Se podría concluir que la relevancia clínica de la hepatitis B oculta radica en el impacto en diferentes situaciones como la posibilidad de transmisión de esta infección, la reactivación, el efecto que pudiera tener en pacientes con enfermedad hepática crónica y la probabilidad de relacionarse con el carcinoma hepatocelular(73)
Progresión a la Cirrosis y Factores de Riesgo
Las secuelas de la infección crónica por el VHB comprenden un amplio rango clínico que va de un estado de portador crónico inactivo al desarrollo de cirrosis, descompensación hepática y carcinoma hepatocelular. (CHC)
Como sabemos la fase de inmunoaclaramiento ocurre en la adolescencia tardía o en la adultez y puede mantenerse por años o décadas. Los eventos clínicos e histológicos ocurridos durante esta fase, como la severidad, extensión y frecuencia del daño hepático, frecuentemente determinan el resultado, incluyendo el desarrollo de cirrosis (65,107-109)
Un estudio prospectivo que incluyó 684 pacientes con infección crónica VHB demostró que la cirrosis se desarrollaba a una incidencia estimada anual de 2.1% y la edad, la extensión (necrosis en puente), severidad, frecuencia de las exacerbaciones y la duración de las alteraciones hepáticas lobulares fueron los factores para el resultado de la enfermedad y el aclaramiento del VHB (107). Pacientes con infección crónica VHB con HBeAg persistentemente positivo tenían una incidencia aun más alta (3,5% por año) de cirrosis (110).
Otro estudio demostró que el 23% de pacientes con hepatitis HBeAg negativo progresaron a cirrosis durante un periodo de seguimiento de 9 años (rango1-18.4) (34). Un reciente estudio hecho en Corea, con un seguimiento de 120 meses en promedio, incluyendo 188 pacientes (52 HBeAg negativos) demostró que la edad y la elevación persistente de aminotranferasas son factores independientes para el desarrollo de cirrosis, descompensación y carcinoma hepatocelular (111). En otro estudio en Montreal, de 16 años de seguimiento a 317 pacientes donantes de sangre HBsAg positivos, mostró que solo tres pacientes murieron de cirrosis relacionada al VHB y ninguno desarrollo carcinoma hepatocelular (112) Otro reporte incluyo 296 potenciales donantes de sangre que fueron excluidos de la donación por ser HBsAg positivos, fueron seguidos por 30 años. La incidencia de enfermedad hepática clínicamente significante, carcinoma hepatocelular u otra morbilidad o mortalidad relacionada no fue significativamente mayor que en la población de control de donantes VHB negativos (58).
El riesgo de progresión parece ser mayor en pacientes que progresan de una fase inmunotolerante a una de inmunoaclaramiento (20), en pacientes que tiene una seroconversión de HBeAg retardada (113), y en pacientes que han tenido reactivación de la replicación de VHB después de seroconversión de HBeAg (32, 42,48).
Los factores que influencian la supervivencia fueron estudiados en 98 pacientes con cirrosis compensada HBsAg positivo (114) La tasa de supervivencia a los 5 años fue significativamente mas baja en pacientes HBeAg positivos (72 versus 97 % en aquellos HBeAg negativos). El aclaramiento de HBeAg fue asociado con una disminución de 2.2 veces en la tasa de muerte. Similares resultados fueron notados en una serie de 366 pacientes europeos con cirrosis compensada HBsAg positivo: la tasa de supervivencia a los 5 años fueron 77 y 88% en pacientes HBeAg positivos y negativos respectivamente (115). Otros factores independientes asociados con una pobre supervivencia fueron la mayor edad, hipoalbuminemia, trombocitopenia, esplenomegalia e hiperbilirrubinemia. La remisión bioquímica y el aclaramiento de HBeAg o DNA VHB del suero fueron asociados significativamente con una mas alta tasa de sobrevida.
También se ha estudiado la concurrencia de otras condiciones clínicas como factores predisponentes para el empeoramiento de la hepatitis B crónica como la hepatitis Delta, hepatitis C, o el virus de la inmunodeficiencia humana o el abuso concomitante de alcohol. Los bebedores fuerte incrementan el riesgo de progresión a cirrosis en 6 veces(116). La infección concurrente de VHB y VHC en pacientes con hepatitis crónica B ha sido reportado que ocurre aproximadamente en 10-25% de pacientes, particularmente en drogadictos, por lo que dicho grupo requeriría ser evaluado para infección por VHC (117,118).
Estudios en Asia sugieren que genotipo C del VHB esta asociado con un riesgo mas alto de desarrollar cirrosis que genotipo B y datos preliminares sugieren también que el genotipo C, pero no el promotor core o mutaciones precore, se correlacionan con más severidad de la enfermedad en pacientes con hepatitis crónica HBeAg negativo (119,120).
Finalmente en la historia natural de la hepatitis crónica B, la transición de cirrosis compensada a descompensada tiene importantes implicancias pronosticas. Cada año 5-7% de casos de cirrosis relacionada al VHB pasa del estadio compensado al descompensado (121) Una vez que empieza el estadio descompensado, el resultado es pobre. En un estudio, 30 de 93 pacientes murieron después de desarrollar varices esofágicas durante el periodo de 131 meses de observación (supervivencia media de 20 meses) (122). Otros estudios han reportado una supervivencia media de 2-3 años después de la aparición de la ascitis (123,124). Otro estudio en 203 pacientes con cirrosis descompensada con ascitis, seguidos por 80 meses promedio después de su primera descompensación ascitica, tuvieron una sobrevida media de 12.4 meses y los factores pronósticos que se correlacionaron independientemente fueron, la clasificación Child-Pugh B/C, recuento leucocitario (> 10,000x mm3), la creatinina sérica (>1.5 mg/dl), el sodio sérico (< 135 mEq/L) y la ausencia de terapia antiviral (125).
Desarrollo de Carcinoma Hepatocelular
La infección crónica por el VHB y la cirrosis hepática son factores de riesgo bien reconocidos para carcinoma hepatocelular (CHC) (126); este cáncer es uno de los mas comunes a nivel mundial, y alrededor del 75% de los cuales son relacionados a la infección crónica por el VHB. La incidencia de carcinoma hepatocelular se ha incrementado en todo el mundo y en nuestros días constituye el quinto cáncer mas frecuente, representando alrededor del 5% de todos los canceres en el mundo (127) En las áreas de alta endemicidad la incidencia de tumor es 0,1 por 100 personas año para pacientes portadores crónicos del HBsAg asintomáticos (128,129) y aproximadamente 1.0 por 100, personas año con hepatitis crónica no tratadas, sin cirrosis pre-existente al diagnostico (130,131).
Varios estudios han demostrado que el riesgo de carcinoma hepatocelular es mucho mas alto en pacientes que son HBeAg positivos comparado con aquellos que son HBsAg positivos pero HBeAg negativos. Uno de los estudios prospectivos mas grandes, que incluyo 11,893 varones quienes fueron evaluados para HBsAg y HBeAg al enrolarse en el estudio y fueron seguidos por 10 años.; en ese periodo hubieron 111 casos de carcinoma hepatocelular (CHC)(132). La incidencia fue significativamente mas alta en aquellos HBsAg y HBeAg positivos comparado con aquellos solo HBsAg positivos (324 versus 39 por 100,000 personas año).
Otro factor de riesgo independiente parece ser el nivel elevado de DNA VHB (133,134). En un estudio basado en la comunidad en Taiwán que incluyo una cohorte de 3653 pacientes que fueron HBsAg positivo y anti HVC (antihepatitis C) negativo, el carcinoma hepatocelular (CHC) se desarrolló en 164 pacientes durante un promedio de seguimiento de 11 años (133). Una mas alta incidencia de CHC fue asociado con el nivel de DNA VHB a la entrada al estudio, en un rango de 108 a 1152 casos por 100,000 personas año para niveles de DNA VHB de <300 y > 1 millón de copias/ml, respectivamente. Los autores concluyen que los niveles > 10,000 copias/ml fueron asociados con un significativo incremento del riesgo de CHC. También sugieren que el tratamiento será administrado a portadores de HBsAg con niveles séricos de DNA VHB > 10,000 copias/mL, independiente del nivel de las transaminasas, como una manera de prevenir el CHC.
Un reciente estudio en 1,536 nativos de Alaska con infección crónica ha demostrado que la media de edad para el aclaramiento de HBeAg fue menos de 20 años para los genotipos A, B, D y F, pero mas de 40 años para genotipo C y los pacientes con genotipo C y F tenían significativamente mas frecuente reversión de HBeAg y mas alto riesgo de CHC (38). Esto podría ser importante para nuestro país, a la luz de un estudio reciente de 12 pacientes con infección aguda por el VHB, provenientes de las áreas endémicas, en los cuales se encontró en todos los pacientes el genotipo F subtipo adw4 y que podría explicar la alta incidencia de carcinoma hepatocelular relacionada a hepatitis B en pacientes de esas áreas (135).-Varios estudios han demostrado que genotipo C es mas propenso al desarrollo de CHC, comparado con genotipo B, que esta asociado con seroconversión espontánea de HBeAg a una edad mas joven, menos enfermedad hepática activa, progresión mas lenta a la cirrosis y menos frecuente CHC (36,38,39, 134,136-139)
CONCLUSIONES
El virus de la hepatitis B puede causar hepatitis aguda, fulminante, crónica, cirrosis y hepatocarcinoma.
La infección adquirida perinatalmente o en los primeros años de vida es subclínica y anictérica. Hasta 90% de infantes quedaran como portadores crónicos, comparado con 30% de aquellos infectados después del periodo perinatal pero antes de 5 años. La infección adquirida en la adultez tiene 1% a 5% de evolución a la cronicidad.
La infección crónica por el VHB es un estado dinámico de interacciones entre el virus, los hepatocitos y el sistema inmune de los pacientes. Clásicamente se consideran 3 fases en el curso natural de la enfermedad. Sin embargo hay dos situaciones clínicas consideradas como fases por su comportamiento evolutivo que son la fase de Hepatitis B crónica antígeno e negativo y la hepatitis B antígeno superficie negativa o Hepatitis B oculta. Estas fases no necesariamente son secuenciales.
Las secuelas de la infección crónica son la cirrosis, la descompensación, y el carcinoma hepatocelular, los cuales tienen como factores de riesgo fundamentalmente la edad de inicio de la infección, los niveles séricos de DNA viral, la persistencia de la elevación de las aminotransferasas, el genotipo C y F y la concurrencia de otras infecciones como el virus hepatitis Delta, Hepatitis C y el Virus de la Inmunodeficiencia Humana además de la ingestión crónica del alcohol.
BIBLIOGRAFIA
1. LIAW YF, CHU CM. Hepatitis B virus Infection. Lancet 2009 vol 373(9663):582-592
2. LAVANCHY D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures J Viral Hepat 2004; 11: 97-107
3. CHU CM, LIAW YF HBsAg seroclearence in Asymptomatic Carriers of High Endemic Areas: Appreciably High Rates During a Long-Term Follow-Up. Hepatology 2007 ; 45.1187-1192
4. MCMAHON BJ, ALWARD WLW, HALL DB et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis 1885;151: 699-603
5. CHANG MH. Natural history of hepatitis B infection in children. J Gastroenterol Hepatol 2000;15(suppl):E11-19
6. FATTOWICH G. natural history and Prognosis of Hepatitis B Sem. Liver Dis 2003; 23:47-58
7. LOK AS, Heathcote EJ, Hoofnagle JH. Management of hepatitis B. 2000-summary of a workshop. Gastroenterology 2001; 120:1828-1853
8. WIWGARD J, HASENCLEVER D, TILLMANN HL. Should treatment of hepatitis B depend on hepatitis B genotypes? A hypothesis generated from an explorative analysis of published evidence. Antivir Ther 2008;13: 211-220
9. MADDREY WC. Hepatitis B: an important public health issue. J Med Virol 2000; 61:362-366
10. DEVESA M, LOUREIRO C. variabilidad genética del virus de la hepatitis B y sus implicancias. Acta Cient Soc Ven Bioanal Esp 2000; 61(1-2):13-28.
11. CHEN HL, CHANG CJ. Pediatricffulminant hepatic failure in endemic areas of hepatitis B infection. 15 years after universal hepatitis B vaccination. Hepatology 2004;39:58-63.
12. HOOFNAGLE JH, SEEFF LB, BALES AB et al Serological response in HB. In Vyas GN, Cohen S, Schmid R editors. Viral hepatitis: Etiology, Epidemiology, pathogenesis and Prevention. Philadelphia. Franklin Institue press. 1978:219-244.
13. FRIEDT M, GARNER P, LAUSCH E et al Mutations in the basic core promoter and precore region of hepatitis B virus and their selection in children with fulminant and chronic hepatitis B Hepatology 1999;29:1252-58.
14. SUMMERS J, MASON WS, replication of the genome of a hepatitis B-like virus by reverse transcription of an RNA intermediate. Cell 1982;29: 403-415
15. LIAW YF. Hepatitis flares and hepatitis e antigen seroconversion: implication in anti-hepatitis B virus therapy. J Gastroenterol Hepatol 2003;18: 246-52
16 CHU CM, KARAYIANNIS P. FOWLER MJF et al. N Natural history of chronic hepatitis B virus infection in Taiwan: Studies of hepatitis DNA in serum. Hepatology 1985;5: 431-4
17. LAI CL, RATZIU V, YUEN MF et al Viral hepatitis B. Lancet 2003 ; 362: 2089-2094
18. CHU CM, LIAW YF. Natural history differences in perinatally versus adult-acquired disease. Curr Hepat Rep 2004;3:123-131
19. DI MARTINO V, THEVENOT T, COLIN JF et al Influence of HIV infection on the response to interferon therapy and the long-term outcome of chronic hepatitis B. Gastroenterology 2002;123: 1812-22
20. HUI CK, LEUNG N, YUEN ST et al. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase. Hepatology 2007,46:395-401
21. LAI M, HYATT BJ, NASSER I et al The clinical significance of persistently normal ALT in chronic hepatitis B infection. J Hepatol 2007;47: 769-767
22. BURK RD, HWANG LY, HO GYF et al Outcome of perinatal hepatitis B virus exposure is dependent on material virus load. J Infect Dis 1994;170: 1418-1423
23. CACCIOLA I, CERENZIA G, POLLICINO T, et al Genomic heterogeneity of hepatitis B virus(HBV) and outcome of perinatal HBV infection. J Hepatol 2002;36:426-432
24. BONI C, BERTOLETTI A, PENNA A et al lamivudine treatment can restore T cell responsiveness in chronic hepatitis B. J Clin Invest 1998;102: 968-975
25. CHANG MH, SUNG JL, LEE CY et al factors affecting clearance of hepatitis B e antigen in hepatitis B surface antigen carrier children J Pediatric 1989;115: 385-390
26. CHU CM,. Natural history of hepatitis B infection in adults with emphasis on the occurrence of cirrhosis and hepatocellular carcinoma. J Gastroenterol Hepatol 2,000;15(suppl): E25-E30
27. HOOFNAGLE JH, DOO E, LIANG TJ et al Management of hepatitis B: summary of a clinical research workshop. Hepatology 2007; 45:1056-1075
28. LOK AS, MCMAHON BJ. Chronic hepatitis B. Hepatology 2007;45: 507-539
29. BORTOLOTTI F, JARA P, CRIVILLARO C et al Outcome of chronic B in Caucasian children during a 20-years observation period. J Hepatol 1998;29: 184-190
30. REALDI G, ALBERTI A, RUGGE M etv al Seroconversion from hepatitis B e antigen to anti-HBe in chronic hepatitis B virus infection. Gastroenterology 1980;79:195-199
31. HOOFNAGLE JH. DUSHEIKO GM Seef LB et al Seroconversion from hepatitis B e antigen to antibody in chronic type B hepatitis. Ann Intern Med 1981;94:744-748
32. SANCHEZ-TAPIAS JM, VILAR JH, Costa et al natural history of chronic persistent hepatitis B. Relationship between hepatitis B virus replication and the course of the disease. J Hepatol 1984;1: 15-27
33. FATTOWICH G., RUGGE M, BROLLO L et al Clinical, virologic and histologic outcome following seroconversion from HBeAg to anti-Hbe in chronic hepatitis type B. Hepatology 1986;6: 167-172
34. HSU YS, CHIEN RN, YEH CT et al. Long-term outcome after spontaneous HBeAg seroconversion inpatients with chronic hepatitis B. Hepatology 2002; 35:1522-1527
35. FONG TL, DI BISCEGLIE AM, GERBER MA et al. Persistence of hepatitis B virus DNA in he liver after loss of HbsAg in chronic hepatitis B. Hepatology 1993;18: 1313-1318
36. CHU CM, LIAW YF. Genotype C hepatitis B virus infection is associated with a higher risk of reactivation of hepatitis B and progression to cirrhosis than genotype B: a longitudinal study of hepatitis B e antigen-positive patients with normal aminotransferase levels at baseline. J Hepatol 2005; 43: 411–7.
37. KAO JH. ROLE of viral factors in the natural course and therapy of chronic hepatitis B. Hepatol Int 2007; 1:415–30.
38. LIVINGSTON SE, SIMONETTI JP, BULKOW LR, et al. Clearance of hepatitis B e antigen in patients with chronic hepatitis B and genotypes A, B, C, D, and F. Gastroenterology 2007; 133:1452–7.
39. NI YH, CHANG MH, WANG KJ, et al. Clinical relevance of hepatitis B virus genotype in children with chronic infection and hepatocellular carcinoma. Gastroenterology 2004; 127:1733–8.
40. LIAW YF, LEUNG N, KAO J_H et al Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int 2008; 2:263-283.
41. CHU CM, LIAW YF Spontaneous relapse of hepatitis in inactive HBsAg carriers. Hepatol Int 2007;1:311-5.
42. CHU CM, LIAW YF. Predictive factors for reactivation of hepatitis B following hepatitis B e antigen seroconversion in chronic hepatitis B. Gastroenterology 2007; 133:1458-1465
43. LIAW YF, TSAI SL. Pathogenesis and clinical significance of spontaneous exacerbations and remissions in chronic HBV infection Viral hepatitis Rev 1997;3:143-154
44. SHEEN IS, LIAW YF, TAI DI et al hepatic decompensation associated with hepatitis B e antigen clearence in chronic type B hepatitis. Gastroenterology 1985;89: 732-735
45. BORTOLOTTI F, GUIDO M, bartolacci S et al Chronic heopatitis B in children after e antigen seroclearence: final report of a 29-year longitudinal study. Hepatology 2006;43:556-62
46. FATTOWICH G., OLIVARI N, PASINO M et al Long-term outcome of chronic hepatitis B in Caucasian patients: mortality after 25 years. Gut 2008; 57:84-90
47. YUEN MF, HUI HY, CHENG CC et al Lon-term follow-up interfweron alfa treatment in Chinese patients with chronic hepatitis B infection: the effect on hepatitis B e antigen seroconversion and the development of cirrhosis-relates complications. Hepatology 2001; 34:139-145
48. MCMAHON BJ, HOLCK P, BULKOW et al Serologic and clinical outcomes of 1536 Alaska natives chronically infected with hepatitis B virus. Ann Intern Med 2001;135:759–768
49. LIAW YF, SHEEN IS,. CHEN TJ et al Incidence, determinants and significance of delayed clearance of a serum HBsAg in chronic hepatitis B virus infection: a prospective study. Hepatology 1991;13: 627-631
50. LOK ASF, LAI CL, WU PC et al Spontaneous hepatitis B e antigen to antibody seroconversion and reversion in Chinese patient with chronic hepatitis B virus infection. Gastroenterology 1987;92:1839-1843
51. LOK ASF, LAI C. Acute exacerbations in Chinese patients with chronic hepatitis B(HBV) virus infection: incidence, predisponing factors and etiology. J Hepatol 1990;10: 29-34
52. DAVIS GL, HOOFNAGLE JH, WAGGONER JG. Spontaneous reactivation of chronic hepatitis: virus infection. Gastroenterology 1984;86:230-235
53. LIAW YF, TAI DI, CHU CM et al Cut exacerbation in chronic type B hepatitis: comparison between HBeAg and antibody-positive patient. Herpatology 1987;7:20-23
54. EUROPEAN ASSOCIATION for the Study of the Liver. EASL. Clinical Practice Guidelines: Management of chronic hepatitis B. J Hepatol 50 (2009) doi:10.1016/j.jhep.2008.10.001
55. CHEN YC, SHEEN IS, CHU CM et al Prognosis following spontaneous HBsAg Seroclearence in chronic hepatitis B with or without xconcurrent infection. Gastroenterology 2002; 123: 1084-89
56. HOOFNAGLE JH, SHAFRITZ DA, POPPER H. Chronic type B hepatitis and the "healthy" HBsAg carrier state. Hepatology 1987; 7:758-763
57. DE FRANCHIS R, MEUCCI G, VECCHI M, et al. The natural history of asymptomatic hepatitis B surface antigen carriers. Ann Intern Med 1993;118:191–194
58. MANNO M, CAMMA C, SCHEPIS F et al. Natural history of chronic HBV carriers in Northern Italy: morbidity and mortality after 30 years. Gastroenterology 2004;127:756-763
59. HADZIYANNIS SJ.. HEPATITIS B e antigen–negative chronic hepatitis B: from clinical recognition to pathogenesis and treatmen. Viral Hep Rev 1995;1:7- 36
60. CARMAN WF, JACYNA MR, HADZIYANNIS SJ et al mutation opreventing formation of e antigen in patients with chronic HBV infection. Lancet 1989;2: 588-591
61. CHAN HLY, HUSSAIN M, LOK ASF.Different hepatitis B virus genotypes are associated with different mutations in the core promoter and precore regiopns during hepatitis B e antigen seronversiopn Hepatology 1999;29: 976-984
62. CHAN HLY, LEUNG NWY, HUSSAIN M, et al.Hepatitis B e antigen–negative chronic hepatitis B in Hong Kong. Hepatology 2000;31:763–768
63. SHINDO M, HAMADA K, KOYA S et al The clinical significance of core promoter and precore mutations during the natural course and interferon therapy in patients with chronic hepatitis B. Am J Gasdtroenterol 1999;94:237-245
64. GRANDJACQUES C, PRADAT P, STRUYVER L et al. Rapid detection of genotypes and mutations in the precore promoter and the precore region of hepatitis B virus genome: correlationwith viral persistence and disease severityu. J Hepatol 2000;33:430-439
65. OKAMOTO H, TSUDA F, AKAHNE Y et al hepatitis B virus with mutations in the core promoter for an e-antigen-negative phenotype in carriers with antibody to e antigen. J Virol 1994;68:8102-8110
66. HADZIYANNIS SJ, VASSILOPOULOS D. Hepatitis B e antigen–negative chronic hepatitis B. Hepatology 2001;34:617–624
67. LIAW YF. Natural history of chronic hepatitis B virus infection and long-term outcome under treatment. Liver Int 2009;29(s1):100-107
68. CHU CM, HUNG SJ, LIN J, TAI DI, LIAW YF. Natural history of hepatitis B e antigen to antibody seroconversion in patients with normal serum aminotransferase levels. Am J Med 2004;116: 829–34.
69. ZACHARAKIS GH, KOSKINAS J, KOTSIOU S, et al. Natural history of chronic HBV infection: a cohort study with up to 12 years follow-up in North Greece (part of the Interreg I-II/ECproject).J Med Virol 2005; 77: 173–9.
70. FELD JJ, AYERS M, EL-ASHRY D, et al. Hepatitis B virus DNA prediction rules for hepatitis B e antigen-negative chronic hepatitis B. Hepatology 2007; 46: 1057–70.
71. FUNK ML, ROSENBERG DM, LOK ASF. Wiorld-widw epidemiology of HBeAg- negative chronic hepatitis B and associated precore and core promoter variants. J Viral Hepat 2002;9:52-61
72. ARASE Y, IKEDA K, SUZUKI F et al. Long-term outcome alter hepatitis B surface antigen seroclearence in patients with chronic hepatitis b Am J Med 2006;119:71 e9-16
73. RAIMONDO G, POLLICINO T, CACCIOLA I et al Occult hepatitis B virus infection J Hepatol 2007 ;46: 160-170
74. GANEM D, PRINCE AM,. Hepatritris B virus infectrion- natural history and clinical consequences. N Engl Med 2004; 350:1118-1129
75. BOCK CT, SCHWINN S, LOCARNINI S et al Structural organization of the hepatitis B virus minichromosome. J Mol Bio 2001;307:183-196
76. MAYNARD M, PARVAZ P, DURANTEL S et al Sustained HBs seroconversion during lamivudine and adefovir dipivoxil combination therapy for lamivudine failure. J Hepatol 2005;42: 279-281
77. WURSTHORN K, LUTGEHETMANN, DANDRI M et al. peginterferon alpha-2bplus adefovir induce strong cccDNA decline and HBsAg reduction inpatients with chronic hepatitis B. Hepatology 2006;44:675-684
78. ZOULIM F. New insigthon hepatitis B virus persistence froom the study of intrahepatic viral cccDNA. J Hepatol 2005;42:302-308.
79. YAMAMOTO K, HORIKITA M, TSUDA F et al: Naturally occurring escapemutants of hepatitis B viruswith varius mutations in the S genein carriers seropositive for antibody to hepatitis B surface antigen. J Virol 1994;68:2671-2676
80. IRELAND JH, O´DONELL B, BASUNI AA et al Reactivity of 13 in vitroexpressed hepatitis B surface antigen variants in 7 commercial diagnostic assays. Hepatology 2000;31:1176-1182
81. CHAUDHURI V, TAYAL R, NAYAK B et aql Occult hepatitis B virus infection in chronic liver disease full-length genome and analysis of mutant surface promoter. Gastroenterology 2004;127: 1356-1371
82. HASS M, HANNOUN C, KALININA T et al Functional analysis of hepatitis B virus reactivating in hepatitis B surface antigen-negative individuals. Hepatology 2005;42:93-103
83. POLLICINO T, RAFFA G, Costantino et al. Molecular and functional analysis of occult hepatitis B virus isolates from patients with hepatocellular carcinoma. Hepatology 2007;43("):277- 285.
84. DEGOS F, LUGASSY C, DEGOT C, et al. Hepatitis B virus and hepatitis B related viral infection in renal transplant recipients. Gastroenterology 1988;94:151–156.
85. CHAZOUILLERES O, MAMISH D, KIM M et al. Occult hepatitis B virus as source of infection in liver transplant recipients. Lancet 1994;343:142–146.
86. HOOFNAGLE JH, SEEFE LB, BALES ZB, et al B hepatitis after transfusion with blood containing antibody to hepatitis B core antigen. N Engl J Med 1978;298:1379–1383.
87. JAPANESE RED CROSS, Hepatitis n–n, Group. R. Effect of screening for hepatitis C virus antibody and hepatitis B virus core antibody on incidence of post-transfusion hepatitis. Lancet 1991;338:1040–1.
88. Wachs ME, Amend WJ, Ascher N et al. The risk of transmission of hepatitis B from HBsAg(-), HBcAb(+), HBIgM(_) organ donors. Transplantation 1995;59:230–234.
89. DICKSON RC, EVERHART JE, LAKE JR et al. Transmission of hepatitis B by transplantation of livers from donors positive for antibody to hepatitis B core antigen. Gastroenterology 1997;113:1668–1674.
90. HOOFNAGLE JH, DUSHEIKO GM, SCHAFER DF et al. Reactivation of chronic hepatitis B virus infection by cancer chemiotherapy. Ann Intern Med 1982;96:447–449.
91. WAITE J, GILSON RJC, WELLER IVD et al. Hepatitis B virus reactivation or reinfection associated with HIV-1 infection. AIDS 1988;2:443–448.
92. GRUMAYER ER, PANZER S, FERENCI P Recurrence of hepatitis B in children with serologic evidence of past hepatitis B virus infection undergoing antileukemic chemiotherapy. J Hepatol 1989;8:232–235.
93. LOK ASF, LIANG RHS, CHIU EKW Reactivation of hepatitis B virus replication in patients receiving cytotoxic therapy. Gastroenterolgy 1991;100:182–188.
94. MARCELLIN P, GIOSTRA E, MARTINOT-PEIGNOUX M, ET AL. Redevelopment of hepatitis B surface antigen after renal transplantation. Gastroenterology 1991;100:1432–1434.
95. RAIMONDO G, ALLAIN JP, BRUNETTO MR ET AL Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol 2008;49: 652-657
96. SCHUTTLER CG, FIEDLER N, SCHMIDT K, ET AL Suppression of hepatitis B virus enhancer 1 and 2 by hepatitis C virus core protein. J Hepatol 2002;37:855–862.
97. CHEN SY, KAO CF, CHEN CM, ET AL. Mechanisms for inhibition of hepatitis B virus geneexpression and replication by hepatitis C virus core protein. J Biol Chem 2003;278:591–607.
98. SHIH CM, LO SJ, MIYAMURA T, ET AL Suppression of hepatitis B virus expression and replication by hepatitis C virus core protein in HuH-7 cells. J Virol 1993;67:5823–5832.
99. TORBENSON M, KANNANGAI R, ASTEMBORSKI J, ET AL. High prevalence of occult hepatitis B in Baltimore injection drug users. Hepatology 2004; 39:51–57.
100. TOYODA H, HAYASHI K, MURAKAMI Y, ET AL. Prevalence and clinical implications of occult hepatitis B viral infection in hemophilia patients in Japan. J Med Virol 2004;73:195–199.
101. SIAGRIS D, CHRISTOFIDOU M, TRIGA K, ET AL. Occult hepatitis B virus infection in hemodialysis patients with chronic HCV infection. J Nephrol 2006;19:327–333.
102. KANBAY M, GUR G, AKCAY A, ET AL. Is hepatitis C virus positivity a contributing factor to occult hepatitis B virus infection in hemodialysis patients?. Digest Diseases Sci 2006; 51(11):1962-6.
103. GORAL V, OZKUL H, TEKES S, ET AL Prevalence of occult HBV infection in haemodialysis patients with chronic HCV. World J Gastroenterol 2006;12:3420–3424.
104. FABRIZI F, MESSA PG, LUNGHI G, ET AL. Occult hepatitis B virus infection in dialysis patients: a multicentre survey. Aliment Pharmacol Ther 2005;21:1341–1347.
105. MINUK GY, SUN DF, GREENBERG R, J, ET AL. Occult hepatitis B virus infection in a North American adult hemodialysis patient population. Hepatology 2004;40:1072–1077.
106. BESISIK F, KARACA C, AKYUZ F, ET AL. Occult HBV infection and YMDD variants in hemodialysis patients with chronic HCV infection. J Hepatol 2003;38:506–510.
107. LIAW YF, TAI DI, CHU CM ET AL The development of cirrhosis in patients with chronic type B hepatitis: a prospective study. Hepatology 1988;8:493-6.
108. HSU YS, CHIEN RN, YEH CT ET AL Long-term outcome after spontaneous HBeAg seroconversion in patients chronic hepatitis B Hepatology 2002;35:1522-1527.
109. LIAW YF hepatitis flares and hepatitis B e antigen serocionversion: implication in anti-hepatitis B virus thjerapy. J Gastroenterol Hepatol 2003;18: 246-52.
110. LIN SM, YU ML, LEE CM ET AL Interferon therapy in HbeAg positive chronic hepatitis reduces cirrhosis and hepatocellular carcinoma J Hepatol 2007;46:45-52.
111. PARK BK, PARK YN, AHN SH ET AL Long-term outcome of chronic hepatitis B based on histological grade and stage. J Gastroenterol hepatol 2007; 22:383-388.
112. VILLENEUVE JP, DESROCHERS M, INFANTE-REVARD CL ET AL A long-term follow-up study of asymptomatic hepatitis B surface antigen-positive carriers in Montreal. Gastroenterology 1994;106: 1000-1007.
113. CHU CM, LIAW YF. Chronic hepatitis B virus infection acquieres in childhood: special emphasis on prognostic and therapeutic implication of delayed HBeAg seroconversion. J Viral Hepat 2007;14:147-153.
114. DE JONGH FE, JANSSEN HL, DE MAN RA ET AL Survival and prognostic indiocators in hepatitis B surface antigen-positive cirrhosis of the liver. Gastroenterology 1992;103.1630-1636
115. REALDI G, FATTOVICH G, HADZIYANIS S ET AL Survival and prognostic factors in 366 patients with compensated cirrhosis type B: A multicenter study. J Hepatol 1994;21:656-672
116. IKEDA K, SAITOH S, SUZUKI Y, ET AL. Disease progression and hepatocellular carcinogenesis in patients with chronic viral hepatitis: a prospective observation in 2215 patients. J Hepatol 1998;28:930–938
117. FATTOWICH G., TAGGER A,, BROLLO L ET AL Hepatitis c virus infection in chronic hepatitis B virus carriers. J Infect Dis 1991;163:400-402
118. FONG TL, DI BISCEGLIE AM, WAGGONER JG ET AL The significance of antibody to hepatitis C virus in patients with chronic hepatitis B. Hepatology 1991;14:64-67
119. KAO JH, CHEN PJ, LAI MY ET AL Hepatitis B genotypes correlate with clinical outcomes in patierts with chronic hepatitis B Gastroenterology 2,000;118.554-559
120. CHAN HL, TSANG SW, LIEW CT ET AL Viral genotype and hepatitis B virus DNA levels arer correlated with histological liver damage in HBeAg-negative chronic hepatitis B viruas infection Am J Gastroenterol 2002;97:406-412
121. LIAW YF, LEUNG N, GUAN R ET AL Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2005 update. Liver Int 2005;25: 472-489
122. DAMICO G, PASTA L, MOADONIA S ET AL The incidence of esophageal varices in cirrhosis. Gastroenterology 2001;120: A2.
123. DAMICO G, GARCIA-TSAO G,L PAGLIARO L.ET AL Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies J Hepatol 2006;44: 217-231
124. GINES P, QUINTERO E, ARROYO V ET AL Compensated cirrhosis: natural history and prognostic factors. Hepatology 1987:7:122-128
125. KIM SU, HAN K-H, NAM CM ET AL. Natural history of hepatitis B virus-related cirrhotic patients hospitalizad to control ascites. J Gastroenterol Hepatol 2008;23: 1722-1727
126. BEASLEY RP. Hepatitis B virus. The major etiology of hepatocellular carcinoma. Cancer 1988;61:1942–1956
127. MARCELLIN P.Hepatitis B and hepatitis C in 2009. Liver Int 2009, 29(s):1-8.
128. YU MW, HSU FC, SHEEN IS, ET AL. Prospective study of hepatocellular carcinoma and liver cirrhosis in asymptomatic chronic hepatitis virus carriers. Am J Epidemiol 1997; 145:1039–47.
129. MCMAHON BJ, BULKOW L, HARPSTER A, ET AL. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B: a 16-year population based study. Hepatology 2000;32:842–846.
130. LIAW YF, TAI DI, CHU CM, ET AL. Early detection of hepatocellular carcinoma in patients with chronic type B hepatitis. A prospective study. Gastroenterology 1985;90:263–267.
131. LIN SM, YU ML, LEE CM, ET AL. Interferon therapy in HBeAg positive chronic hepatitis reduces cirrhosis and hepatocellular carcinoma. J Hepatol 2007; 46: 45–52.
132. YANG HU, LU SN, LIAW YF ET AL hepatitis Be antigen and the risk of hepatocellular carcinoma. N Engl J Med 2002;347:168-174.
133. CHEN YC, YANG HI,, SU J Risk of hepatocellular carcinoma across a biological gradient of serum hepastitis B virus DNA level. JAMA;295:65-73.
134. YU MW, YEH SH,, CHEN PJ, ET AL. Hepatityis B virus genotype and DNA level and hapatocellular carcinoma: a prospective study in men. J Natl Cancer Inst 2005; 97: 265-273.
135. HIJAR G, SUÁREZ M, PADILLA C ET AL Genotipificación del virus de la hepatitis B en pacientes de áreas endémicas del Perú. Rev Peru Med Exp Salud Pública 2007; 24(4):427-430
136. KAO JH. Role of viral factors in the natural course and therapy of chronic hepatitis B Hepatol Int 2007;1:415-430
137. MAHMOOD S, NIIYAMA G, KAMEI A ET AL Influence of viral load and genotype in the progression of hepatitis B-associated liver cirrhosis to hepatocellular carcinoma. Liver Int 2005;25:220-225
138. KAO JH, CHEN PJ, LAI MY ET AL hepatitis B virus g and spontaneous B e antigen seroconversion in Taiwanese hepatitis B carriers. J Med Virol 2004; 72:363-369
139. CHAN HL, HUI AY, WONG ML ET AL Genotype C hepatitis B virus infection is associated with an increased risk of hepatocellular carcinoma. Gut 2004;53:1494-1498.
Correspondencia:
Dr. Herman Vildózola Gonzales
Instituto de Medicina Tropical "Daniel A. Carrión".
Calle José Santos Chocano 199, Bellavista, Callao. Perú.
E-mail: vildosola@infonegocio.net.pe













