Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.29 n.3 Lima jul./set. 2009
ARTÍCULO ORIGINAL
Actividad citotóxica de Physalis peruviana (aguaymanto) en cultivos celulares de adenocarcinoma colorectal, próstata y leucemia mieloide crónica
Cytotoxic effect of Physalis peruviana in cell culture of colorectal and prostate cancer and chronic myeloid leukemia
Angel Quispe-Mauricio1,2 ; David Callacondo3 ; José Rojas1,2 ; David Zavala1,4 ; Margarita Posso1,2 ; Abraham Vaisberg5
1 Sociedad Científica de San Fernando, Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Médico General, Unité de Formation et de Recherche en Sciences de la Vie, Université Pierre et Marie Curie - Paris 6. Paris, Francia.
3 Médico General, Seguro Social de Salud-EsSalud, Red Asistencial Tacna. Tacna, Perú.
4 Médico General, Ministerio de Salud, Dirección Regional de Salud Huánuco. Huánuco, Perú.
5 Departamento de Microbiología, Laboratorios de Investigación y Desarrollo, Facultad de Ciencias y Filosofía Alberto Carzola Talleri, Universidad Peruana Cayetano Heredia, Lima, Perú.
* Trabajo ganador del Premio Hipólito Unanue a los mejores trabajos de investigación en ciencias de la salud 2008.
RESUMEN
INTRODUCCIÓN: Las plantas han sido empleadas como drogas por siglos. Sin embargo, se ha investigado poco sobre su gran potencial como fuentes de nuevos agentes terapéuticos. El objetivo del presente trabajo fue evaluar la actividad citotóxica de los extractos etanólicos de tallos y hojas de Physalis peruviana, sobre las líneas celulares HT-29, PC-3, K-562 y VERO.
MATERIALES Y MÉTODOS: Las líneas celulares HT-29, PC-3, K-562 y VERO, fueron expuestas a cuatro concentraciones de extractos etanólicos de tallos y hojas de Physalis peruviana. Asimismo, a diferentes concentraciones de cisplatino y 5-Fluorouracilo (5-FU), que se usaron como controles positivos. Se hallaron los porcentajes de crecimiento en 48 horas, luego se determinó la concentración inhibitoria 50 (IC50) mediante análisis de regresión lineal y el índice de selectividad de cada muestra.
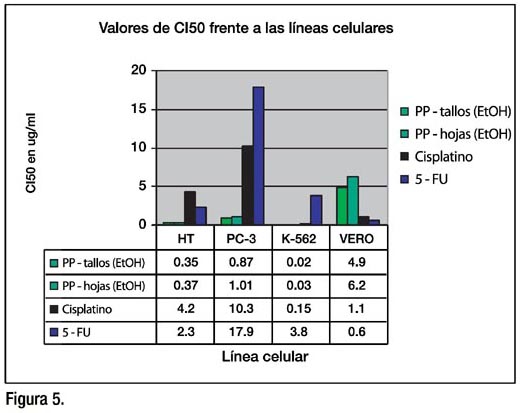
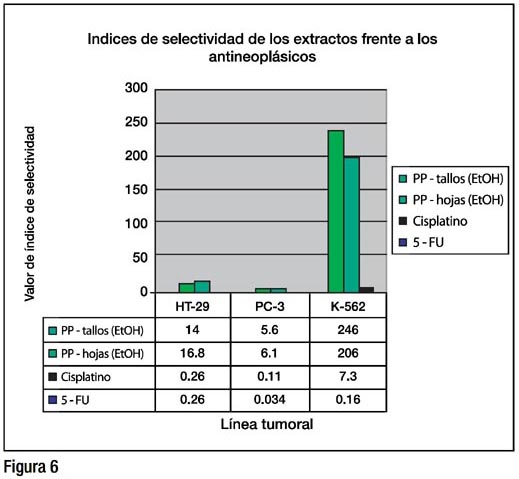
RESULTADOS: Los extractos etanólicos de tallos y hojas de Physalis peruviana mostraron actividad citotóxica: Los CI50 en μg/mL en hojas y tallos fueron, 0.35 (r=-0.95 p<0.025) y 0.37 (r=-0,90 p<0.05) para HT-29; 0.87 (r=-0.98 p<0.01) y 1.01 (r=-0.95 p<0.025) para PC-3; 0.02 (r=-0.98 p<0.01) y 0.03 (r=-0.98 p<0.01) para K-562; 4.9 (r=-0.95 p<0.025) y 6.2 (r=- 0.98 p<0.01) para VERO. Los CI50 para los antineoplásicos fueron: para el cisplatino: 4.2 (r=-0.96 p<0.025), 10.3 (r=-0.97 p<0.025), 0.15 (r=-0.98 p=0.01), y 1.1 (r=-0.98 p=0.01). Para el 5-FU: 2.3 (r=-0.97 p<0.025), 17.9 (r=-0.95 p<0.025), 0.15 (r=-0.98 p=0.01), y 1.1 (r=-0.94 p=0.05) para HT-29, PC-3, K562 y VERO, respectivamente. Los índices de selectividad de los extractos de tallos y hojas, estuvieron entre 5.6 y 245 para las líneas celulares tumorales evaluadas; por el contrario, el cisplatino y el 5-FU, solo alcanzaron valores entre 0.11 y 7.3.
CONCLUSIONES: Los extractos etanólicos de tallos y hojas de Physalis peruviana tienen mayor citotoxicidad que el cisplatino y 5 FU, en las líneas HT-29, PC-3 y K562. Además tienen menor citotoxicidad que el cisplatino y 5-FU en la línea control VERO.
PALABRAS CLAVE: Physalis peruviana; citotoxicidad; línea celular, extracto etanólico, antineoplásico.
ABSTRACT
INTRODUCTION: The plants have been used as drugs for centuries. However, limited research has been done on its great potential as sources of new therapeutic agents. The purpose of this study was to evaluate Physalis peruviana cytotoxic activity on cell lines HT-29, PC-3, K-562 and VERO.
Materials and Methods: The HT-29 cell lines, PC-3, K-562 and VERO, were exposed to four concentrations of P. peruviana ethanolic leave and stem extracts, also at different concentrations of cisplatin and 5-fluorouracil (5-FU), which were used as positive controls. We found rates of growth within 48 hours, then we determined the inhibitory concentration 50 (IC50) using linear regression analysis and the index of selectivity of each sample.
RESULTS: The P. peruviana ethanolic leave and stem extracts showed cytotoxic activity. The IC50 in μg/mL in leaves and stems were, 0.35 (r =-0.95 p <0.025) and 0.37 (r =- 0.90 p <0.05 ) for HT-29; 0.87 (r =-0.98 p <0.01) and 1.01 (r =-0.95 p <0.025) for PC-3; 0.02 (r =-0.98 p <0.01) and 0.03 (r =-0.98 p <0.01) for K-562; 4.9 (r =-0.95 p <0.025) and 6.2 (r =-0.98 p <0.01) for VERO. The IC50 for antineoplastic were: for cisplatin: 4.2 (r =-0.96 p <0.025), 10.3 (r =-0.97 p <0.025), 0.15 (r =-0.98 p = 0.01) and 1.1 (r =- 0.98 p = 0.01); for 5-FU: 2.3 (r =-0.97 p <0.025), 17.9 (r =-0.95 p <0.025), 0.15 (r =-0.98 p = 0.01) and 1.1 (r =-0.94 p = 0.05) for HT-29, PC-3, K562 and VERO respectively. The leaves and stems extracts selectivity index were between 5.6 and 245 for tumor cell lines evaluated, by contrast, cisplatin and 5-FU, only showed values between 0.11 and 7.3.
CONCLUSIONS: The P. peruviana leaves and steams ethanolic extracts were more cytotoxic than cisplatin and 5 FU, on the lines HT-29, PC-3 and K562. Furthermore the P. peruviana cytotoxic effects were less than cisplatin and 5-FU for VERO control cells lines.
KEYWORD: Physalis peruviana; cytotoxicity; cell line, ethanolic extract, antineoplastic.
INTRODUCCIÓN
Las plantas han sido empleadas como drogas por siglos. Sin embargo, se ha investigado poco sobre su gran potencial como fuentes de nuevos agentes terapéuticos1. De las 250000- 500000 especies de plantas, solo un pequeño porcentaje han sido sometidas a investigaciones fitoquímicas, y es aún menor el conocimiento acerca de sus propiedades farmacológicas1, 2. Los extractos de plantas medicinales, son conocidos por tener diferentes componentes quimiopreventivos y quimioteraúticos3.
El género Physalis pertenece a la familia Solanaceae; cuenta con cerca de 120 especies que se distribuyen a través de las regiones tropicales y subtropicales del mundo4, encontrándose principalmente en América del Sur y del Norte, con un pequeño número de especies en Europa y en los países del suroriente y centro de Asia5.
Physalis peruviana, descrita por primera vez por Linnaeus en 1753, es conocida comúnmente como Cape gooseberry (South Africa, U.K.) o grosella del cabo6. En el Perú recibe los nombres de capulí y aguaymanto7. Es una plata herbácea erecta, perenne en zonas tropicales y anual en zonas temperadas. Las ramas son acanaladas y a veces de color violáceo, con hojas opuestas, alternadas de forma acorazonada6-8.
Se ha empleado en la medicina tradicional como agente anticancerígeno, antipirético e inmunomodulador, asimismo para el tratamiento de enfermedades como la malaria, asma, hepatitis, dermatitis y el reumatismo9. Los extractos de las hojas, han mostrado importantes actividades antibióticas y antinflamatorias10, 11. Se han aislado varios componentes químicos como el 28 hidroxiwitanolido, witanolidos, physalinas, phygrina, kaempferol y glicósidos de quercentina12-14. Algunos de estos compuestos tienen una fuerte actividad antioxidante y previenen el daño peroxidativo a microsomas hepáticos y hepatocitos15, 16. Sus compuestos bioactivos principales, las physalinas, han mostrado tener actividad anticancerígena en las líneas celulares HA-22T (carcinoma hepatocelular), HeLa (adenocarcinoma de cérvix), APM1840 (Leucemia linfoide aguda T), HL-60 (Leucemia promielocítica aguda), KG-1 (Leucemia mieloide aguda), CTV1 (Leucemia monolítica aguda) y KB-16 (cáncer nasofaríngeo)9, 17, 18.
Dos estudios previos mostraron que el extracto etanólico de Physalis peruviana posee un buen efecto citotóxico frente a la línea celular HepG2 (Carcinoma hepatocelular)19, 20, activando la apoptosis a través de la liberación de citocromo c, la proteína Smac/DIABLO y la proteasa Omi/ HtrA2, de la mitocondria al citosol, que resulta en la activación de la pro-caspasa 3, 20, concluyendo que la inducción de apoptosis estaba asociada a la disfunción mitocondrial19.
El cáncer colorectal es la segunda causa mas frecuente de muerte por cáncer en USA21, y es el cuarto cáncer mas común en el mundo, con aproximadamente 1 millón de nuevos casos cada año. El 5-Fluorouracilo(5-FU), sigue siendo el antineoplásico de elección en la quimioterapia22. No obstante la toxicidad y reacciones adversas que produce, continúan siendo una razón para continuar buscando nuevas terapias efectivas en la actualidad23-25.
En los países en vías de desarrollo, el cáncer de próstata es la segunda neoplasia maligna más frecuente y la tercera causa más común de muerte por cáncer en hombres26. En el Perú, el Registro de cáncer de Lima metropolitana 1994-1997 realizado por el centro de investigación Maes Heller del Instituto Nacional de Enfermedades Neoplásicas (INEN), evidenció que es la neoplasia maligna más frecuente en varones, con un total de 4 063 casos registrados entre los años 1990 y 199727. Es una enfermedad predominantemente de hombres ancianos, cuya incidencia se incrementa considerablemente en la séptima década de la vida28. Los hombres con cáncer de próstata, viven con la enfermedad por muchos años, y los efectos colaterales de la enfermedad y los tratamientos tienen implicancias físicas y psicosociales para el paciente, cónyuge, y familia29. En relación al cáncer de próstata hormono-refractario, desde la aprobación del docetaxel en el 2004 como terapia de primera línea, no se ha definido aun algún régimen estándar de segunda línea30.
No hay estudios donde se evalúe la citoxicidad de los extractos etanólicos de tallos y hojas de Physalis peruviana en las líneas celulares HT-29 (Adenocarcinoma colorectal), PC-3 (Adenocarcinoma de próstata) y VERO (Fibroblastos de riñón de mono verde africano); Asimismo que comparen este efecto con antineoplásicos como el cisplatino y 5-FU.
En el presente trabajo, nuestro objetivo fue determinar la actividad citotóxica de los extractos etanólicos de tallos y hojas de Physalis peruviana en líneas tumorales HT-29 (adenocarcinoma colorectal) y PC-3 (adenocarcinoma de próstata), debido a su gran prevalencia en nuestro país; así también, en la línea celular K-562 (leucemia mieloide crónica). De igual manera, determinar su efecto citotóxico frente a línea celular VERO (Fibroblastos de riñón de mono verde africano), comparándolo a controles positivos como los antineoplásicos: cisplatino y 5-FU.
MATERIALES Y MÉTODOS
Es un estudio biológico experimental in vitro realizado en la Unidad de Investigación en Productos Naturales y el Laboratorio de Biología Celular y Virología de los Laboratorios de Investigación y Desarrollo (LID), de la Universidad Peruana Cayetano Heredia (UPCH).
La unidad de investigación fue cada célula perteneciente a las líneas celulares HT-29, PC-3, K562 y VERO. El material biológico utilizado fueron los tallos y hojas de Physalis peruviana, recolectados en el distrito de San Antonio de Cajas (departamento de Junín, Perú), las cuales fueron clasificadas taxonómicamente en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (Lima, Perú). Las líneas celulares del American Type Culture Collection (ATCC): HT-29 (adenocarcinoma colorectal), PC-3 (adenocarcinoma de próstata), K562 (leucemia mieloide crónica) y VERO (Fibroblastos de riñón de mono verde africano) fueron proporcionadas por el Laboratorio de Biología Celular y Virología de los LID - UPCH (Lima, Perú).
Para la preparación del extracto, se desecó 500 gramos tallos y hojas de Physalis peruviana; a una temperatura de 40 °C por 3 días, en un horno de aire circulante; los cuales luego fueron pulverizados con un molino eléctrico. 50 gr. de cada muestra, fueron introducidos en un matraz conteniendo 500 mL de etanol al 95%, por un periodo de 10 días. Posteriormente, se filtró cada macerado, utilizando para ello papel de porosidad media y se destiló a presión reducida en un evaporador de tipo rotatorio a una temperatura menor de 40 °C. Finalmente, se desecó al vacío y se obtuvieron los extractos etanólicos.
Las líneas celulares HT-29 y K-562 fueron cultivadas y mantenidas en crecimiento logarítmico en el medio de cultivo RPMI 1640 suplementado con 10% de suero bovino fetal y 50 μg/mL de gentamicina. La línea celular VERO fue cultivada en el medio de cultivo MEM (Minimum Essential Médium) suplementado con 10 % de suero bovino fetal y 50 μg/mL de gentamicina, Finalmente, la línea tumoral PC-3 fue cultivada en el medio de HAM F12-K. Las 4 líneas celulares fueron mantenidas a una temperatura de 37º C, en un ambiente húmedo, con 95% de aire y 5% de CO2.
Para resuspender cada línea celular, se lavó la monocapa de células con 3 x 4 mL de la solución de Hanks sin Ca- Mg; luego, se agregó 1 mL de la solución de tripsina-EDTA, que después de 10 segundos fue eliminada. Se incubó el frasco invertido por 8 minutos a 37 ºC, al término de los cuales los cultivos fueron resuspendidos en 2 mL de cada medio de cultivo. En el caso de la línea K562 no se utilizó este método, porque las células crecen en suspensión.
Luego, se contó las células usando un hemocitómetro. Cada pozo de una placa de 96 pozos recibió 160 uL de medio conteniendo el número de células que se específica en la Tabla 1
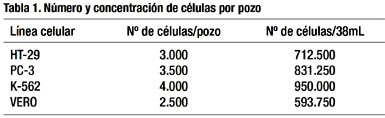
Para el ensayo de la actividad antitumoral se utilizó una placa 0 (control), asignándose 4 pozos para cada línea celular y una placa 1 (experimental) con 12 pozos para cada línea celular. En cada pozo de ambas placas se colocó 160 uL de medio de cultivo conteniendo las células. Se incubó a 37 ºC en una atmósfera húmeda de 5% de CO2 y 95% de aire, por 24 h. A la placa 0 se le añadió ácido tricloroacético (TCA), para fijar las células y cuantificarlas luego, en tiempo cero. A la placa 1 se le agregó las diferentes diluciones de los extractos, cisplatino y de 5-FU, que se muestra en la Tabla 2.
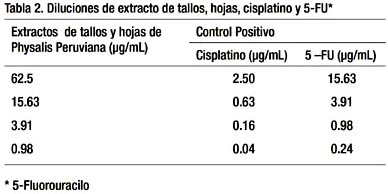
Para las diluciones de extracto, se mezcló 20 mg de extracto + 100 mL de etanol al 100% y fue centrifugado a 12 000 RPM, por 10 minutos. El sobrenadante fue el stock de 20 mg/100 mL y de este 8,5 mL fueron diluidos en 340 mL de medio; con diluciones sucesivas de 1:4. La concentración inicial que se usó fue 62.5 μg/mL para los extractos 2,5 μg/ mL para el cisplatino y 15,63 μg/mL para el 5-FU.
La placa 1 fue incubada por 48 horas adicionales. Luego, a cada pozo se le agregó TCA frío y se incubó a 4 ºC por 1 hora. Para determinar el número de células de las líneas HT-29, PC-3 y VERO, se empleó el método del bioensayo de citotoxicidad con sulforodamina B (SRB)31. Para la línea K562, se utilizó conteo directo, mediante el contador Coulter.
Fueron respetadas las medidas de bioseguridad de trabajo con material biológico.
Para todas las líneas se halló los porcentajes de crecimiento en 48 horas, en función a las 4 diluciones (Tabla 2). La concentración inhibitoria de crecimiento 50 (CI50) se halló mediante el análisis de regresión lineal (ecuación de la recta: y=mx+b). Finalmente, se precisó la relación CI50 (línea control) / CI50 (línea tumoral), que indica el índice de selectividad (IS) de la sustancia en la línea tumoral, siendo >1 cuando la citotoxicidad para las células tumorales supera a la citotoxicidad en las células normales. Para todos los análisis, se utilizó Microsoft Office Excel 2007.
RESULTADOS
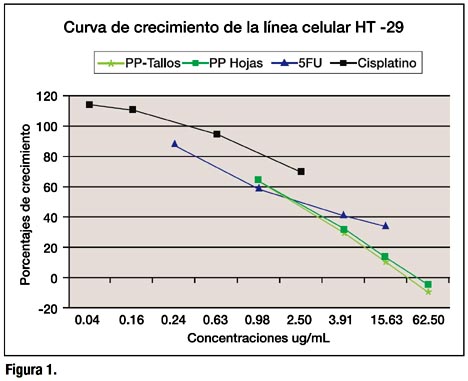
En la línea HT-29, los porcentajes de crecimiento variaron de –4.3 a 63.9. Las menores concentraciones de los extractos de hojas y tallos mostraron un crecimiento similar al del control sin extracto, mientras que las mayores concentraciones no solo inhibieron el crecimiento sino que destruyeron las células inoculadas (Figura 1). Se visualiza que la citotoxicidad de Physalis peruviana es mayor que los antineoplásicos frente a HT-29.
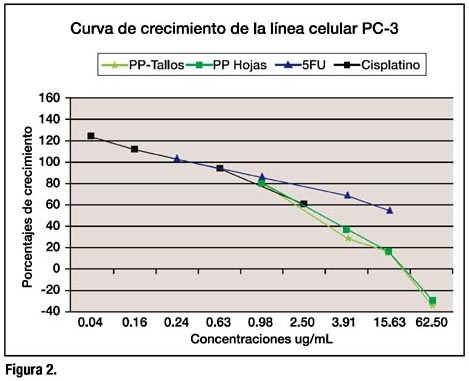
Respecto a la línea PC-3, los porcentajes de crecimiento fueron de -34.4 hasta 79 El comportamiento de los extractos también mostró, una mayor capacidad de inhibir el crecimiento tumoral, en comparación al cisplatino y 5-FU, donde a bajas concentraciones fue también más tóxico que los antineoplásicos. (Figura 2).
El comportamiento de los extractos en la línea celular K-562, mostró una citotoxicidad mayor al 5-FU, sin embargo el cisplatino mostró también una buena citotoxidad. Los porcentajes de crecimiento en esta línea celular fueron de –24.6 hasta 41.3, para los extractos (Figura 3).
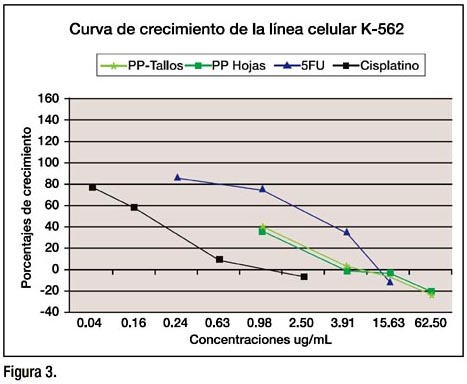
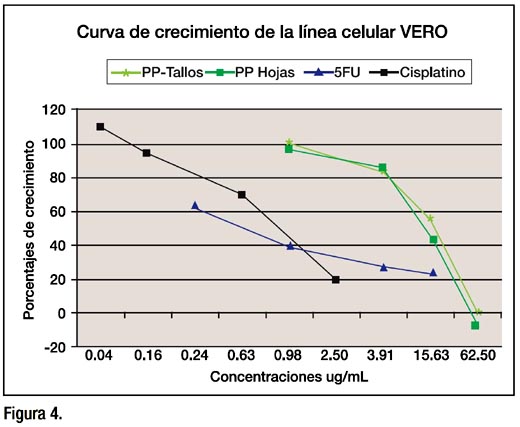
Las curvas descritas por el cisplatino y 5-FU en la línea celular control VERO, muestran claramente una mayor citotoxicidad en comparación a los extractos de tallos y hojas de Physalis peruviana. La Figura 4, muestra que a bajas concentraciones el cisplatino y el 5-FU fueron más tóxicos que los extractos, mostrándonos de esta manera que el extracto respeta en cierta forma a las células normales.
Los extractos etanólicos de tallos y hojas mostraron CI50 menores que los CI50 del cisplatino y 5-FU en todas las líneas tumorales evaluadas. Los CI50 del extracto variaron entre 0.02 y 0.87 μg/mL, pero en todos los casos para las líneas tumorales fueron menores que las concentraciones de cisplatino y 5-FU. Sin embargo, fueron mayores en comparación a los CI50 del cisplatino y 5-FU para la línea control VERO (Figura 5).
Los IS (Índice de selectividad) de los extracto, superaron ampliamente la unidad, (siendo los valores mayor a 1 cuando la citotoxicidad es mayor para células tumorales en comparación de células normales) alcanzando valores entre 5.6 y 245. Contrariamente, el cisplatino y 5-FU solo alcanzaron valores de índice de 0.26 y 7.3, respectivamente (Figura 6).
DISCUSIÓN
Los extractos etanólicos de tallos y hojas de Physalis peruviana, mostraron citotoxicidad frente a las líneas tumorales: HT-29, PC-3 y K-562, superando en todos los casos al cisplatino y al 5-FU. Además, el efecto citotóxico de los extractos, fue menor para la línea celular VERO, comparada con el cisplatino y el 5-FU.
En el caso del adenocarcinoma colorectal, no existen estudios previos que evalúen la citotoxicidad de los extractos de tallos y hojas de Physalis peruviana en la línea celular HT-29. Sin embargo, Lee y col, evaluaron la citotoxicidad de las Witangulatina A y Witangulatina I, asiladas de Physalis angulata, en la línea celular COLO 205 (Adenocarcinoma colorectal), obteniendo CI50 de 16.6 y 53.6 μg/mL, respectivamente32. En otro estudio, realizado por Colombo y col., evaluaron la citotoxicidad de la coptisina, compuesto que aislaron de Chelidonium majus, sobre en la línea celular HT-29, encontrando un CI50 de 0.49 μg/mL33. En nuestro estudio, los CI50 para el cisplatino y 5-FU, fueron de 4.2 y 2.3 μg/mL, respectivamente, siendo los IS de 0.26, para ambas drogas. Nosotros, en cambio, en la línea celular HT- 29 obtuvimos valores de CI50 de 0.35 μg/mL y 0.37 μg/ mL, para los extractos de tallos y hojas, respectivamente, así también, los IS para los extractos de tallos y hojas de Physalis peruviana superaron ampliamente la unidad, con valores de 14 y 16.8, respectivamente, lo cual evidencia un buen margen de seguridad de los extractos. Estos hallazgos, hacen ver que los extractos de los tallos y hojas de Physalis peruviana, puede inhibir el crecimiento de células tumorales a menores concentraciones que la Witangulatina A, Witangulatina I, coptisina y 5-FU, mostrando un gran margen de seguridad sobre las células normales, superando al 5-FU en citotoxicidad y selectividad sobre células tumorales, siendo este antineoplásico el tratamiento de elección en el adenocarcinoma colorectal34.
Las células PC-3, son células epiteliales derivadas de un adenocarcinoma de próstata humano, cuyo crecimiento es independiente de andrógenos35. Esta línea celular, andrógeno-insensible, es un excelente sistema modelo, no solo para realizar estudios básicos, si no también, para la evaluación de nuevos tratamientos y el manejo clínico del carcinoma prostático humano36. En la línea PC-3, un estudio realizado por Magalhães y Col., evaluó la citotoxicidad de las Physalinas B y D, aisladas de Physalis angulata, obteniendo CI50 de 15.18 y 2.43 μg/mL, respectivamente37. En otro estudio, Saetung y Col., evaluaron la actividad citotóxica de los extractos etanólicos de varias plantas originarias de Tailandia. Bridelia ovata, Curcuma zedoaria y Dioscorea membranacea presentaron IC50 de 1.16, 1.32 y 0.73 μg/ mL respectivamente38. En nuestro estudio, los CI50 para el cisplatino y 5-FU, fueron de 10.3 y 17.9, respectivamente, teniendo IS menores a la unidad. En esta línea celular, nosotros obtuvimos CI50 de 0.87 y 1.01 μg/mL con IS de 5.6 para tallos y 6.1 para tallos y hojas de Physalis peruviana. Esto demuestra, el buen perfil antitumoral de los extractos, superando ampliamente a los antineoplásicos mencionados, los cuales, forman parte de estudios, manejo y tratamiento del carcinoma prostático avanzado39, 40.
En relación a la Leucemia mieloide crónica (LMC), Magalhães y Col, también evaluaron la citotoxicidad de las Physalinas B y D de Physalis angulata, sobre la línea celular K-562, obteniendo CI50 de 4.7 y 0.75 μg/mL, respectivamente37. En otro estudio, Gao y Col., evaluaron la actividad antiproliferativa del extracto etanólico de Goldfussia psilostachys en la línea K-562, encontrando un CI50 de 0.5 μg/ mL. En nuestro estudio, el cisplatino y el 5-FU, mostraron CI50 de 0.15 y 3.8 μg/mL, respectivamente, asimismo, los extractos de tallos y hojas mostraron CI50 de 0.02 y 0.03 μg/mL, así como IS de 245 y 206, respectivamente41. Esto evidencia la alta selectividad de los extractos para células leucémicas. El control positivo cisplatino mostró un IS de 7.3, en tanto que el 5-FU solo alcanzó un valor de 0.16.
La cirugía sigue siendo el pilar del tratamiento del cáncer colorectal, ya que ofrece una potencial cura en los cánceres tempranos y una efectiva paliación en los casos avanzados42. La quimioterapia y, algunas veces la radioterapia continúan siendo componentes de un tratamiento efectivo34. El cáncer de próstata localizado puede tratarse con prostatectomía, radioterapia u observación sin tratamiento43, 44. La observación está reservada para pacientes cuya expectativa de vida y enfermedad neoplásica de bajo riesgo haga pensar que no necesitarán tratamiento activo para una enfermedad relativamente indolente45. Finalmente, el tratamiento de la LMC, ha incluido diferentes estrategias que van desde el control de la leucocitosis con el busulfán e hidroxiurea; la supresión no específica de la hematopoyesis con el interferón alfa; hasta el trasplante alogénico de células madre, considerado en la actualidad la única opción curativa de esta enfermedad46, 47. Su manejo, ha cambiado profundamente con la introducción de los inhibidores de la tirosin-kinasa, como el imatinib, sin embargo, 20 – 25% de pacientes no logran una remisión citogenética completa, por lo que necesitarían drogas alternativas48. Esto hace ver la necesidad de continuar buscando nuevas alternativas terapéuticas para el cáncer en la actualidad.
La inducción de la apoptosis es conocida por ser una estrategia eficiente en la terapia del cáncer49. Un estudio sobre la línea celular Hep G2, ha sugerido que el extracto etanólico de Physalis peruviana, inhibe la proliferación celular a través de la regulación positiva de proteínas pro-apoptóticas (Bax y Bad), y la regulación negativa de proteínas anti-apoptóticas (Bcl-2, Bcl-xl), así como la proteína inhibidora de apoptosis XIAP. Esto indicaría que la inducción de la apoptosis mediada por el extractos etanólicos de Physalis peruviana sería a través del sistema CD95/CD95L y la vía de transducción de señales mitocondrial20. En el mismo estudio, el IS para el extracto de Physalis peruviana en la línea celular Hep G2, fue de 303, cifra comparable con nuestro estudio, para el caso de la línea celular K-562.
Los agentes antineoplásicos son conocidos por inducir citotoxicidad en células tumorales, a través de diversos mecanismos, en los cuales los eventos de señalización juegan un rol importante dependiendo del tipo celular y el estímulo. Se necesita encontrar nuevos agentes anticancerígenos que puedan matar células cancerosas con una toxicidad mínima en células normales50.
En conclusión, los CI50 de los extractos etanólicos de tallos y hojas de Physalis peruviana fueron menores para HT-29, PC-3 y K-562 en relación al cisplatino y 5-FU, lo que significa que Physalis peruviana tuvo un efecto citotóxico mayor que los antineoplásicos mencionados. Por el contrario, los CI50 de los extractos de hojas y tallos de Physalis peruviana fueron mayores para VERO que los CI50 del cisplatino y 5-FU, lo que indica que la citotoxicidad de Physalis peruviana es menor en las células normales, con relación a los controles empleados en el bioensayo.
Los resultados del presente trabajo son prometedores e invitan a continuar estudios sobre las diferentes propiedades antitumorales de los extractos etanólicos de Physalis peruviana, a fin de aislar sus principios activos y evaluarlos en otras líneas tumorales. Así también, determinar su mecanismo de acción, y evaluar su gran potencial como agente antineoplásico.
REFERENCIAS
1. HAMBURGER M, HOSTETTMANN K. Phytochemistry bioactive in plants. The link between phytochemistry & medicine. Phytochemistry. 1991; 30: 3864-3867.
2. RATES SM. Plants as source of drugs. Toxicon. May 2001; 39: 603-613.
3. ARUNM, ASHAVV. Preliminarystudiesonantihepatotoxic effect of Physalis peruviana Linn. (Solanaceae) against carbon tetrachloride induced acute liver injury in rats. J Ethnopharmacol. Apr 20 2007; 111: 110-114.
4. BASTOS GN, SANTOS AR, FERREIRA VM, COSTA AM, BISPO CL, SILVEIRA AJ, et al. Antinociceptive effect of the aqueous extract obtained from roots of Physalis angulata L. on mice. J Ethnopharmacol. Jan 16 2006;103:241-245.
5. SHISHKIN BK, BOBROV EG, 1995. Flora of the USSR. Moscow. Vol 22, pp. 62.
6. BAILEY LH. Manual of Cultivated Plants. Macmillan, New York; 1977, pp. 871.
7. MAGUIÑA VC. Ser médico en el Perú: Vivencias y algo más. Segunda ed. Huaraz: DIJAES SRL; 2005.
8. RAM A, BAINI P, CHOPRA R, SANTAPAU H, KRISHNAN MS, 2003. TheWealth of India Raw Materials, vol. VIII (revised). Council of scientifi c and Industrial. Research publication, New Delhi, pp. 38–40.
9. CHIANG HC, JAW SM, CHEN PM. Inhibitory effects of physalin B and physalin F on various human leukemia cells in vitro. . Anticancer Research 1992a.; 12: 1155– 1162.
10. AHMAD S, MALIK A, YASMIN R, AHMAD S, MALIK A, AFZA N, et al. A new withanolide glycoside from physalis peruviana. J Nat Prod. 1999 Mar;62:493-4.
11. WU S, TSAI JY, CHANG SP, LIN DL, WANG SS, HUANG SN, et al. Supercritical carbon dioxide extract exhibits enhanced antioxidant and anti-infl ammatory activities of Physalis peruviana. J Ethnopharmacol 2006;108:407-413.
12. DINAN LN, SARKER SD, SIK V. 28-HydroxywithanolideEfrom Physalis peruviana. Phytochemistry. 1997; 44: 509–512.
13. KEITH B, MCGAW BA, WOOLLEY JG. Phygrine, an alkaloid from Physalis species. Phytochemistry 1992; 31: 4173–4176.
14. ELLIGER CA, EASH JA, ANTHONY C, WAISS J. Kaempferol and quercetin di- and triglycosides from Physalis peruviana leaves. . Biochemical Systematics and Ecology. 1992.;20:268.
15. WANG IK, LIN-SHIAU SY, LIN JK, of EJ, Cancer 35. Induction of apoptosis by apigenin and related fl avonoids through cytochrome c release and activation of caspase-9 and caspase-3 in leukaremia HL-60 cells. European Journal of Cancer. 1999;35:1517–1525.
16. WATSON D, OLIVEIRA GEJ. Solid-phase extraction and gas chromatography-mass spectroscopy determination of kaempferol and quercetin in human urine after consumption of Ginkgo biloba. Journal of Chromatography B Biomedical Science Applications 1999. ;723:203–210.
17. CHIANG HC, JAW, S.M., CHEN, C.F., KAN, W.S., . Antitumor agent, physalin F from Physalis angulata L. Anticancer Research. 1992b.;12 837–843.
18. ISMAIL N, ALAM M. A novel cytotoxic fl avonoid glycoside from Physalis angulata. Fitoterapia 2001.;72:676–679.
19. WU SJ, NG LT, CHEN CH, LIN DL, WANG SS, LIN CC. Antihepatoma activity of Physalis angulata and P. peruviana extracts and their effects on apoptosis in human Hep G2 cells. Life Sci. Mar 5 2004;74:2061- 2073.
20. WU SJ, NG LT, LIN DL, HUANG SN, WANG SS, LIN CC. Physalis peruviana extract induces apoptosis in human Hep G2 cells through CD95/CD95L system and the mitochondrial signaling transduction pathway. Cancer Lett. Nov 25 2004;215:199-208.
21. JEMAL A, SIEGEL R, WARD E, MURRAY T, XU J, THUN MJ. Cancer statistics, 2007. CA Cancer J Clin. Jan-Feb 2007;57:43-66.
22. MEYERHARDT JA, MAYER RJ. Systemic therapy for colorectalcancer. NEnglJMed. Feb32005;352:476-487.
23. KATO T, SHIMAMOTO Y, UCHIDA J, OHSHIMO H, ABE M, SHIRASAKA T, et al. Possible regulation of 5-fluorouracil-induced neuro- and oral toxicities by two biochemical modulators consisting of S-1, a new oral formulation of 5-fl uorouracil. Anticancer Res. May-Jun 2001;21:1705-1712.
24. LAVELLE F. [New anticancer molecules: drugs for tomorrow?]. Bull Cancer. Jan 1999;86:91-95.
25. YAMANAKA T, MATSUMOTO S, TERAMUKAI S, ISHIWATA R, NAGAI Y, FUKUSHIMA M. Analysis of risk factors for severe adverse effects of oral 5-fluorouracil S-1 in patients with advanced gastric cancer. Gastric Cancer. 2007;10(2):129-134.
26. DAMBER JE, AUS G. Prostate cancer. Lancet. May 17 2008;371(9625):1710-1721.
27. Centro de Investigación en Cáncer "Maes Heller". Instituto Nacional de Enfermedades Neoplásicas. Registro de Cáncer de Lima Metropolitana 1994- 1997. Vol III. Dic. 2004.
28. QUINN M, BABB P. Patterns and trends in prostate cancer incidence, survival, prevalence and mortality. Part II: individual countries. BJU Int. Jul 2002;90(2):174-184.
29. DOYLE-LINDRUD S. Prostate cancer: a chronic illness. Clin J Oncol Nurs. Dec 2007;11:857-861.
30. ROSENBERG JE, WEINBERG VK, KELLY WK, MICHAELSON D, HUSSAIN MH, WILDING G, et al. Activity of second-line chemotherapy in docetaxelrefractory hormone-refractory prostate cancer patients : randomized phase 2 study of ixabepilone or mitoxantrone and prednisone. Cancer. Aug 1 2007;110:556-563.
31. SKEHAN P, STORENG R, SCUDIERO D, MONKS A, MCMAHON J, VICTICA D, et al. New colorimetric cytotoxicity assay for anticancer-drug screening. Journal of the National Cancer Institute. 1990;82:1107–1112.
32. LEE SW, PAN MH, CHEN CM, CHEN ZT. Withangulatin I, a new cytotoxic withanolide from Physalis angulata. Chem Pharm Bull (Tokyo). Feb 2008;56:234-236.
33. COLOMBO ML, BUGATTI C, MOSSA A, PESCALLI N, PIAZZONI L, PEZZONI G, et al. Cytotoxicity evaluation of natural coptisine and synthesis of coptisine from berberine. Farmaco. May-Jul 2001;56:403-409.
34. WEITZ J, KOCH M, DEBUS J, HOHLER T, GALLE PR, BUCHLEr MW. Colorectal cancer. Lancet. Jan 8-14 2005;365(9454):153-165.
35. KAIGHN ME, NARAYAN KS, OHNUKI Y, LECHNER JF, JONES LW. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. Jul 1979;17:16-23.
36. KUMAR S, SURESH PK, VIJAYABABU MR, ARUNKUMAR A, ARUNAKARAN J. Anticancer effects of ethanolic neem leaf extract on prostate cancer cell line (PC-3). J Ethnopharmacol. Apr 21 2006;105(1- 2):246-250.
37. MAGALHAES HI, VERAS ML, TORRES MR, ALVES AP, PESSOA OD, SILVEIRA ER, et al. In-vitro and in-vivo antitumour activity of physalins B and D from Physalis angulata. J Pharm Pharmacol. Feb 2006;58:235-241.
38. SAETUNG A, ITHARAT. ARUNPORN, DECHSUKHUM C, WATTANAPIROMSAKUL C, KEAWPRADUB N, RATTANASUWAN P. Cytotoxic activity of thai medicinal plants for cancer treatment. Songklanakarin J.of Sci. Technol. 2005;27:469-478.
39. HUAN SD, STEWART DJ, AITKEN SE, SEGAL R, YAU JC. Combination of epirubicin and cisplatin in hormone-refractory metastatic prostate cancer. Am J Clin Oncol. Oct 1999;22:471-474.
40. SWANSON GP, FAULKNER J, SMALLEY SR, NOBLE MJ, STEPHENS RL, O´ROURKE TJ, et al. Locally advanced prostate cancer treated with concomitant radiation and 5-fluorouracil: Southwest Oncology Group Study 9024.. J Urol. Aug 2006;176:548-553; discussion 553.
41. GAO X, ZHANG G, ZHOU M, LUO D, LI B. Antiproliferative activity of Goldfussia psilostachys ethanolic extract on K562 leukemia cells. Fitoterapia. Dec 2004;75(7- 8):639-644.
42. ROSSI H, ROTHENBERGER DA. Surgical treatment of colon cancer. Surg Oncol Clin N Am. Jan 2006; 15: 109-127, vii.
43. CATALONA. WJ. Surgical management of prostate cancer. Contemporary results with anatomic radical prostatectomy. Cancer 1995;75:1903-1908.
44. SONPAVDE G, CHI KN, POWLES T, SWEENEY CJ, HAHN N, HUTSON TE, et al. Neoadjuvant therapy followed by prostatectomy for clinically localized prostate cancer. Cancer. Dec 15 2007;110:2628- 2639.
45. CHODAK G, THISTED R, GERBER G, JOHANSSON J, ADOLFSSON J, JONES G. Results of conservative management of clinically localized prostate cancer. N Engl J Med. 1994;330:242-248.
46. KANTARJIAN HM, O'BRIEN S, CORTES J, GILES FJ, RIOS MB, SHAN J, et al. Imatinib mesylate therapy improves survival in patients with newly diagnosed Philadelphia chromosome-positive chronic myelogenous leukemia in the chronic phase: comparison with historic data. Cancer. Dec 15 2003;98:2636-2642.
47. DRUKER BJ. Imatinib mesylate in the treatment of chronic myeloid leukaemia. Expert Opin Pharmacother. Jun 2003;4(6):963-971.
48. APPERLEY JF. Part II: management of resistance to imatinib in chronic myeloid leukaemia. Lancet Oncol. Dec 2007;8:1116-1128.
49. LOS M, BUREK CJ, STROH C, BENEDYK K, HUG H, MACKIEWICZ A. Anticancer drugs of tomorrow: apoptotic pathways as targets for drug design. Drug Discov Today. Jan 15 2003;8:67-77.
50. TIAN Z, CHEN S, ZHANG Y, HUANG M, SHI L, HUANG F, et al. The cytotoxicity of naturally occurring styryl lactones. Phytomedicine. 2006; 13 181–186.
Correspondencia:
Dr. Angel Quispe-Mauricio.
Av. Colectora Cuadra 1 Urb Residencial
Los Olivos de Ate. Lima 3, Perú
Correo-e: angelquispe2@gmail.com













