Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.29 n.4 Lima oct./dic. 2009
ARTÍCULOS ORIGINALES
Técnica de sedimentación en tubo de alta sensibilidad para el diagnóstico de parásitos intestinales
Spontaneous sedimentation in tube technique (sstt) for diagnosis of intestinal parasites
Angélica Terashima1, Luis Marcos1,2, Vicente Maco1, Marco Canales1, Frine Samalvides1, Raúl Tello1.
1. Instituto de Medicina Tropical Alexander Von Humboldt (IMTAVH), Universidad Peruana Cayetano Heredia, Lima, Perú.
2. Washington University School of Medicine, Infectious Diseases Division, St. Louis, Missouri, US.
RESUMEN
OBJETIVO. El objetivo de este estudio fue medir la eficacia diagnóstica de la técnica de sedimentación espontánea en tubo descrita por Tello (TSET), en comparación con el examen directo y otras técnicas de concentración, cuando se usa para determinar la prevalencia de enteroparasitosis en trabajos de campo y laboratorio en zonas rurales de la sierra y selvas peruanas.
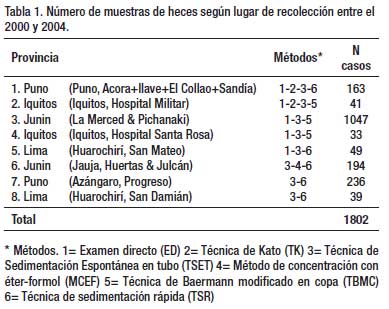
METODOS. Se realizó un estudio prospectivo (2000 – 2004) donde se incluyeron 1 802 muestras de heces de diversas zonas del Perú: Iquitos (N=74), Puno (N=399), Junín (N=1241), Lima (N=88).
RESULTADOS. La TSET presentó mayor sensibilidad para la detección de helmintos y protozoarios en comparación con las otras técnicas convencionales empleadas simultáneamente (P<0.000). Aunque no se debe prescindir de otras técnicas coprológicas, como Baermann para diagnóstico de Strongyloides stercoralis y la Técnica de Sedimentación Rápida de Lumbreras (TSR) para Fasciola hepatica, la TSET contribuye a un diagnóstico eficaz y oportuno de las enteroparasitosis.
CONCLUSIONES. Debido a su bajo costo, fácil ejecución y adaptabilidad en la realización, tanto en el trabajo dentro de laboratorios como en los trabajos de campo, se constituye en un hecho de necesidad urgente su implementación en los laboratorios de áreas rurales, así como la capacitación del personal de salud encargado del diagnóstico, como un primer paso en la lucha contra la parasitosis intestinal en el Perú.
PALABRAS CLAVES: Técnica de Sedimentación en Tubo, Parásitos intestinales, Perú.
ABSTRACT
OBJECTIVE. The objective of this study was to evaluate the diagnostic efficacy of the Spontaneous Sedimentation in Tube Technique (SSTT) described by Tello, in comparison with the direct smear and other concentration techniques, when it is used to determine the prevalence of intestinal parasites in field and laboratory studies in rural areas of the Andean Region.
METHODS. A prospective study (2000 – 2004) was carried out including 1 802 fecal samples from several areas around Peru: Iquitos (N=74), Puno (N=399), Junín (N=1241), Lima (N=88).
RESULTS. SSTT showed more sensitivity to detect helminthes and protozoa in comparison to other conventional techniques carried out simultaneously (P;0.000). Although Baermann Technique and Lumbrera's Rapid Sedimentation Technique are crucial for Strongyloides larvae and Fasciola eggs detection, respectively; SSTT contributes to an effective and timely diagnosis of the intestinal parasites.
CONCLUSIONS. Due to its low cost, easy reproducibility and adaptability both in the laboratory and field work, it should be mandatory and urgent its implementation in laboratories from rural areas, as well as training of the staff involved in the diagnosis, as first step in the fight against intestinal parasites in Peru.
KEYWORDS: Spontaneous Sedimentation in Tube Technique, Intestinal Parasites, Peru
INTRODUCCIÓN
La parasitosis intestinal representa un problema de Salud Pública, al situarse dentro de las diez primeras causas de muerte en países en vías de desarrollo, principalmente. (1) En el Perú, los helmintos y protozoarios están ampliamente distribuidos en la costa, sierra y selva y su hallazgo es muy frecuente. Las características climáticas, los factores socioeconómicos y culturales de las poblaciones son determinantes para explicar la magnitud de este problema( 2,3). Coincidiendo con Náquira, se estima que uno de cada tres peruanos es portador de uno o más especies de parásitos en el intestino. (4)
Por lo tanto, es importante hacer un diagnóstico oportuno de las infecciones parasitarias intestinales para poder brindar un tratamiento precoz y así evitar la morbilidad o mortalidad, en casos extremos, que producen. Algunos autores proponen una relación entre las infecciones parasitarias y consecuencias negativas en la función cognoscitiva, la habilidad para el aprendizaje y anemia. (5-7) Otros han mostrado relación entre las infecciones parasitarias intestinales y los niveles de hemoglobina, postulando que existe relación entre los parásitos, intensidad de infección y anemia. (8-10)
En el Perú, las técnicas de diagnóstico de escasa eficacia implementadas en la mayoría de áreas rurales, así como en hospitales, centros o puestos de salud de zonas urbanas (examen directo en solución salina y lugol, al cual se denomina seriado si es ejecutado en número de dos o tres) subdiagnostican y subestiman la prevalencia real de la infección por parásitos intestinales. Sin embargo, aun así se reportan altas tasas de parasitismo y esto aumenta cuando se ejecuta una técnica parasitológica de sedimentación. (11-16)
La necesidad de establecer técnicas de laboratorio confiables, reproducibles, de bajo costo y de mayor eficacia diagnóstica de las enteroparasitosis, es imperativa para casos no diagnosticados en exámenes de rutina y con sospecha clínica o en los controles post-tratamiento, así como para establecer fracasos al tratamiento antiparasitario de uso rutinario. En los casos en que la infestación es leve o los métodos de rutina tienen baja sensibilidad diagnóstica, como sucede en el examen directo, estos métodos de concentración simples ayudarían a establecer diagnósticos altamente eficaces y confiables para luego establecer el tratamiento específico.
Por consiguiente, la necesidad de un diagnóstico rápido y eficaz mediante el uso e implementación de herramientas diagnósticas adecuadas será fundamental para iniciar esquemas masivos de tratamiento antiparasitario. Por ello es necesario implementar una técnica parasitológica sencilla y eficaz que pueda ser reproducible en los centros y puestos de salud a lo largo del Perú, donde actualmente se realiza el examen parasitológico del método denominado directo, el cual nos brinda información subestimada de la parasitosis intestinal en nuestro país.
El objetivo de este estudio es evaluar la Técnica de Sedimentación Espontánea en Tubo, descrita por Tello, determinando la eficacia diagnóstica del método en comparación con el examen directo y otras técnicas de concentración para conocer la prevalencia de la enteroparasitosis en trabajos de campo y de laboratorio, en zonas rurales de la sierra y selva peruanas.
MATERIALES Y MÉTODOS
El presente estudio prospectivo se inició en el año 2000, mediante un Proyecto de Investigación titulado Implementación y Evaluación de la Técnica de Sedimentación Espontánea en Tubo descrita por Tello para países en vías de desarrollo, el cual fue ejecutado en diferentes regiones del Perú hasta finales del 2003. Este estudio tiene como finalidad evaluar esta técnica en diferentes regiones del Perú, tanto en condiciones de campo como de laboratorio. Esta técnica es de uso rutinario en el Laboratorio de Parasitología del Instituto de Medicina Tropical Alexander von Humboldt (IMTAVH) de la Universidad Peruana Cayetano Heredia.
Áreas de estudio. Las zonas donde se recolectaron las muestras de heces en los cuatro años que duró el proyecto fueron: en el año 2000, los Hospitales Militar y Regional de Iquitos (Loreto), los centros poblados de Sandia, Acora, Ilave y El Collao (Puno), y los distritos de Huertas y Julcán en Jauja (Junín); en el 2001, el centro poblado de San Mateo de Huanchor en Huarochirí (Lima) y el centro poblado de Progreso en Azángaro (Puno); en el 2002, el Hospital Santa Rosa de la ciudad de Iquitos (Loreto) y el centro poblado de San Damián en Huarochirí (Lima); en el 2003, las ciudades de La Merced y Pichanaki en Chanchamayo (Junín). Las zonas fueron seleccionadas por su fácil accesibilidad a las poblaciones rurales como a los hospitales o centros de salud. Todas las áreas seleccionadas pertenecían a poblaciones de bajos recursos económicos y en extrema pobreza.
Número de pacientes. Los pacientes fueron tomados de campañas de despistaje de enteroparásitos que organizamos en cada zona y el número de muestras de heces evaluadas fueron las que se lograron recolectar durante los días que duraban las campañas. En algunos lugares, como La Merced y Pichanaki, la estadía fue de dos meses, mientras que en otras zonas como Iquitos, Puno, San Mateo de Huanchor, San Damián y Jauja, la estadía fue entre 5 y 14 días.
Recolección de las muestras de heces. Un envase nuevo de plástico (250 cc), de boca ancha, con tapa rosca, con un número de identificación, fue proporcionado a cada persona. Cada individuo recibió dos envases, luego se les solicitó que trataran de llenarlo con su propia muestra fecal y devolverlo inmediatamente. Las muestras de heces fueron recolectadas con el consentimiento o asentimiento de cada adulto o menor de edad, respectivamente, y el consentimiento de los padres o tutores de los menores. Los datos personales fueron anotados en el envase. Las muestras recolectadas por los pacientes fueron preservadas en formol al 10% y fueron debidamente transportadas al Laboratorio de Parasitología del IMTAvH en Lima. Algunas muestras fueron procesadas sin preservante en la misma zona de estudio y el diagnóstico fue verificado por lo menos con dos técnicos experimentados.
Técnicas parasitológicas. Una vez obtenidas las muestras fecales, éstas fueron transportadas a Lima formolizadas, para su procesamiento en el laboratorio arriba mencionado. Esto ocurrió para las muestras procedentes de Sandia, Acora, Ilave, El Collao, Huertas, Julcán, San Mateo de Huanchor, San Damián y Progreso. En los Hospitales de Pichanaki y La Merced, mediante un protocolo de implementación de técnicas parasitológicas, se procesaron las muestras frescas en un ambiente instalado por el IMTAvH en cada laboratorio de ambos hospitales. En Iquitos se instaló el Laboratorio de Parasitología del IMTAvH en el Hospital Regional de Iquitos y las muestras frescas fueron procesadas por personal técnico del IMTAvH. Las muestras de heces fueron examinadas mediante tres, cuatro o cinco técnicas parasitológicas: examen parasitológico directo, Técnica de Kato, Técnica de Sedimentación Espontánea en Tubo, Método de Concentración Éter-formol, Método de Baermann modifi cado en copa y Técnica de Sedimentación Rápida de Lumbreras.
A continuación describimos brevemente el protocolo de cada técnica empleada:
Examen parasitológico directo (ED).
Se colocó aproximadamente 2 mg de heces en una lámina portaobjetos, se hizo un homogenizado encima de la lámina con 2 gotas de solución salina. Se colocó una laminilla de celofán de 6x2 cm. Se observó al microscopio (100X y 400X).(17)
Técnica de Kato (TK).
Se hizo un frotis grueso con heces a lo largo de una lámina, se agregó solución de Kato para permitir la mejor visualización de helmintos. Se cubrió y se hizo la lectura (100X y 400X).(17)
Técnica de Sedimentación Espontánea en Tubo (TSET).
La técnica se llevó a cabo de acuerdo con las descripciones realizadas por Tello en 1987.(23) Se separó aproximadamente 4g de heces de cada recipiente y se hizo un homogenizado en 10 ml de solución salina hasta que se logró una suspensión adecuada. La mezcla fue vertida en un tubo cónico de plástico de 13 x 2.5cm, de 50 ml de capacidad filtrándola a través de gasa. Se completó el volumen del tubo con solución salina y se tapó herméticamente. Se agitó enérgicamente por 30 segundos y se dejó reposar por 45 minutos. Se eliminó el sobrenadante y con una pipeta se tomó una muestra del fondo del tubo. Se colocaron 4 gotas en dos láminas distintas, agregándole luego gotas de lugol y de solución salina a cada una. Finalmente, las láminas portaobjetos fueron cubiertas con laminillas de celofán de 6x2cm. Se observó al microscopio (100X y 400X). (18-23)
Método de Concentración con Éter- Formol (MCEF).
Parte del total de muestras fueron procesadas por el Método de Concentración con Éter-Formol (MCEF).(24) Las muestras preservadas con el fijador fueron homogenizadas con formol adicional dependiendo de la cantidad y viscosidad de la muestra. Parte de ésta fue tamizada a través de dos capas de gasa y trasvasada a un tubo cónico de centrífuga de 15 ml, completándose con formol hasta 10 ml, luego de lo cual fue centrifugada a 2500 rpm por 10 minutos, para obtener de 0.5 a 1 ml de sedimento. Se decantó el sobrenadante y posteriormente se agregó NaCl al 0.09% hasta completar un volumen de 10ml y se centrífugó a 2500 rpm por 10 min. Luego de una nueva decantación se obtuvo un sedimento de aproximadamente 1 ml. Se adicionó formol al 10% hasta 5 ml y, a continuación, acetato de etilo hasta completar un volumen de 10 ml, agitándose vigorosamente la mezcla por 30 segundos. Se empleó acetato de etilo como sustituto del éter, debido a que es menos inflamable, de menor costo y menos dañino para su uso en el laboratorio y porque se ha demostrado que no se presentan distorsiones ni alteraciones en la morfología de los huevos, larvas o quistes de las muestras estudiadas.(25) Se centrifugó por 10 minutos y se obtuvo 4 capas distintivas: una cantidad pequeña de sedimento en el fondo del tubo, una capa de formol, un tapón de detritus sobre la capa de formol y una capa de acetato de etilo en la cercanía del tope del tubo. El tapón de detritus fue eliminado desprendiéndola por medio de una bagueta. Se decantó todo el sobrenadante y se colocaron gotas del sedimento con una pipeta en dos láminas, a las que se les agregó lugol y solución salina, respectivamente. Finalmente las láminas portaobjetos fueron cubiertas con laminillas de celofán y observadas al microscopio óptico (100X y 400X).
Técnica de Baermann Modifi cado en Copa (TBMC).
Esta técnica se realizó como método de elección en el diagnóstico de Strongyloides stercoralis. Primero se colocó una rejilla de metal sobre la parte inferior de la copa de sedimentación, luego se agregó una capa doble de gasa sobre el metal. Se puso aproximadamente 5 a 10g de muestras de heces sobre la gasa en la rejilla. Se agregó solución salina a 37oC por las paredes de la copa, de tal manera que la muestra de heces fuese cubierta completamente por la solución salina. Se dejó reposar la copa a temperatura ambiente, aproximadamente de 30 a 45 minutos. Se retiró la rejilla de metal y se desechó la muestra junto con la gasa. Se tomó una muestra pequeña de sedimento del fondo de la copa y se colocó en un blister. Finalmente se examinó la muestra bajo microscopio de luz (25X, 100X). (26)
Técnica de Sedimentación Rápida de Lumbreras (TSR).
De cada recipiente de plástico se tomaron de 4 a 8 g de heces que fueron homogenizados con agua corriente filtrada, en un tubo cónico de 50 ml de capacidad. La mezcla se trasvasó a un recipiente de vidrio, de boca ancha, de 200 a 300ml de capacidad, con previo tamizaje a través de un colador de plástico. Se completó el volumen con agua filtrada y se dejó reposar por 30 minutos. Luego se decantó los 2/3 del sobrenadante y se volvió a completar el mismo volumen inicial con agua filtrada. Se repitieron los mismos pasos 3-5 veces con un intervalo de 30 min., hasta que el sobrenadante quedó limpio. Finalmente, el último sedimento fue vertido en una placa petri de vidrio. Se observó al microscopio (10X, 100X). (27)
Análisis estadístico. Los resultados fueron ordenados, clasificados y codificados. El análisis estadístico fue procesado en el SPSS 9.0 para Windows (Copyright© SPSS Inc., 1989-1999). Un valor de p<0.05 fue considerado como el nivel crítico de significancia. La sensibilidad de las técnicas se evaluó mediante la fórmula: número de muestras positivas / número total de muestras evaluadas. La comparación de proporciones se realizó mediante la prueba de Chi-cuadrado, calculándose los respectivos valores p.
Consideraciones éticas. Se solicitó el consentimiento informado oral a los individuos adultos y los padres o tutores de los menores, y el asentimiento informado a los menores de edad, A las autoridades de Salud de los respectivos Hospitales, Centros, y Postas de Salud de Junín, Puno, Lima y Loreto, se les informó sobre los objetivos del proyecto, beneficios (diagnóstico gratuito) y riesgos (mínimos).
RESULTADOS
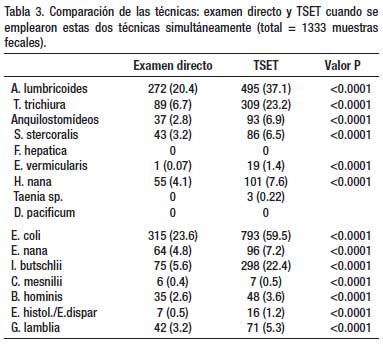
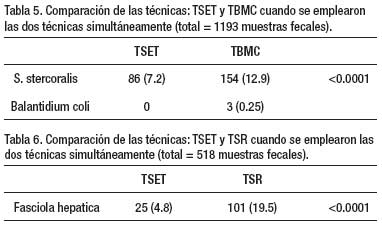
Un total de 1 802 exámenes de heces se realizaron en 4 años de estudio, con empleo de dos o más técnicas de diagnóstico (Tabla 1). La Tabla 2 muestra que en 204 especímenes, procesados por tres técnicas parasitológicas simultáneamente (ED – TK – TSET), la mayor eficacia diagnóstica fue la de la TSET, con diferencia estadísticamente significativa. En la Tabla 3, en 1333 muestras de heces se realizó simultáneamente la TSET y ED y hubo mayor eficacia diagnóstica estadísticamente significativa, para todos los parásitos intestinales, con la TSET. En la Tabla 4, cuando se comparó el MCEF y TSET con 194 muestras fecales para evaluar la eficacia, se observó mayor sensibilidad con TSET, pero no hubo significancia estadística, excepto para T. trichiura y algunos protozoarios. En la Tabla 5 se muestra que TBMC tuvo mayor eficacia para diagnóstico de S. stercoralis, estadísticamente significativa, en 1193 muestras de heces procesadas (P<0.0001). Finalmente, en la Tabla 6, al comparar TSR y TSET, en 518 muestras de heces, se obtuvo una mayor eficacia significativa con TSR para la detección de huevos de F. hepatica (P<0.0001).
DISCUSIÓN
En concordancia con nuestros resultados, es importante y urgente disponer de técnicas coproparasitológicas sencillas, de bajo costo, alta eficacia y especialmente ser reproducibles en los laboratorios de áreas rurales, como la TSET o Técnica de Tello llamada así por ser el Dr. Raúl Tello, médico parasitólogo e investigador del IMTAvH, quien la describió en 1987 e hizo modificaciones posteriores para ser implementada en trabajos de campo y diagnósticos precisos de laboratorio. La alta eficacia diagnóstica descrita a partir de estudios preliminares nos condujo a realizar este estudio prospectivo para el diagnóstico precoz de enteroparásitos, para poder establecer medidas de control sanitario y terapéutico a nivel poblacional.
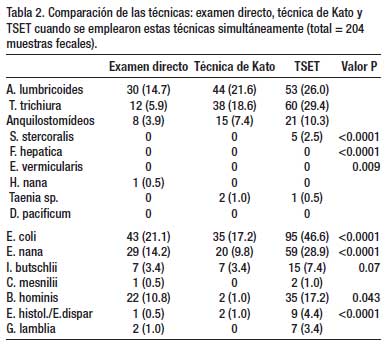
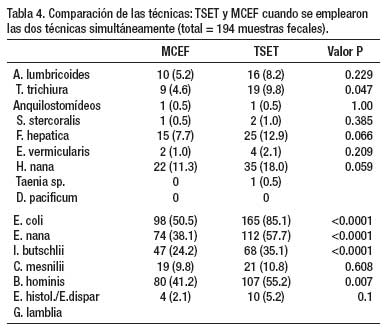

Según nuestros resultados, la Técnica de Sedimentación Espontánea en Tubo tiene una alta eficacia en el diagnóstico de la mayoría de los enteroparásitos de nuestro medio, teniendo ventajas frente a técnicas convencionales (ED, TK) y otros métodos de concentración (MCEF), que incluye la propiedad de diagnosticar tanto protozoarios como helmintos. A pesar que no hubo una diferencia significativa entre esta última técnica y la TSET, esta tuvo mayor eficacia y diagnosticó más casos de helmintos y protozoarios que el MCEF. Cabe señalar que el MCEF es una técnica ampliamente usada internacionalmente como método de concentración, cuyo costo y procedimiento son más significativos, y junto al uso de la centrifuga no lo hace ideal para nuestro medio.
Por otro lado, la TBMC y TSR fueron superiores que la TSET en el diagnóstico de S. stercoralis y F. hepática, respectivamente. Por ello, esta técnica, si bien es cierto, diagnostica la mayoría de helmintos y protozoarios debe emplearse como método adicional o complementario a la TBMC y TSR en trabajos de campo donde exista la fasciolosis y la strongyloidosis en forma endémica.
En nuestro país el método parasitológico empleado rutinariamente en los centros de salud y hospitales para descartar la infección por parásitos intestinales es el examen directo de heces. Inclusive se solicita en repetidas oportunidades (denominándose seriado) para descartar la parasitosis. Como hemos observado las diferencias entre el examen directo y la TSET son amplias y se debe de ejecutar un programa de implementación de esta técnica en los centros de salud y hospitales distribuidos a nivel nacional.
Como observamos, la TSET debe ser de necesidad primordial en los laboratorios de los hospitales como método rutinario que reemplace al examen directo. Estos métodos de fácil ejecución son útiles también en trabajos de campo y, por lo tanto, aplicables para el desarrollo de campañas de desparasitación masiva en poblaciones de alto riesgo.
Las altas tasas de parasitismo en el Perú nos obligan a implementar la Técnica de Sedimentación en Tubo en programas de control y prevención contra la parasitosis intestinal para obtener resultados más confiables. La eliminación de las formas infectantes parasitarias y la disminución de la carga parasitaria en la población, como solución a corto plazo es propuesta por la Organización Mundial de la Salud (OMS), cuando impone a los gobiernos de países en vías de desarrollo la desparasitación masiva de los grupos de riesgo, mediante la administración de monodosis de benzimidazoles una vez cada 6 meses. Sin embargo, el seguimiento de los pacientes no debería ser realizado con el examen directo por su baja sensibilidad y en consecuencia no tendríamos la seguridad que el paciente haya erradicado al parásito ni refleja la cifra real de nuevos pacientes parasitados.
Si bien las posibilidades de infección son enormes en zonas endémicas, estas serán mucho menores si se emplea como criterio de monitoreo la carga parasitaria, sin cambiar los hábitos de riesgo, por el hecho de eliminarse cada vez menos parásitos, la contaminación sería menor. Progresivamente, este hecho derivará necesariamente en una disminución de la transmisión parasitaria. La solución más adecuada que cumpla con esta alternativa de control poblacional es el empleo de la TSET en los centros de salud de zonas rurales debido a su sencillez de ejecución, bajo costo y alta eficacia diagnóstica.
Otros autores,18,19 describen también una mayor sensibilidad con la TSET que con el examen directo de heces; esto se hace evidente en nuestro estudio prospectivo donde hemos analizado el mayor número de muestras en distintas regiones del Perú, antes nunca evaluado a gran escala.
Recomendamos la implementación de esta técnica coproparasitológica en los laboratorios de áreas rurales y urbanas, así como la capacitación al personal técnico sobre los materiales, procedimientos y metodología para ser establecida como método rutinario y de descarte de enfermedades parasitarias.
Finalmente, proponemos que la Técnica de Tello sea empleada en estudios posteriores de prevalencia y tamizaje de enteroparásitos a lo largo de nuestro país, con la finalidad de evitar su subestimación y tener una idea concreta y real para posteriormente desarrollar adecuados programas de control, tratamiento y prevención, así como también la capacitación y orientación al personal de salud de esta eficaz técnica de diagnóstico coproparasitológico.
Agradecimientos. Agradecemos al Dr. Eduardo Gotuzzo, Director del Instituto de Medicina Tropical Alexander von Humboldt (IMTAvH) de la Universidad Peruana Cayetano Heredia, Lima, Perú; por su gentil apoyo durante los años del presente estudio. A la Sra. Carmen Quijano del Laboratorio de Parasitología del IMTAvH, de manera muy especial, por su apoyo y colaboración constante durante el periodo que abarcó el estudio.
Financiamiento. Este estudio fue autofinanciado por los autores y el Instituto de Medicina Tropical Alexander von Humboldt de la Universidad Peruana Cayetano Heredia, Lima, Perú.
REFERENCIAS
1. Organizacion Panamericana de la Salud, Oficina Sanitaria Panamericana, Oficina Regular de la OMS. La Salud en las Americas ED.98, Washington DC; OPS Publicacion Cientifica, Vol.2, No.569.
2. CORNEJO DA, GONZALES D, DIEGUES J. Estudio sobre Parasitismo intestinal en el Personal Tecnico, Administrativo y Auxiliar de los Hospitales de Iquitos. Arch Per Patol Clin. 1948; 2:123-130.
3. GONZALES ML. Algunas observaciones sobre parasitismo intestinal en escolares de Iquitos. Rev Med Exper. 1955; 9:110.
4. NAQUIRA C. Diagnostico y tratamiento de las enteroparasitosis. La Revista Medica 1997; 3:18-26.
5. NOKES C & BUNDY DAP. Does Helminth Infection Affect Mental Processing and Educational Achievement? Parasitology Today 1994; 10:14-18.
6. OBERHELMAN RA, GUERRERO ES, FERNANDEZ AM, SILIO M, MERCADO D, COMISKEY N, et al. Correlation between intestinal parasitosis, physical growth and psychomotor development among infants and children from rural Nicaragua. Am J Trop Med Hyg. 1998; 58:470-475.
7. CROMPTON DWT. Ascaris and childhood malnutrition. Tran R Soc Trop Med Hyg. 1992; 86: 577-579.
8. FERREIRA MR, SOUZA W, PEREZ EP, LAPA T, CARVALHO AB, FURTADO A, et al. Intestinal Helminthiasis and Anemia in Youngsters from Matriz da Luz, District of Sao Lourenco da Mata, State of Pernambuco, Brazil. Mem Inst Oswaldo Cruz, Rio de Janeiro. 1998; 93(3): 289-93.
9. BROOKER S, PESHU N, WARN PA, MOSOBO M, GUYATT HL, MARSH K, et al. The epidemiology of hookworm infection and its contribution to anaemia among pre-school children on the Kenyan Coast. Trans R Soc Trop Med Hyg. 1999; 93:240-246.
10. GARCIA A. Encuesta sobre parasitismo y anemia en los escolares de Yurimaguas, Iquitos. Rev. Salud. Pub. 1951; 6:63.
11. AYULO V. Estudio parasitologico en Satipo. Rev. Med. Exper. 1946; 5:86.
12. CORNEJO DA. Incidencia del Parasitismo Intestinal por helmintos y protozoos en el departamento de Madre de Dios. Ann Fac Med. 1959; 42:580.
13. DELGADO A. La helmintiasis intestinal en el distrito de Satipo. Arch Per Patol Clin. 1995; 19:130-131.
14. NAQUIRA F, CORDOVA E, NAQUIRA C. Contribucion al estudio del parasitismo I. Observaciones preliminares en algunas localidades del Sur del Peru. Arch Per Patol Clin. 1962; 16:41-50.
15. URTEAGA O. Algunas observaciones en la patologia del parasitismo intestinal. Arch Per Patol Clin. 1948; 2:215.
16. VALDIVIA L, MONTESINOS J, NAQUIRA F, CORDOVA E. El Parasitismo Intestinal en Quillabamba, provincia de la Convencion, departamento del Cuzco. Boletin Peruano de Parasitologia. 1979; 1:2-14.
17. FORBES BA, SAHM DF, WEISSFELD AS. Laboratory Methods for Diagnosis of Parasitic Infections. In: Bailey & Scott's Diagnostic Microbiology, Tenth Edition. Mosby, Inc., 1998; 859-860.
18. VERA L, TELLO R, TERASHIMA A, et al. Evaluacion en campo de la tecnica de sedimentacion espontanea para el diagnostico de enteroparasitosis. Revista Medica Herediana 1996; 7:50-51.
19. SALAS R, RODRIGUEZ J. Evaluacion de la tecnica de sedimentacion espontanea en el diagnostico de enteroparasitos. III Congreso Peruano de Parasitologia, 9, 1997.
20. TORRES M, COLAN E, CHAVEZ R. Comparacion de la efi cacia de la TSE con otras tecnicas para el diagnostico de Enteroparasitosis. Libro de Resúmenes V Congreso Peruano de Enfermedades Infecciosas y Tropicales. Bol SPEIT Vol.6 No.2 Abs.109.
21. SALAS R, CULLAS F, RODRIGUEZ J. Comparacion de metodos de diagnostico para helmintos. Libro de Resumes V Congreso Peruano de Enfermedades Infecciosas y Tropicales. Bol SPEIT Vol.6 No.2 Abs.91
22. RODRIGUEZ J, CULLAS F, SALAS R, MUSAYON J. Evaluacion de metodos diagnosticos para protozoarios. Libro de Resumes V Congreso Peruano de Enfermedades Infecciosas y Tropicales. Bol SPEIT Vol.6 No.2 Abs.90
23. TELLO R, CANALES M. Tecnicas de diagnostico de enfermedades causadas por enteroparasitos. Diagnostico 2000; 39(4):197-8.
24. KNIGHT W, HIATT R, BARNETT C, RITCHIE L. A modifi cation of the formol-eter concentration for increased sensitivity in detecting Schistosoma mansoni eggs. Am J Trop Med Hyg. 1976; 25: 818-23.
25. YOUNG KH, BULLOCK SL, MELVIN DM, SPRUILL CL. Ethyl Acetate as a Substitute for Diethyl Ether in Formalin-Ether Sedimentation Technique. J Clin Microbiol. 1979; 10(6): 852-853.
26. LUMBRERAS H, 1963. Strongyloidiosis: I. Evaluacion de la Tecnica de Baermann modifi cada en copa en el estudio de la strongyloidosis. Revista Medica Peruana 32(334): 119-126.
27. LUMBRERAS H, CANTELLA R, BURGA R. Acerca de un procedimiento de sedimentacion rapida para investigar huevos de Fasciola hepática en las heces, su evaluacion y uso en el campo. Revista Medica Peruana 1962; 31(332):167-174.
Correspondencia:
Angélica Terashima, MD
Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia; Av. Honorio Delgado 430, San Martín de Porras, Lima 31, Perú
AP 4314, Lima 100. Perú. Email: aterashima@upch.edu.pe
Teléfono: 511-2251273 Fax: 511-3821021













