Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Gastroenterología del Perú
versão impressa ISSN 1022-5129
Rev. gastroenterol. Perú v.30 n.3 Lima jul./set. 2010
ARTÍCULOS ORIGINALES
Perfil clínico, endoscópico e histológico de los humores estromales gastrointestinales en el Hospital Rebagliati
Clinical, endoscopic and histologic profile of the gastrointestinal stromal tumours in the Rebagliati Hospital
Carlos Ichiyanagui ; Oscar Frisancho y Alejandro Yábar
Departamento del Aparato Digestivo. Hospital Edgardo Rebagliati Martins, EsSALUD.
Departamento de Anatomía Patológica, HNERM, EsSALUD. Lima, Perú.
RESUMEN
INTRODUCCIÓN: Los Tumores Estromales Gastrointestinales (GIST) son lesiones que se originan a partirde las células intersticiales deCajal, y pueden tomar cursos asintomáticos o producir complicaciones, como hemorragia digestiva y degeneración maligna.
OBJETIVO: Determinar el perfil clínico, endoscópico e histológico de los pacientes con GIST diagnosticados en el Hospital Nacional Edgardo Rebagliati Martins (Lima-Perú), en enero del 2002 y diciembre del 2004.
MÉTODO: Estudio descriptivo, transversal, retrospectivo en el cual se revisaron las historias clínicas e informes anatomopatológicos de 34 pacientes con diagnóstico de GIST, vertiéndose los datos en una ficha de recolección.
RESULTADOS: Predominó el sexo masculino (58.82%) sobre el femenino. El grupo etáreo más afectado fue el de 71-80 años, con 26.47%, la edad promedio fue 64.7 años, con un rango de 30 a 86 años. La forma de presentación más frecuente fue dolor abdominal (47.06%) seguido de melena (44.12%). El diagnóstico se hizo por método endoscópico en 58.82%. El tipo histológico predominante fue el fusiforme (47.06%). Hubo riesgo de malignidad alto en 50% de casos, y la localización más frecuente fue estómago (61.77%). Endoscópicamente se manifiesta por la presencia de tumoración submucosa con ulceración y tamaño promedio de 6.44 cm. Se halló relación estadísticamente significativa entre método endoscópico y melena como forma de presentación (p<0.05).
CONCLUSIÓN: Los pacientes con GIST en el HNERM son en su mayoría varones, mayores de 60 años, que se presentan con dolor abdominal y melena, y es la endoscopía el mejor método para diagnosticarlos si acuden por melena (p < 0.05). Predomina la histología fusiforme.
PALABRAS CLAVE: Tumores estromales, tumores mesenquimales, tumores estromales gastrointestinales.
ABSTRACT
INTRODUCTION: Gastrointestinal Stromal Tumors (GIST) are lesions which origin from Intersticial Cells of Cajal that may be asymptomatic or cause complications like digestive bleeding or malignant transformation.
AIM: To determine the clinical, endoscopic and histological profile, as well as the main demographic features of patients with GIST in Hospital Edgardo Rebagliati (Lima-Perú) from January 2002 to December 2004.
METHODS: Descriptive, transversal and retrospective study in which we reviewed clinical and anatomopathological archives from 34 patients with GIST during the above mentioned period. The collected data were placed on a sheet of recollection.
RESULTS: There was male predominance (58.82%).The most affected age group was 71-80 years old (26.47%). The average age was 64.7 years old. The most frequent clinical presentation was abdominal pain (47.06%) followed by melena (44.12%). Diagnosis was made by endoscopic method in 58.82%. The main histological type was spindle (47.06%). There was high risk of malignancy in 50% and the most often involved site was stomach (61.77%). Endoscopicall the characteristic image was a submucosal tumor with ulceration, the average size was 6.44 cm. There was significant statistical relation (p< 0.05) between endoscopic method and melena.
CONCLUSION: Patients with GIST in HNERM are mostly men, older than 60 years that come with abdominal pain and melena, being endoscopy the best method to diagnose if patients present melena. Predominating histology was fusiform
KEY WORDS: Gastrointestinal stromal tumours, mesenchymal tumours.
INTRODUCCIÓN
Los tumores estromales gastrointestinales (GIST) son tumores que se originan del tejido mesenquimal de la pared del tracto gastrointestinal. Se ha postulado que las células que originan estos tumores son las células intersticiales de Cajal, que son las células marcapaso del tracto digestivo y se hallan en el plexo mioentérico (1-4).
Las células intersticiales de Cajal expresan positivamente los marcadores c-kit ó CD 117 y CD 34. Estos tumores son positivos también para actina (diferenciación a tejido muscular liso), S100 y Sinaptofisina (diferenciación a tejido nervioso) (5-7).
Estos tumores antiguamente eran clasificados como leiomiomas, leiomiosarcomas, neurofibromas, neurofibrosarcomas, schwanomas, benignos o malignos (1); asimismo se indica que todos estos tumores son mesenquimales o estromales y pertenecen a esta denominación de GIST (8-10).
La proteína C-KIT, también conocida como CD 117, es reconocida como marcador sensible y específico para GIST. El proto-oncogen del C-KIT, se halla en el brazo largo del cromosoma 4 y codifica un receptor de transmembrana de 145 KD, con actividad de tirosin-kinasa. (1,2,11,12).
Generalmente, los tumores estromales gastrointestinales, ocurren en pacientes mayores de 50 años, con una media de 55 a 65 años. Son raros en menores de 40 años y más raros aún en niños. Referente al género, hay leve predominancia masculina. (1,2,13).
En cuanto a la localización, 60–70% se hallan en el estómago, seguido de intestino delgado 20-30 %, colorrectal 5%, y esófago en menos de 5%, también puede ubicarse en omento, mesenterio o peritoneo. (1,2,9,14,15).
En cuanto al cuadro clínico, algunos tumores estromales gastrointestinales pequeños, se detectan incidentalmente durante cirugía, endoscopía o radiología. Los factores fundamentales en la presentación clínica son el tamaño tumoral y la localización (16).
En cuanto al diagnóstico, uno de los principales medios es la endoscopía, en la que se aprecia una lesión protruída redondeada o lobulada, cubierta de mucosa normal, pliegues puente y generalmente con ulceración central ó excéntrica (1,2, 12).
La aparición de la endosonografía ha permitido realizar una evaluación más adecuada de dichas lesiones, caracterizándolas como masas hipoecoicas, que se originan de la cuarta capa de la pared gastrointestinal, con rasgos que sugieren malignidad o benignidad, con una sensibilidad de 80 – 100 %, y además permiten la toma de biopsia por aspiración con aguja fina (10,12,15).
La alternativa es el método radiológico (tomografía axial computarizada, resonancia magnética), que generalmente sólo nos brinda un diagnóstico presuntivo, a la luz de las imágenes, cuadro clínico y localización. Las características ya se mencionaron en la introducción. Por último, cuando a pesar de todos estos métodos no se ha establecido el diagnóstico, se puede efectuar una laparotomía exploratoria (1,10,17,18).
Macroscópicamente, son masas redondeadas u ovoides, bien delimitadas, blanquecino rosadas, con áreas de hemorragia o necrosis, cambios mixoides y formación de cavidades. Microscópicamente, tienen una conformación fusiforme (70-80%), epitelioide (20-30%) o mixta (<10%) (1, 2, 7). La mayoría de los tumores estromales gastrointestinales son benignos (1,16), pero hay 10-30% que son malignos y suelen ocurrir en pacientes más jóvenes. Los criterios histopatológicos de malignidad de los GIST son: número de mitosis, tamaño del tumor, celularidad, necrosis, localización anatómica y crecimiento invasivo (1,2, 12,16).
Desde el punto de vista genético, estos tumores muestran pérdidas de alelos en los cromosomas 14 y 22. Menos frecuentes son las pérdidas en 1p y cromosoma 15. En los GIST malignos se reporta ganancia de ADN con diploidía y altos niveles de amplificación en 3q, 8q, 5p y xp. (19-21).
Respecto al tratamiento, éste es mayormente quirúrgico; una alternativa en el caso de lesiones menores de 2 cm, es la resección endoscópica. En los Tumores Estromales Gastrointestinales malignos irresecables o metastásicos es útil el empleo de la terapia neoadyuvante con mesilato de imatinib (STI-571), que se inició el 2002 con buenos resultados (22-28).
El Hospital Edgardo Rebagliati Martins es centro nacional referencial en gastroenterología y como tal hemos realizado en los últimos años diagnósticos de varios tumores estromales gastrointestinales, con las diversas formas de presentación y métodos diagnósticos ya mencionados anteriormente.
Ello nos motivó a revisar la literatura respecto al tema, encontrando que los GIST son una patología rara, y su incidencia es de 4 a 20 casos por millón de habitantes aproximadamente (1,2). En nuestro país solo hay reportes de casos aislados, que no permiten tener una idea cabal de las implicancias de esta patología.
El Hospital Nacional Edgardo Rebagliati Martins donde laboramos, es una Institución de nivel IV, con aproximadamente 10 a 12 casos anuales en promedio; muchos de los casos fueron diagnosticados endoscópicamente, y el otro grupo por diferentes medios diagnósticos, lo cual fue el incentivo para estudiar en qué medida la endoscopía convencional nos permitía diagnosticar esta rara patología, y evaluar las principales características de esta entidad nosológica en nuestro medio.
MATERIAL Y MÉTODOS
El estudio permitirá establecer el perfil clínico, endoscópico e histológico, así como las características demográficas de los pacientes con tumores estromales gastrointestinales de nuestra población hospitalaria. Su importancia radica en el hecho que puede causar cuadros severos de hemorragia digestiva y que tiene potencial maligno con la consiguiente amenaza a la vida de quienes la padecen (1,2, 8, 9, 11, 12). Al momento sólo hay reportes de casos aislados en Latinoamérica y en el Perú (11, 12 , 13, 14)
Alcances y Limitaciones. El Hospital Nacional Edgardo Rebagliati Martins (Essalud), de Lima-Perú, es el más grande del país. Cuenta con 1,500 camas y es centro de referencia de varias especialidades, especialmente en gastroenterología. Debido a ello, a pesar de ser los tumores estromales Gastrointestinales una entidad nosológica rara, se han registrado en los últimos años una importante cantidad de casos, que hemos analizado tras revisar retrospectivamente los archivos de anatomía patológica e historias clínicas de los pacientes.
Las limitaciones son las de un estudio retrospectivo: algunos malos registros y ausencias de algunos datos en las historias clínicas, que se subsanaron contactando telefónicamente o personalmente a los pacientes, sus familiares o médicos tratantes.
Formulación del problema. ¿Cuál es el perfil clínico, endoscópico e histológico, y las características demográficas de los pacientes con tumores estromales gastrointestinales en el Hospital Rebagliati (HNERM) de Enero 2002 a Diciembre 2004?
Objetivo general. Determinar el perfil clínico, endoscópico e histológico y las principales características demográficas de los pacientes con tumores rstromales gastrointestinales en el Hospital Rebagliati (HNERM), desde enero 2002 a diciembre 2004.
Hipótesis. Los tumores estromales gastrointestinales en el Hospital Rebagliati se presentan mayormente en varones, que pasan los 60 años, con síntomas dependientes del tamaño y localización. La endoscopia el mejor método diagnóstico. La mayoría son benignos de tipo fusocelular y el tratamiento principalmente quirúrgico.
Variables y operacionalizacion de las mismas. Variable dependiente: tumores estromales gastrointestinales, variables independientes: edad, genero, cuadro clínico, método diagnóstico empleado, tipo histológico y tipo de tratamiento
Dimensión espacial y temporal del estudio. El estudio se llevó a cabo revisando retrospectivamente los archivos del Departamento de Anatomía Patológica y las Historias Clínicas de los pacientes diagnosticados como Tumor Estromal Gastrointestinal, de Enero 2002 a Diciembre 2004, en el Hospital Rebagliati. El estudio se llevó a cabo entre enero de 2006 y setiembre de 2007.
Tipo y diseño de investigación: Estudio retrospectivo, descriptivo, y transversal.
Población y Muestra.- Población: constituida por todos los pacientes con dolor abdominal y/o hemorragia digestiva, que se sometieron a endoscopía digestiva alta o baja y/o tomografía axial computarizada, entre enero de 2002 y diciembre 2004.
Muestra: en primer lugar se ubicaron aquellos pacientes con diagnóstico histológico de tumor estroma gastrointestinal en la base de datos del Departamento de Anatomía Patológica del Hospital Rebagliati. Fueron 46 en el período de estudio; luego se revisó detalladamente la historia clínica de cada uno de ellos enfatizando en el informe histológico, endoscópico, tomográfico y los datos clínicos.
De ellos se excluyeron 12 pacientes (5 por no hallarse el estudio histopatológico confirmatorio, 5 por no hallarse las historias clínicas y 2 por corresponder a otro diagnóstico); quedando finalmente 34 pacientes.
Los datos recopilados mediante la ficha de recolección fueron procesados y resumidos en tablas, cada una con su respectivo gráfico respecto a las variables consideradas relevantes para el estudio.
Unidad de Análisis: paciente con diagnóstico de Tumor Estromal Gastrointestinal confirmado por anatomía patológica.
Criterios de Inclusión: pacientes con diagnóstico anatomopatológico de tumor estromal gastrointestinal con estudio inmunohistoquímico positivo a CD 117 y/o CD 34. Contar con informe endoscópico y/o tomográfico completos.
Criterios de exclusión: pacientes sin estudio inmunohistoquímico positivo a CD 117 ó CD 34. Pacientes diagnosticados en otro centro previamente.
Instrumentos de Recolección de datos: Se obtuvo información de fuente secundaria (archivos del Dpto. de Anatomía Patológica e historias clínicas del HNERM). Los datos se recogieron mediante una ficha de recolección dividida en 5 partes: 1) Datos generales, 2)Datos demográficos,3) Datos clínicos, 4) Métodos diagnósticos y 5) Formas de tratamiento. Nivel de confianza o validez: 95%, nivel de significancia: p< 0.05. La base de datos se elaboró mediante codificación numérica de las variables.
Presentación y estrategias de análisis: Finalizado el trabajo de campo los datos fueron procesados en un paquete estadístico STATA versión 7, obteniendo de esta manera los resultados estadísticos descriptivos. Analisis y comprobación estadística. Para comprobar la hipótesis, se ha considerado el uso de la prueba estadística: Prueba Binomial, con un nivel de significación al 5%. Para el análisis hemos considerado las tablas que responden a los objetivos del estudio. A continuación se presentan los resultados.
Aspectos Éticos: En la realización del presente trabajo se han seguido los lineamientos para investigación biomédica de la Declaración de Helsinki de la Asociación Médica Mundial (1964) y sus enmiendas (Tokio 1975, Venecia 1983 y Hong Kong 1989) así como los del código de Ëtica y Deontología del Colegio Médico del Perú.
RESULTADOS
Los resultados están expuestos en las catorce tablas que presentamos más adelante; sin embargo, hemos añadido algunos comentarios para poder entenderlas mejor.
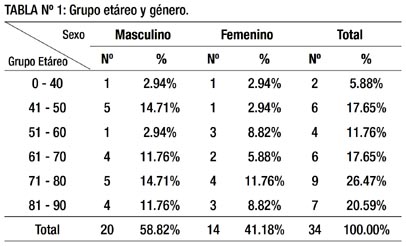
En la tabla 1 se aprecia que los GIST se presentan predominantemente en el sexo masculino (58.82%) y el grupo etáreo más afectado fue el de 71-80 años (26.47%) seguido del 81- 90 años (20.59%).
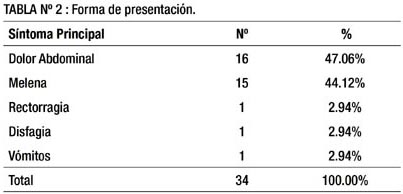
En la tabla 2 sólo se considera el síntoma principal que trajo al paciente al hospital, es probable que algunos pacientes hayan presentado combinaciones de síntomas. Se aprecia que el motivo de ingreso más frecuente en los pacientes con GIST fue dolor abdominal (47.06%) seguido por melena (44.12%).
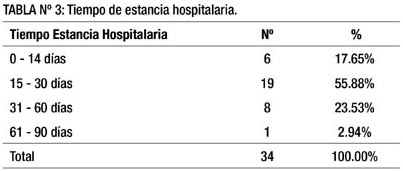
En la tabla 3 apreciamos que el tiempo de estancia hospitalaria fue de 15 a 30 días en 55.88 % de pacientes, tiempo que incluye el diagnóstico y el tratamiento, que mayormente fue quirúrgico, y sus eventuales complicaciones post-operatorias. Cabe mencionar que en 61.76% se llegó al diagnóstico en los primeros 7 días de hospitalización.
En la tabla 4 señalamos que en 5 pacientes se diagnosticó por laparotomía exploratoria en vista de que los estudios endoscópicos e imagenológicos fueron negativos. Se observa que el método endoscópico permitió el diagnóstico en 58.82% y los métodos no endoscópicos en 41.18%, destacando entre estos últimos la Tomografía Axial Computarizada con 26.47% y Laparotomía exploratoria en 14.71%.

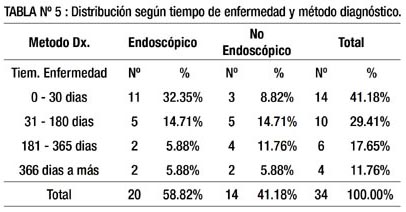
En la tabla 5 se muestra la relación entre método diagnóstico y tiempo de enfermedad. Entre los pacientes diagnosticados por método endoscópico, más de la mitad (11/20) tuvieron un tiempo de enfermedad de 0-30 días (32.35%); y entre los diagnosticados por método no endoscópico predominaron tiempos mayores a los 30 días (11/14).
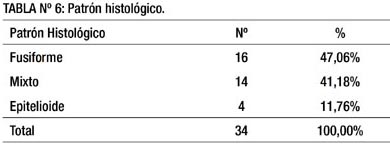
En la tabla 6 se muestra que el tipo histológico que predominó en nuestros pacientes fue el fusiforme (47.06%), seguido del mixto (fusiforme y epitelioide) en 41.18%, y finalmente el epitelioide con 11.76%.
En la tabla 7 el riesgo de malignidad se establece según tamaño tumoral y actividad mitótica: mas de 5-10 mitosis por campos de alto poder (12).

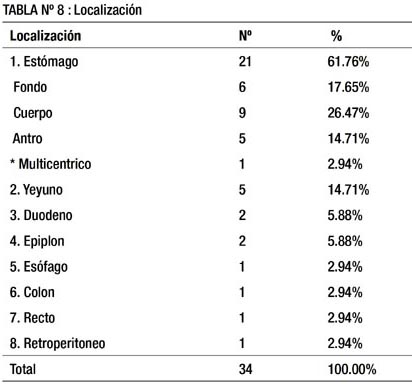
En la tabla 8 señalamos que hubo un paciente que presentó 5 lesiones del estómago: 2 en antro, 2 en cuerpo y 1 en fondo. También se aprecia que en 61.76% de pacientes se halló la lesión en estómago, seguid o de yeyuno 14.71%, duodeno 5.8% y epiplón 5.8%. Las localizaciones más infrecuentes fueron: esófago, colon, recto y retroperitoneo con 2.94% cada una. El segmento más afectado del estómago fue el cuerpo (26.47 %), seguido del fondo (17.65%).
En la tabla 9 señalamos que de los 21 pacientes con lesión gástrica, en 6 el diagnóstico se realizó por método no endoscópico debido a su crecimiento intramural o hacia la serosa, en estos pacientes la endoscopía fue negativa. Los dos pacientes con lesión en colon (1) y recto (1) fueron diagnosticados por método no endoscópico (TAC) debido al crecimiento intramural; la colonoscopia en ellos fue negativa.
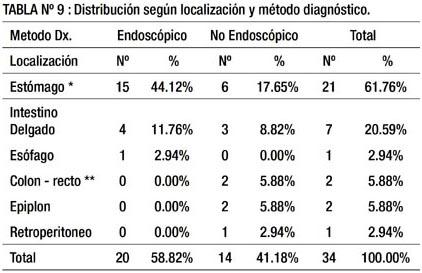
La mayoría de pacientes con GIST de localización gástrica e intestino delgado fueron diagnosticados por método endoscópico mientras que los localizados en colon, epiplón y retroperitoneo fueron diagnosticados por método no endoscópico (tabla 9).
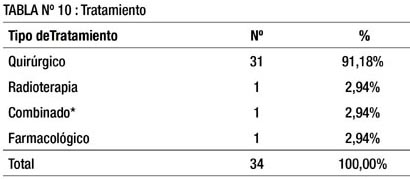
En la tabla 10 apreciamos que el tratamiento más frecuentemente aplicado fue el quirúrgico en 91.18 %; en menor medida: radioterapia, farmacológico y combinado con 2.94 % cada uno. Un paciente recibió tratamiento combinado: quirúrgico y quimioterapia.
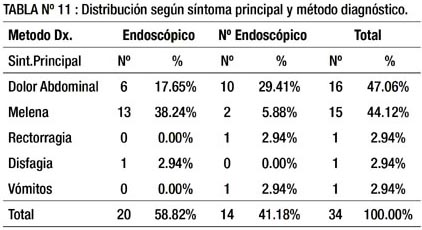
En la tabla 11 mostramos que la mayoría de pacientes con GIST diagnosticados por método endoscópico se presentaron con melena y la mayoría de los tumores GIST diagnosticados por método no endoscópico se presentaron con dolor abdominal. Se muestra en general que los tumores GIST se presentan principalmente con dolor abdominal y melena y que la mayoría son diagnosticados por endoscopía.
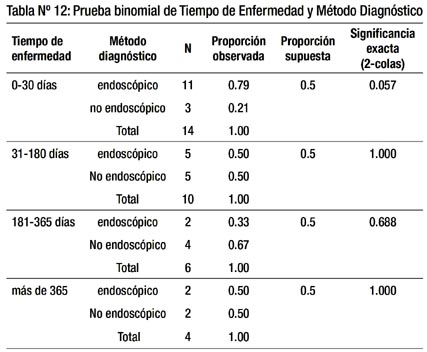
En la tabla 12 observamos que en los pacientes con GIST con cualquier tiempo de enfermedad, se pueden diagnosticar con cualquiera de los dos métodos y no existe diferencia significativa al 5%, para ningún período de tiempo de enfermedad y método diagnóstico. Si se considerara un nivel de significancia del 10%, si habría diferencia significativa entre ambos métodos a favor del método endoscópico para los pacientes con tiempo de enfermedad de 0-30 días.
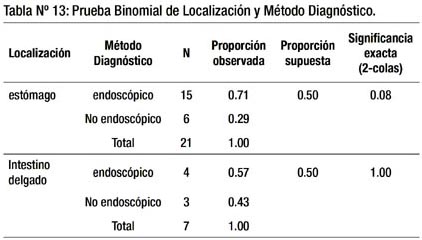
En la tabla 13 no se detectan diferencias significativas al 5%, para ninguna localización considerada, entre ambos métodos diagnósticos. Los pacientes con GIST localizado en estómago e intestino delgado se puede diagnosticar con cualquiera de los dos métodos. Si se considerara un nivel de significancia del 10%, si habría diferencia significativa entre ambos métodos a favor del método endoscópico para la localización gástrica.
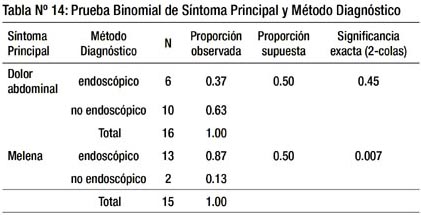
En la tabla 14 señalamos que es significante al 1%. Existe diferencia significativa al 1%, entre los pacientes con GIST que se presentaron con melena a favor del método endoscópico. En los pacientes que presentan melena es más probable llegar al diagnóstico por método endoscópico.
DISCUSIÓN
En el período de estudio tuvimos 34 pacientes que cumplieron con los criterios de inclusión planteados y cuyas historias clínicas fueron revisadas.
El rango de edad varió desde los 30 años hasta los 86 años, siendo la edad promedio de 64.7 años. Hubo un predominio masculino de 58.8% . El grupo etáreo más afectado fue el de 71–80 años con 26.4 %, seguido del de 81-90 años con 20.59%. La mayoría de autores (29-37) coinciden que la mayor parte de casos se presentan entre los 55 y 65 años, siendo muy rara su presentación en niños. Diversos estudios confirman asimismo, la predominancia masculina (30, 34, 38).
Respecto a la forma de presentación por la que acudieron nuestros pacientes, la tabla 2 nos revela que fue el dolor abdominal el más frecuente (47.06%) seguido de melena en 44.12%. Además acudieron por rectorragia, disfagia y vómitos, en menor frecuencia. Es decir, las 2 formas de presentación dominantes fueron el síndrome doloroso abdominal y hemorragia digestiva alta.
Halpin (39) encuentra hemorragia digestiva en 56% de sus pacientes. Saccia (37) refiere que los síntomas son generalmente sutiles y de lento desarrollo; siendo factores importantes para ello la ubicación (antropilórico en 60%, corporal 25% y cardial 15%) y el tipo de crecimiento tumoral (intra ó extraluminal y mixto), pudiendo el tamaño tumoral a veces llegar a ser considerable como en nuestro estudio, donde tuvimos lesiones de hasta 26 cm, pero en promedio fue 6.44 cm.
Hay 4 categorías de pacientes basándonos en los síntomas: a) asintomáticos, b) inespecíficos (síntomas vagos como epigastralgia, dispepsia, etc), c) sintomáticos (masa abdominal, anemia crónica, etc), d) complicado (comienzo de complicaciones, siendo frecuente la hemorragia digestiva). Monig (40) también refiere que muchos son asintomáticos, pero entre los sintomáticos destacan los cuadros de dolor abdominal y hemorragia digestiva (37,41-45).
Respecto al tiempo de estancia hospitalaria (tabla 3), el 55.58% estuvo internado 15 a 30 días, y casi ¾ partes de los pacientes menos de 1 mes. 23.53% estuvo hospitalizado 31 a 60 días, ello incluyó el tiempo que se requirió para el diagnóstico, el tratamiento quirúrgico al que fue sometido la mayor parte de ellos y el post-operatorio con sus eventuales complicaciones. Aquí es necesario resaltar que en 61.76% se llegó al diagnóstico en los primeros 7 días y que más de la mitad de nuestros pacientes fue dado de alta antes de los 30 días , lo cual desde el punto de vista gerencial es bastante adecuado habida cuenta que es una patología compleja en pacientes añosos con comorbilidades diversas.
En cuanto al método diagnóstico, la tabla 4, nos muestra que el método endoscópico logró diagnosticar 58.82% de los casos, seguido por la Tomografía Axial computarizada con 26.47% y la laparotomía exploratoria en 14.71%. Es decir, el método endoscópico nos permitió llegar al diagnóstico en 6 de cada 10 pacientes. La endoscopía no detectó las lesiones en más pacientes debido a que varias de ellas en estómago, intestino delgado y grueso tuvieron crecimiento extraluminal y otras se ubicaron en retroperitoneo ó epiplón.
Se han descrito diversos métodos diagnósticos: endoscopía, ecografía, tomografía computada helicoidal, resonancia magnética, scintigrafía, radiografía contrastada, laparotomía exploratoria, ultrasonografía endoscópica (27-31,46-50). En los últimos años, ha emergido como método diagnóstico de elección, en la evaluación de estas lesiones la ultrasonografía endoscópica que además permite tomar biopsia por aspiración para definir diagnóstico con una sensibilidad del 92% (51-53).
Además la Tomografía de Emisión de Positrones con 18-fluorodesoxiglucosa (PET- FDG) es útil para estadiaje (permite excluir compromiso mesentérico o peritoneal), ver recurrencia de los tumores estromales gastrointestinales y cuando la FDG no es captada por las lesiones predice una mejor respuesta al mesilato de imatinib (27,30).
En la tabla 5, se muestra la relación entre método diagnóstico y tiempo de enfermedad. Entre los que el método endoscópico fue exitoso, el tiempo de enfermedad más frecuente fue 0–30 días (32.35%) y entre los que el método no endoscópico permitió el diagnóstico se aprecia tiempo de enfermedad más prolongados: 31-180 días (14.71%) y 181-365 días (11.76%).
A grandes rasgos los pacientes con GIST, en cuanto a tiempo de enfermedad se dividieron en 3 grupos: 0–30 días (algo más de 1/3), 31-180 días y más de 180 días (algo menos de 1/3 cada uno). No hay datos en la literatura revisada respecto a ello. Cuando se efectuó el análisis estadístico en la Tabla 12, no se halló significancia para ningún tiempo de enfermedad. Es decir, los pacientes con las diferentes cifras de tiempo de enfermedad, pueden ser diagnosticados por cualquiera de ambos métodos.
La tabla 6 nos muestra el patrón histológico, siendo el 47% correspondientes al tipo fusiforme, 41% al tipo mixto (mezcla de fusiforme y epitelioide) y sólo 11.76% tipo epitelioide. Palomino (2) en una revisión respecto al tema, refiere que tanto en los casos gástricos, de intestino delgado y colon predomina el tipo fusiforme (70 a 80%) y epitelioide (20-30%). Esto es corroborado por otros autores (29,54-55) que reportan 70% de lesiones fusiformes, 20% de epitelioides y 10% de mixtas. Asimismo, el 88.24 % de pacientes fue CD 117 positivo y el 64.70 % positivo para CD 34.
En lo que respecta al riesgo de malignidad (tabla 7), 50 % tuvo alto riesgo, 41% bajo riesgo e intermedio 8.82 %. La literatura refiere como principales factores predictivos de malignidad: el tamaño tumoral mayor de 5 cm e índice mitótico con más de 5 mitosis por 50 campos de alto poder (56-60). Otros factores de malignidad son: celularidad, atipia o pleomorfismo nuclear, índice de proliferación MIB-1 mayor de 4% y positividad de p53 (55,61). Revisando la literatura hallamos que las lesiones malignas oscilan entre 22 y 66%, lo cual nos coloca en un punto intermedio aunque más cerca del límite superior (59).
En cuanto a la localización (tabla 8), el 61.77% de las lesiones se ubicó en estómago, siendo el cuerpo el más afectado seguido de fondo. En orden descendente, resultó comprometido el yeyuno en 14.71%, duodeno y epiplón 5.88% cada uno y con 2.94% esófago, colon, recto y retro-peritoneo. Cabe resaltar que hubieron 38 lesiones en los 34 pacientes, ya que uno presentó un patrón multicéntrico (5 lesiones a nivel gástrico).
Nuestros resultados son consistentes con lo que reporta la literatura internacional (33-35), siendo el estómago el lugar más afectado por estas lesiones, variando entre 55% y 73.91%. En segundo lugar, intestino delgado oscilando entre 14 y 35% . Luego, colon y recto con cifras que van de 0 a 11.76%. Y en menor medida: esófago, epiplón, mesenterio, retroperitoneo e hígado con cifras inferiores a 6% en las series revisadas (50, 61-63).
En la tabla 9, se observa la relación entre método diagnóstico y localización de las lesiones. Entre quienes el método endoscópico fue determinante para el diagnóstico, la localización más frecuente fue estómago (44.12%) que corresponde a 15 de 20 casos (3/4 partes), y entre los que el método no endoscópico fue decisivo también fue estómago (17.65%) pero en mucho menor medida: 6 de 14 casos, pero más de la mitad de dichos casos diagnosticados por método no endoscópico se ubicó en otras localizaciones.
En la tabla 13 se realiza el análisis estadístico, no hallándose diferencias significativas entre ambos métodos para las diferentes localizaciones. Pero si se considera un nivel de significancia del 10%, hay diferencia significativa a favor del método endoscópico para la localización gástrica.
Endoscópicamente, la apariencia era de lesiones submucosas la mayoría con ulceración generalmente central aunque a veces excéntrica y pliegues puente, cuyo tamaño varió de 1.8 cm la más pequeña hasta 26 cm la más grande , siendo el promedio de 6.44 cm. Barrier et al. (48) hallan un tamaño promedio de 12.6 cm para los malignos versus 5.2 cm para los benignos. Halpin (39) reporta lesiones entre los 2 y 20 cm. Bolükbasi (32) refieren lesiones con un tamaño promedio de 9.1 cm. Los hallazgos tomográficos fueron: masa hipodensa o heterogénea en la pared gastrointestinal, peritoneo o retroperitoneo.
Respecto al tratamiento (tabla 10), fue quirúrgico en 91.18% de los pacientes y los restantes fueron sometidos a radioterapia, farmacológico (con mesilato de imatinib 800 mg/d) ó combinado (quirúrgico y quimioterápico), 2.94% cada uno.
Ocurrió recidiva en 15.62% de los pacientes sometidos a tratamiento quirúrgico. Nuestra mortalidad fue 38.2%, con un seguimiento entre 24 a 48 meses, mientras que la literatura consultada nos muestra una oscilación entre 2 y 22 %, pero con seguimiento menor que el nuestro (33,64).
Un paciente rehusó ser operado, y en otro paciente no se pudo resecar totalmente el tumor durante la intervención quirúrgica .La literatura revisada, coincide en señalar al tratamiento quirúrgico, como el de elección en caso que esté localizada, incluso hace algunos años se efectúa en algunos centros via laparoscópica (40, 43, 46, 63-67).
En aquellos casos, en los que el tumor no sea resecable o sea metastático, tenemos como opción a la radioterapia y el tratamiento farmacológico con mesilato de Imatinib 800 mg/día, el cual en algunos casos, al cabo de 6 meses a 1 año puede permitir la resección del tumor inicialmente irresecable (50,55,58,68). Benjamín (69) reporta que el Imatinib da una respuesta duradera en más de la mitad de pacientes con enfermedad maligna metastásica o irresecable y detiene la progresión de la enfermedad en un tercio adicional de pacientes.
En la tabla 11, se muestra la relación entre las variables: método diagnóstico y síntoma principal por el que concurrían los pacientes. Se observa que en 13 de los 15 (86.6 %) pacientes que acudieron con melena se llegó al diagnóstico por método endoscópico y en 10 de los 16 (62.5%) con dolor abdominal por el método no endoscópico.
Al realizar el análisis estadístico en la tabla 14, se halló diferencia estadísticamente significativa al 1% para aquellos que presentaron melena, a favor del método endoscópico. Es decir, cuando el paciente con GIST viene por melena (hemorragia digestiva alta) es estadísticamente mayor la probabilidad de llegar al diagnóstico por endoscopia.
CONCLUSIONES
-
Los pacientes con GIST que se presentan con melena, son diagnosticados significativamente más por método endoscópico (p < 0.05).
-
Hubo predominio del género masculino (relación M/F es 1.43:1).y el grupo etáreo más afectado fue el de 71–80 años con 26.4%. La edad promedio fue de 64.7 años, con un rango de 30 a 86 años.
-
La forma de presentación más frecuente fue dolor abdominal (47%), seguido de melena (44.1%). Se llegó al diagnóstico en 58,8% de casos por método endoscópico.
-
Respecto a las características endoscópicas de las lesiones, destaca la tumoración de aspecto submucoso con ulceración central (a veces excéntrica) y pliegues en puente, con un tamaño promedio de 6.44 cm.
-
El tipo histológico predominante fue el fusiforme con 47%, con un riesgo de malignidad alto en 50% de casos.
-
La localización más frecuente fue estómago (61.7%) seguido de yeyuno (14.7%) y duodeno (5.8%); y el tratamiento fue principalmente quirúrgico (91%).
RECOMENDACIONES
-
En todo caso de hemorragia digestiva alta, la endoscopía debe realizarse teniendo en cuenta entre las posibilidades diagnósticas un GIST, que puede ofrecer dificultad diagnóstica dada la magnitud del sangrado, por lo cual se deben tomar todas las medidas, como lavado gástrico, cambios de posición y de ser posible biopsias profundas, a fin de conseguir diagnóstico eficiente y oportuno.
-
Mejorar el registro de datos en las historias clínicas, estableciendo protocolos consensuados de diagnóstico y tratamiento.
-
Implementar el uso de registros informatizados en los hospitales a fin de facilitar el acceso a la información.
BIBLIOGRAFÍA
1. SÁNCHEZ L. GIST. Acta Cancerológica 2003;32(1):3-4.
2. PALOMINO A. Tumores estromales gastrointestinales. Enfermedades del Aparato Digestivo 2003;6:19-25.
3. DAVILA R, FARDEL DG. Stromal tumors. Gastrointest Endosc 2003;58:80–88.
4. MIETTINEN M, SARLOMO-RIKALA M, LASOTA J. GIST: recent advances in understanding of their biology. Human Pathology 1999; 30:1213– 1220
5. MIETTINEN M; SARLOMO-RIKALA Y LASOTA J Gastrointestinal Stromal tumors a new finding on their biology. A review Human Pathology. Human Pathology 1999; 23:1209-1220.
6. MIETTIN M, LASOTA J. GIST: definition, clinical, histological, inmunohistochemical and molecular genetic factors and differential diagnosis. Virchows arch 2001, 438:1-12
7. KINDBLOM LG; RREMOTTI HE y Meis-Kindblom JM Gastrointestinal pacemaker tumor. Gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998; 152:1259-1269.
8. MAZUR MT, CLARK HB Gastric stromal tumors: reapraisal of histogenesis. Am J Surg Pathol 1983; 7:507–519.
9. CLARY BM, DE MATTEO RP, LEWIS JJ et al. Gastrointestinal stromal tumors and leiomyosarcomas of the abdomen and retroperitoneum : a clinical comparison. Ann Surg Oncol 2001; 8:90–9.
10. SHEN EF; ARNOTT ID y Penman ID Endoscopic ultrasonography in the diagnosis and management of suspected upper gastrointestinal submucosal tumours. British J Surg 2002; 89:231-235.
11. KADAMANI A, MOSQUERA M. Y PONCE DE LEÓN E Tumores estromales gastrointestinales: enfoque actual: presentación de 6 casos. Rev Col de Cirugía 2004; 19:116-125.
12. GÓMEZ G, LOMBO M Y PEÑALOZA F Tumores estromales gástricos malignos. Presentación de dos casos. Rev Col Gastroenterol 2004; 19:137-142.
13. HUAMÁN M, AGUILAR L, JÁUREGUI F, BLÁCIDO D, RIOS P, CHACÓN P, et al. Tumores estromales gastrointestinales: experiencia en la sede docente del Departamento de Cirugía del Hospital ins. Rev Fac Med Hum 2005; 5 (1): 6–14.
14. NÚÑEZ J, VOJVODIC I, ORTEGA D. Tumor estromal gastrointestinal: a propósito de un caso. Rev Chil Cir 2007;59(5):103–17.
15. NGUYEN V, TAYLOR A. Gastrointestinal Stromal Tumors:Leiomyoma, leiomyosarcoma. www.emedicine.com
16. HILLEMANS M, PASOLD S Y HOFLER H Pronostic factors of gastrointestinal stromal tumors of the stomach. Verh. Disch Ges Pathol. 1998; 82:261-266.
17. EL RIFAI W, SARLOMO KM Y KNUNTIA S. DNA copy number loses in chromosome 14; and early change in gastrointestinal stromal tumors. Cancer Res 1993; 56:3230–3233.
18. EL RIFAI W, SARLOMO KM Y KNUNTIA S. DNA copy number changes in gastrointestinal stromal tumors-a distinct genetic entity. Am Chir Gynaecol 1998; 87:287–290.
19. DEMETRI GD, VON MEHREN M Y BLANKE CD. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Eng J Med 2002; 347:472-480.
20. OPS. Consulta Regional de las Américas sobre Evaluación de los Sistemas de Salud, mayo 2001. http://www.lachsr.org/es/thesaurus/
21. STROSZCZYNSKI C, CHMELIK P, GAFFKE G et al. Gastrointestinal stromal tumours. Rofo 2003; 175:791–8.
22. GOLD JS, DEMATTEO RP. Combined surgical and molecular therapy: the gastrointestinal stromal tumor model. An Surg 2006;244:176-84.
23. BLACKSTEIN ME, BLAY JY, Corless C et al. Gastrointestinal stromal tumours: consensus statement on diagnosis and treatment. Can J Gastroenterol 2006; 20:157–63.
24. HEINRICH MC, Corless CL. Gastrointestinal stromal tumors: the role of surgery in the era of targeted therapy. J Surg Oncol. 2005; 90: 195–207.
25. HEINICKE T, WARDELMANN E, SAUERBRUCH T et al. Very early detection of response to imatinib mesylate therapy of gastrointestinal stromal tumours using 18fluoro-deoxyglucose-postron emisión tomography. Anticancer Res 2005; 25:4591–4.
26. BONVALOT S. Surgical management of GIST in the era of Gleevec. Ann Chir 2005;130:144–51.
27. NICKL NJ. Gastrointestinal stromal tumors: new progress, new questions. Curr opin Gastroenterol 2004;20:482–7.
28. LUDOLPH T, SCHWEITZER A, BREMER A, SCHULZ U, GLASBRENNER B. Gastrointestinal Stromal tumors. Clinical Characteristics, diagnosis and therapy in five cases. Med Klin 2006; 101:69-74.
29. MIETTINEN M, MAJIDI M Y LASOTA J. Pathology and diagnostic criteria of gastrointestinal stromal tumours: a review. Eur J Cancer 2002; 38(5):s39–s 51.
30. GOERRES GW, STUPP R, BARGHOUTH G et al. Functional analysis of the different c-kit mutations and their impact on the response to tyrosine kinase inhibitors are under intense investigation. Eur J Nucl Med Mol Imaging 2005; 32:153–162.
31. MOSCA F, STRACQUALURSI A, PERSI A, ZAPPALA O, Portale TR, Latteri S. Our experience in the surgical treatment of gastrointestinal stromal tumors. Chir Ital 2001; 53: 809-20.
32. BöLUKBASI H, NAZLI O, TANSUG T, BOZDAG AD, ISGIIDER AS, YAMAN I et al. Gastrointestinal Stromal Tumors: analysis of 20 cases. Hepatogastroenterology 2006;53:385-8.
33. NGUYEN SQ, DIVINO CM, WANG JL, DIKMAN SH. Laparoscopic management of gastrointestinal stromal tumors. Surg Endosc 2006; 20:713–6.
34. DEL RÍO P, DELLABATE P, SOLÍAN P, et al Gastrointestinal stromal tumours: an análisis based on personal experience. Acta Biomed Ateneo Parmense 2002; 73:41–5.
35. SCOTT W, GRISOLANO MD, JEFFREY A et al. Gastrointestinal mesenchymal tumors not GIST; another submucosale nodule. Gastroenterology and Hepatology 2002; 97:5143.
36. NADIR D, DE PASQUALE. Malignant gastric stromal tumor. Am J Gastroenterol 2001; 96:s190–s l93.
37. SACCIA A, DIGIROLAMO P, MANCONI P, DAGATA M. MYOID tumors of the stomach. Our experience. Minerva Chir 1993; 48: 993-7.
38. LIBERATI G, LUECHETTA MC, PETRACCIA L, NOCCHI S, ROSENTZWIG F, DE MATTEIS A. Metaanalytical study of gastrointestinal stromal tumors. Clin Ter 2006; 154: 85–91.
39. HALPIN R, THOMSON SR, CATTERALL N, HAFFEJEE A. Smooth muscle tumours of the stomach: clinicopathological aspects. J R Coll Surg Edimb 1993; 38:23-7.
40. MONIG SP, TURLER A, RAAB M. Special problems of benign stomach tumors. Leber Magen Darm 1995; 25:213– 6.
41. MORRONE C, CALOMAGNO G, MORRONE F. Bleeding gastric leiomyoma: diagnostic error solving an emergency case. G Chir 1995; 16: 449–51.
42. WALTHER H, RATH M, LEIDL L, FILLER RD. Leiomyosarcoma of the stomach. Leber Magen Darm 1996; 26:107-8.
43. FERNANDEZ JA, PARRILLA P. Surgical treatment of an advanced GIST in the age of imatinib. Cir Esp 2009;86:3-12
44. ALBERTI P, PRUNERI U, BIANCHI P, CERRA V. UNUSUAL cause of gastric bleeding: leiomyoma. Minerva Chir 1996;51:779–83.
45. BERENSTEIN E, GHIGLIANI M, CARO L, UEHARA U. Endoscopic ultrasonography in the diagnosis of submucosal tumors of the upper digestive tract. Acta Gastroenterol Latinoam 1998; 28:5–8.
46. BENAVIDES C, BURMEISTER R, APABLAZA S, GARCÍA C, PINEDO M. Tumores gástricos estromales. Rev Chil Cir 2002;54:44-8.
47. PASTA V, MONTI M, MARTINO G, MERLINO G, BLANCHINI GP, BOCCACHINI F et al. Gastric leiiomyoma. Diagnostic and surgical problem. G Chir 1999; 20:413–8.
48. BARRIER A, HUGUIER M, LEVARD H, MONTARIOL T, FAGNIESZ PL, Y SAUVANET A. Gastric Stromal tumors. Results of a multicenter study. French Asssociations of Surgery Resesarch. Chirurgie 1999; 124: 494–502.
49. SASS D. CHOPRA K, FINKELSTEIN S Y SCHAUER P. JEJUNAL gastrointestinal tumor (GIST): a cause of obscure GI bleeding. Am J Gastroenterol 2001; 96:5241.
50. PAI J, KHUN N, BALART L. Primary hepatic gastrointestinal tumor. Am J Gastroenterol 2003; 98:5165.
51. STELZNER S, ANTONI C, HAROSKE G, JACOBASCH L, ERK JU, LUDWIG K. How should patients with completely resected gastrointestinal stromal tumours (GIST) be followed up?. Zentralbl Chir 2005; 130:554–61.
52. GHANDI H Y DAHHAN W. The role of enteroscopy in the diagnosis of gastrointestinal stromal tumor presenting with gastrointestinal bleeding: a case report. Am J Gastroenterol 2001; 96: s199-s200.
53. KALANTZIS N, LAOUDI F, KALLIMANIS G, GABRIEL P, FARMAKIS N. The role of endoscopic ultrasonography in diagnosis of benign lesions of the upper GI tract. Eur J Surg Oncol 1993; 19:449 .
54. MA CK, AMIN MB, KINTANAR E, LINDEN MD, ZARBO RJ. Immunohistologic characterization of gastrointestinal stromal tumors: a study of 82 cases compared with 11 cases of leiomyomas. Mod Pathol 1993; 6:139–144.
55. COINDRE JM, EMILE JF, MONGES G, RANCHèRE-VINCE D, SCOAZEC JY. Gastrointestinal Stromal Tumors: definition, histological, immunohistochemical, and molecular features, and diagnostic strategy. Ann Pathol 2005; 25:358 -85.
56. HILLEMANS M, HöFLER H. Current classification of gastrointestinal stromal tumors. Chirurg 2000; 71: 1327– 34.
57. PALAZZO L, LANDI B, CELLIER C, CUILLERIER E, ROSEAU G Y BARBIER JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut 2000; 46: 88–92.
58. BALLARINI C, INTRA M, CERETTI AP, PRESTIPINO F, BIANCHI FM, SPARACIO F et al. Gastrointestinal stromal tumors: a benign tumor with hepatic metastasis after 11 years. Tumori 1998; 84:78–81.
59. LEE JS, NASCIMENTO AG, Farnell MB, Carney JA, Harmsen WS, Ilstrup DM. Ephitelioid gastric stromal tumors : a study of 55 cases. Surgery 1995; 18:653–660.
60. NILSSON B, BüMMING P, MEIS-KINDBLOM JM, ODEN A, DORTOK A, GUSTAVSSON B et al. Gastrointestinal Stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era – a population based study in western Sweeden. Cancer 2005; 103:821–9.
61. SUGAR I, FORGACS B, ISTVAN G, BOGNAR G, SAPY Z, ONDREJKA P. Gastrointestinal Stromal tumors. Hepatogastroenterology 2005; 52: 409-13.
62. HELLIES R, SULIS R, PULIGA A, PALA M, PIETRANGELI M. GIST: surgical treatment of 34 cases. Tumori 2003; 89:133– 4.
63. GOMEZ S, GOMEZ C, SEGURA J. Tratamiento de los tumores del estroma gastrointestinal. Med Clin (Barc)2006; 127:660-8.
64. DAMATO A, BRINI A, MONTESANI C, PRONIO A, CHESSA A, MANZI F, RIBOTTA G. Gastrointestinal Stromal tumors: a series of 23 surgically treated cases. Ann Ital Chir 2001; 72: 175 – 180.
65. ALLAM ME, MEHTA D, ZELEN J, FOGLER R. Posterior wall gastric leiomyoma: endoscopio tattooing facilitates laparoscopic resection. J Soc Laparoendosc Surg. 1998; 2: 83–4.
66. AOGI K, HIRAI T, MUKAIDA H, TOGE T, HARUMA K, KAJIYAMA G. Laparoscopic resection of submucosal gastric tumors. Surg today 1999; 29:102–6.
67. RUGGIERO R, DE MARTINO A, FERRARA A, PROSCCINI F, PROCACCINI E. Direct experience in the treatment of unusual, primary and secondary malignant tumors of the stomach. Ann Ital Chir 2001; 72:165-73.
68. BLAY JY, BONVALOT S, CASALI P, CHOI H, DEBIECRICHTER M, DEI TOS AP et al. Consensus meeting for the management of gastrointestinal stromal tumors. Ann Oncol 2005; 16:566–78.
69. BENJAMIN RS, BLANKE CD, BLAY JY, BONVALOT S, EISENBERG B. Management of gastrointestinal stromal tumors in the imatinib era: selected case studies. Oncologist 2006; 11: 9–20.
Carlos Ichiyanagui Rodriguez
E-Mail: carlosichiyanagui@yahoo.es













