Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.30 no.4 Lima Sept./Dec. 2010
ARTÍCULOS ORIGINALES
Utilidad del NBI y Magnificación Óptica en el Diagnóstico Diferencial de las Lesiones Neoplásicas y no Neoplásicas Colorrectales en el Perú
NBI utility and optical magnification in the differential diagnosis of neoplastic and non-neoplastic colorectal lesions in Peru
Olivia Canales Sevilla1
; Juan Miyagui Maeda1 ; Juan Takano Moron2 ; Ebert Poquioma Rojas31. Gastroenterólogo del Instituto de Medicina Avanzada en Gastroenterología. Lima-Perú.
2. Patólogo del Instituto de Medicina Avanzada en Gastroenterología. Lima-Perú.
3. Jefe del Departamento de Epidemiología y Estadística en Cáncer del INEN. Lima-Perú
RESUMEN
INTRODUCCIÓN: La colonoscopía con imagen de banda angosta (NBI) y Magnificación Óptica es un método útil para evaluar in vivo el patrón Capilar y el Patrón de las criptas de los pólipos colorrectales.
OBJETIVO: Evaluar la utilidad del NBI y magnificación óptica en el diagnóstico diferencial de los pólipos colorrectales empleando las clasificaciones de Sano-Emura y Kudo.
RESULTADOS: La sensibilidad, especificidad y precisión diagnóstica para la clasificación de Sano-Emura fue 97.3%, 90.7% y 94.9% respectivamente. La sensibilidad, especificidad y precisión diagnóstica para la clasificación de Kudo fue 94.7%, 90.6% y 93.2% respectivamente.
CONCLUSIONES: La colonoscopia con NBI y magnificación óptica es un método efectivo, confiable y sencillo para el diagnóstico diferencial de las lesiones neoplásicas y no neoplásicas colorrectales cuando se emplean las clasificaciones de Sano-Emura y Kudo.
PALABRAS CLAVES: NBI, Magnificación Optica, Pólipos Colorrectales.
ABSTRACT
INTRODUCTION: The Narrow Banding Image NBI-Colonoscopy and Optical Magnification is a useful method for evaluation in vivo of capillary pattern and pit pattern of colorectal polyps.
AIM: To evaluate the usefulness of NBI and Optical Magnification in differential diagnosis of colorectal polyps using Sano-Emura and Kudos Classifications.
METHODS: Between january and may 2010, 86 colonoscopies were analyzed by two colonoscopists; 136 polyps were found and histologically analyzed. All polyps under 10 mm (119) were evaluated in accord with Sano-Emura and Kudos classifications; data was analyzed together with an epidemiologist in cancer.
RESULTS: The sensitivity, specificity and diagnostic accuracy was 97.3%, 90.7% and 94.9%, respectively, for Sano-Emuras classification. The sensitivity, specificity and diagnostic accuracy was 94.7%, 90.6% and 93.2%, respectively, for Kudos Classification.
CONCLUSIONS: The colonoscopy with NBI and Optical Magnification is an effective, reliable and simple method for Colorectal neoplastic and non – neoplastic differential diagnosis when Sano-Emuras and Kudos Classifications are used.
KEY WORDS: NBI, Optical Magnification, Colorectal polyps.
INTRODUCCIÓN
El cáncer colorrectal en el Perú es la sexta causa de muerte por cáncer en ambos sexos, según datos del Ministerio de Salud del año 20046 y su incidencia va gradualmente en ascenso. El pronóstico de los pacientes con cáncer colorrectal depende estrictamente de la detección precoz de las lesiones premalignas (adenomas) y del cáncer temprano del colon5. Está demostrado que una de las rutas para el desarrollo de esta enfermedad es la conocida secuencia adenoma-carcinoma, descrita por Muto y colaboradores en 1975; y por tanto, para prevenirla deben removerse todos los adenomas.4 Recientemente durante el Workshop de Kyoto del 2008 se propuso otra ruta alternativa a través de las lesiones serratas, mediada por una secuencia de mutaciones que involucran la inactivación del APC, mutación del K-ras e inactivación del TP53.22,10La colonoscopía es el único método que permite encontrar y remover lesiones premalignas y el cáncer temprano colorrectal,5ejerciendo un doble impacto en la prevención de esta enfermedad, ya que disminuye su incidencia después de la detección y la erradicación de las lesiones premalignas y reduce la mortalidad después de la detección y tratamiento del cáncer temprano,22,10sin embargo, la colonoscopía estándard en ausencia de magnificación está limitada para determinar la naturaleza de los pólipos colorrectales por lo que se hace necesario tomar una biopsia para la confirmación histológica antes de realizar el tratamiento.7Actualmente con el advenimiento de colonoscopios de alta resolución y Magnificación Óptica (MO) y la aplicación de la Cromocolonoscopía Magnificada (con Índigo Carmín) se consigue realizar una evaluación minuciosa de la arquitectura del patrón de las criptas, permitiendo el diagnóstico diferencial in vivo de las lesiones Neoplásicas y No Neoplásicas colorrectales.5 En 1994, el Dr. Sano y el ingeniero Gono desarrollaron el sistema NBI (Narrow Band Imaging o Imagen de banda angosta) como herramienta de visualización endoscópica basada en el uso de filtros ópticos, que permite el pasaje de la luz azul (415nm), la cual penetra superficialmente en la pared del colon y es absorvida por la hemoglobina presente en los capilares superficiales de la mucosa, observándose éstos de color marrón,1,4 permitiendo una valoración detallada del patrón vascular (microvasculatura) y de la superficie de la mucosa (microestructura), facilitando de esta manera el diagnóstico diferencial de las lesiones Neoplásicas y No Neoplásicas colorrectales sin la aplicación de Índigo Carmín in vivo y en tiempo real.1,4,8,13,14 Ésta tecnología fue comercializada en Diciembre del 2005 con los equipos Excera II (Olympus Medical System), difundiéndose rápidamente sus aplicaciones en el diagnóstico y tratamiento de las lesiones del tracto gastrointestinal.14
El propósito de nuestro estudio fue evaluar prospectivamente la utilidad del NBI y la Magnificación Óptica en el diagnóstico diferencial de los pólipos colorrectales empleando la Clasificación del Patrón Capilar de Sano-Emura y la Clasificación del Patrón de las Criptas de Kudo.
MATERIAL Y MÉTODOS
Se realizaron 86 colonoscopías en el Instituto de Medicina Avanzada en Gastroenterología. Lima, Perú, entre enero y mayo del 2010. El motivo del exámen se muestra en la tabla 1. Todos los pacientes firmaron previamente un consentimiento informado.
Se encontraron 136 lesiones, que fueron analizadas histológicamente, excluyéndose 17 (6 > de 10 mm y 11 adenomas serratos). El total de lesiones incluídas en el estudio fue 119, todas ellas ≤ 10 mm que correspondieron a 61 pacientes.
La preparación del colon se llevó acabo con 6 Lt de una solución de Polietilenglicol (2lts administrados la noche anterior y 4lts el día del procedimiento). La colonoscopía se realizó con Colonoscopios OLYMPUS CF-Q 160ZL, con un videoprocesador EVIS EXCERA IICV- 180, bajo sedación y analgesia con Propofol 1%, Clorhidrato de Petidina y N-butilbromuro de hioscina endovenosos, administrados por médicos anestesiólogos. Los exámenes fueron realizados y analizados por dos colonoscopistas entrenados en NBI y Magnificación Óptica (MO).
Según su localización las lesiones fueron clasificadas en dos grupos teniendo como referencia el ángulo esplénico: colon proximal (que incluye ciego, colon ascendente, ángulo hepático, colon transverso) y colon distal (colon descendente, colon sigmoides y recto).4
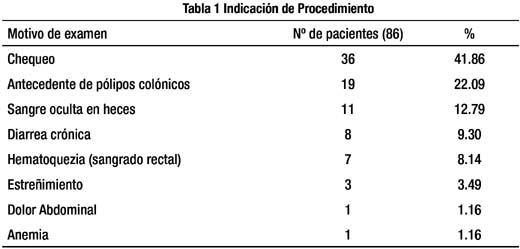
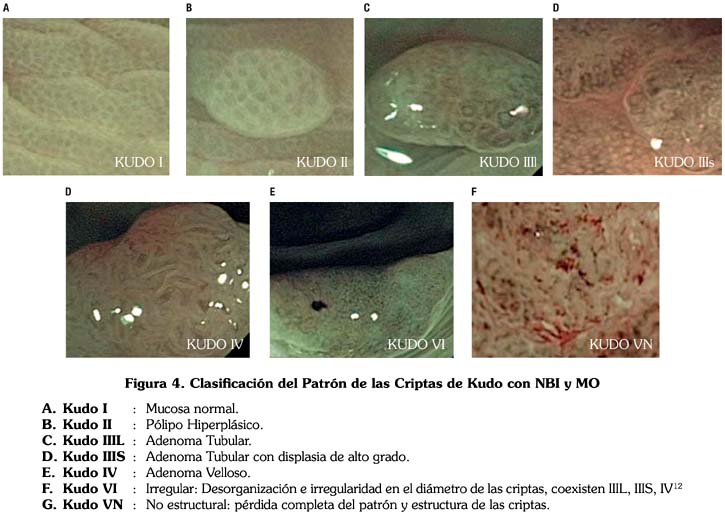
Cada una de las lesiones encontradas fue evaluada siguiendo los siguientes pasos.3 Fig.1:
-
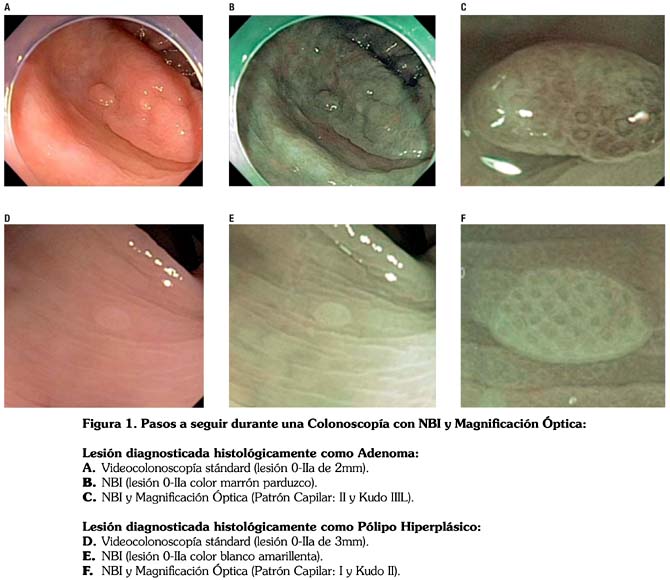
Colonoscopía stándard con luz blanca: las lesiones detectadas fueron lavadas con una solución de dimetilpolisiloxano y acetilcisteína, a fin de remover el moco presente en su superficie, siendo luego clasificadas macroscópicamente de acuerdo a los criterios de la Clasificación de París16, Fig. 2;
-
A continuación se procedió a activar el sistema NBI presionando un botón del colonoscopio, observando bajo esta luz las lesiones neoplásicas (adenomas) de un color marrón parduzco, debido a la presencia de la red capilar, mientras que las lesiones no neoplásicas (pólipos hiperplásicos) se observaron de un color blanco amarillento similar a la mucosa normal.3
-
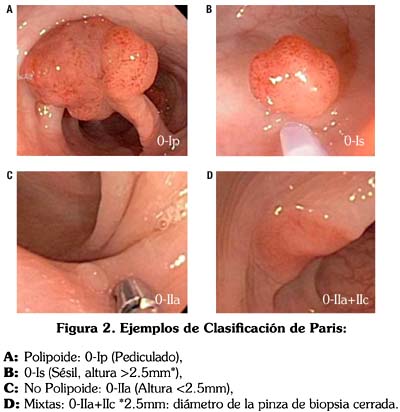
Seguidamente se utilizó el NBI y la Magnificación Óptica (MO), presionando el botón del zoom del colonoscopio en 75-100%, con la finalidad de evaluar en cada lesión la presencia de la red capilar de acuerdo a los criterios de la Clasificación del Patrón Capilar de Sano Emura.1,3,9,11 Fig. 3 (Patrón Capilar: I, II, III); PC:I (No neoplásico), PC:II (Adenoma), PC:III (Cáncer); para luego analizar el Patrón de las Criptas (con una magnificación de 50%) mediante la Clasificación de Kudo2,3 (Tipos: I-V) Fig. 4, subdividiéndolas en lesiones No Neoplásicas (Tipos: I-II) y Neoplásicas (Tipos: III-V) de acuerdo a la clasificación clínica del patrón de las criptas de Fujii7.
-
Todas las lesiones fueron medidas utilizando la pinza de biopsia completamente abierta (7mm) y aquellas lesiones ≤5mm fueron extirpadas y las >5mm biopsiadas, siéndo posteriormente tratadas por Resección Mucosa Endoscópica (RME) ó polipectomía4.
Los especímenes fueron sometidos a estudio histológico por un patólogo experto, siendo los adenomas definidos como lesiones neoplásicas y los pólipos hiperplásicos como lesiones no neoplásicas4.
Los datos obtenidos fueron analizados en conjunto con un epidemiólogo en cáncer del Instituto Nacional de Enfermedades Neoplásicas.
RESULTADOS
Se realizaron 86 colonoscopías de Enero a Mayo del 2010, encontrándose 136 pólipos, se excluyeron 17 (6 > de 10mm y 11 adenomas serratos). El total de pólipos incluídos en el estudio fue 119 (≤ 10mm) los cuales correspondieron a 61 pacientes (71%). La edad promedio fue 55 años (rango: 27-78 años), 26 fueron varones y 35 mujeres. En todos los pacientes evaluados, la preparación del colon fue óptima y la colonoscopía completa, ingresando al Íleon terminal en todos los casos, sin ningún tipo de complicaciones.
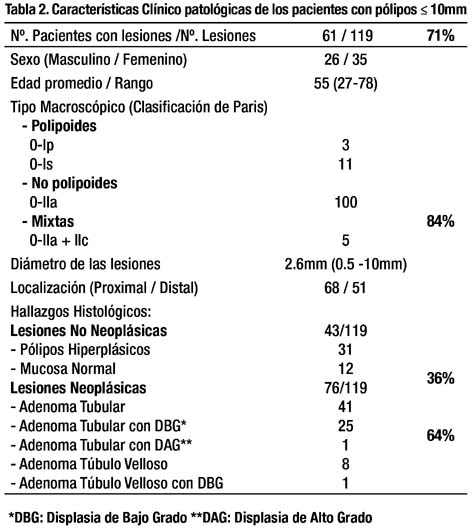
Macroscópicamente las lesiones fueron clasificadas de acuerdo a la clasificación de París16 en: Tipos Polipoide: 0-Ip (3), 0-Is (11), No Polipoide: 0-IIa (100), y Mixtas 0-IIa+IIc (5). La prevalencia de lesiones No Polipoides 0-IIa (100/119) fue 84% y el 58% (58/100) de estas lesiones fueron adenomas. No encontramos ninguna lesión No Polipoide 0-IIc en el grupo evaluado. El diámetro promedio de las lesiones examinadas fue 2.5mm (rango:0.5-10mm), encontrando 111 lesiones ≤5mm (93.2%) y 8 de 6-10mm (6.7%). De acuerdo a su localización 68 (57.1%) de los pólipos se encontraron en el colon proximal y 51(42.8%) en el colon distal. Según el examen histopatológico, 76 (63.8%) de las lesiones fueron diagnosticadas como Neoplásicas (adenomas) y 43 (36.1%) como No Neoplásicas (pólipos hiperplásicos y mucosa normal) como se muestra en la tabla 2 (características clínico patológicas de los pacientes con pólipos ≤ 10mm). Se encontró un adenoma con displasia de alto grado que representa el 1.31% (1/76) de los adenomas evaluados, ésta lesión tuvo un diámetro de 5mm y macroscópicamente fue clasificada como una lesión 0-IIa, la cual se extirpó completamente con la pinza de biopsia. Cuando analizamos las lesiones utilizando la clasificación del patrón de las criptas de Kudo encontramos los siguientes hallazgos: Kudo I (3), Kudo II (40), Kudo IIIL (66), Kudo IIIS (3), Kudo IV (7). Cuatro de las lesiones diagnosticadas endoscópicamente como Neoplásicas (adenomas) Kudo IIIL y IV, fueron histológicamente pólipos hiperplásicos (3) y mucosa normal (1). como se observa en la tabla 3. Cuatro de las lesiones diagnosticadas endoscópicamente como No Neoplásicas (pólipos hiperplásicos) Kudo II, fueron histológicamente adenomas tubulares. Encontramos 6.7% de errores en el diagnóstico (8/119); sin embargo, cuatro de ellas tuvieron 2mm de diámetro y las cuatro restantes 1mm. El 4.5% de las lesiones Kudo IIIL fueron diagnosticadas histológicamente como pólipos hiperplásicos.
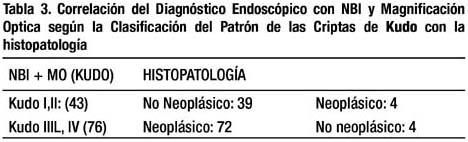
La sensibilidad, especificidad y precisión diagnóstica para la Clasificación del Patrón de las Criptas de Kudo fue 94.7%, 90.6% y 93.2% respectivamente.
Cuando evaluamos las lesiones empleando la Clasificación del Patrón Capilar de Sano-Emura encontramos los siguientes resultados: Patrón Capilar II en 78 lesiones y Patrón Capilar I en 41. Cuatro de las lesiones diagnosticadas endoscópicamente como Neoplásicas (adenomas) PC:II, fueron histológicamente pólipos hiperplásicos (3) y mucosa normal (1) tres de ellas midieron 2mm y la cuarta 1mm de diámetro. Dos de las lesiones diagnosticadas endoscópicamente como No Neoplásicas (pólipos hiperplásicos) PC:I, fueron histológicamente adenomas tubulares, una de ellas con displasia de bajo grado, ambas midieron 1mm. Encontramos 5% de errores en el diagnóstico (6/119), como se observa en la tabla 4.
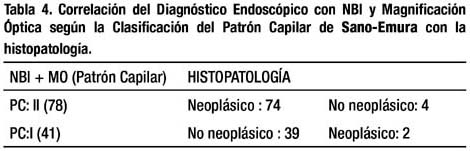
La sensibilidad, especificidad y precisión diagnóstica para la Clasificación del Patrón Capilar de Sano-Emura fue 97.3%, 90.7% y 94.9% respectivamente.
DISCUSIÓN
Es importante señalar que este es el primer estudio prospectivo realizado en el Perú que validará la experiencia de los profesores. Sano, Emura, Matsuda y otros investigadores japoneses en relación a la utilidad del NBI y Magnificación Óptica como herramienta para el diagnóstico diferencial de las lesiones neoplásicas y no neoplásicas colorrectales ≤10mm in vivo y en tiempo real.
El estudio ha incluido sólo aquellas lesiones ≤10mm, las cuales fueron analizadas utilizando el NBI y Magnificación Óptica sin cromoendoscopía con Indigo Carmín, siguiendo los parámetros de la Clasificación del Patrón de las Criptas de Kudo, encontrando una sensibilidad, especificidad y precisión dignóstica de 94.7%, 90.6%, 93.2% respectivamente, a semejanza de los resultados obtenidos por Sano5 y Tanaka2 quienes reportan un precisión diagnóstica de 93%, mientras que Emura utilizando cromocolonoscopía magnificada encuentra 95% (135/142); en nuestro estudio encontramos 6.7% de errores en el diagnóstico (8/119); hallazgos similares a lo reportado por Emura (7/142) con cromocolonoscopía magnificada, sin embargo, cuatro de las lesiones tuvieron 2mm de diámetro y las restantes 1mm, pensamos que el error se debe al diámetro tan pequeño de las lesiones y a la presencia de moco en su superficie. 4.5% de las lesiones Kudo IIIL fueron histológicamente pólipos hiperplásicos a semejanza de lo publicado por Kudo quien encuentra 3.1% 7. El análisis del Patrón de las Criptas con el NBI y Magnificación Óptica es fácilmente reproducible como lo señala el estudio realizado por Huang y col.15
Cuando analizamos las mismas lesiones siguiendo los parámetros de la clasificación del patrón capilar de Sano-Emura obtuvimos una sensibilidad, especificidad y precisión dignóstica de 97.3%, 90.7% y 94.9% respectivamente, a semejanza de los resultados obtenidos por Sano,4 sin embargo encontramos 5% (6/119) de error diagnóstico a semejanza de lo encontrado por Sano (7/150).4 Es posible que el error esté relacionado con el diámetro de las lesiones, las cuales midieron de 1-2mm y estuvieron cubiertas de moco difícil de remover.
63.8% (76/119) de las lesiones estudiadas fueron neoplásicas (adenomas), a diferencia de lo encontrado por Sano 74% (111/150)4. La prevalencia de lesiones no polipoides 0-IIa en nuestro estudio fue (100/119) 84%, similar a lo reportado por Sano (125/150) 83%4, pero mayor a los resultados encontrados por Emura, otros trabajos japoneses; y a los datos reportados en USA y UK,17,18 58% de estas lesiones fueron adenomas a diferencia de lo encontrado por Sano (83%)4; y el 1% de las lesiones 0-IIa fueron adenomas con displasia de alto grado a diferencia del 3% encontrado por Emura7.
Recientemente se ha reportado un incremento en la tasa de cánceres colorrectales ≤10mm (7%) durante una colonoscopía de screening por lo que es necesario prestar mayor atención a estas pequeñas lesiones a fin de detectarlas y tratarlas precozmente.4, 7,19,20
En conclusión, la colonoscopía con NBI y Magnifi cación Óptica sin cromoendoscopía con índigo carmín es un método útil, simple y fácil de reproducir para el diagnóstico diferencial de las lesiones neoplásicas y no neoplásicas colorrectales in vivo y en tiempo real, cuando se emplea el patrón de las criptas de Kudo y el patrón capilar de Sano-Emura; sin embargo, requiere de un corto periódo de aprendizaje.
REFERENCIAS
1. SANO Y, HORIMATSU T, FU K.I, et al.
Magnifying observation of microvascular architecture of colorectal lesions using a narrow-band imaging system. Dig. Endosc. 2006; 18 (suppl. 1): S44-512. TANAKA S, OKA S, YOSHIDA S, et al.
Pit pattern diagnosis for colorectal neoplasia using narrow-band imaging magnification. Dig. Endosc. 2006; 18 (suppl. 1): S52-563. SANO Y, MUTO T, TAJIRI H, et al.
Optical/Digital chromoendoscopy during colonoscopy using narrowband imaging system. Dig. Endosc. 2005; 17 (suppl): S43-484. SANO Y, YKEMATSU H, FU K.I, et al. Meshed Capillary vessels by use of narrow-band imaging for differential diagnosis of small colorectal polyps. Gastrointest. Endosc. 2009; 69 (2): 278-283
5. SANO Y, SAITO Y, FU K.I, et al. Efficacy of Magnifying chromoendoscopy for the differentive diagnosis of colorectal lesions. Dig. Endosc. 2005; 17: 105-116
6. Dirección General de Epidemiología Ministerio de Salud, base de datos a nivel nacional, Perú (2004).
7. EMURA F, SAITO Y, TANIGUCHI M, et al. Further validation of magnifying chromoendoscopy for differentiating colorectal neoplastic polyps in a health screening center. Gastroenterol Hepatol 2007; 22: 1722-1727
8. EMURA F, SAITO Y, YKEMATSU H, et al. Narrow-band imaging optical chromoendoscopy: Advantages and limitations. World y Gastroenterol 2008; 14: 4867-4872
9. KATAGINI A, FU K.I, SANO Y, et al.
Narrow-band imaging with magnifying colonoscopy as diagnostic tool for predicting histology of early colorectal neoplasia. Aliment Pharmacol ther 2008; 27: 1269-127410. LAMBERT R, KUDO S, VIETH M, et al. Pragmatic clasification of superficial neoplastic colorectal lesions. Gastrointest Endosc 2009; 70: 1182-1199
11. YKEMATSU H, MATSUDA T, EMURA F, et al. Effi cacy of capillary pattern IIIA/IIIB by magnifying narrow band imaging for estimating depth of invasion of early colorectal neoplasms. BMC Gastroenterology 2010; 10: 33
12. KANOO H, TANAKA S, OKA S, et al. Clinican significance of type VI pit pattern subclasifi cation in determining the depth of invasion of colorectal neoplasms. World y Gastroenterol 2008; 14:211-217
13. MUTO M, KATADA C, SANO Y, et al. Narrow band imaging: A new diagnostic approach to visualize angiogenesis in superficial neoplasia. Clinical Gastroenterol and Hepatology 2005; 3: S16-S20
14. OSPINA J, VILLANIZAR J. Utilidad de las imágenes de banda angosta (NBI) en la endoscopia diagnóstica. Rev. Col Gastroenterol 2009;24: 60-70
15. HUANG Q, FUKANI N, KASHIDA H. Interobserver and intraobserver consistency in the endoscopic assesment of colonic pit patterns. Gastrointest Endosc 2004; 60:520-526
16. The paris endoscopic clasification of superfi cial neoplastic lesions: esophagus, stomach and colon: november 30 to december 1, 2002. Gastrointest Endosc 2003, 58:S3-43
17. SAITO Y, WAXMAN I, WEST AB, et al. Prevalence and destenctive biologic features of fl at colorectal adenomas usa North American population. Gastroenterology 2001; 120:1657-65
18. REMBACKEN BJ, FUJII T, CAIRNS A, et al. Flat and depressed colonic neoplasms: a prospective study of 1000 colonoscopies in the UK. Lancet 2000; 355: 1211-14
19. SHIDA H, BANK, MATSUMOTO M, et al. Asymptomatic colorectal cancer detected by screening. Dis colon rectum 1996, 39: 1130-5
20. SMITH GA, OIEN KA, O`DARYER PJ. Frecuency of early colorectal cancer in patients undergoing colonoscopy. Br.J Surg 1999; 86:1328-31
21. EMURA F, SAITO Y, MATSUDA T, et al. Colorectal cancer less than 10mm. Should we look at small lesions during screening colonoscopy? (abstract) Gastrointest Endosc 2006; 63:AB199.
22. A WORKSHOP held in Kyoto on February 10-11, 2008. Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointest Endosc (suppl) 2008; 68.













