Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.30 no.4 Lima Sept./Dec. 2010
ARTÍCULOS ORIGINALES
Expresión de HER2 en cancer gástrico en el Perú
HER2 expression in gastric cancer in Peru
Brady Beltran Gárate1 ; Alejandro Yabar Berrocal2
1 Oncólogo Médico, Departamento Oncología Médica - Radioterapia Hospital Edgardo Rebagliati Martins.
2 Anatomopatólogo, Departamento de Anatomía Patológica Hospital Edgardo Rebagliati Martins.
RESUMEN
La positividad al HER2 se plantea como un factor pronóstico negativo en Cáncer Gástrico (CG), correlacionando con pobres tasas de sobrevida. Los reportes de tasas de positividad al HER2 en CG varían ampliamente (6-35%). El objetivo del estudio fue determinar la tasa de positividad y describir las características clínicas y patológicas de los CG Her2(+). Los tumores CG fueron centralmente screneados para inmunohistoquímica y FISH. 9% de los casos fueron positivos, encontrándose mayor positividad en los estadios avanzados (III / IV) vs. los estadios tempranos (I/II)(p= 0.045); en el tipo histológico intestinal vs. mixto/ difuso ( p=0.03 ) y en los cánceres de la unión gastroesofágica vs CG ( p=0.005).
PALABRAS CLAVES: Cáncer gástrico, factores pronósticos, oncógenos.
ABSTRACT
HER2 positivity is thought to be a negative prognostic factor in gastric cancer (GC), correlating with poor survival rates. Reported HER2-positivity rates in GC have varied widely (6-35%).Objetive of this study is to determine rate of positivity and describe clinical and pathological characteristics of HER-2(+) GC. 100 GC tumour samples were centrally screened by immunohistochemistry and FISH. 9% of cases were positive. More positivity HER2 was found in advanced stages (III/IV) vs. early stages (I/II)(p=0.045) ; intestinal histology subtype vs diffuse/ mixed (p=0.045) and gastro-oesophageal junction cancer vs GC ( p=0.005).
KEY WORDS: Gastric cancer, prognostic factors, oncogens.
INTRODUCCIÓN
El cáncer gástrico (CG) es uno de los tumores mas frecuentes en el Peru y el mundo. El receptor tipo 2 del factor de crecimiento epidermoide humano [1]. (HER2) actúa como un oncogen, que codifica un receptor de membrana celular que genera señales de proliferación, supervivencia, invasividad, metástasis y angiogénesis [2].
Los reportes de tasas de positividad HER2 en CG varían ampliamente en la literatura (6-35%).
Recientemente el estudio Trastuzumab of Gastric Cancer (TOGA) demostró un beneficio en sobrevida (11.8 vs 16 meses) en los pacientes con CG HER2+ que recibían trastuzumab más quimioterapia convencional comparado con los pacientes Her2+ que recibieron sólo quimioterapia(3).
Este es el primer reporte peruano que pretende determinar la tasa de positividad del HER2 en CG y describe las características clínico-patológicas de esta entidad.
MATERIAL Y MÉTODOS
El presente estudio corresponde a un estudio prospectivo y analítico que se realizó de Julio 2009 hasta Marzo del 2010 en el Servicio de Ontología Medica del Hospital Edgardo Rebagliati Martins.
Se reclutaron 100 pacientes con CG, mayores de 18 años, con cualquier estadio clínico y que contaran con un taco de parafina del tumor gástrico en buenas condiciones.
Se colecto información clínica obtenida de las historias clínicas de los pacientes.
Todos los casos fueron sometidos a la prueba de inmunohistoquímica (IHQ) Herceptest, la cual tipifi caba 4 categorías de acuerdo a la expresión del HER2 (1+, 2+, 3+ o negativo). Sólo fueron considerados positivos, los que presentaron IHQ 3+ ó Fluorecense in situ hybridization (FISH) +. Los casos que por IHQ fueron 2+, se sometieron a FISH.
El método FISH Her2 consistió en un estudio de interfase en cortes desparafinados de tumor invasor, empleándose una sonda dual fluorescente de Her 2 neu/Centrómero 17 (Her2 FISH pharmDX Kit, Dako Cytomation) y luego las preparaciones se observan en microscopio de fluorescencia.
Se realizó estadística descriptiva y para el análisis de grupos se empleó Chi cuadrado y T student.
RESULTADOS
La tasa de positividad HER2 para el estudio fue del 9%. 8 casos fueron positivos por Herceptest 3+ y dos casos fueron positivos 2+. Estos últimos fueron sometidos a FISH, resultando sólo un caso con positividad (tabla
1).

El promedio de edad fue de 69.5 años y para el grupo HER2+ 72.8 años, no encontrándose diferencia estadística entre ambos grupos ( p=0.45). Tampoco se detectó diferencia entre la relación masculino/femenino ( p=0.52) (tabla 2).
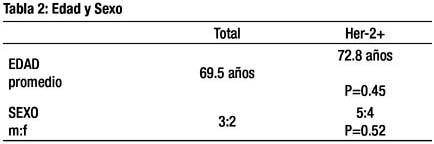
Con respecto a los estadios clínicos: 10.9% de los casos incluidos tuvieron estadio I ; el estadio II en 31.5% ; el estadio III en 26.1% y el estadio IV en 31.5%. La tasa de positividad HER2 en los estadios IIII/IV fue mayor comparado con los estadios tempranos I/II (p=0.045) (tabla 3).
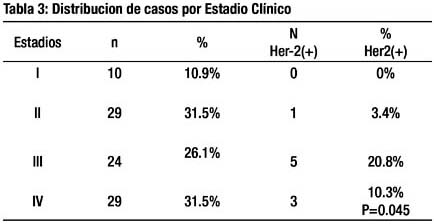
El tipo histológico intestinal se presentó en el 70% de los casos, el mixto en 17% y el difuso en 13%. Los 9 casos positivos Her2 tuvieron el tipo intestinal. Este último hallazgo fue estadísticamente significativo ( p=0.03) (tabla 4).

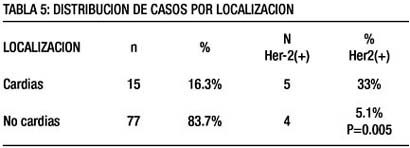
La localización en la región del cardias de 5 casos HER2 positivos (33%) de todos los casos encontrados en esta zona (n=15) fue significativamente superior p<0,005 a los casos ubicados en zonas diferentes al cardias (4/77=5.1%) (tabla 5).
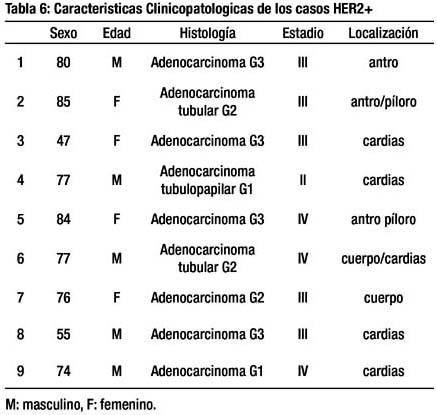
Las características clínicas y patológicas de los 9 casos HER2+ se presentan en la (Tabla 6).
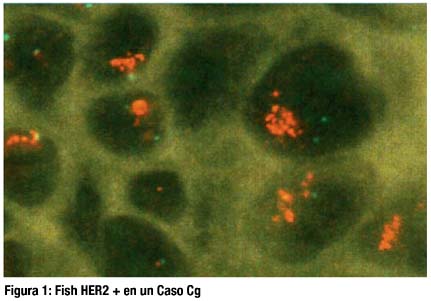
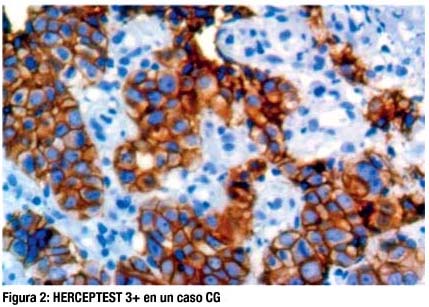
DISCUSIÓN
El cáncer gástrico (CG) es uno de los tumores más frecuentes y es el segundo como causa de mortalidad en el mundo. En el Perú se constituye en una causa importante de muerte por cáncer (1).
Es conocido que existen factores de riesgo para el desarrollo de CG. Así el esófago de Barrett está asociado con el adenocarcinoma de la unión cardioesofágica (4) mientras que el Helicobacter pylori, la gastritis atrófica y la metaplasia intestinal se asocian al adenocarcinoma gástrico (5).
La proteína HER2 (p185, HER2/neu, ErbB-2) es un receptor de tirosinaquinasa transmembrana de 185KDa y es un miembro de los receptores del Factor de Crecimiento Epidérmico (EGFR). Esta familia de receptores está compuesta por 4 miembros: HER1 (también conocido como EGFR), HER2, HER3 y HER4. Estos receptores comparten la misma estructura molecular con un dominio de enlazamiento extracelular para el ligando, un dominio corto transmembrana y un dominio intracelular con actividad de tirosinacinasa. La unión del ligando con los dominios extracelulares genera una cascada de señales de transducción que pueden influenciar en varios aspectos de la biología celular del tumor incluyendo proliferación, apoptosis, adhesión, migración y diferenciación. HER2 es codificado por un gen localizado en el cromosoma 17q21 [6, 7]. En carcinomas, HER2 actúa como un oncogen, principalmente por el alto nivel de amplificación del gen que induce una sobreexpresión proteica en la membrana celular y la subsecuente adquisición de propiedades ventajosas para la célula maligna [2].
En cánceres como colon, vejiga, ovario, endometrio, pulmón, cérvix, cabeza y cuello, esófago y cáncer gástrico, la sobreexpresión y/o amplificación del HER2 ha sido descrita (12-19). En cáncer de mama, HER2 ha sido detectado entre el 10-34% de los cáncer invasivos de mama y correlaciona con el curso clínico, confiere pero pronóstico y constituye en un factor predictivo negativo a la quimioterapia y hormonoterapia [8].
La sobreexpresión de la proteína HER2 en cáncer gástrico usando IHQ fue descrita en 1986[9]. Estudios recientes empleando IHQ con un anticuerpo monoclonal (HercepTest) y/o amplificación del gen por FISH detectaron tasas similares(13-23%).Un grupo japonés detectó 23% por IHQ y por FISH 27% de 200 tumores resecados[10]. Otro grupo detectó un 13% en 166 biopsias de especímenes de cáncer gástrico[11]. Sin embargo el estudio más grande fue el estudio TOGA que incluyó a 3,807 pacientes con CG de 24 países. Los resultados finales mostraron una positividad del 22.1%. La tasa de positividad fue similar en Europa y Asia. En el presente estudio, la tasa de positividad sólo alcanzó un 9%, porcentaje bajo comparado con otros estudios y explicado por dos razones: primero que en nuestro estudio se incluyeron pacientes en todos los estadios clínicos a diferencia del TOGA que sólo involucró a pacientes con enfermedad metastásica siendo conocido la mayor expresión HER2 en estadios avanzados y segundo, la baja frecuencia de cánceres de la unión gastroesofágica que en nuestro estudio fue del 16.3% comparado con otros estudios.
El estudio TOGA encontró que la positividad fue más alta en los cánceres de la unión gastroesofágica que del estómago (33.2% vs 20.9%; p<0.001) y en los subtipos histológicos intestinal que en los difusos/mixtos (32.2% vs 6.1%/20.4%; p<0.001).(3). La mayor expresión HER2 en los cánceres de la unión gastroesofágica y en el subtipo intestinal fueron datos estadísticamente signifi cativos encontrados en el presente estudio.
Además, el estudio TOGA demostró que aquellos pacientes HER2+ que recibieron quimioterapia más trastuzumab, anticuerpo monoclonal dirigido contra el HER2 vs. los pacientes que recibieron sólo quimioterapia convencional, tuvieron tasas de respuesta más altas y una sobrevida global más larga (3).
En otro estudio asiático se evaluó la sobreexpresión de HER2 y HER3, las cuales ocurrieron en 18.6% y 13.7% respectivamente de los 102 casos incluidos. El tipo intestinal tuvo mayor expresión de Her2 que la forma difusa (26.7% vs. 7.1%, p < 0.05), mientras que la difusa, presentaba una mayor actividad del HER3 que el tipo intestin al (26.2% vs. 5.0%, p < 0.01). Otro aspecto interesante del estudio fue que estadios III/IV tuvieron mayor expresión de HER2 y HER3 que los estadios I/II, además que la sobreexpresión de HER2 y HER3 correlacionó con una pobre sobrevida (12).
La mayor expresión Her2 en casos avanzados fue también confirmado en nuestro estudio, lo que sugiere que la sobrexpresión HER2 podría ser un evento tardio en la oncogénesis de este tipo de CG a diferencia de lo que ocurre en cáncer de mama, donde el HER-2 es un evento temprano.
En conclusión, CG HER2+ en Perú se presenta en un porcentaje inferior al 10%; usualmente en estadios avanzados, con histología intestinal y de localización en el cardias. Estudios prospectivos tendrán que confirmar estos hallazgos en la población peruana.
REFERENCIAS
1. PILCO P, PAYET E, CÁCERES E. Cáncer Gástrico en Lima Metropolitana. Rev. gastroenterol. Perú 2006; 26:377-385.
2. SLAMON DJ, GODOLPHIN W, JONES LA et al.
Studies of the HER-2/neu protooncogene in human breast and ovarian cancer. Science 1989; 244: 707–712.3. BANG Y, CHUNG H, XU J, LORDICK F, SAWAKI A et al. Pathological features of advanced gastric cancer (GC): Relationship to human epidermal growth factor receptor 2 (HER2) positivity in the global screening programme of the ToGA trial. J Clin Oncol 27:15s, 2009 (suppl; abstr 4556).
4. MONTGOMERY E, GOLDBLUM JR, GREENSON JK et al. Dysplasia as a predictive marker for invasive carcinoma in Barretts esophagus. A follow-up study based on 138 cases from a diagnostic variability study. Hum Pathol 2001; 32: 379–388.
5. CORREA P. Helicobacter pylori and gastric cancer: state of the art. Cancer Epidemiol Biomarkers Prev 1996; 5: 477–481.
6. AKIYAMA T, SUDO C, OGAWARA H et al. The product of the human c-erbB–2 gene:a 185-kilo-Dalton glycoprotein with tyrosine kinase activity. Science 1986; 232:1644–1646.
7. COUSSENS L, YANG-FENG TL, Liao YC et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985; 230: 1132–1139.
8. KAPTAIN S, TAN LK, CHEN B. Her–2/neu and breast cancer. Diagn Mol Pathol 2001; 10: 139–152.
9. SAKAI K, MORI S, KAWAMOTO T et al. Expression of epidermal growth factor receptors on normal human gastric epithelia and gastric carcinomas. J Natl Cancer Inst 1986; 77: 1047–52.
10. YANO T, OCHIAI A, DOI T et al. Expression of HER2 in gastric cancer: comparison between protein expression and gene amplification using a new commercial kit.J Clin Oncol 2004; 22: 14S (Abstr 4053).
11. GRAVALOS C, MÁRQUEZ A, GARCÍA-CARBONERO R et al. Correlation between Her2/neu overexpression/ amplification and clinicopathological parameters in advanced gastric cancer patients: a prospective study 2007 Gastrointestinal Cancers Symposium. 130 (Abstr 89).
12. ZHANG XL, YANG YS, XU DP, QU JH, GUO MZ, GONG Y, HUANG J. Comparative study on overexpression of HER2/neu and HER3 in gastric cancer. World J Surg 2009 Oct;33(10):2112-8.













