Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.30 no.4 Lima Sept./Dec. 2010
ARTÍCULOS ORIGINALES
Seguimiento posterior a la cirugía curativa para el cáncer colorrectal: impacto de la tomografía por emisión de positrones - tomografía computarizada (PET/TC)
Follow-up after curative surgery for colorectal cancer: impact of positron emission tomography - computed tomography (PET/CT)
Pedro P. Alvarez-Falconi1,2 ; Bessy Amanda Ríos Ruiz3,4
1. Oficina de Inteligencia Sanitaria, Centro Nacional de Salud Pública, Instituto Nacional de Salud.
2. Médico. Doctor en Medicina.
3. Directora del Hospital I Juanjui EsSalud. Coordinadora de Atención Primaria y Programas Preventivo Promocionales de la Red Asistencial Tarapoto-EsSalud
4. Médico.
RESUMEN
INTRODUCCIÓN: En Perú, el primer brote de fiebre de Oropuche (OROF) fue en Iquitos en 1992, como diseminación del virus oropuche (OROV) desde Brasil. La OROF produce gastos en recursos de salud, pérdida laboral, inasistencia académica y sufrimiento social.
OBJETIVO: Contribuir a evaluar el brote de OROF en el pueblo Bagazán del Departamento San Martín, comparar las manifestaciones gastrointestinales (MGI) y hemorrágicas con las del brote de Iquitos y los de Brasil.
MÉTODOS: En Bagazán, con 1,082 habitantes, se produjo bruscamente en mayo de 2010 un síndrome febril agudo en muchos habitantes. La información fue registrada en formatos estandarizados. Muestras sanguíneas fueron enviadas al Instituto Nacional de Salud de Lima.
RESULTADOS: En 108 pacientes se confirmó el diagnóstico. La mayoría presentó fiebre > 38ºC, cefalea, dolores musculares, artralgias, inyección conjuntival, dolor abdominal, náuseas, vómitos, diarrea. En pocos casos epistaxis, sangrado gingival, menorragia. Las MGI fueron más frecuentes que en el de Iquitos.
CONCLUSIONES: El brote demostró la persistente diseminación del OROV al Perú. El brote ocurrió al producirse una conjunción de situaciones propicias. Se discuten hipótesis del incremento de MGI y hemorrágicas, incluyendo razones ecológicas, inmunitarias, individuales y virales.
PALABRAS CLAVE: Fiebre de Oropuche.
Arbovirus. Iquitos. Bagazán. Perú.
ABSTRACT
INTRODUCTION: In Peru, the first outbreak of Oropuche fever (OROF) occurred in Iquitos during 1992, as dissemination of oropuche virus from Brazil. The OROF causes expenses in public health, loss of labour and academic activities and social suffering.
OBJECTIVE: Evaluation of the outbreak of OROF in Bagazan community of San Martin Department, and comparison of the gastrointestinal and hemorrhagic clinical manifestations with those occurred in Iquitos and Brazil.
METHODS: The sudden onset of an acute fever syndrome in many people of Bagazan, little village with 1082 residents, happened in may 2010. The symptoms and signs were registered in a standardized pattern. Blood samples were sent to the laboratory of the National Health Institute in Lima.
RESULTS: The diagnosis was confirmed in 108 patients. The clinical manifestations were fever of 38º C, headache, muscle and joint pains, congestion of conjunctiva, nausea, vomiting, and diarrhea. Some cases presented nose, gum and/ or vaginal bleeding. The gastrointestinal manifestations were more frequent than those of the Iquitos cases.
CONCLUSIONS: The outbreak showed the dissemination of OROF to Peru, because of various favorable conditions. We discuss the hypothesis of the increase of gastrointestinal and hemorrhagic manifestations, including ecological, immunity, individual and viral characteristics.
KEY WORDS: Oropuche fever. Arbovirus. Iquitos. Bagazan. Peru.
INTRODUCCIÓN
En 1955 se aisló por primera vez, desde un paciente febril con malaria en la región Oropuche de la isla Trinidad, el virus oropuche (OROV), un arbovirus de la familia Bunyaviridae, encontrándose además anticuerpos del OROV en trabajadores forestales de la zona y en monos diversos (1). El OROV era desconocido en Sudamérica. En 1961, por primera vez se produjo en Brasil, en la ciudad Belém, una epidemia urbana de fiebre de Oropuche (OROF), con más de diez mil infectados. Desde ese año, Brasil ha tenido diversos brotes de OROF, expresión de la diseminación del OROV en su territorio.
Por primera vez se produjo en el Perú, en 1992, un brote de OROF, en la ciudad de Iquitos del Departamento Loreto (2). El aislamiento del OROV fue desde cinco pacientes febriles residentes en Iquitos, sin antecedentes de haber salido de esa ciudad. Las manifestaciones clínicas comunes a los 5 (100%) fueron fiebre, cefalea intensa y dolores osteomusculares; en cuatro (80%) además conjuntivitis y fotofobia; uno (20%) también manifestaciones gastrointestinales caracterizadas por dolor en el epigastrio, vómitos y diarreas. El aislamiento del OROV fue en el laboratorio central del U.S. Naval Medical Research Center Detachment en Lima. El brote evidenció la diseminación del OROV desde Brasil por la cuenca amazónica hacia Perú.
Desde 1993 a 1995, en la ciudad de Iquitos se identificaron anticuerpos de OROV en 16 pacientes (3), lo que demostró su circulación activa en la zona. En 1994 se presentó un brote de OROF en la ciudad Puerto Maldonado en el Departamento Madre de Dios (4), aunque sin mayor información al respecto. En 1997, un estudio encontró alta prevalencia de anticuerpos de oropuche en pobladores de varios distritos (5) de Iquitos, lo cual reafirmó la diseminación.
En las áreas rurales el OROV es transmitido entre primates, marsupiales y aves, mediante los vectores Aedes serratus y Culex quinquefasciatus (6), constituyendo la forma selvática o rural, asintomática y silente, que mantiene al virus en la naturaleza. Esto significa que no es necesario que el humano esté presente para mantener el desarrollo natural del arbovirus. De otro lado, está la forma urbana, que es la epidémica, en la cual el OROV es transmitido de humano a humano por el vector Culicoides paraensis (7). En ambas formas tal vez puedan participar otros vectores, incluyendo especies de Culicoides, descubiertos en la amazonía (8) y cuya participación no ha sido aún claramente defi nido.
Desde los meses de Abril y especialmente Mayo de 2010, en el pueblo Bagazán que se encuentra en el Departamento San Martín en la selva del Perú, ocurrió un brote de un Síndrome febril agudo, confirmado más adelante por anticuerpos séricos como OROF. Dicha infección ocurría por primera vez en esa región del país.
El propósito de este trabajo fue contribuir a evaluar epidemiológicamente el brote de OROF en el pueblo Bagazán, así como comparar algunas manifestaciones clínicas que se presentaron ahí, con las del brote de Iquitos y con brotes de Brasil, incluyendo las manifestaciones gastrointestinales y hemorrágicas, discutiendo algunas hipótesis.
MATERIAL Y MÉTODOS
Lugar del brote. Bagazán, pueblo situado en el nororiente del Perú, a 365 metros snm, en las coordenadas latitud 7º 13 41 S y longitud 76º 29´ 28 W. El pueblo se encuentra en el Distrito Pachiza, que a su vez pertenece a la Provincia Mariscal Cáceres, situada en el Departamento San Martín. Pachiza está a 25 kilómetros de Juanjuí, que es la ciudad más cercana y a su vez capital de dicha Provincia (Figura 1).
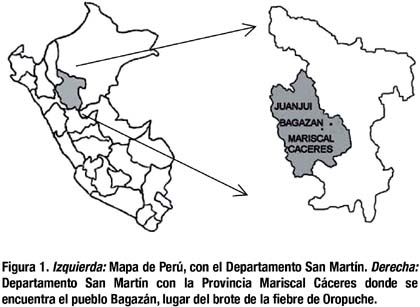
En la región el río principal es el Huallaga, el cual es navegable y con afluentes cercanos al pueblo. La zona es boscosa con lluvias frecuentes y temperatura calurosa que durante los días del año oscila entre 20 a 37°C. La principal actividad es la agricultura, con plantaciones de cacao, plátano, café y maíz. La crianza del ganado vacuno suele ser importante.
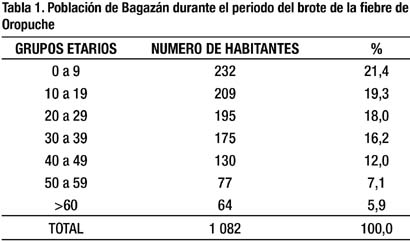
Según el censo del año 2007 (9), el pueblo Bagazán albergaba 701 habitantes en 169 viviendas, sin embargo alrededor de la fecha del brote tenía 1,082 habitantes (Tabla 1), así como 207 viviendas precarias, muchas con malezas alrededor y con acúmulo de inservibles. El saneamiento básico era deficiente por el inadecuado mantenimiento del sistema de agua, con letrinas en mal estado e inapropiada eliminación de residuos. El pueblo no cuenta con energía eléctrica.
Obtención de datos. La información epidemiológica y clínica, fueron registradas en formatos estandarizados.
La anamnesis, en algunas personas que habían presentado Síndrome febril agudo durante la fase del brote y estaban recuperados o en vías de recuperación, fue útil para complementar o reafirmar datos clínicos.
Consideraciones éticas. En todo momento se consideraron los principios éticos y valores de protección al humano. El estudio no incluyó aspectos de intervención.
Información de otras fuentes. Muestras sanguíneas de pacientes en fase aguda fueron enviadas desde el Laboratorio de Referencia Regional al Instituto Nacional de Salud (INS) del Perú en Lima, para determinar los títulos de IgM contra el OROV. Para este estudio no se consideró pertinente ejecutar nuevas tomas de muestras para determinar títulos, considerando que los resultados en el INS pueden ser acopiados por los investigadores.
RESULTADOS
Producido el brote, personal de salud asistió a la zona, confirmando en los siguientes días que muchos pobladores adquirieron la infección. En zonas urbanas o periurbanas se pudo apreciar un posible agente vector, el Culicoides paraensis (Goeldi). Este prolifera en los suelos con desechos húmedos constituidos por las cáscaras vacías del cacao y tallos de banano eliminados.
En una importante evaluación diaria, desde el 18 hasta el último día de Mayo, la población afectada por el Síndrome febril agudo fue de 171 personas (Tabla 2).

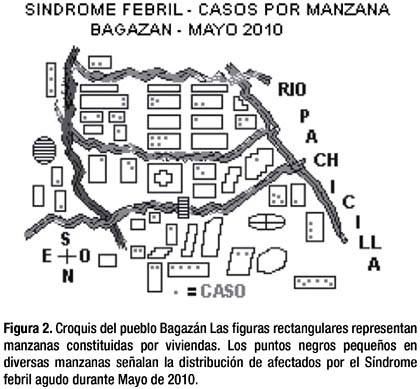
La diseminación de la infección hacia fines de Mayo, se aprecia en el esquema de distribución de los afectados en las viviendas de las manzanas del pueblo (Figura 2).
Las manifestaciones clínicas comunes correspondieron en la mayoría de pacientes a un inicio súbito con fi ebre > 38ºC, acompañado de cefalea intensa y dolores musculares generales, a veces más intensos en la espalda o en el cuello, escalofríos, artralgias, malestar general, con postración en los casos intensos, lumbalgia, inyección conjuntival, anorexia, tos, astenia, mareos, dolor retroocular, rinorrea, fotofobia, dolor abdominal, náuseas, vómitos, diarrea, deshidratación.
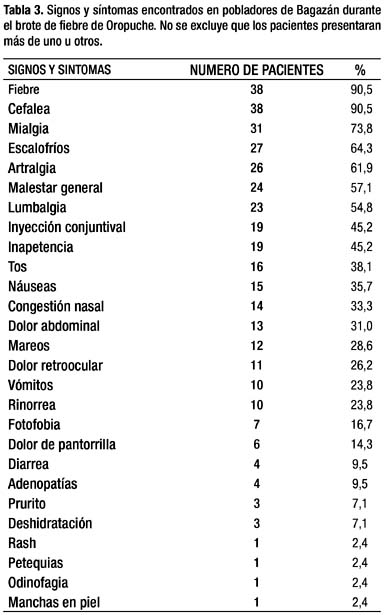
No se conoció de recaídas, confirmando en la búsqueda las manifestaciones gastrointestinales (MGI), así como en pocos casos un fenómeno hemorrágico caracterizado por epistaxis, sangrado gingival, y menorragia. Un niño presentó manifestaciones compatibles con meningismo, de recuperación rápida y sin secuelas. En 42 pacientes afectados se evaluó completamente los signos y síntomas (Tabla 3), los afectados se incrementaron a 171 personas registradas como se ha señalado. Así mismo, desde más de un centenar de afectados en la fase aguda de la infección los servicios de salud obtuvieron muestras sanguíneas que finalmente se enviaron al INS para el diagnóstico por laboratorio. El porcentaje de afectados con estas cifras fue del 16% de la población. Sin embargo, por referencia de la población la apreciación fue que estuvieron afectados muchos más, incluyendo los que presentaron sintomatología leve y no acudieron a un servicio de salud, u otros fuera de la fase aguda y en recuperación, lo que podría alcanzar un porcentaje similar al señalado.
La extensión de la epidemia comprometió en nuestro estudio al 16% de la población, pero en total posiblemente alrededor del 40% de los habitantes, entre confirmados y presuntivos, pero también los que no accedieron a atención médica estatal. Se afectó la asistencia de niños a la escuela en los meses Abril y Mayo. El tratamiento fue sintomático. La duración de la enfermedad fue entre siete a diez días y no se reportó secuela alguna, no conociéndose de defunciones por la enfermedad.
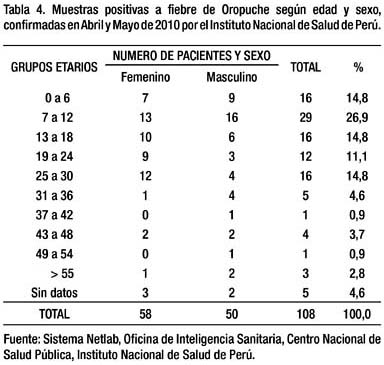
El diagnóstico de OROF se confirmó por la información de los resultados desde el INS. La prueba ELISA de captura IgM para OROV fue positiva en 18 muestras en Abril y en 91 en Mayo. A partir de Junio no se reportaron muestras positivas. De las positivas, 58 correspondieron a pacientes de sexo femenino y 50 al masculino (Tabla 4).
DISCUSIÓN
Por primera vez en el Departamento San Martín, en el pueblo Bagazán, se produjo en Abril y Mayo de 2010 un brote de OROF que afectó al 16% y posiblemente al 40% de sus 1,082 habitantes. La cantidad de infectados de 16% y los posibles infectados no debe sorprender si lo comparamos con el brote en el pueblo Serra Pelada del Estado de Pará, Brasil, donde en 1994 fueron infectados cerca de 5,000 personas (10), correspondiente al 83% de sus 6,000 habitantes. Así mismo, en el pueblo Quatro Bocas en el mismo Estado, en el brote de 1978 fueron infectados (11) por el OROV el 40% de sus 2,280 habitantes.
Hasta 1930 se conocían tres arbovirus patógenos, pero hacia los años 90 se confirmaron varios más (12) dentro de los más de 500 listados (13) de la familia. Se tiende a admitir que los patógenos pueden producir una fase aguda febril indistinguible (14) entre ellos, y no hay manifestaciones clínicas específicas. Sin embargo, algunos investigadores sugieren que, respecto a las manifestaciones gastrointestinales (2) pueden encontrarse algunas diferencias discretas entre ellos Otros estiman que un 5% de casos puede presentar náuseas vómitos, diarreas, dolor epigástrico moderado, congestión conjuntival y dolor retroocular, y un número aún menor compromiso del sistema nervios central (15).
Comparando las MGI en los infectados en el brote de Iquitos de 1992, con las presentadas en el brote de Bagazán, el de Iquitos alcanzó un 20% con dolor en el epigastrio, náuseas, vómitos y diarrea. En Bagazán se apreciaron con mayor frecuencia las MGI como dolor en el epigastrio o abdominal (31%), náuseas (35,7%) y vómitos (23,8%), aunque diarreas en pocos casos y no nos referiremos a ellas. En epidemias en Brasil, las MGI se describieron en los brotes de los Estados Maranhao y Goiás, en 1988, con más de 120 pacientes, con las manifestaciones clínicas señaladas (16). En el 2006, la enfermedad re-emerge después de 26 años en el Estado de Pará, región Bragantina, confirmada en más de 100 pacientes, con las manifestaciones clínicas comunes(17), apreciándose que las MGI fueron tan frecuentes como en Bagazán.
Las manifestaciones hemorrágicas en Bagazán, epistaxis, sangrado gingival, menorragia y aún petequias, no fueron encontradas en el brote de Iquitos de 1992. Al respecto existe referencia de dos casos de menorragia en infectadas accidentalmente con OROV en el laboratorio (18), lo cual permite asumir una capacidad potencial del virus en tal sentido. En diversos brotes en Brasil no se han descrito, no se halla en el brote de Villa Mojuí dos Campos, ciudad de Santarém en el Estado de Pará en 1975, con más de 80 infectados (19). Sin embargo, manifestaciones hemorrágicas se observaron en la epidemia de OROF en la ciudad Manaus, Brasil, en los años 20072008 donde un 15,5% de 631 pacientes presentaron espontáneamente dicho fenómeno hemorrágico caracterizado por petequias, epistaxis y sangrado gingival (20). No es posible señalar si dichas manifestaciones expresaron un incremento de la virulencia o una condición previa de los pacientes.
El brote en el pueblo Bagazán demostró el incremento de la diseminación del OROV en la selva amazónica peruana. En un estudio del 2000 al 2007, para confi rmar infecciones por arbovirus en 20,000 pacientes reclutados (21) en varios países pero la mayoría de Perú (87% del total), en sitios urbanos como rurales de Iquitos, fue aislado el OROV en 18 pacientes. Ello reafirmó su persistencia en esa región, pero su diseminación por la selva amazónica posiblemente está ocurriendo en una circulación silente (22). En un estudio ulterior, el OROV fue detectado en uno de más de 500 pacientes con enfermedad febril aguda en Ecuador (23), lo que podría confirmar la expansión hacia la cuenca amazónica de dicho país.
Considerando las diferencias sutiles o no, en la frecuencia de algunas MGI y en las manifestaciones hemorrágicas en la epidemia de Bagazán, comparativamente con el brote de Iquitos, pueden explorarse hipótesis. Puede ser importante la diferencia entre los universos a comparar, el de Iquitos fue escaso en pacientes afectados aunque se dieron todas las manifestaciones clínicas de una infección considerada benigna pero relevante por causar problemas en salud pública. En el brote de Bagazán hubo más de un centenar de pacientes confirmados. A más universo de afectados, puede admitirse una mayor posibilidad de sintomatologías, incluso las menos frecuentes.
El análisis filogenético diferencia al OROV en tres distintos genotipos: I, II y III. El I corresponde a la cepa de Trinidad y responsable de muchos de los brotes en Brasil, el genotipo II corresponde a cepas aisladas en Perú y Brasil entre 1992 y 1998, el III corresponde a cepas aisladas en Panamá en 1989 (24), aunque también se halló en el 2005 en primates platirrinos del sudeste del Brasil (25). Los tres genotipos circulan en Sudamérica, en regiones separadas, pero posiblemente más adelante difundirán. Es posible que cada genotipo, pueda tener alguna distinción particular expresada en sutiles manifestaciones clínicas, como la frecuencia de MGI y manifestaciones hemorrágicas. Las cepas responsables del brote de Pará, Bragantina, con MGI comunes al de Bagazán correspondían al genotipo II, que también se encuentra en Iquitos. No se ha confirmado el genotipo del OROV en Bagazán, pero por la relativa cercanía podría corresponder al genotipo II. Sin embargo en Pará, Bragantina, no se describió petequias ni epistaxis, con un número mayor de cien pacientes, universo suficiente. No es posible señalar sólo por este mérito, que el genotipo de Iquitos y de Bagazán fueran distintos.
Por otro lado, posiblemente contribuyó en el origen del brote, la influencia de las alteraciones ambientales. Por alguna circunstancia ecológica (12), como el cambio climático, deforestación, u otros factores humanos que pueden interferir en la ecología (26), pudo haber influido en la redistribución de vectores.
La carretera Tarapoto a Juanjuí de 132 km, era afi rmada, pero en los meses previos y coincidentes con el brote en Bagazán que está relativamente cerca de Juanjuí, para su construcción adecuada se realizó una remoción de tierras y capa asfáltica en caliente en 72 kms, desconociéndose las migraciones de personal laboral en la zona, siendo inaugurada alrededor de tres meses después del brote. No es fácil demostrar la magnitud, si la tuvo, en la introducción de factores que alteraran el steady-state o equilibrio ecológico, en la cual una forma selvática del OROV hubiera migrado a una forma urbana. Comparativamente, se recuerda que cerca de la carretera Belém-Brasilia que estuvo en construcción en los años 60, se había aislado el OROV desde un mamífero (perezoso) y en el año siguiente 1961 más de 7,000 casos de OROF fueron confirmados en la epidemia de esa ciudad Belém (27). Es difícil encontrar una relación directa entre esos eventos, construcción y brote, pero tal vez de algún modo constituyó una perturbación del equilibrio ecológico. La intervención humana perturbadora del equilibrio ecológico puede acreditarse en parte al menos en áreas diferentes como las marítimas donde contribuye al florecimiento de algas tóxicas y biotoxinas (28), sin considerar estrategias para evitar alterar la ecología (29).
En el año 2007 el pueblo Bagazán contaba con 701 habitantes, pero en el momento del brote, tres años después, su población se había incrementado en 54%, sin existir industrias en la zona que justificara un crecimiento mayor que el vegetativo que se considera alto si alcanza el 4%. La actividad creciente en la agricultura que incluye remoción del ambiente natural está en expansión y necesitó nuevos brazos, de donde vinieren. Las viviendas en el mismo periodo previo al brote sólo aumentaron en 22%, con las deficiencias descritas. Prima facie, para que el brote ocurriera, se requirió la conjunción de situaciones que se dieron en Bagazán.
En el brote de Iquitos se describieron pocos casos, comparativamente en el brote de Bagazán se presentaron más casos y manifestaciones clínicas tal vez más intensas. Para infecciones análogas se había sugerido una inmunidad protectora contra fiebre amarilla (FA) por una respuesta cruzada a los anticuerpos del dengue, que explicaría la casi ausencia de FA en el sudeste asiático, cuya inmunidad al dengue está en la mayoría de la población. Los estudios al respecto demostraron que no existía tal respuesta cruzada protectora de los anticuerpos del dengue, pero sorprendentemente demostraron que sí estaban significativamente asociados con la severidad de la enfermedad y con reducción de la viremia (30). Una infección previa por dengue podría inducir una respuesta anamnéstica inmune, insuficiente para prevenir la FA, pero suficiente para reducir su severidad. Por analogía, tal vez una respuesta de esa naturaleza podría explicar la frecuencia de las MGI y la severidad por la aparición del fenómeno hemorrágico de la OROF en habitantes de Bagazán sin infección previa al dengue hasta donde se conoce, y lo contrario podría encontrase en Iquitos. A este respecto, los casos de OROF en el brote de Iquitos fueron inicialmente confundidos con dengue (2) por la frecuencia de esa infección en la ciudad, pero especialmente porque estaban en un brote de dengue. En Bagazán, si la respuesta anamnéstica fuera cierta, hubo manifestaciones algo más frecuentes y severas del OROV, tal vez porque los habitantes de Bagazán no tuvieron una experiencia inmunológica previa con dengue, como en Iquitos, que pudiera reducir la severidad clínica de la OROF. Adicionalmente, es conocida la presentación explosiva de los brotes de OROF (31), afectando a docenas, centenares y miles en poco tiempo, como ocurrió en Bagazán con más de un centenar confirmados en pocos días, presentación explosiva que inclusive infectó a personal de salud que fue en ayuda. En Iquitos, el brote fue confi rmado en cinco casos o algunos pocos más, no pareciendo una respuesta explosiva tal vez por tal fenómeno protector.
En la re-emergencia de la OROF en el Estado de Pará en el año 2006, se halló que las mujeres y niños debajo de los 15 años de edad fueron los más afectados (32), como ocurrió en Bagazán a partir de los casos confi rmados donde los más afectados estuvieron entre los 7 y 12 años de edad. En el grupo de 13 a 18 las mujeres fueron las más afectadas, como en el grupo de 25 a 30 años donde fueron tres veces más afectadas que los varones, y en el total también lo fueron, lo cual coincide también con los hallazgos de la epidemia de Santarém (33) en el Estado de Pará del año 1975. Si bien no podemos afirmar que exista una diferencia marcada en cuanto a vulnerabilidad relacionada al sexo con los datos de Bagazán, podría señalarse que la mayor exposición al vector por razones de sus actividades y vestidos en mujeres, como en los niños por sus juegos fuera de la casa, sería responsable entre otras causas de dicha supuesta mayor vulnerabilidad.
Se presume que muchas infecciones por arborvirus en la región amazónica cursan sin diagnóstico por la lejanía, falta de servicios oportunos y en razón que pueden producir manifestaciones clínicas leves y autolimitadas. En Brasil se han descrito pacientes con OROF y manifestaciones clínicas leves, al respecto en un paciente ligeramente sintomático se aisló el OROV del genotipo I (34). En Bagazán diversos casos pudieron no haber sido notifi cados.
Si las políticas nacionales de salud, recursos, metas en investigación en salud (35) y política de medicamentos (36), son insuficientes y erráticas, nuevos brotes de OROF podrán ocurrir en cualquier lugar del país. Ello podría contribuir a profundizar los problemas de salud pública ocasionando mayores gastos en recursos, pérdidas económicas por ausencias laborales, atraso en la escolaridad en los niños, pero sobre todo sufrimiento innecesario de la sociedad.
Conflicto de interés
Los autores no tienen conflicto de interés en relación al estudio reportado en este artículo.
Agradecimiento
Al Bachiller en Estadística Sr. Orlando Angulo, de la Ofi cina de Inteligencia Sanitaria de la Dirección General de Salud Pública, por la confirmación de los datos de muestras positivas.
REFERENCIAS
1. ANDERSON CR, SPENCE I, DOWNS WG, AITKEN THG. Oropuche virus: a new human disease agent from Trinidad, West Indies. Am J Trop Med Hyg. 1961; 10: 574-578.
2. CHÁVEZ R., COLÁN E, PHILLIPS I. Fiebre de Oropuche en Iquitos: Reporte preliminar de 5 casos. Rev Farmacol Terap (Lima). 1992; 2(1): 12-14.
3. WATTS DM, CALLAHAN J, ROSSI C, et al. Venezuelan equine encephalitis febrile cases among humans in the Peruvian amazon river region. Am J Trop Med Hyg. 1998; 58(1): 35-40.
4. TRAVASSOS DA ROSA APA, VASCONCELOS PFC, TRAVASSOS DA ROSA JFS, editors. An overview of arbovirology in Brazil and neighbouring countries. Belém, Instituto Evandro Chagas; 1998. p. 186–92.
5. WATTS D M, PHILLIPS I, CALLAHAN J D, et al. Oropouche virus transmission in the Amazon River basin of Peru. Am J Trop Med Hyg. 1997; 56(2): 148-152.
6. HOCH AL, PINHEIRO FP, ROBERTS DR, GOMES MLC.
El virus Oropuche. Transmisión en el laboratorio por Culex quinquefasciatus. Bol Of Sanit Panam. 1987; 103(2): 106-112.7. ROBERTS DR, HOCH AL, DIXON KE, LLEWELLYN CH. Oropuche virus. III. Entomological observations from three epidemics in Pará, Brazil, 1975. Am J Trop Med Hyg. 1981; 30(1): 165-171.
8. FELIPPE-BAUER ML, CÁCERES AG, SILVA CS, et al. Two new Culicoides of the paraensis species group (Diptera: Ceratopogonidae) from the Amazonian region of Peru. Mem Inst Oswaldo Cruz. 2003, 98(8): 1051-58.
9. INSTITUTO NACIONAL DE ESTADÍSTICA E INFORMÁTICA. Censos Nacionales 2007: XI de Población y VI de Vivienda. Ed. Dirección Nacional de Censos y Encuestas. Lima, Diciembre de 2008.
10. TRAVASSOS DA ROSA AP, RODRIGUES SG, NUNES MR, et al. Outbreak of oropuche virus fever in Serra Pelada, municipality of Curionópolis, Pará, 1994. Rev Soc Bras Med Trop. 1996; 29(6): 537-541.
11. LEDUC JW, HOCH AL, PINHEIRO FP, TRAVASSOS DA ROSA APA.
Enfermedades epidémicas causadas por el virus oropouche en el norte de Brasil. Bol Of Sanit Panam. 1982; 92(2): 143-152.12. SHOPE RE. The discovery of arbovirus diseases. Ann NY Acad Sci 1994; 740: 138-145.
13. GUBLER DJ. Human arbovirus infections worldwide. Ann N Y Acad Sci 2001; 951:13-24.
14. BERNARDES TERZIAN AC, MONDINI A, DE MORAES BRONZONI RV, et al.
Detection of Saint Louis Encephalitis virus in dengue-suspected cases during a dengue 3 outbreak. Vector-Borne Zoonotic Dis. 2010; online ahead of print Jul 20.15. FIGUEIREDO LTM. Vírus brasileiros da família bunyaviridae. Medicina, Ribeirão Preto. 1999; 32: 154–158.
16. VASCONCELOS PF, TRAVASSOS DA ROSA JF, GUERREIRO SC, et al. Primeiro registro de epidemias causadas pelo virus oropuche nos estados do Maranhao e Goiás, Brasil. Rev Inst Med trop Sao Paulo 1989; 31(4): 271-278.
17. AZEVEDO RS, NUNES MR, CHIANG JO, et al. Reemergence of Oropuche fever, Northern Brazil. Emerg Infect Dis. 2007; 13(6): 912-915.
18. PINHEIRO FP, TRAVASSOS DA ROSA AP, TRAVASSOS DA ROSA JF, et al. Oropouche virus: I. A review of clinical, epidemiological, and ecological findings. Am J Trop Med Hyg. 1981; 30(1): 149-160.
19. PINHEIRO FP, TRAVASSOS DA ROSA AP, TRAVASSOS DA ROSA JF, BENSABATH G. An outbreak of Oropuche virus disease in the vicinity of Santarem, Para, Brazil. Tropenmed Parasitol. 1976; 27(2): 213-223.
20. MOURÁO MPG, BASTOS MS, GIMAQUE JB, et al. Oropuche fever outbreak, Manaus, Brazil, 2007– 2008. Emerg Infect Dis. 2009; 15(12): 2063-2064.
21. FORSHEY BM, GUEVARA C, LAGUNA-TORRES VA, et al.
Arboviral etiologies of acute febrile illnesses in western South America, 2000-2007. PLoS Negl Trop Dis. 2010; 4(8): e787.22. AZEVEDO RS, NUNES MR, CHIANG JO, et al. Reemergence of Oropuche fever, Northern Brazil. Emerg Infect Dis. 2007; 13(6): 912-915.
23. MANOCK SR, JACOBSEN KH, DE BRAVO NB, et al. Etiology of acute undifferentiated febrile illness in the Amazon basin of Ecuador. Am J Trop Med Hyg. 2009; 81(1):146-151.
24. SAEED MF, WANG H, NUNES MRT, et al. Nucleotide sequences and phylogeny of the nuclecapsid gene of Oropuche virus. J Gen Virol. 2000; 81: 743-748.
25. NUNES MR, MARTINS LC, RODRIGUES SG, et al. Oropuche virus isolation, southeast Brazil. Emerg Infect Dis. 2005; 11(10): 1610-1613.
26. 26. TESH RB . The emerging epidemiology of Venezuelan hemorrhagic fever and Oropouche fever in tropical South America. Ann N Y Acad Sci. 1994; 740:129-137.
27. PINHEIRO FE, PINHEIRO M, BENSABATH G, et al. Epidemia de virus Oropuche em Belém. Rev Serv Esp Saude Publica. 1962; 12: 15-23.
28. ALVAREZ-FALCONÍ PP. Acido domoico e intoxicación amnésica por moluscos en salud pública. Rev Peru Med Exp Salud Publica. 2009; 26(4): 505-516.
29. ALVAREZ-FALCONI PP, JURADO TB, CALIXTO CM, et al. Prebiótico Inulina/Oligofructosa en la Raíz del Yacón (Smallanthus sonchifolius), Fitoquímica y Estandarización como Base de Estudios Preclínicos y Clínicos. Rev Gastroenterol Peru. 2008; 28: 22-27
30. IZURIETA RO, MACALUSO M, WATTS DM, et al.
Anamnestic immune response to dengue and decreased severity of yellow fever. J Glob Infect Dis. 2009; 1(2): 111-116.31. VASCONCELOS PFC, TRAVASSOS DA ROSA APA, DÉGALLIER N, et al.
Clinical and ecoepidemiological situation of human arboviruses in Brazilian Amazonia. Ciencia e Cultura. 1992; 44(2/3): 117-124.32. VASCONCELOS HB, AZEVEDO RS, CASSEB SM, et al.
Oropuche fever epidemic in Northern Brazil: epidemiology and molecular characterization of isolates. J Clin Virol. 2009; 44(2): 129-33.33. DIXON KE, TRAVASSOS DA ROSA AP, TRAVASSOS DA ROSA JF, LLEWELLYN CH.
Oropuche virus. II. Epidemiological observations during an epidemia in Santarém, Pará, Brazil in 1975. Am J Trop Hyg. 1981; 30(1): 161-4.34. TERZIAN AC, BRONZONI RVM, DRUMOND BD, et al. Sporadic Oropuche virus infection, Acre, Brazil. Emerg Infect Dis. 2009; 15(9): 348-350.
35. ALVAREZ-FALCONI PP. Decisiones en reacciones adversas a medicamentos, intoxicaciones y respuestas inesperadas de productos naturales como problema de salud pública. Rev Peru Med Exp Salud Publica. 2007; 24(4): 405-426.
36. ALVAREZ-FALCONI, PP. Política de medicamentos del país: la perspectiva desde una teoría básica de los fines. Rev Peru Med Exp Salud Publica. 2009; 26(4): 422-425.
Correspondencia:
Dr. Pedro P. Alvarez-Falconí
Dirección: Instituto Nacional de Salud.
Jr. Cápac Yupanqui 1400, Jesús María. Lima. Perú.
e-mail: catecol@hotmail.com













