Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.30 no.4 Lima Sept./Dec. 2010
CONTRIBUCIÓN ESPECIAL
Cápsula endoscópica del intestino delgado
Small bowel capsule endoscopy
Hugo Cedrón-Cheng*
* Miembro Titular de la Sociedad de Gastroenterología del Perú. Unidad de Cápsula Endoscópica de la Clínica Angloamericana.
RESUMEN
La Cápsula Endoscópica permite la evaluación del tracto digestivo sin la incomodidad, necesidad de sedación y los riesgos propios de la endoscopía tradicional. Esta revisión presenta una actualización en cápsula endoscópica del intestino delgado desde su aparición en 2001. Revisaremos las características tecnológicas de los diversos sistemas de cápsula endoscópica de intestino delgado disponibles, las indicaciones clínicas, complicaciones posibles y situación especiales del estudio.
PALABRAS CLAVE: Cápsula endoscópica, intestino delgado.
SUMMARY
Capsule endoscopy enables inspection of the gastrointestinal tract without discomfort or need for sedation and thus obviates the risks associated with traditional endoscopy. This review presents an update on small bowel capsule endoscopy since its introduction in 2001. We will review salient features of the small-bowel capsule endoscopy devices, clinical indications, possible complications and special situations during the study.
KEY WORDS: Capsule endoscopy, small bowel.
BREVE RESEÑA HISTÓRICA
El intestino delgado ha sido un territorio inaccesible para la endoscopía durante muchos años. La enteroscopía por pulsión permite evaluar solamente hasta yeyuno proximal, la radiografía de intestino delgado tiene poca especificidad y una baja a nula capacidad en la detección de lesiones mucosas planas; y finalmente la enteroscopía intraoperatoria, considerada por mucho tiempo como el gold standard en la evaluación del intestino delgado, es un procedimiento altamente invasivo con elevada morbimortalidad asociada.
En el año 1966, el soñar que una pequeña nave podría entrar al cuerpo y tratar enfermedades era una utopía, incluso era el tema central de novelas de ciencia ficción como "El Viaje Fantástico" de Isaac Asimov. A partir de 1981, se iniciaron los trabajos experimentales de los grupos del Dr. Paul Swain y el Ing. Gabriel Iddan con una idea revolucionaria, introducir una diminuta cámara al interior del aparato digestivo que por transmisión inalámbrica pudiera darnos imágenes de territorios tradicionalmente inaccesibles. En octubre de 1999, el Dr. Paul Swain ingirió dos prototipos de cápsula endoscópica de 11 x 33mm, logrando obtener imágenes del interior de su tracto digestivo por espacio de 2 y 6 horas. En el año 2000, apareció una editorial en la revista Nature con respecto a estos estudios experimentales en cápsula endoscópica titulada: "La molestía de la endoscopía puede ser pronto cosa del pasado".(1) La cápsula endoscópica (CE) logró la aprobación de la Food and Drug Administration (FDA) en el año 2001. En ese mismo año, el Dr. Swain publicó una carta al editor en New England Journal of Medicine de cuatro casos de hemorragia digestiva oculta diagnosticados por CE, y el año siguiente, investigadores de New York y Londres presentaron la primera serie de casos.(2,3)
La CE ha revolucionado la evaluación del intestino delgado, por ser mínimamente invasiva, fácil de realizar y capaz de evaluar directamente toda la superficie del intestino delgado, con una muy baja tasa de complicaciones. Sin embargo, el estudio de CE no es perfecto, periódicamente aparecen modificaciones de la cápsula y el software original con el objetivo de mejorar el tiempo de grabación, la superfi cie evaluada, la localización de las lesiones detectadas, obtener las imágenes en tiempo real, y mejorar la resolución de imagen. La última frontera en el desarrollo de la CE orienta a mejorar su funcionalidad, tener la capacidad de controlar su movimiento en el interior del cuerpo, tener la capacidad de tomar biopsias, de permitir intervencionismo – detener sangrados o liberar medicamentos – y con ello finalmente reemplazar a la endoscopía flexible.(4-6)
TECNOLOGÍA ALREDEDOR DE LA CÁPSULA ENDOSCÓPICA
La cápsula endoscópica (CE) permite una endoscopía fisiológica, permite evaluar la mucosa del intestino en su estado basal, sin los artefactos que produce la insuflación de aire o el trauma que produce el paso del endoscopio. La CE no genera incomodidad en su paso, no necesita sedación, no limita la actividad física del paciente, no requiere hospitalización e incluso se puede usar en pacientes sin necesidad de suspender anticoagulación.(2,7,8)
Actualmente, ningún sistema de cápsula endoscópica es perfecto, por ello la tecnología cambia frecuentemente. Desde la aparición de la primera CE, la cápsula M2A® (Mouth-to-Anus) de Given Imaging, en el año 2001, se han desarrollado nuevas tecnologías en el procesamiento de datos y software, mejoras en las características estructurales de la cápsula endoscópica y en las características de los receptores de imágenes. (4,9) En la tabla Nro. 1, se pueden apreciar las características físicas de los sistemas de CE disponibles en el mundo, en el Perú tenemos disponibles los dos primeros.
El peso y tamaño de la CE permite una ingesta sencilla y disminuyen el riesgo de atragantamiento. Actualmente, la CE más pequeña del mercado es la Mirocam®, cuya tecnología de trasmisión de señal denominada Human Body Communication (HBC), que a diferencia de los sistemas de CE basados en radiofrecuencia, utiliza el cuerpo para la transmisión de señal, permite disminuir el peso y el tamaño de la cápsula.(10)
La CE durante su recorrido por el intestino delgado no viaja necesariamente en sentido axial, por momentos lo recorre adherida a una de las superficies mucosas, ello genera puntos ciegos durante el estudio.(11) Entre las estrategias diseñadas para compensar este defecto tenemos: 1. Aumentar el ángulo de visión de una CE, para evaluar una mayor superficie mucosa. 2. Incrementar la velocidad de adquisición de imágenes, porque la velocidad tránsito del intestino delgado no es uniforme, y por ende durante un tránsito rápido se pueden perder lesiones, si la captura de imagen no es lo suficientemente rápida, en especial en puntos ciegos. 3. La CE experimental Sayaka® (RF System, Japón) tiene su lente en la parte central de la cápsula y gira alrededor de su eje, de esta manera intenta evitar la pérdida de imágenes generando reconstrucciones espaciales al procesar los datos, además no tiene batería dentro de la misma cápsula, generando energía para su funcionamiento por inducción.(5,12)
La primera cápsula del mundo fue la M2A®, distribuida por Given Imaging, la cual capturaba una imagen cada 0.5s, en total 55000 imágenes. Actualmente, la PillCam® SB2 (Given), la endocapsule® (Olympus) y la OMOM® (Jianshan Science) capturan 2 fotos por segundo por una rango de 7 a 8 horas y transmiten su señal al receptor por un sistema de radiofrecuencia.(4,13) La cápsula MiroCam® (Intromedic) captura 3 fotos por segundo y utiliza el HBC, ahorrando la energía y obteniendo mayores tiempos de transmisión de imágenes (11 a 12 horas de duración).(4,5,10)
Endocapsule® desarrollado por Olympus utiliza como procesador de imágenes la misma tecnología de sus endoscopios, el "charged coupled device" (CCD), todas las otras cápsulas utilizan un "complementary metal oxide semiconductor" (CMOS).(5) Endocapsule® tiene un tiempo de grabación un poco mayor a PillCam® (591 min vs 471 min), sin embargo ambos dispositivos son seguros y comparables en su tasa diagnóstica. (14)
Un problema importante en CE son los denominados estudios incompletos, porque impiden visualizar toda la superficie del intestino delgado. Se define estudio incompleto a todo aquel estudio donde no es posible durante el tiempo de grabación visualizar la primera imagen cecal, lo cual necesariamente no implica retención de la CE, sino que en la mayoría de los casos la energía de la batería es insufi ciente para permitir la captura de imágenes durante el tránsito de todo el intestino delgado. Entre los factores asociados a un estudio incompleto tenemos: tiempo prolongado de tránsito gástrico, gastroparesia, diabetes mellitus, pobre preparación intestinal, hipotiroidismo, pacientes con cirugía intestinal previa, pacientes hospitalizados y en especial los postrados en cama y en cuidados intensivos. (15-17). Varias estrategias se han planteado para solucionar este problema como detallaremos a continuación.
Con los sistemas de radiofrecuencia se obtienen grabaciones entre 7 a 8 horas, en ellos los estudios incompletos ocurren entre un 17 a 45% de casos dependiendo del estudio revisado.(17-21) La CE Mirocam® permite obtener grabaciones de 11 a 12 horas; en el artículo de Kim y col, los pacientes ingieren primero una CE MiroCam® y luego una CE PillCam®, la tasa de estudios completos fue de 83.3% para MiroCam®, y de 58.3% para la PillCam® (p=0.031) (22). El estudio multicéntrico francés de Pioche y col, comparando MiroCam® and PillCam SB2® determinó que ambas cápsulas tiene una alta calidad de imagen y una excelente concordancia en el diagnóstico, sin embargo se encontraron mayor número de lesiones con MiroCam® fundamentalmente angiodisplasias, y se concluye que el mayor número de imágenes obtenidas y el mayor tiempo de grabación podrían ser las causas de esta discrepancia.(23) En nuestra experiencia presentada en el Congreso Mundial de Cápsula Endoscópica de Paris 2010, de 56 estudios realizados con CE MiroCam®, sólo el 5.7% tuvieron un estudio incompleto, todos asociados a estenosis severas, además cuatro pacientes tenían por lo menos un estudio incompleto previo con una CE basada en radiofrecuencia, y al repetir el estudio, todos completaron el estudio, determinando lesiones significativas en tres de ellos.(24)
Otra posible solución tecnológica, es el lector en tiempo real para la CE, debido a que el tiempo de tránsito gástrico es un factor importante que genera estudio incompletos, al visualizar el recorrido de la CE, y ver que no pasa el estómago en una a dos horas se puede plantear la asistencia endoscópica para pasar al intestino delgado evitando el consumo innecesario de la energía de la batería.(25) Actualmente, todos los sistema de CE mencionados poseen un lector en tiempo real, que puede ser inalámbrico o no dependiendo del modelo. Sin embargo, no todos los lugares donde se hace CE a nivel mundial necesariamente poseen lectores en tiempo real dado que incrementa marcadamente los costos. En Perú, no tenemos a la fecha lectores de tiempo real disponibles.
Un tercio de los pacientes que tuvieron estudios incompletos en el estudio de Rondonotti y col. fueron causados por retardo en el vaciamiento gástrico de la CE.(20) La cápsula OMOM® tiene un sistema para regular el número de imágenes capturadas por segundo durante la grabación, se puede regular a 0.5, 1 y 2 fotos/s con lo cual la batería durará 17, 12 y 8 horas respectivamente; por ende utilizando el visor en tiempo real, se puede reducir la captura de imágenes en estómago, y con ello incrementar la tasa de estudios completos.(26) Otra opción, para evitar el retardo de vaciamiento gástrico de una CE es utilizar asistencia endoscópica para la colocación transpilórica.
Las imágenes transmitidas desde la CE se recuperan en un receptor que se conecta por electrodos al cuerpo del paciente durante el tiempo de grabación, y luego se procede a pasar el archivo a la computadora para su revisión clínica sistemática. El receptor y la plataforma (software) de procesamiento de datos también han variado en el tiempo, para obtener un manejo más eficiente: revisión, análisis y generación del reporte de mayor resolución y facilidad de lectura. El ejemplo más claro lo tenemos con el software Rapid Reader de Given Imaging para PillCam®, Rapid Reader 3 podía procesar visiones de una, dos y cuatro imágenes para revisión a una velocidad de 5 a 40 fotos por segundo regulables por el operador e introducía como novedad el detector de sospecha de sangrado para identificar los píxeles rojos lo cual generó diferencia con las versiones anteriores.(27) Rapid Reader 4 agregó un atlas de imágenes de referencia y ayudas para una lectura más rápida para ayudar al operador. La última versión es la Rapid Reader 6, la cual permite modos de lectura de imágenes múltiples (1, 2, 4 o 24 imágenes simultáneas dependiendo de la experiencia del lector), permite estimar el tamaño de las lesiones, permite utilizar fi ltros de color para simular una cromoendoscopía, y además posee sistema FICE (Fuji Intelligent Chromo Endoscopy).
INDICACIONES PARA EL ESTUDIO DE CÁPSULA ENDOSCÓPICA
Las indicaciones de cápsula endoscópica para el intestino delgado se han expandido desde el inicio del estudio; en la última "Conferencia Mundial de Cápsula Endoscópica y Enteroscopía a Doble Balón" en agosto 2010 en París se confirmaron las siguientes indicaciones formales: (7-8, 28-30)
Sangrado digestivo oscuro (SDO), que incluye el sangrado oscuro manifi esto, el sangrado oscuro oculto y la anemia ferropénica.
Es la indicación más frecuente para solicitar el estudio y donde la CE ofrece su mayor rendimiento diagnóstico.
Tradicionalmente, previo a identificar el punto de sangrado los pacientes que tienen un sangrado digestivo oscuro se someten a múltiples estudios endoscópicos repetidos no contributorios, transfusiones y hospitalizaciones. Se estima que el tiempo promedio para lograr un diagnóstico definitivo en un paciente con sangrado oculto es de 2 años, con un rango variable entre 1 mes y 8 años.(31) Actualmente, las sociedades norteamericanas y europeas sugieren que "el estudio de cápsula endoscópica debe ser el primer estudio a realizarse en un paciente con sangrado digestivo oscuro luego de una endoscopía digestiva alta y baja negativa".(7-8, 30-33) La tasa diagnóstica de la CE para identificar el origen en un sangrado oculto varía entre 55 a 81%.(34-37) En varios estudios está demostrado que el tiempo entre la aparición del sangrado y el momento del examen de CE influye en la posibilidad de diagnosticar el punto de sangrado. Mientras más cercano es el estudio de CE al episodio de sangrado, mayor es el rendimiento diagnóstico.(30, 38) En el estudio de Pennazio y col, en 100 pacientes consecutivos con SDO, la CE fue positiva en 92.3% de pacientes con sangrado digestivo oscuro manifiesto, pero sólo 12.9% y 44.2% en pacientes con antecedente de sangrado digestivo oscuro manifiesto y en pacientes con sangrado digestivo oculto, respectivamente.(39)
Una CE negativa en pacientes con SDO predice una baja tasa de resangrado a largo plazo.(40) La tasa de re-sangrado en pacientes con SDO y CE negativa es 4.6% comparado con 48% en pacientes con hallazgos positivos en la CE.(41)
En un estudio retrospectivo de la Clínica Mayo se demostró que la tasa diagnóstica de la CE fue de 60% en caso de SDO manifiesto comparado con 46% en caso de SDO oculto. Con el resultado de la CE hubo una disminución en el tiempo de hospitalización, investigaciones adicionales y número de transfusiones.(42)
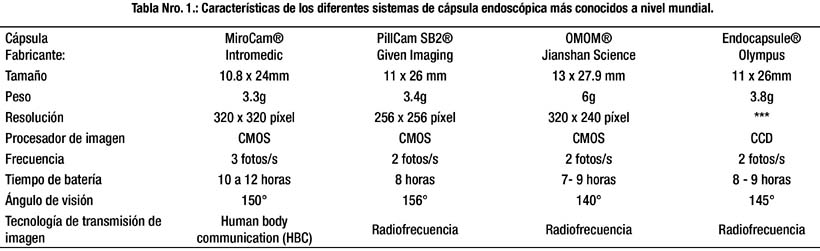
Es importante considerar que el impacto final de un estudio de CE va a depender de la eficacia en el manejo de las lesiones diagnosticadas. Las angiodisplasias son la causa más frecuente de SDO, entre 70 a 80% de los casos.(43) (Foto Nro.1) Sin embargo, la historia natural de las angiodisplasias de intestino delgado no es clara, y menos de un 50% presentan resangrado constante que requiere intervención directa. La CE ha demostrado ser superior en la detección de lesiones comparado con la enteroscopía por pulsión, tomografía, angiotomografía y angiografía convencional.(44-46) Cuando la CE se compara con la enteroscopía intraoperatoria, la sensibilidad, especificidad, valor predictivo positivo y negativo es 95%, 75%, 95% y 86% respectivamente.(47) Actualmente, la enteroscopía a doble balón tiene una tasa diagnóstica comparable a la CE. En el estudio multicéntrico de Kamalaporn y col, la concordancia enteroscopía CE fue 74% para angiodisplasias, 96% para úlceras, 94% para pólipos y 96% para tumores.(48) Actualmente se les consideran estudios complementarios. La CE sugiere la mejor ruta de abordaje para la enteroscopía (oral o rectal).(49, 50)
En conclusión, la CE es un estudio altamente efectivo en casos de SDO, y su uso temprano es lo más recomendable. La CE disminuye el tiempo de diagnóstico, predice la posibilidad de un nuevo sangrado, ayuda a establecer un tratamiento definitivo y disminuye el número de estudios diagnósticos alternativos.
Enfermedad inflamatoria intestinal – Enfermedad de Crohn del ID no estenosante.
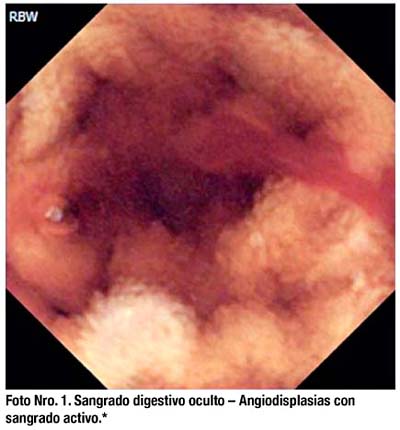
La CE puede identificar lesiones ulceradas a nivel del ID mejor que otros. (Foto Nro 2) La CE permite establecer el diagnóstico de Enfermedad de Crohn en pacientes sospechosos o con colitis indeterminada, mejor que los marcadores serológicos, además permite valorar la extensión y severidad del cuadro, estimar el pronóstico, valorar la actividad de enfermedad y valorar la curación mucosa posterior a tratamiento.(51). Los hallazgos por CE permiten plantear cambios en el tratamiento (uso de inmunomoduladores y biológicos). El metanálisis de Triester y col. donde se incluyen 11 estudios con 223 pacientes, concluyó que existe un incremento en la tasa diagnóstica de Crohn entre 25 a 40% a favor de la CE sobre los estudios de bario, la enteroTAC, la enteroscopía por pulsión, ileoscopía y enteroRMN.(52)
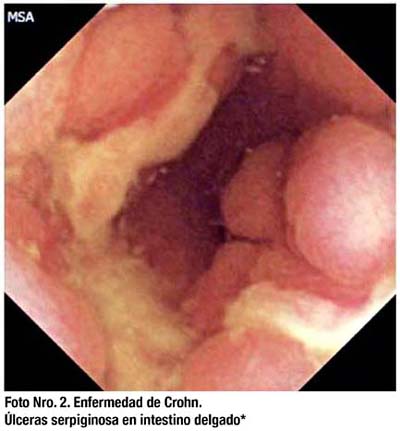
Sin embargo, el riesgo de retención de CE en pacientes con Enfermedad de Crohn es mayor que en la población general, varía entre 5 a 13% y se debe a estenosis severas no identificables por otros métodos.(53) Actualmente, ningún método no invasivo ha demostrado ser lo suficientemente efectivo para excluir completamente la posibilidad de retención de la cápsula endoscópica en el intestino delgado.
Tumores de Intestino Delgado
La frecuencia de tumores de intestino delgado desde la aparición de la CE promedia entre 2.4% a 9.6% de los casos examinados.
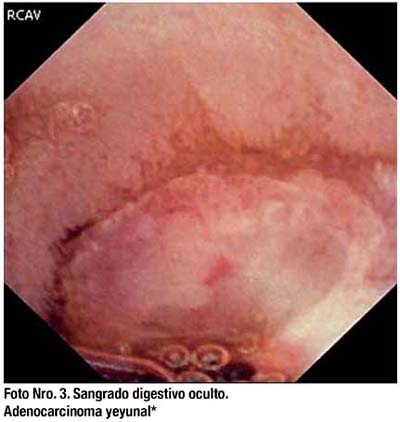
La presentación más común de los tumores de ID es el sangrado digestivo oscuro. La mayoría de los tumores encontrados son adenocarcinomas, carcinoides, linfomas, sarcomas y hamartomas. (Fotos Nro. 3 y 4) La mayoría de tumores se localizan en yeyuno (40 a 60%), íleon (25 a 40%) y con menor frecuencia en duodeno (15 a 20%).
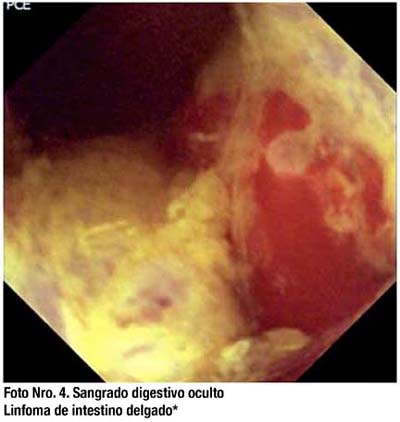
Tradicionalmente el diagnóstico de tumores a nivel de intestino delgado era tardío con las técnicas tradicionales y cada paciente tenía un promedio 3.6 a 5 procedimientos previos negativos. Con el uso de la CE se espera que los tumores se detecten en estadios más tempranos y ello repercuta en un mejor pronóstico, sin embargo aún no tenemos evidencia sufi ciente para llegar a esta conclusión.(30) En el estudio de Bailey y col, 23 de 26 pacientes con diagnóstico de tumor de intestino delgado por CE fueron tributarios de cirugía, el resultado fue considerado curativo sólo en 52%.(58)
Síndromes Polipósicos Hereditarios
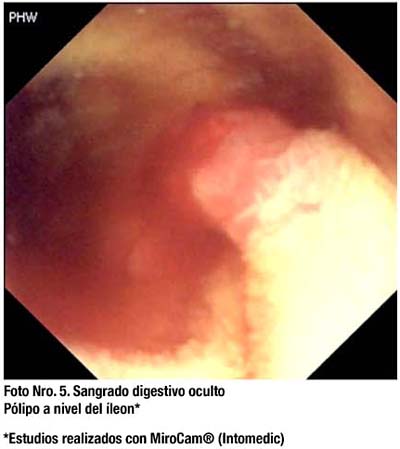
En estudios de casos de pacientes con Poliposis Adenomatosa Familiar (PAF) o Síndrome de Peutz Jeghers, la CE tiene mayor sensibilidad en la detección de pólipos a nivel del ID en comparación con la radiografía baritada.(59) La CE es una buena alternativa para sustituir a la enteroclisis en el seguimiento de pacientes con Peutz Jeghers.(60) (Foto Nro.5)
Enfermedad Celiaca:
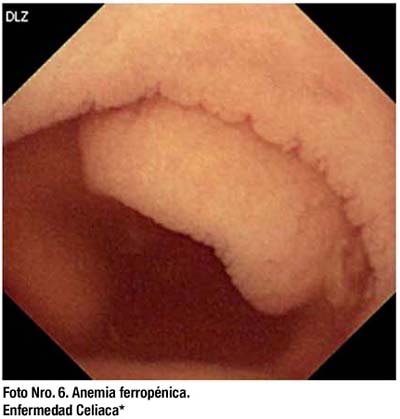
La CE no es por sí sola diagnóstica para enfermedad celiaca, sin embargo puede ser muy útil para evaluar de manera mínimamente invasiva toda la extensión del intestino delgado y encontrar lesiones mucosas asociadas a cambios de las vellosidades intestinales. (Foto Nro.6) Así la CE es útil en dos circunstancias en esta enfermedad:
En sospecha de enfermedad Celiaca. La CE puede identificar cambios en la mucosa de ID típicos de la enfermedad celiaca (patrón en mosaico, pérdida de pliegues y atrofia) similares o superiores a la endoscopía.(54) La sensibilidad, especificidad, valor predictivo positivo y negativo de la CE para la enfermedad celiaca se han reportado en 70%, 100%, 100% y 77% respectivamente comparado a la biopsia.(55) La CE es de utilidad en pacientes con alta sospecha de enfermedad celiaca, serología y clínica compatibles, pero con hallazgos histológicos normales o no concluyentes. En enfermedad Celiaca complicada o refractaria. La CE es útil para valorar lesiones mucosas e identifi car complicaciones de la enfermedad celiaca en pacientes que aún con dieta libre de gluten, continúan sintomáticos. La CE puede detectar adenocarcinomas, yeyunoileitis ulcerativa y linfoma de células T. (56, 57)
Otras posibles indicaciones del estudio de CE reportadas, pero aún no incluidas en los consensos son: descartar el rechazo en pacientes con trasplante de intestino delgado; valorar lesiones asociadas con el uso de analgésicos no esteroideos en intestino delgado, valorar la enteropatía perdedora de proteínas, valorar enteritis por radiación, valorar la presencia de algunos parásitos y de hipertensión portal a nivel de intestino delgado.
LIMITACIONES Y RIESGOS DE LA CÁPSULA ENDOSCÓPICA - SITUACIONES ESPECIALES
El estudio de CE es mínimamente invasivo, sin embargo se pueden presentar algunas complicaciones técnicas y clínicas que deben considerarse.
Complicaciones Técnicas:
Si bien, no son mencionados muy frecuentemente en los estudios, los problemas técnicos asociados a defectos del sistema de la cápsula o el receptor deben ser conocidos por quienes realizan este estudio y los pacientes.
En el estudio de Rondonotti y col(20) los problemas técnicos se presentaron en 8.59% de los estudios de CE, de la siguiente manera:
-
- Errores en la transmisión de señal (4.09%) generan intervalos blancos que impiden visualizar algunas zonas.
-
- Menor duración de las baterías de CE (menor de 6horas) (2.34%).
-
- Falla en la activación de la CE al retirarla de su estuche. (1.09%)
-
- Imposibilidad de realizar la descarga del estudio de CE del receptor a la computadora. (0.68%)
Complicaciones Clínicas:
-
Estudios incompletos – definidos como la falta de visualización del ciego durante el tiempo de grabación. En la retención gástrica, la CE no pasa el píloro durante el tiempo de grabación. El tránsito gástrico prolongado es un factor importante en la génesis de estudios incompletos como mencionamos anteriormente. Con los sistemas de radiofrecuencia con grabaciones entre 7 a 8 horas, los estudios incompletos ocurren entre un 17 a 45% de casos según el estudio revisado (16-20).
-
Retención de Cápsula Endoscópica. Implica la imposibilidad de eliminar la CE espontáneamente después de dos semanas de la ingesta, y que finalmente obliga a tomar una acción médica, endoscópica o quirúrgica para el retiro de la cápsula del intestino.(61) La retención no implica obstrucción intestinal. Ocurre en promedio en 0.7% de los todos los estudios de CE. La frecuencia varía según el diagnóstico motivo del examen. En pacientes sanos, la retención es 0%; En Sangrado Oscuro, la retención es 1.5%; En sospecha de enfermedad de Crohn, la retención es 1.4%; en paciente con Enfermedad de Crohn diagnosticada la retención es entre 5 a 13% y en pacientes con sospecha de obstrucción intestinal, la retención es 21%. Los estudios radiológicos con presencia o ausencia de estenosis no protegen al paciente para el desarrollo de una futura retención de CE. La cápsula Agile se utiliza en pacientes con sospecha o estrecheces diagnósticas para minimizar el riesgo de retención previo al estudio formal de CE.(62) En Perú, la cápsula Agile no está disponible. Actualmente, no existe un método completamente aceptado como predictor para evitar una retención de cápsula endoscópica, es claro que obtener una buena historia clínica es importante: la presencia de dolor abdominal, distensión o nauseas y vómitos deben sospechar retención potencial.
-
Misceláneas: La CE puede impactarse accidentalmente en el músculo cricofaríngeo o en un divertículo del tracto digestivo, puede ocurrir aspiración bronquial de la CE. Existe un reporte caso de una CE que se fraccionó durante su trayecto, y otro que generó obstrucción intestinal aguda y perforación intestinal.(8)
Situaciones Especiales:
-
Los pacientes con problemas de deglución requieren colocación endoscópica de la CE para evitar la impactación en el cricofaringeo o la aspiración. La colocación asistida de la CE en endoscopía puede realizarse con ayuda de un asa de polipectomía, una net de Roth o por medio de un dispositivo AdvanCE® (US Endoscopy).(8)
-
En población pediátrica, la CE tiene las mismas indicaciones que los adultos. Sin embargo en niños, una diferencia principal es la dificultad en la deglución espontánea de la CE, lo cual obliga a la colocación endoscópica bajo anestesia general en muchos casos. (63, 64) Actualmente, la FDA sólo aprueba el uso de la CE en niños mayores de 10 años, sin embargo cada día aparecen mayores reportes de casos en niños menores de 10 años que demuestra la seguridad de su uso y valor diagnóstico. (65) El temor que la CE quede retenida en niños sólo por las dimensiones del ID, sin tener ninguna evidencia de patología, no ha podido ser demostrado con estudios formales.
-
La FDA establece como contraindicación formal el uso de la CE en pacientes portadores de marcapasos o cardiodesfibriladores implantables. Actualmente son múltiples los estudios que han demostrado la seguridad de realizar CE en pacientes portadores de marcapasos(66, 67) o cardiodesfi briladores implantables(68, 69) sin presentarse interferencia, sin embargo debe individualizarse cada caso y conversarlo con el paciente. Existe un reporte de caso donde la calidad de las imágenes obtenidas por la CE, se vio alterada por la presencia de generador de marcapaso abdominal.(8)
-
El embarazo es una contraindicación para el estudio de CE por las ondas emitidas, sin embargo en situaciones extremas existen reportes de casos que demuestran su seguridad en el primer trimestre.(70)
-
Los pacientes no deben someterse a estudios de resonancia magnética hasta que la CE haya sido eliminada.
CONCLUSIÓN
La evaluación del intestino delgado está en pleno desarrollo, la tecnología es incipiente y si bien ha habido muchos cambios y mejoras desde su aparición, la cápsula endoscópica y la enteroscopía asistida por balón requieren a mediano plazo muchas mejoras más. Debemos entender que los sistemas de cápsula endoscópica no son iguales entre sí, tienen generaciones y actualizaciones. Conocer las bondades y limitaciones de cada sistema, nos permite poder interpretar un resultado y obtener mejores resultados. La cápsula endoscópica de intestino delgado tiene un rol importante en el estudio del sangrado digestivo oscuro, enfermedad de Crohn, tumores y pólipos de intestino delgado, y enfermedad celiaca. La alta tolerabilidad, alto rendimiento diagnóstico y bajo número de complicaciones lo hace ideal para estar en primera línea en el estudio del intestino delgado. En un futuro cercano esperamos la cápsula endoscópica con funcionalidad, donde podamos dirigir su movimiento, recolectar muestras y liberar medicamentos.
BIBLIOGRAFÍA
1. IDDAN G, MERON G., GLUKHOVSKY et al. Wireless capsule endoscopy. Nature 2000: 405: 417.
2. APPLEYARD M., GLUKHOVSKY D., SWAIN P. Wireless-capsule diagnostic endoscopy for recurrent small bowel bleeding. N Engl J Med 2001: 344: 232-233.
3. FLEISCHER D. Motion in the direction of making the video capsule our primary endoscope. Gastrointest Endoscopy 2010: 72(2): 388-91.
4. MOGLIA A, MENCIASSI A, DARIO P Y CUSCHIERI A. Capsule endoscopy: progress update and challenges ahead.
Nat Rev Gastroenterol Hepatol 2009: 6: 353-62.5. SHARMA VIRENDER. The future is wireless: Advances in Wireless Diagnostic and Therapeutic Technologies in Gastroenterology. Gastroenterology 2009: 137(2): 434-465.
6. TWOMEY K., MARCHESI J. SWALLOWABLE capsule technology: current perspectives and future directions. Endoscopy 2009: 41: 357-362.
7. MERGENER K, PONCHON T, GRALNEK I, et al. Literature review and recommendations for clinical application of small-bowel capsule endoscopy, based on a panel discussion by international experts. Consensus statements for small-bowel capsule endoscopy, 2006/2007. Endoscopy 2007: 39(10): 895-909.
8. ASGE Technology Status Evaluation Report: Wireless capsule endoscopy. Gastrointest Endosc 2006: 63 (4): 539-545.
9. WANG T. A novel capsule endoscope: do we need new kids on the block?. Gastrointest Endosc 2009: 69 (2): 260-1.
10. BANG S, PARK J., JEONG S., et al. First clinical trial of the "MiRo" capsule endoscope by using a novel transmission technology: electric fi eld propagation. Gastrointest Endosc 2009: 69: 253-259.
11. CAVE D., FLEISCHER D., LEIGHTON J. et al. A multicenter randomized comparison of the Endocapsule and PillCam SB. Gastrointest Endosc 2008: 68: 487-94.
12. RF SYSTEM LAB. SAYAKA. Datos obtenidos de: http://www.rfamerica.com/sayaka/index.html.
13. GHEORGHE C, IACOB R, Bancila I. Olympus capsule endoscopy for small bowel examination. J Gastrointestin Liver Dis 2007: 16: 309-313.
14. HARTMANN D, EICKHOFF A, DAMIAN U, RIEMANN JF. Diagnosis of small bowel pathology using paired capsule endoscopy with two different devices: a randomized study. Endoscopy 2007: 39: 1041-5.
15. PONFERRADA A, GONZALEZ-ASANZA C, MENCHEN L. Predictive factors of incomplete capsule endoscopy examination. Gastrointest Endosc 2005: 61 (5): AB178.
16. CAREY E, LEIGHTON J, HEIGH et al. A single-center experience of 260 consecutive patients undergoing capsule endoscopy for obscure gastrointestinal bleeding. Am J Gastroenterol 2007: 102: 89-95.
17. SHAMSA, M. WONG R, FANG J et al. Risk factors for incomplete or unsatisfactory capsule endoscopy. Gastrointest Endosc 2006: 63(5): AB193.
18. DE FRANCHIS R, AVGERINOS A, BARKIN J et al. ICCE consensus for bowel preparation and prokinetics. Endoscopy 2005: 37: 1040-1045.
19. PENNAZIO M, EISEN G, GOLDFARB N. ICCE consensus for obscure gastrointestinal bleeding. Endoscopy 2005: 37: 1046-50.
20. RASTOGI A, SCHOEN R, SLIVKA A. diagnostic yield and clinical outcomes of capsule endoscopy. Gastrointest Endosc 2004: 60: 959-64.
21. RONDONOTTI E, HERRERIAS J, PENNAZIO M. et al. Complications, limitations and failures of capsule endoscopy: a review of 733 cases. Gastrointest Endosc 2005: 62: 712-6.
22. KIM, H, KIM Y, KIM H et al.
A pilot study of sequential capsule endoscopy using MiroCam and PillCam SB Devices with different transmission technologies. Gut and Liver 2010: 4(2): 192-200.23. PIOCHE M, FILOCHE B, JACOB P, et al.
Randomized Prospective Comparison of the Diagnostic Yield of PillCam SB2® and MiroCam® videocapsules in patients with obscure digestive bleeding. Gastrointest Endosc 2010: 71(5): AB123.24. CEDRÓN H, PISCOYA A, Cayetano Heredia Group.
Longer battery duration and longer duration recording capsule endoscopy time decrease rate of incomplete capsule endoscopy examination. An experience from Perú. 1st. International Conference on Capsule Endoscopy and Double Ballon Enteroscopy (2728th August 2010) Abstract Book, page 56. Poster presentation 11.25. LAI LH, WONG GL, LAU JY et al. Initial experience of real-time capsule endoscopy in monitoring progress of the videocapsule through the upper GI tract. Gastrointest Endosc 2007: 66: 1211-4.
26. LIAO Z., LI Z., XU C. Reduction in capture rate in the stomach increases the complete examination rate of capsule endoscopy: a prospective randomized controlled trial. Gastrointest Endosc 2009: 69: 418-25.
27. D´HALLUIN PN, DELVAUX M, LAPALUS MG et al. Does the "suspected blood indicator" improve the detection of bleeding lesions by capsule endoscopy? Gastrointest Endosc 2005: 61: 243-9.
28. RAJU GS, GERSON L, DAS A et al. American Gastroenterological Association Institute Medical Position Statement on Obscure Gastrointestinal Bleeding. Gastroenterology 2007: 133(5): 1694-6
29. REY J., LADAS S., ALHASSANI A., KUTNETSOV K., and the ESGE Guidelines Committee. European Society of Gastrointestinal Endoscopy. Video capsule endoscopy: Update to guidelines (May 2006). Endoscopy 2006: 38 (10): 1047-53.
30. LADAS S, TRIANFAGYLLOU K, SPADA C, et al.
European Society of Gastrointestinal Endoscopy (ESGE): Recommendations (2009) on clinical use of video capsule endoscopy to investigate small-bowel, esophageal and colonic disease. Endoscopy 2010: 42: 220-7.31. LEWIS B, GOLDFARB N. The advent of capsule endoscopy – a not-so-futuristic approach to obscure gastrointestinal bleeding. Aliment Pharmacol Ther 2003:17:1085-96.
32. PENNAZIO M, EISEN G, GOLDFARB N. ICCE consensus for obscure gastrointestinal bleeding. Endoscopy 2005: 37: 1046-50.
33. RAJU GS, GERSON L, DAS A et al. American Gastroenterological Association Institute Medical position statement on obscure gastrointestinal bleeding. Gastroenterology 2007:133: 1694-6.
34. EII C, REMKE S, MAY A et al. The fi rst prospective controlled trial comparing wireless capsule endoscopy with push enteroscopy in chronic gastrointestinal bleeding. Endoscopy 2002: 34: 685-9.
35. SAURIN JC, DELVAUX M, GAUDIN JL et al. Diagnostic value of endoscopic capsule in patients with obscure digestive bleeding: blinded comparison with video push-enteroscopy. Endoscopy 2003: 35: 576-84.
36. HARTMANN D, SCHMIDT H, BOLZ G et al. A prospective two-center study comparing wireless capsule endoscopy with intraoperative enteroscopy in patients with obscure GI bleeding. Gastrointest Endosc 2005: 61: 826-32.
37. TRIESTER SL, LEIGHTON JA, Leontidadis GI et al. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with obscure gastrointestinal bleeding. Am J Gastroenterol 2005: 100: 2407-18.
38. APOSTOLOPOULOS P, LIATSOS C, GRALNEK IM et al. Evaluation of capsule endoscopy in active, mildto-moderate, overt GI bleeding. Gastrointest Endosc 2007: 66: 1174-81.
39. PENNAZIO M, SANTUCCI R, RONDONOTTI E, et al. Outcome of patients with obscure gastrointestinal bleeding after capsule endoscopy: report of 100 consecutive cases. Gastroenterology 2004: 126: 643-53.
40. MC DONALD J, PORTER V, MCNAMARA D. Negative capsule endoscopy in patients with obscure GI bleeding predicts low rebleeding rates. Gastrointest Endosc 2008: 68: 1122-7.
41. LAI LH, WONG GI, CHOW DK et al. Long term followup of patients with obscure gastrointestinal bleeding after negative capsule endoscopy. Am J Gastroenterol 2006: 101: 1224-8.
42. CAREY E, LEIGHTON J, HEIGH R et al. A single experience of 260 consecutive patients undergoing capsule endoscopy for obscure gastrointestinal bleeding. Am J Gastroenterol 2007: 102: 89-95.
43. FOUTCH PG. Angiodysplasia of the gastrointestinal tract. Am J Gastroenterol 1993: 88: 807-18.
44. TRIESTER S, LEIGHTON J, LEONTIADIS G et al. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with obscure gastrointestinal bleeding. Am J Gastroenterol 2005: 100: 2407-18.
45. DE LEUSSE A, VAHEDI K, EDERY J et al. Capsule endoscopy or push enteroscopy for fi rst-line exploration of obscure gastrointestinal bleeding?. Gastroenterology 2007: 132: 855-62.
46. SAPERAS E, DOT J, VIDELA S et al.
Capsule endoscopy versus computed tomographic or standard angiography for the diagnosis of obscure gastrointestinal bleeding. Am J Gastroenterol 2007: 102: 731-7.47. HARTMANN D, SCHMIDT H, BOLZ G et al. A prospective two-center study comparing wireless capsule endoscopy with intraoperative enteroscopy in patients with obscure GI bleeding. Gastrointest Endosc 2005: 61: 826-32.
48. KAMALAPORN P, CHO S, BASSET N et al. Doubleballoon enteroscopy following capsule endoscopy in the management of obscure gastrointestinal bleeding: outcome of a combined approach. Can J Gastroenterol 2008: 22: 491-5.
49. GAY G, DELVAUX M, FASSIER I. Outcome of capsule endoscopy in determing indication and route for push-and-pull enteroscopy. Endoscopy 2006: 38(1): 49-58.
50. LI X, CHEN H, DAI J. et al.
Predictive role of capsule endoscopy on the insertion route of double-ballon enteroscopy. Endoscopy 2009: 41: 762-6.51. MAUNOURY V, SAVOYE G, BOURREILLE A, et al. Value of wireless capsule endoscopy in patients with indeterminate colitis (infl ammatory bowel disease type unclassifi ed). Inflamm Bowel Dis 2007: 13(2): 152-5.
52. TRIESTER S, LEIGHTON J, LEONTIADIS G et al. A meta-analysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with non-stricturing small bowel Crohn´s disease. Am J Gastroenterol 2006: 101: 954-64.
53. CHEIFETZ AS, KORENBLUTH AA, LEGNANI P et al. The risk of retention of the capsule endoscope in patients with known or suspected Crohn´s disease. Am J Gastroenterol 2006: 101: 2218-22.
54. HOOPER AD, SIDHU R, SANDERS DS et al. Capsule endoscopy: An alternative to duodenal biopsy for the recognition of villous atrophy in celiac disease?. Dig Liver Dis 2007: 139: 140-5.
55. PETRONIENE R, DUBCENCO E, BAKER JP et al. Given capsule endoscopy in celiac disease: evaluation of diagnostic accuracy and interobserver agreement. Am J Gastroenterol 2005: 100: 685-94.
56. CULLIFORD A., DALY J, DIAMONG B et al. The value of wireless capsule endoscopy in patients with complicated celiac disease. Gastrointest Endosc 2005: 62: 55-61.
57. DAUM S, WAHNSCHAFFE U, GLASENAPP R et al. Capsule endoscopy in refractory celiac disease. Endoscopy 2007: 39: 455-8.
58. BAILEY AA, DEBINSKI H, APPLEYARD M et al. Diagnosis and outcome of small bowel tumors found by capsule endoscopy: a three-centre Australian experience. Am J Gastroenterol 2006: 101: 2237-43.
59. MATA A, LLACH J, CASTELLS A et al. A prospective trial comparing wireless capsule endoscopy and barium contrast series for small-bowel surveillance in hereditary GI polyposis syndromes. Gastrointest Endosc 2005: 61: 721-5.
60. SCHULMANN K, HOLLERBACH S, KRAUS K et al. Feasibility and diagnositic utility of video capsule endoscopy for the detection of small bowel polyps in patients with hereditary polyposis syndromes. Am J Gastroenterol 2005: 100: 27-37.
61. CAVE D, LEGNANI P, DE FRANCIS R el al. ICCE Consensus for Capsule Retention. Endoscopy 2005: 37(10): 1065-1067.
62. CAUNEDO-ALVAREZ A, ROMERO-VAZQUEZ J. Herrerias-Gutierrez J. Patency and agile capsules. World J Gastroenterol 2008: 14 (34): 5269-73.
63. UKO V, ATAY O., MAHAJAN L., et al.
Endoscopic deployment of the wireless capsule using a capsule delivery device in pediatric patients: a case series. Endoscopy 2009: 41: 380-2.64. DE ANGELIS GL, FORNAROLLI F, DE ANGELIS N et al.
Wireless capsule endoscopy for pediatric small bowel diseases. Am J Gastroenterol 2007: 102: 1749-1757.65. FRITSCHER-RAVENS A., SHCHERBAKOV P., BUFLER P., et al. Impact on management of small intestinal disorders by wireless capsule endoscopy in young children less than age 8: A European Multicenter Study. GIE: 2008: 67 (5): AB79.
66. BANDORSKI D, IRNICH W., BRÜCK M et al. Capsule endoscopy and cardiac pacemakers: investigation for possible interference. Endoscopy 2008: 40: 36-9.
67. PAYERAS G. PIQUERAS J, MORENO V et al.
Effects of Capsule endoscopy on Cardiac pacemakers. Endoscopy 2005: 37 (12): 1181-1185.68. LEIGHTON JA, SRIVATHSAN K, CAREY EJ et al. Safety of wireless capsule endoscopy in patients with implantable cardiac defi brillators. Am J Gastroenterol 2005: 100: 1728-31.
69. DUBNER S. DUBNER Y, GALLINO S. et al. Electromagnetic interference with implantable cardiac pacemakers by video capsule. Gastrointest Endosc 2005: 61: 250-4.
70. HOGAN RB AHMAD N HOGAN R et al. Video capsule endoscopy detection of jejunal carcinoid in lifethreatening hemorrhage, first trimester pregnancy. Gastrointest Endoscopy 2007: 66: 205-7.













