Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.30 no.4 Lima Sept./Dec. 2010
REPORTE DE CASOS
Hepatitis aguda secundaria a virus de Hepatitis E. Reporte de dos casos provenientes de una población de nivel socio económico alto de Lima
Acute hepatitis secondary to Hepatitis E. Report of two cases from a population of high socioeconomic level Lima
Machicado Rivero Jorge David* ; Bernardo Manrique Roberto Jesús* ; Tagle Arróspide Martín*
* Clínica Angloamericana, Lima, Perú
RESUMEN
Describimos dos casos de hepatitis aguda de pacientes residentes de Lima, Perú, y que pertenecen a un nivel socioeconómico alto. El caso 1, es una paciente mujer de 58 años, con astenia, ictericia, coluria y prurito. El examen físico reveló solo ictericia, y los exámenes de laboratorio transaminasemia (TGO = 1754, TGP= 2680) e hiperbilirrubinemia (Bil. Total= 7.98, Bil. Directa= 7.03). El estudio de serología fue positivo para IgM e IgG para virus de Hepatitis E. Los síntomas remitieron a las 3 semanas. El caso 2, es una paciente mujer de 64 años, con astenia, hiporexia y dolor abdominal, sin ictericia. El examen físico es normal y los exámenes de laboratorio mostraron TGO = 2999, TGP= 4370. La paciente remitió totalmente sus síntomas a las 3 semanas de enfermedad. La prueba de ELISA de IgM para virus de Hepatitis E fue positiva. En ambos casos las serologías para otras hepatitis virales fueron negativas. Hacemos una descripción de estos 2 casos y una revisión de la literatura, por ser ambos los primeros casos de hepatitis E descritos en la bibliografía médica en nuestra ciudad, y por la relevancia que supone este tema en el conocimiento médico actual en casos de hepatitis aguda no A, no B, no C.
PALABRAS CLAVE: hepatitis E, hepatitis aguda, Perú.
ABSTRACT
We describe two cases with acute hepatitis of patients who live at Lima, Peru and have a high socio-economic status. The first case, is a 58 years old female with asthenia, jaundice, coluria and pruritus. The physical exam revealed jaundice and laboratory exams revealed transaminasemia (AST= 1754, ALT= 2680) and hyperbilirubinemia (total bilirrubin= 7.98, direct bilirrubin=7.03). Furthering serologic tests, revealed a positive test for anti-Hepatitis E virus IgM and IgG. All the symptoms were remitted by the 3rd week of disease. The second case described, is a 64 years old female with asthenia, hyporexia and abdominal pain, without jaundice. The physical exam was normal and initial laboratory tests revealed an AST= 2999 and ALT= 4370. All the symptoms were remitted by the 3rd week of disease. The ELISA testing for anti-Hepatitis E virus IgM, was positive. In both cases other viral hepatitis serologic tests were negative. We make a description of these 2 cases and a literature review, because these both, are the first cases of Hepatitis E described in our city, and for the relevance of this virus in current medical knowledge for patients with non A, non B, non C acute hepatitis.
KEY WORDS: Hepatitis E, acute hepatitis, Peru.
INTRODUCCIÓN
a hepatitis E constituye un problema de salud pública, con un comportamiento distinto en países desarrollados y en vías de desarrollo. Los diferentes genotipos que pertenecen a este virus tienen diferentes modos de transmisión, patogenicidad, reservorio y transmisibilidad entre especies. La presentación clínica es similar a los demás virus hepatotropos. La tasa de infección y severidad es mayor en gestantes. Se ha reportado casos de cronicidad en pacientes inmunosuprimidos y con genotipo 3. Aún no existe un test diagnóstico, ni vacuna aprobada para prevención por la FDA
Presentamos a continuación, dos casos de hepatitis aguda por este virus, que constituyen los dos primeros reportados en la literatura médica en nuestra ciudad y hacemos una revisión de la literatura.
REPORTE DE CASOS
CASO 1
Paciente mujer de 58 años, previamente asintomática, con historia de 15 días de astenia, malestar general y náuseas. 1 semana después, se agrega ictericia, coluria y prurito generalizado, motivo por el que acude a consulta. Niega dolor abdominal, niega fiebre, niega baja de peso.
Antecedentes de importancia: Hipertensión arterial y dislipidemia diagnosticadas hace 8 años, en tratamiento con Hidroclorotiazida, Irbesartán y Atorvastatina. No ha tenido cirugías previas. Niega viajes. Niega transfusiones.
Sus signos vitales revelaron PA: 130/80 mmHg, FC: 74x´, FR: 18x´, afebril. Al examen físico, se observa ictericia de piel y mucosas. El abdomen era blando, depresible, no dolor a la palpación, sin visceromegalia. El examen pulmonar y cardiovascular fue normal.
Los exámenes basales de hemograma, glucosa, urea, creatinina, electrolitos y PCR, estuvieron en rangos de normalidad. Las pruebas de función hepática al ingreso y en la evolución se muestran en la tabla 1.
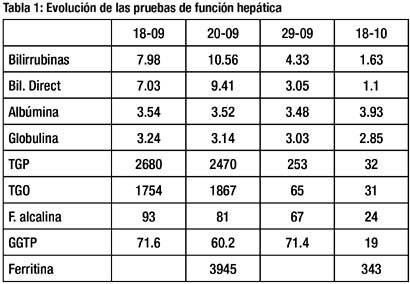
Se realizó un estudio de ultrasonido abdominal, el cual sólo revelaba aumento de la ecogenicidad hepática. Posteriormente la colangiorresonancia fue negativa para lesiones estructurales.
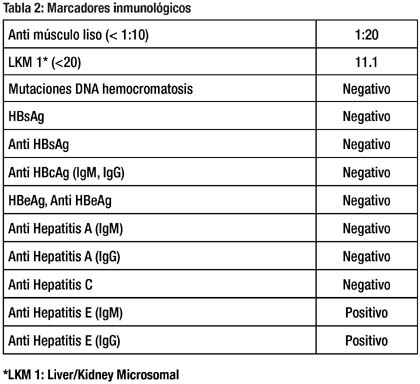
El estudio de la paciente se completó con marcadores inmunológicos, que se muestran en la tabla 2. La IgM e IgG para hepatitis E resultaron ambas positivas. La sintomatología remitió completamente tras 3 semanas de enfermedad.
CASO 2
Paciente mujer de 64 años admitida al hospital por 10 días de astenia e hiporexia, y 5 días de dolor abdominal tipo punzada de intensidad 6/10, a predominio de hipogastrio y flanco izquierdo, con irradiación a región lumbar. El día del ingreso dolor se torna insoportable por lo que es hospitalizada. Asimismo, refiere constipación desde hace 5 días. Niega alteraciones en la orina.
Antecedentes de importancia: Diabetes Mellitus diagnosticada hace 1 año y 5 meses, en tratamiento con Metformina, Sitagliptina y Glimepiride. Dislipidemia en tratamiento con Ezetimibe y Simvastatina. Enfermedad Coronaria en tratamiento con Aspirina. Además, historia de colecistectomía laparoscópica, apendicectomía, hernioplastía umbilical, ooforectomía por quiste de ovario benigno, hemicolectomía izquierda por enfermedad diverticular, y colocación de banda gástrica hace 7 años, con posterior retiro hace 5 años por esofagitis de retención. Presenta un antecedente adicional de hepatitis medicamentosa por halotano hace 10 años. Refi ere consumo de alcohol de manera social, y de tabaco por 30 años, 2 cajetillas al día hasta hace 10 años. Niega viajes recientes.
Sus signos vitales al ingreso revelaron PA: 120/70 mmHg, FC: 70x´, FR: 18x´, afebril. Peso de 92.5 kg. El examen abdominal revelaba un abdomen blando, depresible, ruidos hidroaéreos normales, dolor leve a la palpación profunda en hipogastrio, no encontrándose masas ni visceromegalias. No ictericia, no lesiones dérmicas, examen cardiovascular, pulmonar y ginecológico dentro de rangos de normalidad.
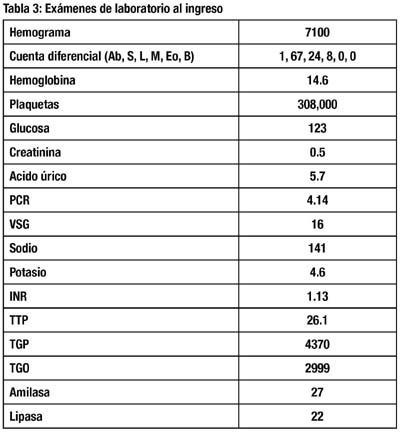
Se realizó una ecografía abdominal que revelaba una hepatomegalia con ecogenicidad aumentada, sin evidenciarse alteraciones de la vía biliar. La TEM y RMN de abdomen revelaron un hígado y vías biliares, sin lesiones focales. La tabla 3, muestra los resultados de laboratorio al ingreso.
Ya hospitalizada, el dolor abdominal persistió siendo refractario a los AINES, y requiriendo narcóticos para su control. Fue dada de alta al 6to día con mejoría parcial.
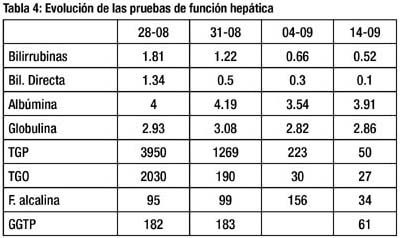
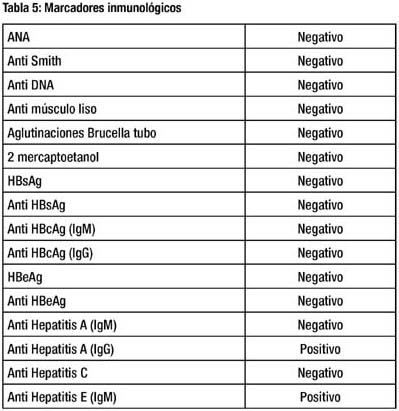
Luego del alta, se recibió el resultado de la serología para IgM contra Hepatitis E, siendo positivo. Sus resultados de prueba de función hepática en el tiempo y marcadores inmunológicos se muestran en las tablas 4 y 5, respectivamente. Las transaminasas retornaron al valor normal tras 3 semanas de enfermedad, y el dolor remitió completamente.
DISCUSIÓN
El virus de la hepatitis E (HEV), es un problema de salud pública en muchos lugares del mundo, inicialmente descrito en 1983 (1). Pertenece al género Hepevirus, y morfológicamente es un virus RNA de cadena simple, de 7.2 kb de tamaño. Su material genético fue clonado por primera vez en 1990, e incluye 3 ORF´s (open reading fragment). El ORF 1 codifica proteínas no estructurales, el ORF 2 codifi ca proteínas de cápside, y el ORF 3 a una fosfoproteína del citoesqueleto.
Hasta el momento se han descrito 4 genotipos del HEV. El genotipo 1 ha sido causante de epidemias y casos esporádicos en Asia y Africa. El genotipo 2 es también causa de epidemias y casos esporádicos en México y Africa (Nigeria, Chad). Ambos genotipos 1 y 2, sólo han sido descritos en humanos. Por otro lado, tanto el genotipo 3 y 4, han sido descritos en animales como cerdos y venados, con posibilidad de transmisión cruzada entre especies. Sin embargo el genotipo 3, se ha descrito más en casos aislados de países industrializados (USA, Gran Bretaña, Francia, Holanda, España, Austria, Grecia, Italia, Japón, Australia, Nueva Zelanda); mientras que el genotipo 4 en casos esporádicos de Asia (China, Taiwan, Japón, Vietnam).
Epidemiológicamente la HEV en el mundo se distribuye en: 1) Zonas endémicas, donde se han descrito epidemias y casos esporádicos y 2) Zonas no endémicas, con descripción de casos aislados en países desarrollados.
La primera epidemia descrita fue en India en 1955 (2), a la que siguieron varias más en Africa, Asia y México, asociadas al genotipo 1 y 2. Ninguna epidemia ha sido descrita en países industrializados. En países con condiciones sanitarias sub-óptimas, HEV es la causa más importante de hepatitis esporádica y epidémica, como en India, en donde representa el 70% de los casos de hepatitis aguda esporádica en adultos. Inicialmente se describía como una infección transmitida por aguas contaminadas con material fecal, y esto podría explicar la diseminación de enfermedad en epidemias. Asimismo, se ha descrito la transmisión persona a persona en epidemias, como recientemente en un brote de HEV en Uganda (3), pero es infrecuente, a diferencia de la HAV (tasa de ataque a contactos caseros de 50-75%). Sin embargo el reservorio de los casos esporádicos en zonas endémicas es aún poco claro. La potencial contaminación del agua con material fecal es la más sugerida, pero esto indicaría una continua presencia de HEV en la población, de individuos clínicamente manifi estos, en convalecencia o con infección sub-clínica, que contaminan periódicamente los suplementos de agua. Otras vías de transmisión descritas, pero que contribuyen en menor índole a los casos esporádicos, son la transfusión de productos sanguíneos y transmisión vertical (materno-fetal).
Por otro lado, la transmisión de enfermedad en lugares industrializados, se consideraba exclusiva de viajeros a zonas endémicas hace 10 años. Sin embargo el incremento de casos autóctonos, y la alta correlación genética entre los genotipos 3 y 4 entre cerdos, venados y humanos, evidencia que se trataría de una zoonosis. La primera evidencia, fueron 2 casos descritos en USA, que tenían secuencias genéticas más parecidas a la HEV del cerdo que a la humana (4,5). De esta manera, los factores de riesgo considerados para contraer HEV en lugares industrializados son: consumo de hígados de cerdo crudos o poco cocidos, trabajo como cuidadores de cerdos, veterinarios, historia de viajes a lugares endémicos, y consumo de productos agropecuarios contaminados con heces de animales infectados. Un estudio hecho en hígados de cerdos empacados para la venta en el mercado de USA, detectó que de 127 muestras, 11% estuvieron contaminadas con HEV (6). Sin embargo, difícilmente cualquiera de estas formas de contagio descritas, pueden explicar el 21% de seroprevalencia (IgG de HEV) en USA (7), que sugiere que la gran mayoría de infecciones son asintomáticas o muy poco sintomáticas, por la limitada casuística descrita.
El periodo de incubación de la HEV, es de una media de 40 días luego de la exposición oral a aguas contaminadas (rango de 2-10 semanas) (2). El espectro clínico de las personas infectadas por hepatitis E, incluye desde pacientes asintomáticos, hepatitis anictérica, hepatitis ictérica y hepatitis fulminante. El cuadro típico, es el mismo descrito en otros casos de hepatitis virales. Estos síntomas son: ictericia, malestar, anorexia, fiebre, discomfort abdominal, hepatomegalia y prurito. Las anormalidades de laboratorio típicas son: marcado aumento de transaminasas, elevación de bilirrubinas y leve aumento de fosfatasa alcalina. Atípicamente se describe la presencia de autoanticuerpos tipo ANA, anti mitocondriales y Anti músculo liso en pacientes con Hepatitis Aguda E (8), como en el caso 1, que tenía un título signifi cativo de Anticuerpos Anti músculo liso.
El diagnóstico está basado en inmunoensayo para IgM para HEV, siendo detectable días antes del inicio de los síntomas y desapareciendo en 4-6 meses. La IgG para HEV, aparece poco después de la IgM, y puede permanecer por 12 años y luego ir decayendo (9). Existen diferentes ensayos inmunológicos usados comercialmente que detectan distintos fragmentos proteicos del ORF 2 o 3 (ambos estructurales); pero ninguno ha mostrado resultados consistentes en sensibilidad y especifi ci-dad, por lo que ninguno ha sido aprobado aún por la FDA. Los métodos de amplificación genética también pueden jugar un rol en el diagnóstico, tanto en muestras de heces como sanguíneas.
La tasa de ataque de HEV y el riesgo a presentar hepatitis fulminante, son mayores en gestantes. En un brote en India, 8.8% de gestantes en el 1er trimestre tuvieron hepatitis aguda por HEV, y 19% tanto en el 2do como en el 3er trimestre; mientras que las no gestantes sólo 2.1% desarrolló hepatitis aguda (10). En algunos países, HEV, constituye la causa más común de hepatitis en gestantes. En un estudio epidemiológico en India, la HEV constituyó el 37% de todos los casos de hepatitis virales en gestantes y el 81% de los casos de hepatitis fulminante (11). Este incremento en el riesgo de hepatitis fulminante en gestantes, es lo que incrementaría su mortalidad particularmente en el 3er trimestre, con tasas de fatalidad por caso de HEV de 10-25% (12). Sin embargo en un estudio de 1015 pacientes con hepatitis fulminante en India, la tasa de mortalidad en gestantes con hepatitis fulminante por HEV es de 51% (74/145) y no gestantes 54% (52/95) (P > 0.1), lo que mostraría que la mortalidad no es mayor en gestantes que en la población general con hepatitis fulminante por HEV (13). No se sabe los factores que aumentan el riesgo de severidad en gestantes, pero podrían estar involucrados factores hormonales o inmunológicos (14). Mayores estudios se requieren en esta área. Además el riesgo de desarrollar complicaciones obstétricas, como ruptura prematura de membranas y restricción del crecimiento intrauterino, se incrementa en gestantes con HEV.
El curso de enfermedad se consideraba convencionalmente autolimitado. Sin embargo, varios casos reportados y series de casos (15, 16), muestran que la HEV puede causar hepatitis crónica y riesgo a cirrosis en pacientes transplantados en países desarrollados. Todos los casos descritos de hepatitis E crónica, han sido en pacientes inmunosuprimidos y por HEV genotipo 3. Se requiere mayor información en el futuro, para conocer el riesgo de cronicidad con otros genotipos y en sujetos no inmunosuprimidos.
La tasa de fatalidad descrita varía de 0.5-4%, pero la data incluye solo pacientes hospitalizados, lo que podría ser un sesgo de selección. En brotes epidémicos, la tasa de fatalidad es de 0.07-0.6%. En estudios con primates, se ha mostrado que la severidad del cuadro clínico depende de la cantidad de inóculo(17). Esto no ha sido comprobado en humanos. Además de las gestantes, otros grupos en los que aumenta el riesgo de severidad, es en personas con enfermedad hepática preexistente (18), y en recientes estudios asiáticos, también los niños menores de 2 años (19).
La experiencia en el Perú es limitada. Vildosola et. al. en el año 2000, estudiaron a 191 sujetos cuidadores de cerdos, encontrando una seroprevalencia de IgG para HEV de 10.5% (20). Hyams y col (21) como comunicación corta, reportaron que del suero de 158 pacientes con hepatitis aguda no A, no B, no C, se realizó ELISA de 2da generación para el estudio de estos pacientes para IgG de 2 fragmentos de ORF 2 y 3, resultando 24 pacientes con serología positiva a una dilución de 1:21. Luego se aplicó 4 pruebas de ELISA experimentales para IgM e IgG de diferentes fragmentos de ORF 2 y 3 a estos 24 pacientes, siendo sólo 4 positivos para IgM y 12 positivos para IgG o IgM de HEV a dilución de 1:100. La seroprevalencia en otros países de América es variable: Brazil 3.3% (22), Chile 4% (23), Bolivia 10-66% (24), Venezuela 1.6-5.4% (25), Nicaragua 4.6-8% (26) y Cuba 5.3%(27). La ausencia de hepatitis aguda en muchos de estos sujetos, indicaría que la infección asintomática es común. No se ha realizado estudios de seroprevalencia en la población general en Perú. Los dos casos que describimos en este reporte provienen de un estrato socio económico alto de Lima Metropolitana, y son los primeros casos descritos de esta infección en nuestra ciudad. Es importante incluir a la hepatitis E en el diagnóstico diferencial de toda hepatitis aguda cuando la serología inicial para hepatitis A, B y C es negativa, luego de descartar otras etiologías como autoinmunidad y hepatitis medicamentosa. Es de vital importancia realizar estudios de seroprevalencia para conocer mejor el comportamiento de esta enfermedad y su frecuencia en nuestro medio.
BIBLIOGRAFÍA
1. BALAYAN MS, ANDJAPARIDZE AG, SAVINSKAYA SS et al.
Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route. Intervirology 1983; 20: 23–31.2. VISWANATHAN R. Infectious hepatitis in Delhi (1955– 56). A critical study: epidemiology. Indian J Med Res. 1957; 45:49–58.
3. TESHALE EH, GRYTDAL SP, HOWARD C, et al. Evidence of person to person transmission of hepatitis E virus (HEV) during a large outbreak in northern Uganda. Clin Infect Dis. 2010; 50:1006–10.
4. KWO PY, SCHLAUDER GG, CARPENTER HA, et al.
Acute hepatitis E by a new isolate acquired in the United States. Mayo Clin. Proc. 1997; 72: 1133–6.5. SCHLAUDER GG, DAWSON GJ, ERKER JC, et al. The sequence and phylogenetic analysis of a novel hepatitis E virus isolated from a patient with acute hepatitis reported in the United States. J. Gen. Virol. 1998; 79: 447–56.
6. FEAGINS AR, OPRIESSNIG T, GUENETTE DK, HALBUR PG, MENG XJ. Detection and characterization of infectious hepatitis E virus from commercial pig livers sold in grocery stores in the USA. J Gen Virol. 2007; 88:912–7.
7. KUNIHOLM MH, PURCELL RH, MCQUILLLAN GM, ENGLE RE, WASLEY A, NELSON KE. Epidemiology of hepatitis E virus in the United States: results from the Third National Health and Nutrition Examination Survey 1988–1994. J Infect Dis. 2009; 200:48–56.
8. NAGASAKI F, UENO Y, KANNO N, OKAMOTO H, SHIMOSEGAWA T. A case of acute hepatitis with positive autoantibodies who actually had hepatitis E virus infection. Hepatol Res. 2005 Jun;32(2):134-7.
9. CHADHA MS, WALIMBE AM, ARANKALLE VA. Retrospective serological analysis of hepatitis E patients: a long term follow up study. J Viral Hepat. 1999; 6:457–61.
10. KHUROO MS, TELI MR, SKIDMORE S, SOFI MA, KHUROO MI. Incidence and severity of viral hepatitis in pregnancy. Am. J. Med. 1981; 70: 252–5.
11. BENIWAL M, KUMAR A, KAR P, et al. Prevalence and severity of acute viral hepatitis and fulminant hepatitis during pregnancy: a prospective study from North India. Indian J Med Microbiol. 2003; 21:184–5.
12. TSEGA E, KRAWZYSKI K, HANSSON L, et al.
Hepatitis E virus infection in pregnancy in Ethiopia. Ethiop Med J. 1993; 31:173–81.13. BHATIA V, SINGHAL A, PANDA SK, ACHARYA SK.
A 20-year single-center experience with acute liver failure during pregnancy: is the prognosis really worse? Hepatology. 2008;48(5):1577–158514. NAVANEETHAN U, AL MOHAJER M, SHATA MT.
Hepatitis E and pregnancy: understanding the pathogenesis. Liver Int. 2008;28: 1190–9.15. KAMAR N, SELVES J, MANSUY JM et al.
Hepatitis E virus and chronic hepatitis in organ-transplant recipients. N. Engl. J. Med. 2008; 358: 811–1716. TAMURA A, SHIMIZU YK, TANAKA T et al.
Persistent infection of hepatitis E virus transmitted by blood transfusion in a patient with T-cell lymphoma. Hepatol Res 2007; 37(2): 113–120.17. TSAREV SA, TSAREVA TS, EMERSON SU, et al.
Infectivity titration of a prototype strain of hepatitis E virus in cyanomolgus monkeys. J Med Virol. 1994; 43:135–42.18. KUMAR ACHARYA S, KUMAR SHARMA P, SINGH R, et al.
Hepatitis E virus (HEV) infection in patients with cirrhosis is associated with rapid decompensation and death. J Hepatol. 2007; 46:387–94.19. TESHALE EH, HOWARD C, GRYTDAL S, et al. A large outbreak of hepatitis E in northern Uganda. Emerg Infect Dis. 2010; 16:126–9.
20. VILDOSOLA H, COLICHÓN A, BARREDA M, PISCOYA J, PALACIOS O. Hepatitis E IgG Antibodies Seroprevalence in a Peruvian risk group.
Rev Gastroenterol Peru. 2000;Apr-Jun;20(2):111-16.21. HYAMS KC, YARBOUGH PO, GRAY S, CALLAHAN J, GOTUZZO E, et al. Hepatitis E Virus Infection in Peru. Clinical Infectious Diseases. 1996;22(4): 719-720
22. CARRILHO FJ, MENDES CLEMENTE C, SILVA LC.
Epidemiology of hepatitis A and E virus infection in Brazil. Gastroenterol Hepatol. 2005; Mar 28(3):118-25.23. BRAHM J, HURTADO C, MORAGA M, GIL LC, VELASCO M, ALEGRÍA S, PAGLIERO B. Hepatitis E virus infection in Chile: preliminary report. Rev Med Chil. 1996 Aug;124(8):947-9.
24. LEÓN P, VENEGAS E, et al. Prevalencia de las infecciones por virus de las hepatitis B, C, D y E en Bolivia. Rev Panam Salud Publica Vol.5 N.3
25. PUJOL FH, FAVOROV MO, MARCANO T, ESTÉ JA, MAGRIS M, LIPRANDI F, KHUDYAKOV YE, KHUDYAKOVA NS, FIELDS HA. Prevalence of antibodies against hepatit is E virus among urban and rural populations in Venezuela. J Med Virol. 1994 Mar;42(3):234-6.
26. PEREZ OM, MORALES W, PANIAGUA M, STRANNEGARD O. Prevalence of antibodies to hepatitis A, B, C, and E viruses in a healthy population in Leon, Nicaragua. Am J Trop Med Hyg. 1996 Jul;55(1):17-21.
27. QUINTANA A, SANCHEZ L, LARRALDE O, ANDERSON D. Prevalence of antibodies to hepatitis E virus in residents of a district in Havana, Cuba. J Med Virol. 2005 May;76(1):69-70.













