Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.31 no.1 Lima Jan./Mar. 2011
ARTÍCULOS ORIGINALES
Evaluación del Test Diagnóstico índice número de plaquetas / diámetro mayor del bazo, como predictor de la presencia de várices esofágicas en cirrosis hepática
Evaluation of the diagnostic test of index platelet counts / size spleen, as a predictor of the presence of esophageal varices in Cirrhosis
Jorge R. Mosqueira* ; Johana B. Montiel* ; Diana Rodríguez** ; Eduardo Monge***
* Médico Cirujano, Lima – Perú.
** Médico Internista – Geriatra del Hospital Nacional Arzobispo Loayza.
*** Médico Gastroenterólogo del Servicio de Gastroenterología del Hospital Daniel Alcides Carrión. Profesor de la Facultad de Ciencias y Filosofía-Universidad Peruana Cayetano Heredia. Lima-Perú.
RESUMEN
OBJETIVO: Evaluar el índice número de plaquetas/diámetro mayor del bazo (P/DMB) como un método diagnóstico no invasivo de la presencia de várices esofágicas (VE) en pacientes con cirrosis hepática.
MATERIAL Y MÉTODOS: Estudio de Test Diagnósticos, análisis retrospectivo. Se recolectaron los datos de pacientes, con el diagnóstico de cirrosis hepática, en el Servicio de Gastroenterología del Hospital Nacional Daniel Alcides Carrión (HNDAC), entre Septiembre 2010 y Enero 2011; posteriormente se calculó la sensibilidad, especificidad, valor predictivo positivo y negativo, razón de probabilidades positiva y negativa; utilizando a la endoscopía digestiva alta como patrón de oro.
RESULTADOS: Se evaluaron los datos de 47 pacientes, la edad promedio fue de 60,74 años; la etiología fue consumo de alcohol en el 25,5%, y no determinada en el 48,9% de pacientes. El 25% de pacientes no presentaron VE y 74,5% las presentaron. El índice P/ DMB se comparó con la endoscopía, encontrándose una Sensibilidad de 40%, Especificidad de 75%, Valores predictivos positivo y negativo de 82% y 30% respectivamente; y razón de probabilidades positiva y negativa de 1,6 y 0,8 respectivamente.
CONCLUSIONES: El índice P/DMB no es una prueba diagnóstica efectiva para el diagnóstico de la presencia de VE en la muestra estudiada.
PALABRAS CLAVE: Cirrosis hepática, várices esofágicas, número de plaquetas, diámetro mayor del bazo, método no invasivo, endoscopía digestiva alta.
ABSTRACT
AIM: To evaluate the platelet count/spleen diameter (PC/SD) ratio as a non invasive diagnostic test to predict esophageal varices (VE) in patients with cirrhosis.
METHODS: Diagnostic test study, retrospective analysis. Data was collected from patients with diagnosis of liver cirrhosis at gastrointestinal unit of Hospital Nacional Daniel Alcides Carrión between September 2010 and January 2011. Using a PC/SD ratio with a cut off value of 909, sensitivity, specificity, Positive and negative predictive values, positive and negative likelihood ratios were calculate.
RESULTS: There were 47 patients; mean age of 60,74; etiology: alcoholic (25,5%); undeterminated (48,9%). Twenty-five percent patients had varices and 74,5% had no varices. The PC/SD ratio had a sensitivity of 40%, specificity of 75%, PPV of 82%, NPV 30%, LR (+) of 1,6 and LR (-) of 0,8.
CONCLUSIONS: The PC/SD ratio was not an effective diagnostic test for esophageal varices.
KEY WORDS: Cirrhosis, esophageal varices, platelet number, spleen diameter, noninvasive method, upper digestive endoscopy.
INTRODUCCIÓN
En la actualidad, se postula que el número de pacientes con problemas crónicos está en constante aumento y tal es el caso de la enfermedad hepática crónica. La cirrosis hepática, cuyas causas más comunes son: la injuria secundaria a consumo de alcohol ó las infecciones tipo Hepatitis B o C, que predisponen a la formación de várices esófago-gástricas, cuya ruptura continúa siendo la causa de muerte más importante en las series más recientes (1, 2, 3). La prevalencia de VE, en pacientes cirróticos, varía entre 60 y 80%, dependiendo de la severidad y la etiología de la enfermedad hepática (4); aumentando la morbimortalidad para el paciente.
Las VE son una complicación común de la cirrosis. Se estima que, en el momento del diagnóstico las VE se encuentran presentes en aproximadamente 40 % de los pacientes con enfermedad compensada y en 60% de los pacientes con enfermedad descompensada y con presencia de ascitis(5). Más del 80% de los pacientes cirróticos desarrollan VE en algún momento de su vida, y el 30% de estos pacientes, presentarán sangrado por ruptura de las mismas (5, 6). En el estudio realizado en la Unidad de Hígado del Hospital Nacional Edgardo Rebagliati Martins (HNERM), se encontró que el 80,4% de los pacientes tenían VE, siendo el sangrado variceal la causa más importante de hospitalización (6).
El patrón de oro para el diagnóstico de VE es la endoscopía digestiva alta (7), la cual debe realizarse una vez que el diagnóstico de cirrosis ha sido establecido (8). Sin embargo, es una técnica invasiva, costosa y frecuentemente percibida como no placentera por los pacientes; por esta razón ha conllevado al interés de desarrollar predictores no invasivos para la presencia de VE (9). En ese sentido, se han propuesto varios sistemas de predicción como son: el diámetro del bazo, la clasificación de Child-Pugh, el número de plaquetas, la ascitis, la relación entre el lóbulo derecho y la albúmina, etc (9, 10, 11, 12, 13, 14, 15, 16). Entre estos predictores, encontramos al índice P/DMB propuesto por Gianini et al 2003 (17); y debido a que la información sobre predictores no invasivos de la presencia de VE en Perú es muy escasa, se ha considerado importante realizar un estudio nacional.
El objetivo del trabajo es evaluar la capacidad del índice P/DMB con punto de corte ≤ 909 para predecir la presencia de VE en pacientes con cirrosis hepática en el HNDAC.
MATERIAL Y MÉTODOS
Se realizó un estudio de test diagnóstico, de forma retrospectiva, realizado en el servicio de Gastroenterología del HNDAC, Callao-Perú, entre Septiembre 2010 y Enero 2011. Teniendo en cuenta los objetivos y la frecuencia del problema, se realizó un cálculo de tamaño muestral de 40 pacientes (18). Se incluyeron en el estudio pacientes con el diagnóstico de cirrosis hepática, mayores de 18 años en atención ambulatoria; a quienes se les haya realizado (en un tiempo máximo de un mes) una endoscopía digestiva alta, una ecografía abdominal (medición del diámetro mayor del bazo en milímetros) y un conteo del número de plaquetas (número de plaquetas/mm3) .
Para motivos de nuestro trabajo, consideramos para el diagnóstico de cirrosis hepática cualquiera de las siguientes premisas:
-
Biopsia hepática positiva, con presencia de nódulos de regeneración rodeadas por bandas fibróticas (19, 20).
-
Diagnóstico clínico de cirrosis, en base a la asociación de signos clínicos, signos ecográficos, y evidencia bioquímica de enfermedad hepática crónica.
2.1. Signos clínicos: al menos uno de los siguientes: ictericia, telangiectasias, nodularidad hepática, esplenomegalia, ascitis, caput medusae, sindrome de Cruveilhier Baumgarten, eritema palmar, leuconiquia, osteoartropatía hipertrófica, hipocratismo digital, contractura de Dupuytren, ginecomastia, hipogonadismo, asterixis, fetor hepático.
2.2. Signos ecográficos, al menos uno de los siguientes: nodularidad del hígado, hiperecogenecidad del hígado, atrofia del lóbulo derecho del hígado, hipertrofia del lóbulo izquierdo del hígado y especialmente en el lóbulo caudado (19, 20), diámetro de vena porta mayor de 12 mm.
2.3. Evidencia bioquímica: al menos uno de los siguientes: aumento de bilirrubinas, aumento de TGO y TGP, disminución de albúmina, inversión de la relación albúmina/globulina, trastornos de coagulación como tiempo de protombina prolongado e INR aumentado.
La presencia de VE fue determinada mediante una endoscopía digestiva alta diagnóstica realizada, supervisada o revisada por un solo Gastroenterólogo y catalogada usando la escala del North Italian Club que se utiliza habitualmente en el servicio y que gradúa las várices en 0 (ausente); y 1,2 y 3 (presentes y en grado ascendente) (21).
Las endoscopías fueron realizadas con un equipo de endoscopía OLYMPUS, modelo GIF E3.
El recuento de plaquetas se obtuvo utilizando un equipo de conteo celular automatizado marca SYSMEX, modelo XT-1800i.
Las ecografías fueron realizadas por ecografistas experimentados (se consideraron cinco de ellos para el estudio) utilizando un equipo de ecografía General Electric, modelo LOGIP P5.
Se excluyó a los pacientes hemodinámicamente inestables, que presenten sangrado gastrointestinal activo, pacientes que hayan recibido tratamiento para VE (quirúrgico, endoscópico o farmacológico) o aquellos sometidos a trasplante hepático.
Luego, con los datos obtenidos, se calculó el índice P/ DMB y utilizando el programa SPSS v. 19.0 se realizó el análisis de los mismos; se calculó la sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), razón de probabilidades positiva (RP+) y razón de probabilidades negativa (RP-) del índice P/DMB.
En este estudio, se establecerán dos grupos para la comparación: el primero sin VE y el segundo con VE; utilizando la endoscopía digestiva alta como patrón de oro. Aceptamos como diferencia significativa un valor de p < 0.05.
RESULTADOS
Entre los meses de Septiembre del 2010 y Enero del 2011, se incluyeron 47 pacientes con el diagnóstico de cirrosis hepática, cuyas características demográficas, etiología de la cirrosis y la distribución de pacientes según el grado de várices se detallan en la Tabla 1. La relación hombre: mujer fue 1:1. La edad promedio es 60,74 años (Rango entre 18 y 87 años); así mismo, se evidenció que las causas más frecuentes de cirrosis fueron: consumo crónico de alcohol (25,5%), viral (17,1%) con 1 paciente con hepatitis B crónica y 7 con hepatitis C crónica; autoinmune (8,5%) y, no determinada (48,9%). Se observó también, que los hombres presentaban la mayoría de casos de cirrosis alcohólica (91,6%) y las mujeres la mayoría de casos de cirrosis de etiología no determinada (66,7%). De los 47 pacientes incluídos, 35 (72,3%) tuvieron várices esofágicas. La frecuencia de VE de acuerdo a la escala del North Italian Club (21), no mostró gran diferencia: grado 0 (25,5%), grado 1 (27,7%), grado 2 (21,3%) y grado 3 (25,5%).
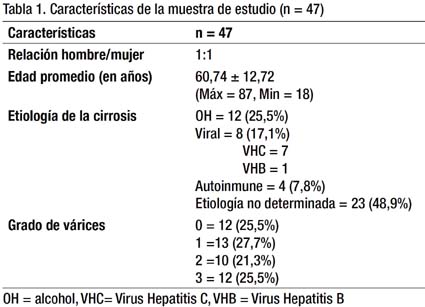
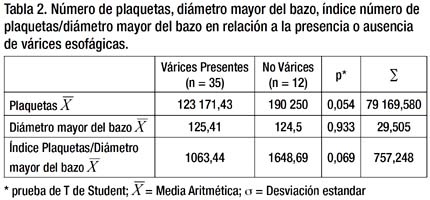
Se realizó una tabla comparando los promedios de los valores obtenidos de plaquetas, diámetro mayor del bazo y del índice P/DMB en los pacientes con presencia y ausencia de VE mediante una prueba de T Student, no encontrándose diferencias significativas. En el caso de plaquetas y del propio índice P/DMB se encontró diferencias, aunque éstas no llegaron a alcanzar la significancia estadística. Dichos resultados se exponen en la Tabla 2.
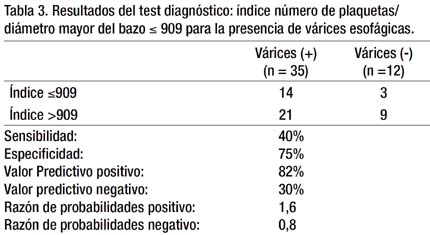
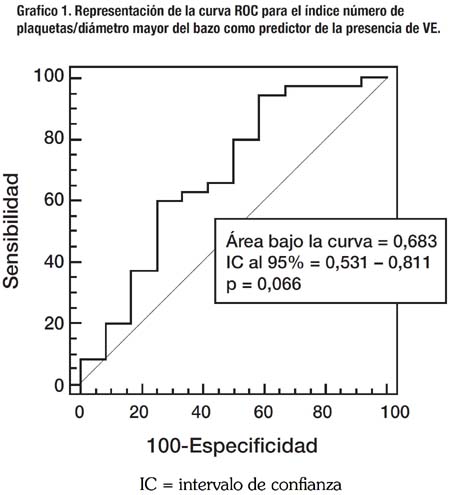
Los resultados referentes al estudio del test diagnóstico se muestran en la Tabla 3. La sensibilidad fue de 40%, especificidad de 75%, el VPP y VPN de 82% y 30% respectivamente; y la RP+ y RP- fue de 1.6 y 0.8 respectivamente. La sensibilidad y especificidad de la prueba son bajos. Asimismo, con los datos obtenidos se elaboró una curva ROC (Receiver operating characteristic o curva operador-receptor) hallándose un área bajo la curva de 0.683 con un p de 0.066, que se observa en el Gráfico 1.
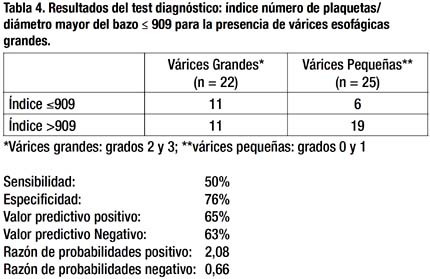
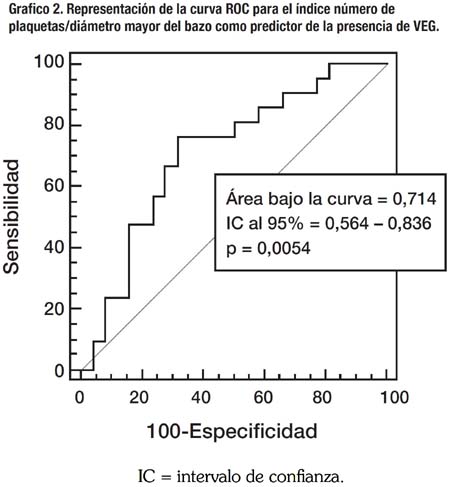
Se realizó un análisis similar reagrupando los pacientes de acuerdo a la presencia de várices esofágicas grandes (VEG). Considerándose VEG a los Grados 2 y 3, y pequeñas a los Grados 0 y 1. Los resultados de ese análisis aparecen en la Tabla 4 y en forma similar, son pobres con una sensibilidad de 50%, especificidad de 76%, VPP y VPN de 65% y 63% respectivamente; y la RP+ y RP- de 1.6 y 0.8 respectivamente. Además, se construyó también una curva ROC con estos resultados, obteniéndose un área bajo la curva de 0.741 con un p de 0.0054, la cual se observa en el Gráfico 2.
DISCUSIÓN
La cirrosis y la falla hepática crónica, fueron la decimosegunda causa de muerte en los Estados Unidos, en el año 2002; con la mayoría de causas prevenibles atribuidas al consumo excesivo de alcohol, hepatitis viral y obesidad con esteatohepatitis no alcohólica concomitante (19).
En el Perú, la mortalidad por cirrosis es del orden de 9,48 por 100,000 habitantes, ocupando el quinto lugar entre las causas de mortalidad general, el segundo lugar entre las enfermedades digestivas y hepatobiliares, y el segundo lugar entre los 20 y 64 años (6).
En un estudio descriptivo realizado en el Perú, entre Enero del 2001 y, Junio del 2004, en la Unidad de Hígado del HNERM, se encontró que las causas más frecuentes de cirrosis fueron: consumo crónico de alcohol (28%), hepatitis B crónica (15,2%), y hepatitis C crónica (11.8%) (6). En forma similar, el consumo de alcohol, fue la causa más común de cirrosis en nuestra serie y tuvimos un número alto de pacientes con etiología no determinada.
Se realizó un análisis en el cual se comparan los promedios obtenidos de plaquetas, diámetro mayor del bazo y del índice P/DMB para la presencia y ausencia de VE; encontrándose diferencias entre el promedio del conteo de plaquetas y el índice a pesar de no alcanzar la significancia estadística. Resultados similares han sido reportados por diversos autores (9, 10, 12, 13, 14, 15, 17, 22, 23, 24,25). Hallamos lo contrario para el diámetro del bazo similar a ciertos autores. (10, 11).
Las VE pueden ser divididas de varias formas: para algunos, pueden graduarse en 0, 1, 2 y 3 (21); otros, prefieren hablar más sencillamente de VE pequeñas y grandes; y por último, hay quienes más que al tamaño le dan importancia a la presencia de puntos rojos sobre las VE. Estas formas de reagrupar a las VE están en relación al riesgo de sangrado que se les atribuye. Nosotros rehicimos nuestro análisis considerando VE pequeñas (grados 0 y 1) y VE grandes (grados 2 y 3); y encontramos inclusive en este caso y realizando la curva ROC, que el rendimiento del índice no es el más adecuado para reemplazar a la endoscopía digestiva alta.
Con todo lo mencionado, se concluye que el índice P/ DMB con el punto de corte ≤909, no es un buen predictor para la presencia de VE y VEG en la muestra estudiada.
Sin embargo, teniendo en cuenta las limitantes del estudio al considerar 909 como punto de corte (cifra tomada del hemisferio norte), los problemas para estandarizar la ecografía y al no ser un estudio cegado, sugerimos por el momento, que tal como lo menciona el reporte de Baveno V (8), la endoscopia digestiva alta continúa siendo el método diagnóstico más acertado para predecir VE en pacientes con cirrosis hepática.
BIBLIOGRAFÍA
1. DAMICO G, DE FRANCHIS R, and a cooperative study group. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. J Hepatol. 2003;38:599–612.
2. CHALASANI N, KAHI C, FRANCOIS F, et al. Improved patient survival after acute variceal bleeding: A multicenter, cohort study. Am J Gastroenterol. 2003;98:653–59.
3. CARBONELL N, PAUWELS A, SERFATY L, et al. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. J Hepatol. 2004;40:652–59.
4. JENSEN DM. Endoscopic screening for varices in cirrhosis: Findings, implications, and outcomes. Gastroenterol. 2002;122:1620–30.
5. DAMICO G, LUCA A. Natural history. Clinical-hemodyanamic correlations. Prediction of the risk of bleeding. Baillieres Clin. Gastroenterol. 1997;11:243–56.
6. BUSTÍOS C, DÁVALOS M, ROMÁN R, ZUMAETA E. Caracteristicas Epidemiológicas y Clínicas de la Cirrosis Hepática en la Unidad de Hígado del HNERM Es-Salud. Rev Gastroenterol Peru. 2007;27(3):238-45.
7. GARCIA-TSAO G, SANYAL A, GRACE N, CAREY W. Practice guidelines. Prevention and Management of Gastroesophageal Varices and Variceal Hemorrhage in Cirrhosis. Am J Gastroenterol. 2007;102:2086–102.
8. DEFRANCHIS R. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on methodology of diagnosis and therapy in portal hypertension. J Hepatol. 2010;53:762-68.
9. MADHOTRA R, MULCAHY H, WILLNER I, REUBEN A. Prediction of esophageal varices in patients with cirrhosis. J Clin Gastroenterol. 2002;34(1):81-85.
10. SANJAY KUMAR SHARMA, RAKESH AGGARWAL. Prediction of large esophageal varices in patients with cirrhosis of the liver using clinical, laboratory and imaging parameters. J Gastroenterol and Hepatol. 2007; 22:1909-15.
11. ALEMPIJEVIC T, BULAT V, DJURANOVIC S, KOVACEVIC N, JESIC R, TOMIC D, et al. Right liver lobe/albumin ratio: Contribution to non-invasive assessment of portal hypertension. World J Gastroenterol. 2007; 13(40):5331-35.
12. BERZIGOTTI A, GILABERT R, ABRALDES J, NICOLAU C, BRU C, BOSCH J, et al. Noninvasive prediction of clinically significant portal hypertension and esophageal varices in patients with compensated liver cirrhosis. Am J Gastroenterol. 2008;103:1159-67.
13. GENTILE I, VIOLA C, GRAF M, LIUZZI R, QUARTO M, CERINI R, et al. A simple noninvasive score predicts gastroesophageal varices with chronic viral hepatitis. J Clin Gastroenterol. 2009;43(1):81-87.
14. WAN-DONG HONG, QI-HUAI ZHU, ZHI-MING HUANG, XIANG-RONG CHEN, ZEN-CAI JIANG, SI-HAO XU, KUNLIN JIN. Predictors of esophageal varices in patients with HBV-related cirrhosis: a retrospective study. BMC Gastroenterol. 2009;9:11-17.
15. SEN S, GRIFFITHS W. Non-invasive prediction of oesophageal varices in cirrhosis. World J Gastroenterol. 2008;14(15):2454-55.
16. JÜRG REICHEN. The splenoportal index accurately predicted the presence of oesophageal varices in compensated cirrhosis. EBM. 2009;14(1):27.
17. GIANNINI E, BOTTA F, BORRO P, RISSO D, ROMAGNOLI P, FASOLI A, et al. Platelet count/spleen diameter ratio: proposal and validation of a noninvasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis. Gut. 2003;52(8):1200-05.
18. GASTÓN DUFFAU T. Tamaño Muestral en Estudios de Pruebas Diagnósticas. Rev. Chil. Pediatr. 1998;69 (3):122-25.
19. BRAVO, A.A., S.G. SHETH, S. CHOPRA. Liver biopsy. N Engl J Med. 2001;344(7):495-500.
20. MCCORMICK PA. The spleen, hypersplenism, and other relationships between the liver and spleen. En: Bircher J, Benhamou J-P, McIntyre N, et al, eds. Oxford Textbook of Clinical Hepatology. Oxford: Oxford University Press;1999:787–95.
21. CESTARI R, MINELLI L, LANZINI A, MISSALE G, RAVELLI P, SALERNI B. Digestive endoscopy and portal hypertension. North Italian Endoscopic Club. Ital J Gastroenterol. 1996;28(2):18-33.
22. GIANNINI EG, BOTTA F, BORRO P, DULBECCO P, TESTA E, MANSI C, et al. Application of the platelet count/spleen diameter ratio to rule out the presence of oesophageal varices in patients with cirrhosis: a validation study based on follow-up. Dig Liver Dis. 2005;37(10):779-85.
23. GIANNINI EG, ZAMAN A, KREIL A. Platelet Count/ Spleen Diameter Ratio for the Noninvasive Diagnosis of Esophageal Varices: Results of a Multicenter, Prospective, Validation Study. Am J Gastroenterol. 2006;101:2511–19.
24. DE FRANCHIS R. Noninvasive Diagnosis of Esophageal Varices: Is It Feasible?. Am J Gastroenterol. 2006;101:2520–22.
25. SCHWARZENBERGER E, MEYER T, GOLLA V, PENA SAHDALA N, Min A. Utilization of platelet count spleen diameter ratio in predicting the presence of esophageal varices in patients with cirrhosis. J Clin Gastroenterol. 2010;44(2):146-50.
26. TAPE TG. Interpreting Diagnostic Tests [internet]. [Consultado 2011 Feb 16]. Disponible en: http://gim.unmc.edu/dxtests/Default.htm.













