Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.31 no.1 Lima Jan./Mar. 2011
REPORTE DE CASOS
Tumor sólido pseudopapilar del páncreas: ¿Una neoplasia de bajo potencial maligno?
Solid pseudopapillary tumor of the pancreas: a neoplasm of low malignant potential?
Gustavo Reaño1 ; José De Vinatea1 ; José Arenas2 ; Fritz Kometter1 ; Luis Villanueva1 ; Edgar Gonzáles1 ; Mónica Uribe1 ; Jorge Tang1 ; Guillermo Casas1 ; Hernán Robledo1
1 Servicio de Cirugía de Páncreas, Bazo y Retroperitoneo, Departamento de Cirugía General, Hospital Nacional Guillermo Almenara Irigoyen, Lima, Perú.
2 Departamento de Anatomía Patológica, Hospital Nacional Guillermo Almenara Irigoyen, Lima, Perú.
RESUMEN
INTRODUCCIÓN: El tumor sólido pseudopapilar del páncreas es considerado una neoplasia de bajo potencial maligno, por lo que la radicalidad del abordaje quirúrgico es aún controversial.
PACIENTES Y MÉTODOS: Se describe y analiza en forma retrospectiva los datos clínicos, radiológicos, de laboratorio, el reporte operatorio y el resultado patológico de 7 pacientes que fueron diagnosticados y operados por tumor sólido pseudopapilar del páncreas en el período 2003 al 2010, en nuestra institución.
RESULTADOS: Seis pacientes fueron de sexo femenino y uno masculino. La mediana de edad fue 35 años (rango: 15-49). El síntoma más frecuente fue dolor abdominal (100%). Se presentó ictericia en un paciente (14.3%). La apariencia radiológica mixta sólido-quística fue la más frecuente. En 5 pacientes el tumor se localizó en la cabeza del páncreas (71.4%) y en 2 se ubicó en la cola (28.6%). La mediana del tamaño tumoral fue de 93 mm (rango: 20-150) Se realizó 4 procedimientos de Whipple (57.1%), 2 pancreatectomías distales con esplenectomía (28.6%), una por vía laparoscópica y una resección local. En 2 casos (28.6%) se encontró el borde de sección pancreático comprometido. Se presentó morbilidad en 4 pacientes. No hubo mortalidad postoperatoria, ni reoperaciones. Cuatro tumores mostraron comportamiento maligno (57.1%): infiltración de cápsula esplénica y metástasis hepática metacrónica (1), infiltración de arteria mesentérica superior (1), metástasis linfática (1) y metástasis hepática sincrónica, infiltración duodenal e invasión linfovascular (1). No se detectó mortalidad por la enfermedad durante el período de seguimiento que fue en promedio 26 meses (rango: 6-70 meses).
CONCLUSIÓN: El tumor sólido pseudopapilar es una neoplasia con alto potencial maligno en nuestra experiencia, por lo que recomendamos una actitud quirúrgica agresiva, con resecciones radicales incluyendo linfadenectomía.
PALABRAS CLAVE: Tumor sólido pseudopapilar – Frantz - Páncreas – Cirugía – Patología - Pronóstico
SUMMARY
BACKGROUND: Solid pseudo papillary tumor of the pancreas is considered a neoplasm of low malignant potential. The radicality of surgical approach is controversial.
PATIENTS AND METHODS: We describe and analyze retrospectively the clinical, radiological, laboratory, operative report and pathology results of seven patients who were diagnosed and operated by solid pseudo papillary tumor of the pancreas in the period 2003 to 2010, in our institution.
RESULTS: Six patients were female and one male. The median age was 35 years (range: 15-49). The most common symptom was abdominal pain (100%). Jaundice in one patient (14.3%). The radiological appearance mixed solid-cystic was the most common. We performed four Whipple procedures (57.1%), 2 distal pancreatectomy with splenectomy (28.6%), one by laparoscopy and the other by local resection. Morbidity presented in four patients. There was no postoperative mortality or reoperation. Five tumors were located in the pancreatic head (71.4%) and two in the tail (28.6%). The median tumor size was 93 mm (range: 20-150). Two (28.6%) were R1 resections. Four tumors showed malignant behavior (57.1%): splenic capsule and infiltration of metachronous liver metastases (1), infiltration of superior mesenteric artery (1), lymphatic metastasis (1) and synchronous liver metastases, and lymphovascular invasion duodenal infiltration (1). There was no mortality from the disease during the average follow-up of 26 months (range 6-70 months).
CONCLUSION: Solid pseudo papillary tumor is a neoplasm with high malignant potential in our experience. We recommend an aggressive surgical approach with radical resection including lymphadenectomy.
KEY WORDS: Solid pseudo papillary tumor - Frantz - Pancreas - Surgery - Pathology - Prognosis.
INTRODUCCIÓN
El tumor sólido pseudopapilar (TSP) o tumor de Frantz es una neoplasia rara de bajo potencial maligno que se presenta predominantemente en mujeres jóvenes. Su origen celular, histogénesis y comportamiento biológico, no se conocen aún con exactitud. Habitualmente alcanzan grandes dimensiones al momento del diagnóstico y se distribuyen uniformemente en los diferentes segmentos pancreáticos. Desde 1996 en que se incorpora este tumor en la clasificación de la Organización Mundial de la Salud, la descripción clínica, radiológica y patológica de esta entidad se ha incrementado notablemente en los últimos 10 años.(1-3) Existe consenso en que la resección completa es el único método potencialmente curativo para esta enfermedad. Sin embargo, existe controversia en que su demostrado potencial maligno sea suficientemente significativo como para adoptar una conducta quirúrgica oncológica formal o bastaría realizar resecciones locales, como las enucleaciones o pancreatectomías sin linfadenectomía para el tratamiento de estas lesiones. (3)
En el presente artículo se describe y analiza las características clínicas, radiológicas, quirúrgicas, patológicas y de seguimiento de siete casos consecutivos de TSP, con una inusual frecuencia de malignidad, manejados en un servicio especializado de un hospital de referencia.
PACIENTES Y MÉTODOS
Se revisó y analizó en forma retrospectiva todos los pacientes que fueron diagnosticados y operados por tumor sólido pseudopapilar del páncreas en el período 2003 al 2010, en nuestra institución. Fueron identificados mediante diagnóstico patológico de la pieza operatoria. Los datos clínicos, radiológicos, de laboratorio, el reporte operatorio y el resultado patológico se obtuvieron de la historia clínica. El estudio histológico estuvo a cargo de un solo patólogo especializado en el área, revisándose las láminas para confirmar el diagnóstico, el cual se basó en los hallazgos macroscópicos y microscópicos del tumor, así como, de su perfil inmunohistoquímico. La morbilidad y mortalidad operatoria se definió como la ocurrida durante los 30 días del período post-operatorio. El diagnóstico de fístula pancreática y retardo del vaciamiento gástrico se basó en las definiciones del ISGPS (International Study Group on Pancreatic Surgery) (4,5). Los registros de seguimiento por consulta externa fueron revisados, y se contactó a algunos de los pacientes o a sus familiares por vía telefónica para verificar su condición actual y seguimiento post-quirúrgico, no pudiéndose localizar a uno de ellos. Se definieron los siguientes criterios de malignidad: invasión pancreática y extrapancreática, metástasis a distancia, metástasis ganglionar e invasión vascular o perineural. (6)
RESULTADOS
Se identificaron 7 pacientes con diagnóstico patológico de tumor sólido pseudopapilar del páncreas. Se encontró predominancia de presentación en mujeres en una relación de 6:1. La mediana de edad fue 35 años (rango 15-49). El dolor abdominal epigástrico, intermitente, fue el síntoma más frecuente, seguido de hiporexia y vómitos (Tabla 1). Ictericia se presentó en el único paciente varón (Bilirrubina total 10.63 mg/dl). Todos los pacientes fueron sintomáticos al momento del diagnóstico.
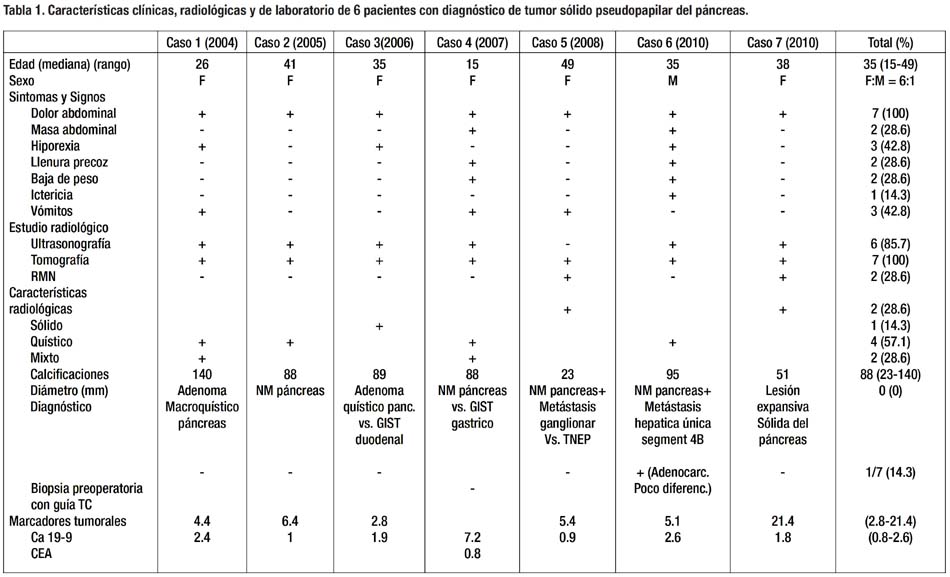
La tomografía computarizada (TC) fue el estudio de imagen que se utilizó en todos los pacientes. La ecografía se realizó en 5 casos, detectando la lesión en 4 de ellos. La resonancia magnética nuclear (RMN) se usó en 2 de los pacientes más recientes. (Fig. 1) Un paciente fue detectado durante una colecistectomía laparoscópica por colelitiasis. La apariencia radiológica mixta fue la más frecuente (57.1%), siendo las sólidas más frecuentes en tumores de menor diámetro. Finas calcificaciones se observaron en 2 de los pacientes (28.6%). En ninguno de los casos se propuso el diagnóstico por imagen de tumor sólido pseudopapilar, siendo la lesión quística y una mixta interpretadas como adenoma quístico o macroquístico y las sólidas y el resto de mixtas como neoplasia maligna de páncreas (NM) o tumor estromal gastrointestinal (GIST) duodenal y en un caso tumor neuroendocrino (TNEP). Cabe resaltar que la paciente con metástasis ganglionar se detectó por tomografía (TC), (Fig. 1) y en un caso con metástasis hepática sincrónica se confirmó lesión sólida de 4 cm en segmento 4B y dilatación del conducto de Wirsung, (Fig. 1) también por TC realizándose biopsia percutánea de lesión primaria, cuyo diagnóstico histológico inicial fue adenocarcinoma poco diferenciado siendo la revisión de lámina compatible con tumor sólido pseudopapilar. Dicho caso fue el único en el que se realizó biopsia preoperatoria. Los marcadores tumorales CEA y Ca 19-9 fueron uniformemente normales en todos los casos. (Tabla 1).
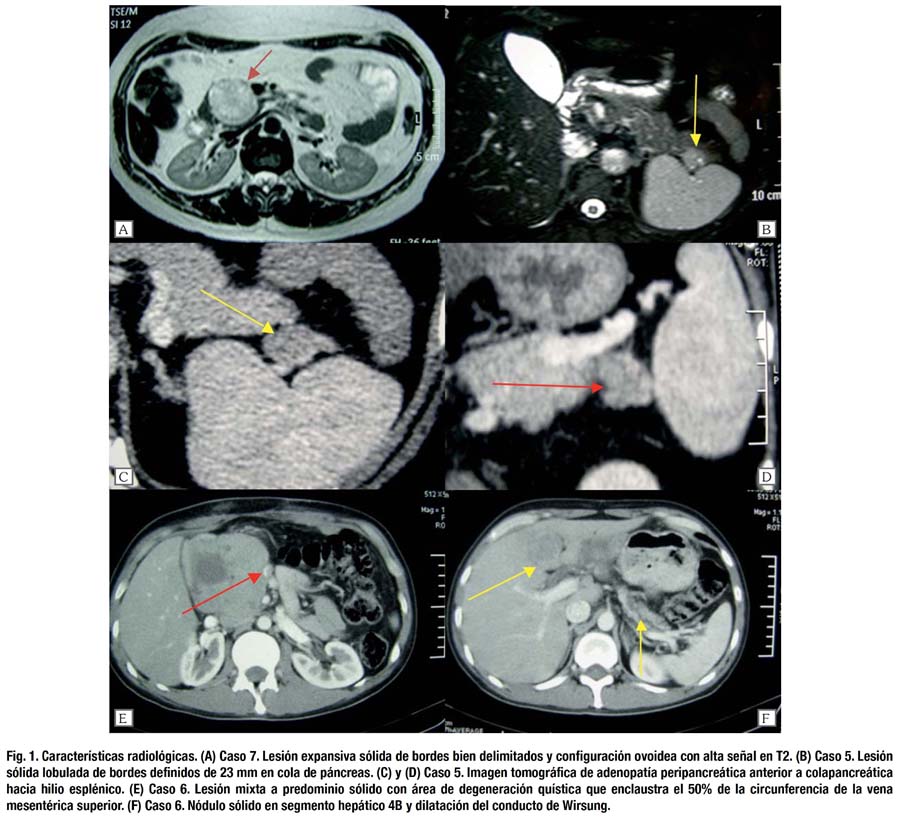
La resección fue radical, en bloque con linfadenectomía en 6 de los pacientes, excepto uno en el que se realizó resección local. Se realizaron 4 procedimientos de Whipple, 2 pancreatectomías distales con esplenectomía, 1 de ellas por vía laparoscópica y 1 resección local. Se realizó resección hepática no anatómica con márgenes libres en caso con metástasis hepática sincrónica incluyendo colectomía segmentaria transversa por compromiso tumoral del meso-colon transverso. En un caso se encontró sospecha de infiltración de la arteria mesentérica superior lográndose sin embargo completar la resección. Dos resecciones tuvieron enfermedad residual microscópica (R1). No hubo mortalidad postoperatoria. Se presentaron complicaciones en 4 pacientes. No hubo necesidad de reoperación en ningún caso. Se confirmó fístula pancreática grado A en 2 pacientes. Una paciente reingresó al hospital por 2 días para drenaje percutáneo de colección en celda esplénica. El cultivo fue negativo, sin embargo, recibió cobertura antibiótica por 7 días en forma ambulatoria, confirmándose la resolución de la complicación en controles de TC y RMN realizados posteriormente. Se registró retardo del vaciamiento gástrico en uno de los pacientes que además cursó con fístula pancreática. Se desarrolló infección del sitio quirúrgico en paciente que requirió colectomía como parte del procedimiento quirúrgico. El tiempo operatorio, la necesidad de transfusión y la estancia hospitalaria fue de acuerdo a la complejidad del procedimiento. (Tabla 2)
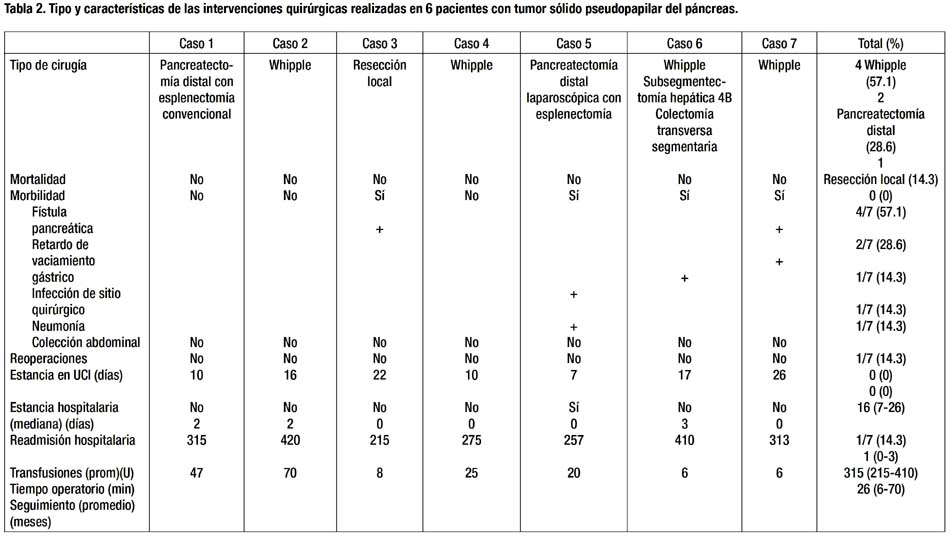
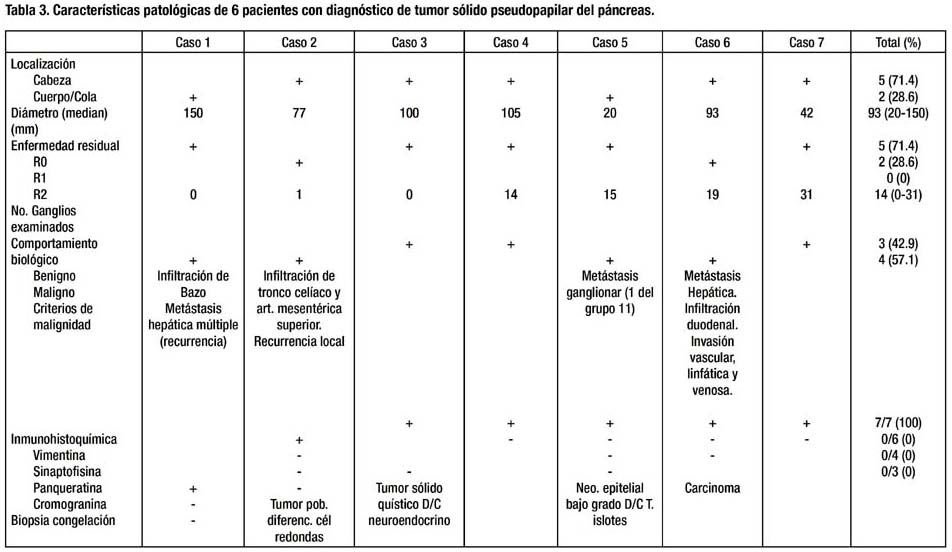
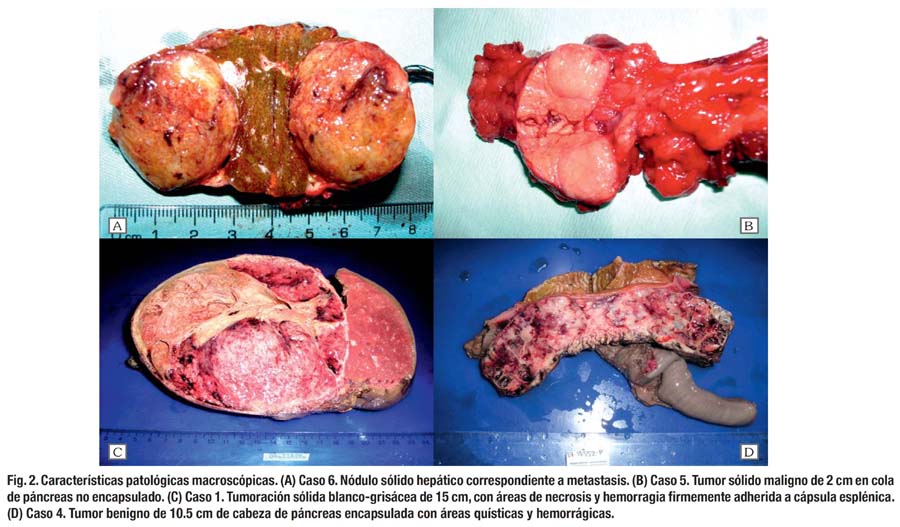
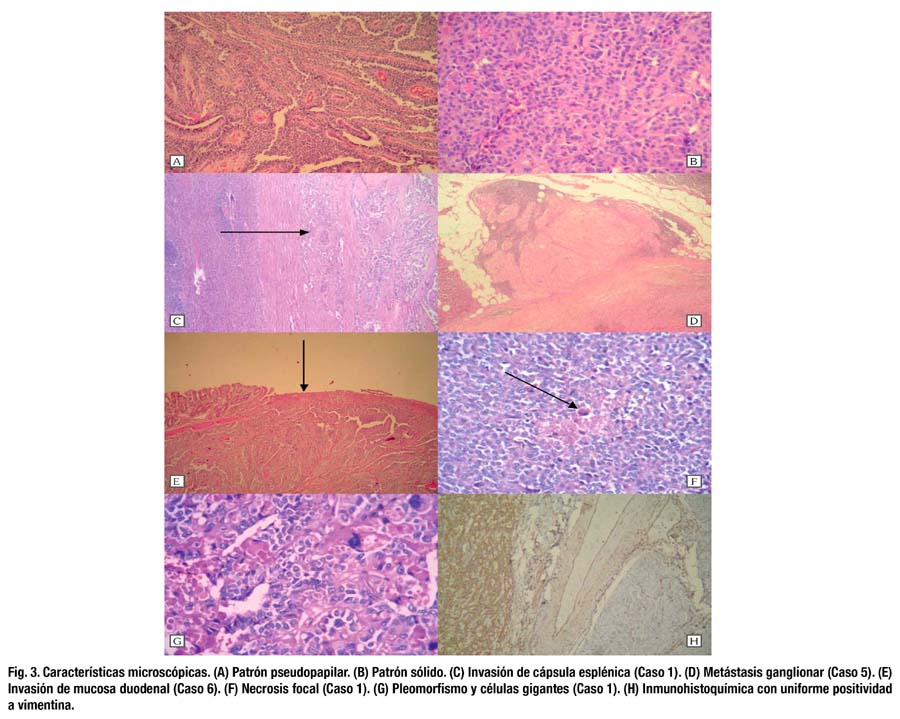
En cuanto a los hallazgos patológicos, 5 de los 7 tumores (71.4%) se localizaron en la cabeza del páncreas. La mediana del diámetro tumoral fue 93 mm, sin embargo, el mayor diámetro (150 mm) lo tuvo una lesión de cola. En uno de los casos en que la lesión rodeaba al tronco venoso portomesentérico (caso 6), se encontró compromiso focal del borde de sección pancreático y en otro (caso 2) la tumoración mostraba compromiso difuso del borde de sección pancreático (R1). Cuatro tumores (57.1%) mostraron comportamiento maligno. Uno presentó infiltración extrapancreática (arteria mesentérica superior, bazo, duodeno), invasión vascular y metástasis hepática sincrónica. Se demostró recurrencia local perivascular en otro paciente con borde de sección comprometido. Se confirmó metástasis ganglionar en un paciente con tumor de 2 cm en cola de páncreas. En otro paciente se presentó metástasis hepática múltiple 4 años después de resección curativa de tumor primario que infiltraba cápsula esplénica (Tabla 3). La mediana de ganglios examinados fue 14. La mayoría de los casos fueron tumoraciones sólidas y quísticas, bien circunscritas, (Fig. 2) compuestas de células monótonas, poligonales, epitelioides, con escaso estroma, sin fibrosis, muy vascularizadas por vasos de tipo capilar, de patrón de crecimiento sólido. (Fig. 3) En algunos casos, las células se ordenaban alrededor de los vasos, dando un aspecto pseudopapilar, con estroma perivascular hialinizado. Focalmente se observaron glóbulos hialinos intracitoplasmáticos, encontrándose necrosis focal, invasión capsular y del páncreas adyacente. Los núcleos eran uniformes y ovales, con escasas mitosis. En un caso se observó pleomorfismo celular focal, y en otro, áreas fusocelulares y pseudoglandulares. En todos los casos se realizaron PAS e inmunohistoquímica para los marcadores panqueratina, vimentina, cromogranina y sinaptofisina, observándose consistentemente positividad sólo para vimentina. (Fig. 3)
Durante el período de seguimiento (promedio: 26 meses, rango: 6-70), se detectó recurrencia de la enfermedad en 2 casos. Uno presentó recurrencia local en la raíz de la arteria mesentérica superior por ecografía y TC 1 año después de la operación inicial, siendo la paciente sometida a exploración quirúrgica confirmándose histología de esta recidiva mediante biopsia incisional, no pudiéndose resecar por compromiso vascular. Se le programó radioterapia recibiendo 36 Gy en 20 fracciones. Lleva 2 años de seguimiento después de este tratamiento, persistiendo nódulo de 16 mm sin variación en los estudios de imagen. En otro paciente se detectaron por TC múltiples lesiones hepáticas de aspecto quístico 4 años después de la operación inicial, siendo intervenida mediante laparotomía exploradora encontrándose múltiples tumoraciones quísticas cuya biopsia confirmó metástasis de TSP. (Tabla 3) Esta paciente se encuentra viva 2 años después con enfermedad estable sin tratamiento. El resto se mantienen vivos y libres de enfermedad a la actualidad, excepto uno perdido durante el seguimiento.
DISCUSIÓN
El tumor sólido pseudopapilar del páncreas es una neoplasia rara con reconocido potencial maligno. Fue descrito inicialmente por Frantz en 1959 y luego Hamoudi en 1970, dando a conocer sus características clínico-patológicas, momento desde el cual se ha venido reportando en la literatura cada vez mayor número de casos, con lo que se viene avanzando en el conocimiento de su comportamiento biológico, histopatología e historia natural, no quedando claro aún si estos tumores deben ser erradicados mediante una resección oncológica formal o de acuerdo al caso optar por cirugías menos radicales, como resecciones locales o sin linfadenectomía.(1-3)
El comportamiento maligno de esta enfermedad está claramente descrito en las revisiones, series y reportes de casos publicadas al respecto, sin embargo, este ocurre en bajo porcentaje de pacientes, describiéndose una alta supervivencia a largo plazo (>95%) incluso con enfermedad a distancia(7,8) La mayoría de tumores primarios se encuentran localizados (85-90%) en el páncreas al momento del diagnóstico. Sin embargo, pueden ser invasivos localmente o presentar metástasis, principalmente hepática o peritoneal, y se describe la posibilidad de recurrencia incluso después de resección completa del primario.(9) Por estas razones no existe consenso aún en cuanto a la radicalidad del procedimiento quirúrgico a realizar, habiendo una significativa variedad en la agresividad con que se enfrenta esta neoplasia.(7-15) No se cuenta actualmente con parámetros ya sea clínicos, imagenológicos o de laboratorio que nos permitan predecir su malignidad, por lo que queda a criterio del cirujano decidir la extensión de la resección.
Actualmente se cuenta con 2 grandes revisiones de casos tanto en la literatura inglesa, como en la china. Papavramidis y cols.(7) y Yu y cols.(8) describen 718 y 553 casos de TSP, respectivamente, y coinciden en que esta neoplasia representa el 1-2% de todos los tumores pancreáticos y que hay una fuerte predominancia de presentación en mujeres jóvenes. Los síntomas más frecuentes son el dolor y masa abdominal, y por lo menos una tercera parte son un hallazgo incidental.
CARACTERÍSTICAS CLÍNICAS
En nuestro estudio se encontró que 6 de 7 pacientes fueron de sexo femenino, con una mediana de edad de 35 años, comparable con las series occidentales donde se aprecia una edad de presentación similar (10-14), a diferencia de los estudios orientales donde la mediana de edad es alrededor de 26 años en series recientes.(16-19).
Los síntomas más frecuentes fueron dolor abdominal (100%), hiporexia (42.8%) y vómitos (42.8%). Ningún tumor se diagnosticó en forma incidental. Un caso de nuestra serie, presentó ictericia obstructiva severa, un signo de extrema rareza, descrito en 7 de 643 pacientes (1.03%) en una extensa revisión.(7) Este paciente fue el único de sexo masculino en quien se demostró en el estudio patológico, invasión duodenal hasta la mucosa, así como invasión linfovascular y metástasis hepática, no identificándose metástasis en 19 ganglios examinados. Este hallazgo sugiere que la ictericia podría ser un signo clínico de malignidad y que los pacientes de sexo masculino tengan un peor pronóstico por razones aún no establecidas. Machado y cols.,(20) reportan 34 casos de los cuales 7 fueron varones (21%) encontrando distintos patrones de inicio y agresividad tumoral cuando se comparan con pacientes mujeres, recomendando que los pacientes varones deberían ser tratados con cirugías más radicales y que el seguimiento debería ser más frecuente, por la mayor incidencia de invasión vascular y metástasis.
CARACTERÍSTICAS RADIOLÓGICAS
La apariencia radiológica en la mayoría de nuestros pacientes fue mixta, heterogénea, con áreas quísticas y sólidas (57.1%), encontrándose calcificaciones en 2 pacientes. La TC fue el método más utilizado siendo preciso en detectar los siguientes hallazgos sugestivos de malignidad: metástasis linfática, metástasis hepática, enclaustramiento del tronco venoso porto-mesentérico, infiltración de vasos esplénicos y dilatación del conducto de Wirsung. La resonancia magnética (RMN) se utilizó en 2 casos más recientes debido a su actual disponibilidad en nuestro hospital. Lee y cols.(21) en una serie de 29 pacientes donde se estudiaron 8 casos malignos, proponen que la dilatación del conducto pancreático y el enclaustramiento vascular y las metástasis son características imagenológicas que pueden ser usadas para diferenciar lesiones benignas de las malignas. El tamaño, la apariencia del tumor (sólida o quística) o la presencia de calcificaciones no ayudan a discriminar ambos tipo de lesiones. Chung y cols. plantean que un margen lobulado focal o eccéntrico y una discontinuidad focal de la cápsula puede sugerir malignidad y una lesión quística con calcificación periférica completa son hallazgos sugestivos de benignidad.(22) Sun y cols. en 28 pacientes encuentran que la RMN es superior a la TC como herramienta diagnóstica, al delinear más claramente las zonas de hemorragia características de este tumor.(18) En la literatura se aprecia una tendencia a reportes de tumores cada vez más pequeños en relación al uso liberal de los estudios por imágenes (20), permitiendo que esta neoplasia sea ahora en buen porcentaje un hallazgo incidental.
ANATOMÍA-PATOLÓGICA
La biopsia preoperatoria se realizó sólo en un paciente que se consideró irresecable por metástasis hepática y enclaustramiento del tronco venoso portal-mesentérico, siendo catalogado como adenocarcinoma en otra institución, siendo nuestra revisión de lámina compatible con tumor sólido pseudopapilar. Actualmente no se recomienda la biopsia preoperatoria. (23) El diagnóstico de un tumor sólido-quístico resecable en una mujer joven sugiere fuertemente el diagnóstico de TSP. Estaría indicada sólo en pacientes de mayor edad con enfermedad metastásica o irresecable o para descartar linfoma. En nuestro caso se realizó precisamente en un varón ictérico con gran masa de cabeza de páncreas y nódulo hepático metastásico, presentación atípica en la que debía descartarse otra patología más agresiva.
La mediana del tamaño tumoral fue 9.3 cm, siendo la localización más frecuente la cabeza del páncreas (71.4%). Estos tumores se localizan más frecuentemente en la cola del páncreas (35.9%) y en la cabeza (34%). (7,8)
En nuestra serie hemos clasificado como malignos a 4 pacientes. Dos que presentaron metástasis hepática y uno ganglionar. Dos pacientes que tuvieron enfermedad localmente avanzada infiltrando el bazo, uno de ellos y la arteria mesentérica superior el otro. El paciente con metástasis hepática también mostró invasión duodenal, vascular y linfática, siendo el de comportamiento más agresivo, coincidiendo con haber sido el único paciente de sexo masculino. Se tuvo 2 recurrencias, una local en región de arteria mesentérica superior y otra hematógena con metástasis hepática múltiple 4 años después de cirugía inicial. Goh y cols. reportan 9 de 16 casos con comportamiento maligno haciendo énfasis en que 8 de ellos tuvieron invasión locorregional, demostrando una peculiar proclividad al compromiso vascular mesentérico o esplénico.
Se ha descrito que 10 a 15% de estos tumores desarrollarán metástasis y en la mayoría de series, se reporta de 3.6% a 38.9% de tumores malignos. (17,18) Así también se ha descrito recurrencias locales tardías de 3 a 10 años después de la resección quirúrgica. (24) Tipton y cols.(10) describen 3 de 14 (21.4%) pacientes operados, de los cuales uno fue irresecable por infiltración de la arteria mesentérica superior, desarrollando metástasis hepática 7 años después de la operación. Este paciente murió 8 meses después. Otro desarrolló recurrencia subcutánea e intra-abdominal las cuales fueron resecadas, permaneciendo libre de enfermedad 9 años después. Un tercer paciente desarrolló metástasis hepática 1 año después de una aparente pancreatectomía distal curativa falleciendo 3 años después de la operación. Ninguno tuvo metástasis linfática, por lo que concluyen los autores que la resección oncológica formal en bloque debe realizarse pero que la linfadenectomía no sería necesaria, por la baja incidencia de metástasis ganglionar.
En la serie más grande publicada por Reddy y cols. (11) de 37 pacientes en una sola institución, se describe 4 casos de tumores malignos (11%). Un paciente tuvo enfermedad metastásica irresecable que murió 11 meses después del diagnóstico. Otro paciente desarrolló recurrencia intraabdominal diseminada 7.7 años después de resección R0 de tumor de 5.2 cm, que invadía duodeno. Dos pacientes más presentaron metástasis linfática. En el estudio del Memorial Sloan Kettering Cancer Center (12) de 24 pacientes se encontraron 7 casos (29.2%) con comportamiento maligno: 2 irresecables por invasión vascular, 4 con metástasis hepática sincrónicas y 1 paciente que tuvo metástasis ganglionar única, muriendo 2 pacientes en relación a progresión de la enfermedad.
Sin embargo, existen 2 grandes series de casos recientes en donde se reporta un bajo porcentaje de malignidad. La primera, (13) donde se analizaron 31 pacientes a quienes se resecó el tumor, no habiendo evidencia de comportamiento maligno ni en la presentación inicial ni durante el seguimiento (58.2 meses) en ninguno de ellos. Sin embargo, describe 2 casos con características histológicas agresivas: infiltración a grasa peripancreática, cápsula esplénica e invasión linfática, en lesión de cola de páncreas. En la segunda serie de 26 casos de Yang y cols., se encontró sólo un caso en que se desarrolló metástasis hepática y murió 6 meses después de la cirugía. (19)
El porcentaje de pacientes con tumores con comportamiento maligno (57.1%) encontrado en nuestra serie es uno de los más elevados descritos a la actualidad, sin embargo, el seguimiento confirma que a pesar de esta conducta biológica agresiva, los pacientes pueden tener una larga supervivencia. En nuestro medio, Targarona y cols., reportan 7 casos en los que en ninguno se observó signos de malignidad. (25)
Se ha tratado de dilucidar los factores clínico-patológicos que logren predecir una conducta agresiva por parte de estos tumores, no pudiéndose establecer aún una clara conclusión al respecto por el bajo porcentaje de tumores malignos en la mayoría de series. (15) Algunos autores han reportado factores predictivos de recurrencia como tumores mayores de 5 cm, invasión venosa, grado nuclear y redes necrobióticas prominentes. (16) Kang y cols. (26) en su serie de 33 pacientes describe 11 casos con potencial maligno (33.3%) siendo la invasión local del tejido peripancreático la característica de malignidad más frecuente. Encontraron además asociación en el análisis univariado de un tamaño mayor de 5 cm y potencial maligno. Esto correlaciona con nuestro caso 1 que tuvo una resección aparentemente curativa, de un tumor que alcanzó 15 cm, el mayor de la serie, y que invadía el bazo; desarrollando metástasis hepática múltiple 4 años después. Así también el caso 2 que desarrolló recurrencia local mostró el borde de sección pancreático comprometido, lo que sugeriría que el status del margen quirúrgico podría ser otro factor predictivo. Sin embargo en un estudio se describió 2 casos de resecciones R1 y R2 no presentando recurrencia en ninguno de ellos. (11) Así mismo, en la serie de 24 pacientes de Martin y cols. (12) no se encontró que el margen quirúrgico, la invasión de estructuras adyacentes o el tamaño fueran factores predictivos de supervivencia, sin embargo al igual que Nishihara y cols, (16) el marcado pleomorfismo nuclear y la presencia de focos de carcinoma sarcomatoide se correlacionó con un peor pronóstico (27).
TRATAMIENTO
Estos tumores se caracterizan por tener una alta resecabilidad y una larga supervivencia (>95% a 5 años) incluso en los pacientes irresecables, con metástasis o con resecciones incompletas (R1 y R2). (7,8) En el estudio Chino 45 (9.2%) de los tumores fueron malignos, sólo 3 tuvieron metástasis linfática. (8) De 315 procedimientos quirúrgicos realizados, 104 (33.02%) fueron resecciones locales o enucleaciones, siendo con esto el procedimiento más frecuente en esta revisión. En el estudio Griego de 497 de pacientes, 97 (19.52%) tuvieron invasión o metástasis, siendo los sitios de compromiso más frecuente, el hígado, la vena porta y el bazo; de 553 operaciones, 147 (26.6%) fueron resecciones locales o enucleaciones, siendo así el segundo método quirúrgico más frecuente después de la pancreatectomía distal (221 pacientes, el 39.96%). Cabe recalcar que se registraron 14 resecciones hepáticas en esta revisión y que durante el período de seguimiento se desarrolló recurrencia de enfermedad en 31 pacientes (6.63%), siendo el hígado y los ganglios linfáticos los lugares más frecuentes de afectación. (7) Por lo tanto, existe una clara controversia en la agresividad quirúrgica con que debe enfrentarse esta enfermedad, debido a su bajo potencial maligno y a la alta supervivencia y juventud de estos pacientes. Varios autores proponen realizar cirugía conservadora (13,14,20), mientras otros plantean la resección radical tal como cualquier otra neoplasia maligna (11,12,23).
Existen pocos reportes sobre el tratamiento de la enfermedad metastásica existiendo consenso en que estas deben ser resecadas completamente si esto es factible, puesto que la supervivencia es alta incluso en estos casos. (9) Gedaly y cols., (28) describen un caso de recurrencia hepática múltiple 3 años después de pancraeticoduodenectomía, realizando hepatectomía derecha y resección local amplia de 2 lesiones en lóbulo izquierdo, presentando 3 nuevas lesiones 4 años después consideradas irresecables y tratadas con radiofrecuencia. Estos autores mencionan una incidencia de metástasis hepática que varía en las series reportadas de 2% a 28% con una mediana de 14%. Hassan y cols., (29) describen la resección de 12 metástasis hepáticas en una mujer de 16 años, encontrándose libre de enfermedad en 18 meses de seguimiento, habiéndose definido la histología definitiva mediante la resección completa del primario, enfatizando que la resección de las metástasis requiere del diagnóstico histológico definitivo previo del primario. En nuestra serie el caso en que se hizo resección simultánea del tumor primario y la metástasis se realizó conociendo la histología previamente. La lesión era única y superficial en segmento 4B. En el caso 1 se presentaron múltiples metástasis en segmentos 2, 3, 5 y 7, 4 años después de pancreatectomía distal las cuales fueron consideradas irresecables. Al respecto, Martin y cols. (12) describen en una de las series más grandes 4 resecciones hepáticas simultáneas por metástasis, con larga supervivencia en 3 de ellos, la mayor de 11 años libre de enfermedad. En un estudio de seguimiento a largo plazo este grupo presentó 34 pacientes, 5 con metástasis hepática siendo la supervivencia promedio de este subgrupo con metástasis de 106 meses (rango 39-193 meses) y sólo 2 murieron de la enfermedad 5 y 10 años, respectivamente. Sin embargo, 2 casos con patrón de crecimiento difuso, necrosis tumoral extensa, atipia nuclear significativa y una alta tasa de mitosis (35-70/50 hpf) y uno con componente de carcinoma sarcomatoide, presentaron metástasis hepática y linfática muriendo a los 6 y 16 meses luego del diagnóstico inicial. (30) Por lo tanto, a pesar del escaso número de pacientes, creemos que el tratamiento de las metástasis sincrónica o metacrónica debe ser agresivo con resección completa con márgenes libres, en vista de la larga supervivencia a largo plazo descrita.
La mayoría de autores plantean que no sería necesario realizar linfadenectomía por la rara incidencia de metástasis ganglionar. (13,14,23) Sin embargo, este patrón de diseminación se ha descrito en varios estudios (7,11,24). Papavramidis (7) reporta que las formas de recurrencia después de la resección son la hepática y la ganglionar. Esto sugeriría que la linfadenectomía debería realizarse en la mayoría de casos ya que no agrega mayor morbilidad al procedimiento. De Castro y cols. (24) en su reporte de 11 casos sugieren que la resección de estos tumores debe ser estandarizada, evitando las enucleaciones, aunque consideran aceptable la pancreatectomía distal con preservación de bazo sin linfadenectomía. Otros autores consideran que por su bajo potencial maligno, esta neoplasia sería ideal para la utilización del abordaje laparoscópico con o sin preservación de bazo, principalmente para lesiones de cuerpo y cola, considerando que la mayoría de pacientes son mujeres jóvenes. (31,32)
Nosotros creemos al igual que el grupo del Hospital John Hopkins, (11) que estos tumores deben ser extirpados siguiendo los principios de una resección oncológica formal incluyendo linfadenectomía. El abordaje laparoscópico podría ser utilizado siempre y cuando se sigan estos principios, tal como se evidencia en uno de los casos presentados en que teniendo una lesión de 2 cm en la cola del páncreas se optó por la resección en bloque con bazo por vía laparoscópica, encontrando metástasis ganglionar en el grupo 11, que de haberse preservado el bazo el tratamiento hubiera sido insuficiente e incorrecto. Como se observa en la tabla 3, el número de ganglios obtenidos y examinados en nuestros pacientes han ido incrementándose notablemente con el tiempo, lo que atestigua esta actitud terapéutica radical.
El rol de la quimioterapia y radioterapia ha sido evaluado en pocos casos, lo cual no permite definir la utilidad de estas terapias en este raro tumor. Se han reportado algunos buenos resultados en pacientes con enfermedad irresecable o recurrente, con esquemas basados en gemcitabina o cisplatino. (3,33) En cuanto a radioterapia se describe un caso de buena respuesta de un tumor localmente avanzado. (34) En nuestro estudio, un caso recibió radioterapia para recurrencia local irresecable evidenciando disminución de más del 50% del tamaño inicial (50 mm a 16 mm) de la lesión. Es probable que la quimioterapia pueda utilizarse en casos con enfermedad a distancia irresecable y que la radio- o quimiorradioterapia se pueda probar como neoadyuvancia en casos localmente avanzados o como tratamiento de la recurrencia no susceptible de ser tratada quirúrgicamente.
CONCLUSIONES
El TSP es una rara neoplasia que en nuestra experiencia presentó un alto porcentaje de comportamiento maligno, incluyendo metástasis hepática, ganglionar y recurrencias, tanto local como a distancia; por lo cual recomendamos que este tumor debe ser extirpado siguiendo los principios de radicalidad oncológica incluyendo linfadenectomía y resección de las metástasis con márgenes libres. Así también creemos que el abordaje laparoscópico es una opción válida en casos seleccionados. Se debe considerar como potenciales factores predictivos de malignidad, el sexo masculino, la presencia de ictericia, la dilatación del Wirsung y la presencia de adenopatías locorregionales.
REFERENCIAS
1. MADAN A, WELDON C, LONG W y cols. Solid and papillary epitelial neoplasm of the pancreas. J Surg Oncol 2004:85;193-198.
2. CHAKHACHIRO Z, ZAATARI G. Solid-pseudopapillary neoplasm. A pancreatic enigma. Arch Pathol Lab Med 2009;133:1989-1993.
3. ROMICS L, OLÁH A, BELÁGYI T y cols. Solid pseudopapillary neoplasm of the pancreas-proposed algorithms for diagnosis and surgical treatment. Langenbecks Arch Surg 2010;395:747-755.
4. BASSI C, DEVERNIS C, BUTTURINI G y cols.
Postoperative pancreatic fistula: An international study group (ISGPF) definition. Surgery 2005;138:8-13.5. WENTE M, BASSI C, DEVERNIS C y cols.
Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2007;142:761-768.6. GOH BK, TAN YM, CHEOW PC, y cols.
Solid pseudopapillary neoplasms of the pancreas: an updated experience. J Surg Oncol 2007;95:640-644.7. PAPAVRAMIDIS T, PAPAVRAMIDIS S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature. J Am Coll Surg 2005:200:965-972.
8. YU PF, HU ZH, WANG XB y cols. Solid pseudopapillary tumor of the pancreas: A review of 553 cases in Chinese literature. World J Gastroenterol 2010:16:1209-1214.
9. VOLLMER CM, DIXON E, GRANT DR. Management of a solid pseudopapillary tumor of the pancreas with liver metastasis. HPB 2003;5:264-267.
10. TIPTON S, SMYRK T, SARR MG, THOMPSON GB. Malignant potential of pseudopapillary neoplasm of the pancreas. Br J Surg 2006:93:733-737.
11. REDDY S, CAMERON JL, SCUDIERE J y cols. Surgical management of solid pseudopapillary neoplasms of the pancreas (Frantz or Hamoudi) tumors: A large single-institutional series. J Am Coll Surg 2009:208:950-959.
12. MARTIN R, KLIMSTRA D, BRENNAN M y cols. Solid-Pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol 2002:9:35-40.
13. SALVIA R, BASSI C, FESTA L, FALCONI M y cols. Clinical and Biological behavior of pancreatic solid pseudopapillary tumors: Report on 31 consecutive patients. J Surg Oncol 2007:95:304-310.
14. MATOS J, GRÜTZMANN R, AGARAM N y cols. Sol-id pseudopapillary neoplasms of the pancreas: A multi-institutional study of 21 patients. J Surg Res 2009;157:137-142.
15. SPERTI C, BERSELLI M, PASQUALI C y cols. Aggressive behavior of solid-pseudopapillary tumor of the pancreas in adults: A case report and review of the literature. World J Gastroenterol 2008;14:960-965.
16. NISHIHARA K, NAGOSHI M, TSUNEYOSHI M y cols. Papillary cystic tumors of the pancreas. Assessment of their malignant potential. Cancer 1993:71:82-92.
17. LEE SE, JANG JY, HWANG DW y cols. Clinical features and outcome of solid pseudopapillary neoplasm: differences between adults and children. Arch Surg 2008;143:1218-1221.
18. SUN CD, LEE WJ, CHOI JS, y cols.
Solid-pseudopapillary tumours of the pancreas: 14 years experience. ANZ J Surg 2005;75:684-9.19. YANG F, JIN CH, LONG J, y cols. Solid pseudopapillary tumor of the pancreas: a case series of 26 consecutive patients. Am J Surg 2009;198:210-215.
20. MACHADO M, MACHADO MA, BACCHELLA T, y cols. Solid pseudopapillary neoplasm of the páncreas: distinct patterns of onset, diagnosis, and prognosis for male versus female patients. Surgery 2008;143:29-34.
21. LEE JH, YU J, KIM H, y cols.
Solid pseudopapillary carcinoma of the pancreas: differentiation from benign solid pseudopapillary tumour using CT and MRI. Clin Radiol 2008;63:1006-1014.22. CHUNG Y, KIM MJ, CHOI JY y cols.
Differentiation of benign and malignant solid pseudopapillary neoplasms of the pancreas. J Comput Assist Tomogr 2009;33:689-694.23. DE CASTRO SM, SINGHAL D, ARONSON DC, y cols.
Management of Solid-pseudopapillary neoplasms of the pancreas: a comparison with standard pancreatic neoplasms. World J Surg 2007;31:1129-1134.24. ALEXANDRESCU D, O`BOYLE K, FELIZ A, y cols. Metastatic solid-pseudopapillary tumour of the pan-creas: Clinico-biological correlates and management. Clin Oncol 2005;17:358-363.
25. TARGARONA J, POGGI L, GARATEA R, y cols. Tumores sólidos pseudopapilares del páncreas reporte de 7 casos y revisión de la literatura. Rev Gastroenterol Peru 2007;27:185-190.
26. KANG CM, KIM K, CHOI JS, y cols.
Solid pseudopapillary tumor of the pancreas suggesting malignant potential. Pancreas 2006;32:276-280.27. WASHINGTON K. Solid-Pseudopapillary tumor of the pancreas: Challenges presented by an unusual pancreatic neoplasm (Ed.). Ann Surg Oncol 2002:9:3-4.
28. GEDALY R, TOLEDANO A, MILLAN G, y cols.
Treatment of liver metastasis from a solid pseudopapillary tumor of the pancreas. J Hepatobiliary Pancreat Surg 2006;13:587-590.29. HASSAN I, CELIK I, NIES C, y cols.
Succesful treatment of solid-pseudopapillary tumor of the pan-creas with multiple liver metastasis. Pancreatology 2005;5:289-294.30. TANG LH, AYDIN H, BRENNAN M, y cols. Clinically aggressive solid pseudopapillary tumors of the pan-creas: a report of two cases with components of undifferentiated carcinoma and a comparative clinicpathological analysis of 34 conventional cases. Am J Surg Pathol 2005;29:512-519.
31. SOKOLOV Y, STONOGIN S, DONSKOY D y cols. Laparoscopic pancreatic resections for solid pseudopapillary tumor in children. Eur J Pediatr Surg 2009;19:399-401.
32. ELOLA-OLASO A, ALLEN A, GAGLIARDI R. Laparoscopic distal pancreatectomy for solid and cystic pancreatic neoplasms: Outpatient postoperative management. Surg Laparosc Endosc Percutan Tech 2009;19;470-473.
33. REDDY S, WOLFGANG C. Solid pseudopapillary neoplasms of the pancreas. Adv Surg 2009;43:269-282.
34. FRIED P, COOPER J, BRENNAN M y cols. A role for radiotherapy in the treatment of solid and papillary neoplasms of the pancreas. Cancer 1985;56:2783-2785.
Correspondencia:
Dr. Gustavo Reaño Paredes e-mail: gustavoreanop@yahoo.es
Dr. José De Vinatea De Cárdenas e-mail: jomal@terra.com.pe
Av. Grau 800. La Victoria. Lima 13-Perú
Telf: 324-2983 Anexo 4123













