Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.1 Lima ene./mar. 2011
REPORTE DE CASOS
Sangrado digestivo oscuro por tumor carcinoide ileal
Obscure digestive bleeding by ileal carcinoid tumor
María Nelly Manrique ; Oscar Frisancho ; Eduardo Zumaeta ; Américo Palomino y César Rodríguez
* Departamento del Aparato Digestivo, Hospital Edgardo Rebagliati Martins, EsSALUD, Lima, Perú.
RESUMEN
Mujer de 82 años con antecedentes de osteoartrosis, hipotiroidismo y anemia desde hace 14 años (ha recibido transfusiones). Refiere desde hace 9 meses malestar general, hiporexia, astenia y sensación de debilidad; asociadas a episodios de dolor abdominal intermitente. En un centro médico le detectaron anemia y Thevenon positivo. En el examen físico observamos a una paciente en regular estado general, obesa, con edema leve de miembros inferiores, sin alteraciones en tórax, cardiovascular, abdomen, etc. Sus exámenes auxiliares fueron normales, excepto que tenía anemia ferropénica. Le realizaron una endoscopia alta y colonoscopia sin detectar alguna fuente potencial de sangrado; se planteó el diagnóstico de hemorragia digestiva de origen oscuro. La evaluación se complementó con una ecografía y tomografía abdominal observando esteatosis hepática y litiasis vesicular; la radiografía de tránsito intestinal detectó una lesión protruida en un asa intestinal aparentemente correspondiente a yeyuno distal; Se le realizó la enteroscopia (con equipo de un solo balón) anterógrada y retrógrada logrando evaluar yeyuno proximal e ileon distal sin observar alguna lesión. El estudio de cápsula endoscópica mostró un tumor polipoideo -aparentemente en yeyuno- con evidencia de haber sangrado. La intervención quirúrgica detectó el área tumoral en el íleon proximal; en el espécimen quirúrgico se evidenciaron 3 tumoraciones de 0.7mm, 10mm y 15mm cuyo estudio histológico mostró que se trataban de lesiones correspondientes a tumor carcinoide. La presentación del tumor ileal carcinoide como hemorragia digestiva de origen oscuro no es frecuente.
PALABRAS CLAVES: Hemorragia gastrointestinal de origen oscuro, Tumor carcinoide, Tumor neuroendocrino.
SUMMARY
The patient is an 82 year-old female with a history of osteoarthritis, hypothyroidism and anemia for 14 years (receiving blood transfusions). She was admited to our hospital with a nine months history of malaise, anorexia, fatigue and weakness, associated with intermitten episodes of abdominal pain. She was diagnosed anemia and occult blood positive stools. Physical examination revealed a patient in generally fair condition, obese, with mild edema of lower limbs, no changes in the evaluation of chest, cardiovascular, abdomen, etc. Laboratory data was unremarkable, except for iron deficiency anemia. The upper endoscopy showed duodenal ulcer scar, fundic polyposis and chronic gastritis. Colonoscopy revealed some diverticula, a small sessile polyp and internal hemorrhoids. The diagnosis of obscure gastrointestinal bleeding was made. The CT scan of the abdomen showed gallstones and fatty liver; a radiograph of intestinal transit detected a lesion apparently protruded intestinal loop for distal jejunum; enteroscopy was performed (with one team ball) anterograde and retrograde achieving assess distal jejunum and distal ileum without observing any injuries. The study of capsule endoscopy showed a polypoid tumor intestinal with evidence of having bleeding. Surgery detected the tumor in proximal ileum. The surgical specimen findings showed three tumors 0.7mm, 10mm and 15mm on the proximal ileum. The microscopic examination revealed that these lesions were neuroendocrine tumors (carcinoid). The Ileal carcinoid tumor may rarely presented with obscure gastrointestinal bleeding.
KEY WORDS: obscure gastrointestinal bleeding, carcinoid tumor, neuroendocrine tumor.
INTRODUCCIÓN
Los tumores carcinoides son lesiones malignas derivadas de la proliferación de las células del sistema neuroendocrino llamadas enterocromafi nes o células de Kulchitsky, su localización más frecuente es el intestino delgado (1). Tiene tres patrones clínicos de presentación: el primero consecuencia del efecto local de la masa tumoral, el segundo es el síndrome carcinoide y el tercero está asociado a la inducción de fibrosis local o vascular; sin embargo la frecuencia del hallazgo incidental en sujetos asintomáticos -durante la cirugía o la endoscopia- supera el 50% (2).
A continuación reportamos el caso de un tumor carcinoide de intestino delgado (ileon) con presentación inusual: primero como anemia ferropénica (sangrado digestivo oculto) y posteriormente -al detectarse el Thevenon positivo- como sangrado digestivo de origen no determinado.
CASO CLÍNICO
Mujer de 82 años, natural y procedente de Chiclayo, que refiere como antecedentes hipotiroidismo desde hace 15 años, recibe levotiroxina; anemia ferropénica desde hace 14 años, ha recibido transfusiones; tabaquismo hasta hace 12 años, hipertensión arterial desde hace 4 años, recibe captopril; hemorroides con sangrado esporádico, y osteartrosis.
ENFERMEDAD ACTUAL
La enfermedad tiene 9 meses, el inicio fue insidioso y el curso progresivo, estaba caracterizada por malestar general, hiporexia, astenia y sensación de debilidad; asociada a veces a dolor abdominal mesogástrico.
En un centro médico le detectaron anemia (Hb: 6.8 g) y Thevenon positivo, le realizaron una endoscopia alta, encontrando cicatriz de úlcera duodenal y poliposis fúndica, en la colonoscopia observaron algunos divertículos y un pequeño pólipo sésil.
Se plantea el diagnóstico de hemorragia digestiva de origen oscuro.
La evaluación se complementó con una tomografía abdominal que mostró esteatosis hepática moderada, litiasis vesicular, no adenomegalias, no ascitis, las asas intestinales delgadas y gruesas de morfología y distribución habitual; y una radiografía de tránsito intestinal, que detectó una lesión elevada de localización aparentemente en asa yeyunal distal (Figura 1) por lo que se planificó una enteroscopía ambulatoria.
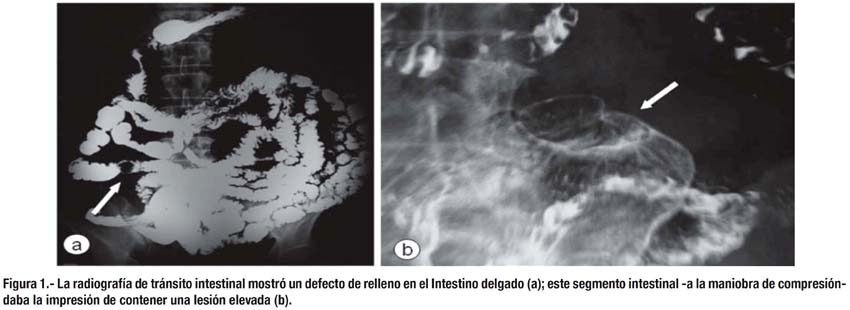
Reingresó (25/05/09) con anemia, lo que obligó a que se le transfundieran tres paquetes globulares. Se le realizó enteroscopía (equipo de un solo balón) vía anterógrada y retrógrada evaluando yeyuno e íleon distal respectivamente, sin observar alguna lesión. Fue dada de alta (18/06/09) con cita para cápsula endoscópica.
Nuevamente ingresa con anemia (08/08/09) por consultorio externo. En el examen físico observamos a una paciente en regular estado general, obesa, con funciones vitales estables, lengua depapilada, leve edema de miembros inferiores, sin adenopatías, tórax y cardiovascular normal. El abdomen era blando, depresible, con leve dolor en epigastrio, el examen neurológico fue normal.
Exámenes auxiliares: Leucocitos: 7,340, Hb: 9.4, VCM:89, HCM:28.7, plaquetas: 335,000P. TP: 13.13, TTPa:31.69, Fibrinógeno:466.57, Glu: 94, U: 47, Cr:0.87, CEA: 2.9 proteínas totales: 6.49, albúmina:3.69, globulinas:2.8, bilirrubinas normales, TGO:21, TGP:16, fosfatasa alcalina: 68, Na: 131, k: 4.34. Marcadores de hepatitis B Y C: No reactivos
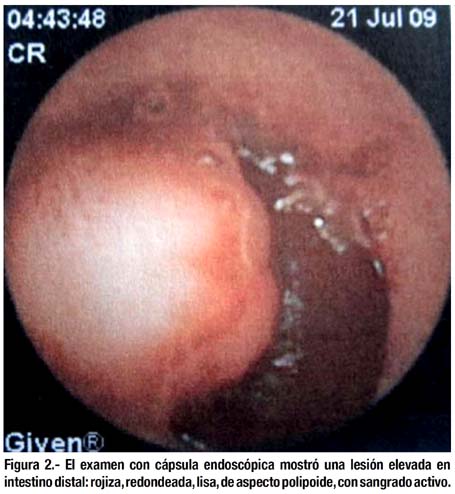
El examen con cápsula endoscópica (21/07/09) mostró tumor polipoideo-aparentemente en yeyuno distal- con evidencia de haber sangrado (figura 2).
La intervención quirúrgica detectó el área tumoral en íleon proximal. Se procedió a resecar el segmento ileal comprometido y complementar con una anastomosis termino-terminal. Abierto el espécimen quirúrgico se evidenciaron 3 tumoraciones ubicadas en el borde anti mesentérico del íleon proximal (figura 3).
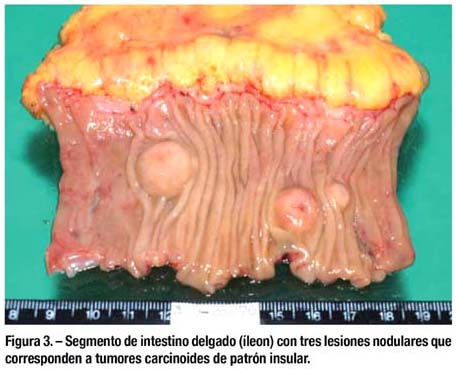
En el examen macroscópico del espécimen se observan 3 lesiones nodulares con insinuación de umbilicación. La menor mide 8x8x4mm y se ubica a 2cm de uno de los bordes, la adyacente mide 14x13x5mm,se encuentra a 7mm de la lesión anterior; la mayor mide 20x15x8mm, se encuentra a 2.2cm del borde opuesto. Las tres lesiones son de consistencia elástica y las dos mayores aparentan tener cierta fi jación a planos profundos. A los cortes seriados, todas las lesiones se ubican en submucosa ileal, con pequeña extensión hasta lámina propia (figura 4).
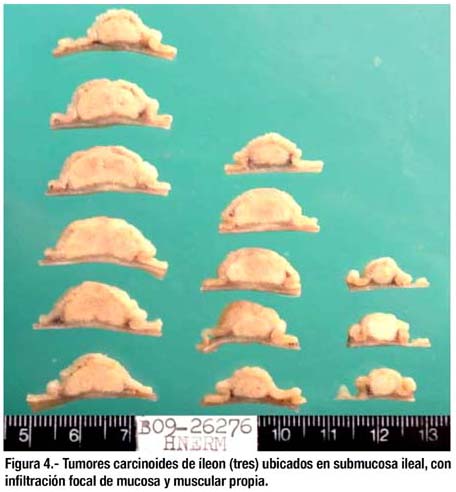
El estudio histológico mostró que se trataban de lesiones elevadas neuroendocrinas correspondientes al tipo tumor carcinoide, de patrón insular, ubicado en submucosa pero con infiltración focal de lámina propia, mucosa y muscular propia (figuras 5-7). Bordes quirúrgicos sin alteraciones, meso congestivo, no se identificaron ganglios linfáticos. El estudio inmunohistoquímico mostró citoqueratina, NSE, cromogranina, sinaptofisina positivo en células tumorales (figura 8); S-100 negativo en células tumorales; el Ki67 fue positivo en menos del 1% de células tumorales (figura 9).
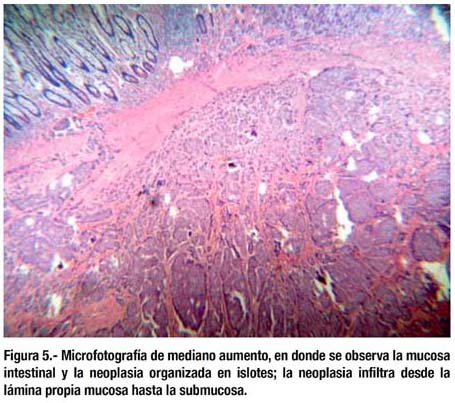
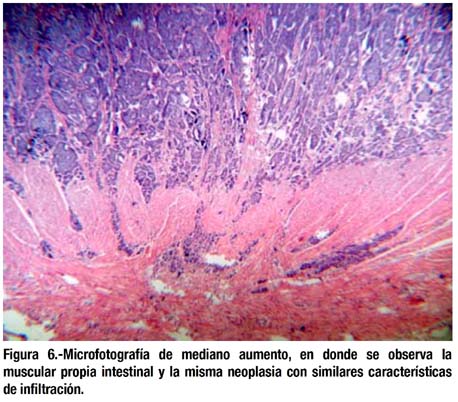
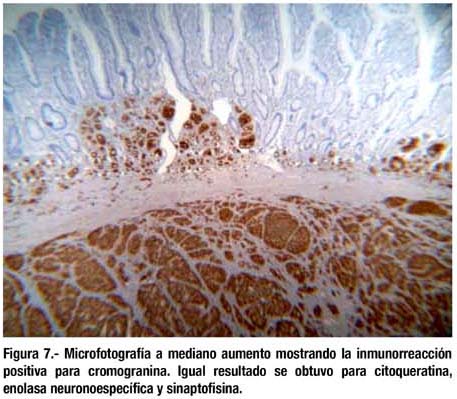
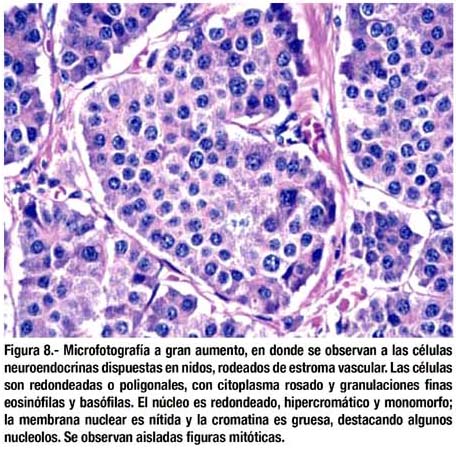
DISCUSIÓN
El sangrado digestivo oscuro (SDO) es definido como el sangrado del tracto gastrointestinal sin etiología, que persiste o recurre después de realizarse endoscopia alta y colonoscopia completa. Su frecuencia no está bien definida.
Existen múltiples causas potenciales de SDO; sin embargo, en pacientes menores de 40 años puede deberse a enfermedad inflamatoria intestinal, divertículo de Meckel, lesión de Dieulafoy o tumor del intestino delgado; en pacientes de más edad son más frecuentes las lesiones vasculares, erosiones o úlceras relacionadas a AINES.
En el presente caso se trató de una mujer de 82 años cuya causa de SDO fue un tumor carcinoide ileal, de presentación poco frecuente en su grupo etáreo (3%) (9). La enfermedad se manifestó inicialmente como anemia ferropénica sin evidencia visible de pérdida sanguínea.
La búsqueda de sangre oculta en heces resultó positiva. Los estudios endoscópicos iniciales (alto y colonoscopia completa) fueron negativos, constituyéndose en un caso de sangrado digestivo de origen oscuro.
La radiografía de tránsito gastrointestinal mostró un área sospechosa de lesión en intestino delgado distal, por esta razón se realizó enteroscopia anterógrada y retrógrada (con enteroscopio de un solo balón) sin lograr llegar al íleon proximal.
La evaluación complementaria con cápsula endoscópica permitió confirmar la sospecha diagnóstica del estudio radiológico; al respecto debemos decir que el rendimiento diagnóstico de este procedimiento supera en 30% a la enteroscopía (18).
La enteroscopia anterógrada por vía oral -con instrumentos de 220 a 250 cm- habitualmente atraviesa el nivel del ligamento de Treitz y debido a la formación de bucles solo logra un examen dentro de los 150 cm proximales del intestino delgado. Solo la enteroscopia de doble balón permite la evaluación de todo el intestino delgado; sin embargo este examen necesita anestesia general, puede durar más de dos horas y no está exento de complicaciones.
En un estudio realizado en pacientes con SOD el hallazgo de fuentes potencialmente posibles de sangrado fue significativamente mayor con la cápsula (66%, con un p < 0,05) que con la enteroscopia simple [19%]). Las lesiones más frecuentes fueron las angiodisplasias y las úlceras yeyunales (19).
En cuatro casos los resultados condicionaron un cambio de la actitud terapéutica; se intervino quirúrgicamente a un paciente con estenosis yeyunal y a dos con lesión ileal (19), y se confirmó el diagnóstico de enfermedad de Crohn en el primer caso y de tumor carcinoide en los dos restantes. Otro paciente con evidencia de angiodisplasia fue tratado eficazmente con argón plasma en el curso de la enteroscopía.
En pacientes con anemia ferropénica siempre debe buscarse sangre oculta en heces; si el examen es positivo, se debe proceder a las evaluaciones endoscópicas iniciales (endoscopia alta y colonoscopia completa), si éstos son negativos la entidad corresponde a un SDO, y el estudio se debe complementar con cápsula endoscópica y enteroscopía de doble balón.
Los tumores carcinoides del tracto gastrointestinal se localizan en intestino delgado 45%, recto 20%, apéndice 16%, colon 11% y estómago 7% (10). Los tumores carcinoides representan un tercio de las neoplasias del intestino delgado y se localizan principalmente en el ileon dentro de los 60 cms de la válvula ileocecal.
La distribución de los tumores carcinoides según la edad es amplia, va de la segunda a la novena década; el pico de mayor incidencia está entre los 50 a 70 años (11), diferente al de nuestra paciente de 82 años.
Dentro de las manifestaciones digestivas predominan el dolor abdominal y la obstrucción intestinal, frecuentemente con metástasis a nódulos linfáticos o hígado, aun si el tumor es pequeño (3,4). La obstrucción puede deberse a intususcepción o al efecto mecánico del tumor; el dolor abdominal aislado podría depender de isquemia mesentérica secundaria a fibrosis focal o angiopatía.
No es frecuente la presencia del síndrome carcinoide en los TC del intestino delgado y solo ocurre en aproximadamente 5 a 7% (5-7).
Los pacientes con carcinoide del intestino delgado deberían ser tratados con resección del segmento intestinal comprometido (incluyendo al mesenterio). La resección puede ser paliativa aún en aquellos con enfermedad metastásica.
El pronóstico depende del estadiaje de la enfermedad. La supervivencia a cinco años en pacientes con metástasis alcanza el 36% (8), de allí la importancia del diagnóstico temprano.
Los tumores carcinoides fueron llamados así debido a su diferente morfología y a que fueron clínicamente menos agresivos que los adenocarcinomas intestinales (12). Los tumores carcinoides crecen de las células enterocromafines del tracto gastrointestinal que contiene serotonina, son lesiones sub mucosas redondeadas bien circunscritas.
Los tumores carcinoides han sido tradicionalmente clasificados de acuerdo al origen embrionario del tracto alimentario (13). La clasificación incluye los TC derivados del intestino anterior (incluye pulmones, bronquios y estómago), del intestino medio (intestino delgado, apéndice y colon proximal) y del intestino posterior (colon distal, recto, y tracto genitourinario). Los diferentes tipos de tumores guardan correlación con su patrón morfológico, afinidad por la plata y su comportamiento clínico.
Un tercio de los TC derivados del intestino medio son sintomáticos (dolor abdominal como en el presente caso) y un décimo son asociados con el síndrome carcinoide. En comparación, los carcinoides derivados del intestino posterior son por lo general asintomáticos y raras veces causan el síndrome carcinoide, incluso cuando hacen metástasis.
Además de estas divisiones basadas en la embriología, los tumores carcinoides han sido clasificados basados en sus características histológicas como "típicas" o atípicas (anaplásicos). Los tumores típicos son bien diferenciados, conteniendo pequeñas células regulares con núcleo redondo. Cinco patrones histológicos distintos han sido reconocidos: insular, trabecular, glandular, indiferenciado y mixto (14).
Comparado a los tumores típicos, los carcinoides atípicos tienen atipia nuclear incrementada, mayor actividad mitótica y contiene áreas de necrosis. A pesar de estas distinciones histológicas, el comportamiento biológico de los tumores carcinoides no siempre corresponde a su característica histológica.
La distinción entre carcinoide benigno y maligno está basada sobre la presencia o la ausencia de metástasis más que por la histología sola, porque existen tumores malignos que pueden mostrar poco o ningún pleomorfismo celular, hipercromasia o actividad mitótica.
El potencial metastásico de los carcinoides se correlaciona mejor con el tamaño y el sitio del tumor primario. Los altos porcentajes de enfermedad metastásica al diagnóstico fueron de carcinoides del intestino delgado y colon; los carcinoides de origen rectal, broncopulmonar o gástrico fueron más localizados (15).
Los tumores neuroendocrinos de yeyuno e ileon benignos son tumores diferenciados, pequeños (≤1cm), que ocupan la mucosa-submucosa sin angioinvasión y son no funcionantes. Los benignos de bajo grado de malignidad son no funcionantes, bien diferenciados, de tamaño intermedio (>1-2cm), sin angioinvasión o extensión más allá de la submucosa.
El maligno de bajo grado es no funcionante, bien diferenciado, grande (>2cm) y se extiende más allá de la submucosa o es angioinvasivo. El maligno funcionante es bien diferenciado, de cualquier tamaño o extensión; el maligno con alto grado de malignidad -funcionante o no funcionante-generalmente corresponde a un carcinoma de células pequeñas o intermedias pobremente diferenciado (16, 17).
En el presente caso el patrón histológico del TC fue insular, ubicado en submucosa con infiltración focal de mucosa y muscular propia; los bordes quirúrgicos no estuvieron comprometidos. El estudio de inmunohistoquímica mostró en las células tumorales citoqueratina, cromogranina y sinaptofisina positivos; S-100 negativo y Ki67 positivo en menos del 1% de células tumorales.
Los hallazgos antes mencionados lo ubican como un tumor carcinoide típico, maligno de bajo grado; a pesar de su bajo índice de replicación celular se le cataloga como maligno por su grado de invasión.
Actualmente (un año después de la intervención quirúrgica) la paciente permanece en control por consultorio externo y no se ha detectado ninguna evidencia de recurrencia de enfermedad.
REFERENCIAS
1. LAUFFER JM, ZHANG T, MODLIN IM. Review article: current status of gastrointestinal carcinoids. Aliment Pharmacol Ther 1999; 13:271–87.
2. NORTON JA. Surgical treatment of gastrointestinal endocrine tumors. In: Mignon M, Colombel JF, editors. Recent advances in the pathophysiology and management of inflammatory bowel diseases and digestive endocrine tumors. Paris: John Libbey Eurotext Publishing; 1999. p.248–59.
3. BARCLAY TH, SCHAPIRA DV. Malignant tumors of the small intestine. Cancer 1983; 51:878-879.
4. MODLIN IM, CHAMPANERIA MC, CHAN AK, KIDD M. A three-decade analysis of 3,911 small intestinal neuroendocrine tumors: the rapid pace of no progress. Am J Gastroenterol 2007; 102:1464-1466.
5. BURKE AP, THOMAS RM, ELSAYED AM, SOBIN LH. Carcinoids of the jejunum and ileum: An immunohistochemical and clinicopathologic study of 167 cases. Cancer 1997; 79:1086-1889.
6. ECKHAUSER FE, ARGENTA LC, STRODEL WE, et al. Mesenteric angiopathy, intestinal gangrene, and midgut carcinoids. Surgery 1981; 90:720-723.
7. MOERTEL CG, SAUER WG, DOCKERTY MB, BAGGENSTOSS, AH. Life history of the carcinoid tumor of the small intestine. Cancer 1961; 14:901-904.
8. MODLIN IM, SANDOR A. An analysis of 8305 cases of carcinoid tumors. Cancer 1997; 79:813-815.
9. SAPERAS E., Hemorragia digestiva baja: esa gran desconocida, Gastroenterology Hepatology 2007; 30(2):93-100
10. HEMMINKI K, LI X. Incidence trends and risk factors of carcinoid tumors. Cancer 2001; 92:2204-2206.
11. MODLIN IM, LYE KD, KIDD M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97:934-935
12. CAPLIN ME, BUSCOMBE JR, HILSON AJ, et al. Carcinoid tumour. Lancet 1998; 352:799-801.
13. WILLIAMS ED, SANDLER M. The classification of carcinoid tum ours. Lancet 1963; 1:238-239.
14. SOGA J, TAZAWA K. Pathologic analysis of carcinoids. Histologic reevaluation of 62 cases. Cancer 1971; 28:990-992.
15. MODLIN IM, LYE KD, KIDD M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97:934-937.
16. CAPELLA C, HEITZ PU, HOFLER H, et al. Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Arch 1995;425:547–60.
17. SOLCIA E, KLOPPEL G, SOBIN LH.
Histological typing of neuroendocrine tumors. New York: Springer; 2000.18. TRIESTER SL, LEIGHTON JA, LEONTIADIS GI, FLEISCHER DE, HARA AK, HEIGH RI, et al. A metaanalysis of the yield of capsule endoscopy compared to other diagnostic modalities in patients with obscure gastrointestinal bleeding. Am J Gastroenterol. 2005; 100:2407-2409.
19. MATA A, LLACH J. Papel de la cápsula endoscópica en los pacientes con hemorragia digestiva de origen indeterminado. Gastroenterol Hepatol 2003; 26(10):619-623
María Nelly Manrique Lemus
Calle 54 N° 173 Dpto. 302 Córpac – San Isidro
E-mail: marianelly20@yahoo.es













