Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.2 Lima abr./jun. 2011
ARTÍCULO ORIGINAL
Pepsinógeno y gastrina en el diagnóstico no invasivo de la atrofia gástrica. Un estudio caso-control en población peruana
Pepsinogen and gastrin in the noninvasive diagnosis of gastric atrophy. A case-control study in peruvian population
Ana Colarossi1 ; Rocío Inga1 ; Ricardo Prochazka2,3 ; Ursula Reyes1 ; Alejandro Bussalleu2,3 ; Raúl León Barúa2
1 Universidad Peruana Cayetano Heredia, Facultad de Ciencias y Filosofía Alberto Cazorla Talleri.
2 Universidad Peruana Cayetano Heredia, Facultad de Medicina Alberto Hurtado.
3 Hospital Nacional Cayetano Heredia, Servicio de Gastroenterología.
RESUMEN
INTRODUCCIÓN: La detección de atrofia gástrica podría ser utilizada en el diagnóstico precoz de cáncer gástrico en Perú. Se evaluó la determinación de niveles séricos de pepsinógenos I y II (PGI, PGII), gastrina-17 (G17), y la relación PGI/PGII como posible prueba de diagnóstico no invasivo de atrofia en pacientes peruanos.
MATERIAL Y MÉTODOS: Se estudiaron adultos con dispepsia sometidos a endoscopía con biopsia gástrica, considerando dos controles sin atrofia por cada caso con atrofia. Se evaluaron las diferencias y se confeccionaron curvas ROC, así como el perfil serológico combinando PGI y PGI/PGII. Se calculó su sensibilidad y especificidad.
RESULTADOS: Se analizaron 22 casos y 44 controles. El área bajo la curva ROC fue 0.599, 0.546 y 0.534 para PGI, PGII, y PGI/PGII respectivamente. Ninguna prueba discriminó entre casos y controles. El perfil serológico no alcanzó sensibilidad y especificidad adecuadas.
DISCUSIÓN: Este primer estudio de pepsinógeno, gastrina y atrofia en Perú, no mostró utilidad de estos métodos. El impacto potencial en la detección y prevención de una neoplasia prevalente justifica mayor investigación. Incluir más pacientes, excluir a los tratados previamente contra Helicobacter pylori, y procesar separadamente las biopsias de antro y cuerpo, podrían revelar asociaciones no vistas en este estudio.
PALABRAS CLAVE: pepsinógeno, gastrina, atrofia gástrica, cáncer gástrico.
ABSTRACT
INTRODUCTION: Detection of gastric atrophy could be used for early diagnosis of gastric cancer in Perú. It was determined the pepsinogens I and II (PGI, PGII) and Gastrin-17 (G17) serum levels, and the PGI/PGII ratio as a non-invasive diagnostic test for gastric atrophy in Peruvian patiens.
METHODS: Dyspeptic adults undergoing endoscopy and gastric biopsies were studied. For each case with atrophy two controls without atrophy were selected. Differences were evaluated and ROC curves constructed. A serologic profile was produced combining PGI and PGI/PGII ratio. Sensitivity and specificity were calculated.
RESULTS: 22 cases and 44 controls were included. Areas under ROC curves were 0.599, 0.546 and 0.534 for PGI, PGII and PGI/PGII ratio, respectively. None of these allowed for discrimination between cases and controls. The serological profile did not reach appropriate sensitivity and specificity.
DISCUSSION: This first study of pepsinogen, gastrin and atrophy in Peru showed none of these tests to be useful. Their potential impact in early detection and prevention of prevalent cancer justify further investigation. Recruiting more patients, excluding those previously treated for Helicobacter pylori, and processing independently the antrum and corpus biopsies, could reveal findings not seen in present study.
KEY WORDS: pepsinogen, gastrin, gastric atrophy, gastric cancer.
INTRODUCCIÓN
La atrofia de la mucosa gástrica se define como la pérdida del tejido glandular "apropiado", es decir, pérdida de glándulas oxínticas en la mucosa oxíntica o de glándulas mucosas en la mucosa pilórica (1,2,3). Esto puede ser resultado de un proceso inflamatorio prolongado con destrucción progresiva de las glándulas (4). El espacio que queda luego de la destrucción glandular puede ser ocupado por tejido fibroso o por glándulas "inapropiadas". Esto último constituye la metaplasia, que morfológicamente se clasifica en metaplasia intestinal completa y metaplasia intestinal incompleta. La infección por Helicobacter pylori (HP) es el fenómeno subyacente a la inflamación crónica, atrofia y metaplasia. La infección por HP, la gastritis atrófica, y la metaplasia intestinal son reconocidos factores predisponentes al desarrollo de cáncer gástrico (5,6).
A pesar del avance tecnológico para el diagnóstico de cáncer gástrico, éste continúa siendo una de las principales neoplasias en el mundo. En el Perú, según el Registro de Cáncer de Lima Metropolitana, la incidencia de cáncer gástrico ha aumentado de 16.3 a 20.6 por 100000 habitantes al año entre 1990 y 1997, constituyendo el segundo cáncer más frecuente en varones y el tercero en mujeres. La mortalidad anual por cáncer gástrico aumentó de 11.5 a 16.5 por 100000 en el mismo período, siendo la primera causa de muerte por cáncer en ambos sexos (7). La supervivencia de los pacientes con cáncer gástrico a nivel mundial es inferior a 20% a 5 años (8,9). En el Instituto Nacional de Enfermedades Neoplásicas la sobrevida global de los pacientes con cáncer gástrico es del 12% (10). En un país como el Perú es deseable contar con un método de despistaje poblacional que permita detectar a los grupos con riesgo aumentado de desarrollar cáncer gástrico para focalizar en ellos estrategias de vigilancia y lograr la detección precoz y la terapia oportuna de esta neoplasia. Este método, lamentablemente, aún no existe. En este sentido, la detección de personas con gastritis atrófica parece ser un objetivo razonable de un eventual método de despistaje poblacional.
Actualmente el método estándar por el que se detecta la gastritis atrófica es la biopsia gástrica tomada durante endoscopía digestiva alta. Sin embargo, la endoscopía es un procedimiento invasivo que produce incomodidad en el paciente, con un riesgo pequeño pero no despreciable de complicaciones, y un costo significativo que lo hace poco aplicable como método de despistaje poblacional. Es deseable disponer de métodos no invasivos, de menor costo, y con menos riesgo de complicaciones para seleccionar pacientes con mayor posibilidad de tener atrofia y restringir a este grupo el uso de la endoscopía. Estudios realizados en varios lugares del mundo han sugerido la posibilidad de usar la medición de gastrina-17, pepsinógeno I, y la proporción de pepsinógeno I/pepsinógeno II en suero, tanto para la detección de atrofia gástrica como para predecir el riesgo de cáncer gástrico (5,6,11,12,13,14,15,16,17,18). El presente estudio busca evaluar en una población peruana la relación entre los niveles de pepsinógeno I (PGI), pepsinógeno II (PGII), gastrina-17 (G17), y la relación PGI/PGII medidos en suero y la presencia de atrofia de la mucosa gástrica.
MATERIAL Y MÉTODOS
A partir de marzo de 2007 a todos los pacientes mayores de 18 años con síntomas de dispepsia sometidos a endoscopía en el servicio de gastroenterología del Hospital Nacional Cayetano Heredia se les invitó a participar en el estudio. Aquellos que aceptaron firmaron un formato de consentimiento informado. Se aceptó a los pacientes que no tomaban inhibidores de bomba de protones y antagonistas H2 histamina los 30 días previos.
Los pacientes fueron citados para endoscopía de acuerdo a la práctica habitual del servicio. El día de la cita, antes de efectuar el procedimiento, se realizó una entrevista en la que se registró la edad, sexo, procedencia, antecedente familiar o personal de úlcera péptica o cáncer gastrointestinal, y la sintomatología, y se tomó una muestra de sangre para determinación de pepsinógeno I, pepsinógeno II, y gastrina-17, que se mantuvo congelada a -80°C hasta su procesamiento. Luego se realizó la endoscopía con una revisión cuidadosa del esófago, estómago, y duodeno. Los pacientes con lesiones sospechosas de cáncer gástrico avanzado fueron excluidos del estudio y tanto la endoscopía como el manejo posterior continuaron según el criterio de su médico tratante. Se tomaron biopsias de la mucosa gástrica (2 de antro y 2 de cuerpo). Además se tomaron muestras de cualquier anormalidad de la mucosa según la decisión del endoscopista.
Las biopsias fueron vistas por patólogos experimentados ciegos a las características clínicas y los hallazgos endoscópicos de cada paciente. Se registró la presencia de inflamación crónica, actividad, atrofia, metaplasia intestinal, displasia, y la presencia de Helicobacter pylori.
Todos los casos con atrofia de mucosa fueron incluidos en el análisis. Para cada caso se eligió, entre los pacientes que aceptaron participar, dos controles sin atrofia, del mismo sexo, y cuya edad no difería en más de 5 años. Se procesaron las muestras refrigeradas de suero de los pacientes con atrofia y los controles sin atrofia para conocer los niveles de pepsinógeno I, pepsinógeno II, y gastrina-17. Se establecieron los niveles promedio de los pepsinógenos I y II, y gastrina-17 en pacientes con atrofia y sin atrofia. Se confeccionaron curvas ROC (Receiver Operating Characteristic) para estimar la utilidad de las pruebas serológicas en el diagnóstico de la atrofia gástrica. Estas curvas permiten evaluar la sensibilidad de la prueba en función de los falsos positivos como valor complementario a la especificidad Se elaboró un perfil serológico "atrófico" basado en los valores combinados del pepsinógeno I y la proporción de los pepsinógenos I y II y se calculó su sensibilidad y especificidad para el diagnóstico de atrofia gástrica, probando diferentes variantes en la definición del perfil atrófico.
RESULTADOS
74 pacientes aceptaron participar en el estudio. En todos los casos se obtuvieron valores séricos de pepsinógeno I y pepsinógeno II. En 70 pacientes se obtuvo el valor sérico de gastrina. El resultado de las biopsias de mucosa estuvo disponible en 66 pacientes. Estos 66 pacientes fueron incluidos en Gráfica 2 el análisis. De ellos 22 eran pacientes con atrofia y 44 eran controles sin atrofia.
Los valores promedio de los marcadores serológicos y su desviación estándar se muestran en la siguiente tabla:
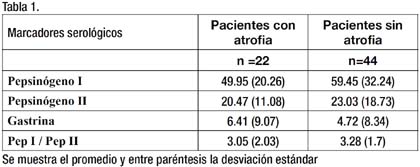
En los 22 pacientes con atrofia de mucosa el promedio del pepsinógeno I fue 49.95 con una desviación estándar de 20.26 y un rango de 3.7 a 83, mientras que en los 44 pacientes sin atrofia el promedio fue 59.45 con una desviación estándar de 32.24 y un rango de 6.3 a 155. Se elaboró la curva ROC de pepsinógeno I para la determinación de atrofia. El área bajo la curva fue 0.599, con un intervalo de confianza de 0.350 a 0.76. Concluimos que el pepsinógeno I no es útil para discriminar entre los pacientes con atrofia y sin atrofia.
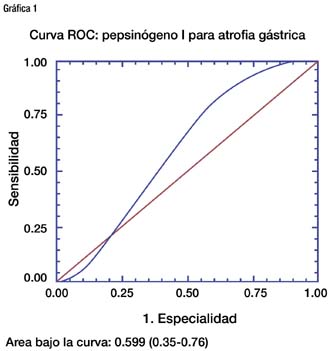
El valor de pepsinógeno II en los pacientes con atrofia el promedio fue 20.47 con desviación estándar de 11.08 y rango de 3.5 a 50, y en los pacientes sin atrofia fue 23.03 con desviación estándar 18.73 y rango de 5 a 82.7. La curva ROC de pepsinógeno II para el diagnóstico de atrofia mostró un área bajo la curva de 0.546, con un intervalo de confianza de 0.288 a 0.731. Igual que el pepsinógeno I, el pepsinógeno II no es útil para discriminar entre pacientes con atrofia y sin ella.
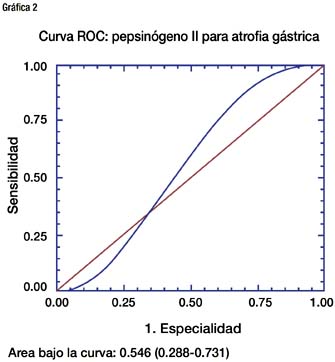
La proporción pepsinógeno I / pepsinógeno II en los pacientes con atrofia fue en promedio 3.05 con desviación estándar 2.03 y rango de 0.42 a 10.3. En los pacientes sin atrofia la proporción fue en promedio 3.28 con desviación estándar 1.7 y rango de 0.36 a 8.46. La curva ROC mostró un área bajo la curva de 0.534, con intervalo de confianza de 0.398 a 0.646. Esto tampoco resulta útil para reconocer a los pacientes con atrofia.
De los 66 pacientes incluidos, 61 tenían valores de gastrina.. En los pacientes con atrofia el promedio fue 6.41 con desviación estándar 9.07 y rango de 0 a 35.22, y en los pacientes sin atrofia el promedio era 4.72 con desviación estándar 8.34 y rango de 0 a 35.99. El valor sérico de gastrina tampoco resulta útil para diferenciar a los pacientes con y sin atrofia.
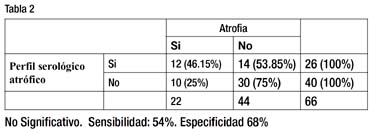
Con la intención de obtener una mejor sensibilidad y especificidad, combinamos las pruebas serológicas. Definimos un perfil serológico "atrófico" con las siguientes características: pepsinógeno I menor o igual que 70 y relación pepsinógeno I / pepsinógeno II menor o igual que 3. Los pacientes que no cumplían estos dos criterios fueron considerados portadores de un perfil serológico "no atrófico".
26 pacientes tenían perfil serológico atrófico, de ellos, en el estudio histológico, 12 (46.15%) tenían atrofia y 14 (53.85%) no tenían atrofia de la mucosa. En contraste, entre los 40 pacientes con perfil serológico no atrófico, 10 (25%) tenían atrofia y 30 (75%) no tenían atrofia en la mucosa. La diferencia no alcanzó significación estadística. La sensibilidad y especificidad del perfil serológico atrófico son 54% y 68%, respectivamente.
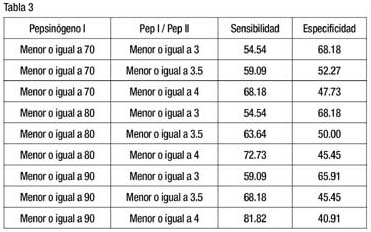
Se hizo el mismo análisis utilizando diferentes valores de corte para definir el perfil serológico atrófico, y se obtuvieron varios niveles de sensibilidad y especificidad, que se muestran en la siguiente tabla:
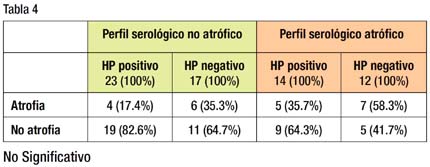
Usando la definición inicial del perfil serológico atrófico: pepsinógeno I menor o igual a 70 y proporción de pepsinógeno I a pepsinógeno II menor o igual a 3, se analizó la relación entre el perfil serológico, la presencia de Helicobacter pylori y la presencia de atrofia de la mucosa. De los 40 pacientes con perfil serológico no atrófico 23 eran HP positivo y 17 eran HP negativo. Entre los 23 pacientes HP positivo 4 (17.4%) tenían atrofia y 19 (82.6%) no tenían atrofia. Entre los 17 pacientes HP negativo 6 (35.3%) tenían atrofia y 11 (64.7%) no tenían atrofia.
De los 26 pacientes con perfil serológico atrófico 14 eran HP positivo y 12 HP negativo. Entre los 14 pacientes HP positivo 5 (35.7%) tenían atrofia y 9 (64.3%) no tenían atrofia. Entre los 12 pacientes HP negativo 7 (58.3) tenían atrofia y 5 (41.7%) no la tenían. Estas cifras muestran una tendencia a mayor frecuencia de atrofia entre los pacientes con perfil atrófico y HP negativo, sin alcanzar significación estadística.
DISCUSIÓN
El riesgo de cáncer es mínimo en individuos con mucosa normal y aumenta progresivamente con la progresión de la atrofia, llegando a ser máximo en las personas con la atrofia más severa que se asocia a la pérdida espontánea de la infección por HP (11). El riesgo podría estar elevado hasta 90 veces en individuos con atrofia que compromete todo el estómago (19). La detección de atrofia gástrica mediante métodos no invasivos es deseable para focalizar en la población con gastritis atrófica los esfuerzos de detección precoz de cáncer gástrico. Estudios realizados en varios países han mostrado la utilidad del dosaje de gastrina y pepsinógeno I y II para este fin.
Los pepsinógenos son enzimas proteolíticas secretadas por células de la mucosa gástrica. El PGI es producido exclusivamente por las glándulas del cuerpo y fondo gástrico, mientras que el PGII es producido por todos los tipos de glándulas gástricas y duodenales. El daño de la mucosa corporal produce un descenso progresivo en el nivel sérico de PGI y en la proporción PGI/PGII. La G17 se produce en el antro y es un marcador de la función de las células G (20).
La sensibilidad de los marcadores serológicos para el diagnóstico de atrofia gástrica ha sido variable, con valores reportados muy diversos, usualmente entre 65 y 90% pero, en algunos estudios, tan bajos como 30, asimismo, la especificidad reportada varía entre 52% y 100% (6,14,15,16,17,18). Algunos estudios han evaluado la relación entre los marcadores serológicos y cáncer de estómago. La sensibilidad y especificidad del perfil serológico atrófico para cáncer gástrico se han reportado en 84.6% y 73.5%, con valor predictivo positivo de 2.88% y negativo de 99.6% (21). Debido a su heterogeneidad, y a potenciales diferencias étnicas, ambientales, y relacionadas a la dieta y enfermedades prevalentes, el uso del pepsinógeno y la gastrina para el despistaje de atrofia gástrica requiere validación local (16).
Este es el primer trabajo realizado en población peruana que estudia la asociación entre estos marcadores serológicos y la atrofia gástrica, con el propósito de utilizarlos en el diagnóstico no invasivo de atrofia, como un factor predisponente a cáncer gástrico.
En nuestro trabajo no encontramos asociación significativa entre los valores de los marcadores serológicos analizados y la presencia de atrofia gástrica. En las curvas ROC, el área bajo la curva fue pobre, y, a diferencia de lo que esperábamos, no se demuestra utilidad de PGI, PGII, PGI/PGII, y G17 para el diagnóstico de la gastritis atrófica en el Perú. Estudios realizados en otros países han combinado el valor de pepsinógeno I y la proporción de pepsinógenos I y II para definir un perfil serológico que tiene buena sensibilidad y especificidad para la detección de atrofia gástrica. Utilizamos este método poniendo a prueba varias definiciones del perfil atrófico y, aunque los valores de sensibilidad y especificidad hallados son consistentes con los reportados en la literatura, no encontramos un perfil serológico con una combinación de sensibilidad y especificidad que parezca adecuada para su uso en el despistaje poblacional de atrofia de la mucosa gástrica.
Aunque los resultados de este primer estudio de pepsinógeno, gastrina, y atrofia en el Perú no han mostrado utilidad de estos métodos de diagnóstico no invasivo, creemos que existe espacio para mayor investigación sobre este tema en nuestra población. En eventuales nuevos estudios se podrían considerar otras condiciones. Reclutar un mayor número de pacientes daría mayor oportunidad de demostrar relaciones importantes entre la atrofia y los marcadores serológicos. La exclusión de los pacientes tratados previamente contra Helicobacter pylori podría reducir la heterogeneidad en los valores de pepsinógeno y gastrina. En algunos estudios se ha visto que la presencia de Helicobacter se asocia a niveles altos de PGI y PGII, y la erradicación disminuye estos niveles (6,12,15). Por lo tanto, la inclusión de pacientes previamente tratados contra Helicobacter podría introducir una distorsión, haciendo difícil demostrar la relación entre la atrofia y los marcadores serológicos. Finalmente, procesar separadamente las muestras del antro y del cuerpo podría demostrar asociaciones no reveladas en el estudio actual. Varios de los estudios realizados en otras áreas del mundo han mostrado asociación entre los marcadores serológicos y la presencia de atrofia corporal (6,13,14,15,16). En nuestro estudio el análisis separado no fue posible por limitaciones de presupuesto.
Considerando el impacto que se podría lograr en la detección precoz y prevención de una neoplasia prevalente en nuestro país, que es causa importante de mortalidad, creemos que se justifica plenamente agotar el espacio existente en nuestro medio para la investigación sobre diagnóstico no invasivo de la atrofia gástrica.
AGRADECIMIENTOS:
Al Dr. Francisco Tejada, al Dr. Jorge Huerta Mercado, a la Lic. Enf. Elizabeth Refulio, y a la Tec. Enf. Gladys Caviedes por el decidido apoyo a la realización de este trabajo.
REFERENCIAS
1. GENTA RM, RUGGE M. Gastric precancerous lesions: heading for an international consensus. Gut 1999;45;5-8.
2. RUGGE M, GENTA RM. Staging and grading of chronic gastritis.Human Pathology2005; 36: 228–233.
3. RUGGE M, CORREA P, DIXON F, FIOCCA R, HATTORI T, LECHAGO J, LEANDRO G, PRICE AB, SIPPONEN P, SOLCIA E, WATANABE H, GENTA RM. Gastric mucosal atrophy: interobserver consistency using new criteria for classification and grading. Aliment Pharmacol Ther 2002; 16: 1249–1259.
4. DIXON MF, GENTA R, YARDLEY J, CORREA P. Classification and Grading of Gastritis: The Updated Sydney System. Lippincott-Raven Publishers 1996; 20(10): 1161-1181.
5. KARITA M, NORIYASU A, TERAMUKAI S, AND MATSUMOTO S. Atrophic Progression Induced by H. pylori Infection Is Correlated with a Changing Pepsinogen I Value and Associated with the Development of Gastric Cancer. Digestive Diseases and Sciences 2004: 49:1615–1620.
6. ROLLAN A, FERRECCIO C, GEDERLINI A, SERRANO C, TORRES J, HARRIS P. Non-invasive diagnosis of gastric mucosal atrophy in an asymptomatic population with high prevalence of gastric cancer. World J Gastroenterol 2006; 12(44): 7172-7178.
7. PILCO P, PAYET E, CÁCERES E. Cáncer Gástrico en Lima Metropolitana. Rev. Gastroenterol Peru 2006; 26: 377-85.
8. RUGGE M, CORREA P, DIXON MF, HATTORI T, LEANDRO G, LEWIN K, RIDDELL RH, SIPPONEN P, WATANABE H. Gastric Dysplasia. The Padova International Classification. Am J Surg Pathol 2000; 24(2): 167–176.
9. PARKIN DM, BRAY F, FERLAY J, AND PISANI P. Global Cancer Statistics, 2002. CA Cancer J Clin 2005;55(2): 74-108.
10. PAYET E. Cáncer Gástrico Precoz. Tesis de Magíster en Medicina. Universidad Peruana Cayetano Heredia.2004.
11. WATABE H, MITSUSHIMA T, YAMAJI Y, OKAMOTO M, WADA R, KOKUBO T, DOI H, YOSHIDA H, KAW ABE T AND OMATA M. Predicting the development of gastric cancer from combining Helicobacter pylori antibodies and serum pepsinogen status: a prospective endoscopic cohort study. Gut 2005;54:764-768.
12. KARITA M, NORIYASU A, KOSAKO E, TERAMUKAI S, AND MATSUMOTO S. Relationship Between Pepsinogen I&II and H. pylori Infection Considered with Grade of Atrophy and Gastroduodenal Diseases. Digestive Diseases and Sciences 2003; 48(9): 1839– 1845.
13. KORSTANJE A, DEN HARTOG G, BIEMOND I AND LAMERS CBHW. The Serological Gastric Biopsy: a Non-Endoscopical Diagnostic Approach in Management of the Dyspeptic Patient. Significance for Primary Care Based on a Survey of the Literature. Scand J Gastroenterol 2002; 37 Suppl 236: 22-26.
14. GRAHAM DY, NURGALIEVA ZZ, EL-ZIMAITY HMT, OPENKUN AR, CAMPOS A, GUERRERO L, CHAVEZ A, AND CARDENAS V. Noninvasive Versus Histologic Detection of Gastric Atrophy in a Hispanic Population in North America. Clin Gastroenterol Hepatol 2006;4:306-314.
15. GERMANÁ B, DI MARIO F, CAVALLARO LG, MOUSSAB AM, LECIS P, LIATOUPOLOU S, COMPARATO G, CARLONI C, BERTIATO G, BATTIESTEL M, PAPAC N, ARAGONA G, CAVESTRO GM, IORI V, MERLI R, BERTOLINI S, CARUANA P, FRANZÉ A. Clinical usefulness of serum pepsinogens I and II, gastrin-17 and anti-Helicobacter pylori antibodies in the management of dyspeptic patients in primary care. Digestive and Liver Disease 2005; 37: 501–508.
16. WU KC, LI HT, QIAO TD, LI CN, JI WS, TIAN FQ, WANG X, WANG BL, MIAO JY, DING J AND FAN DM. Diagnosis of atrophic body gastritis in Chinese patients by measuring serum pepsinogen. Chinese Journal of Digestive Diseases 2004; 5; 22–27.
17. PASECHNIKOV VD, CHUKOV SZ, KOTELEVETS SM, MOSTOVOV AN, MERNOVA VP, AND POLYAKOVA MB. Possibility of non-invasive diagnosis of gastric mucosal precancerous changes. World J Gastroenterol 2004;10(21):3146-3150.
18. NARDONE G, ROCCO A, STAIBANO S, MEZZA E, AUTIERO G, COMPARE D, DE ROSA D AND BUDILLON G. Diagnostic accuracy of the serum profile of gastric mucosa in relation to histological and morphometric diagnosis of atrophy. Aliment Pharmacol Ther 2005; 22: 1139–1146.
19. SIPPONEN P, KEKKI M, HAAPAKOSKI J, IHAMAKI T, SIURALA M. Gastric cancer risk in chronic atrophic gastritis: statistical calculations of cross-sectional data. Int J Cancer 1985; 35: 173-177.
20. GENTA RM, RUGGE M. Assessing risks for gastric cancer: New tools for pathologists. World J Gastroenterol 2006 September 21; 12(35): 5622-5627.
21. KITAHARA F, KOBAYASHI K, SATO T, KOJIMA Y, ARAKI T, FUJINO MA. Accuracy of screening for gastric cancer using serum pepsinogen concentrations. Gut 1999;44:693–697.













