Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.2 Lima abr./jun. 2011
ARTÍCULO ORIGINAL
Gastritis crónica atrófica: concordancia endoscópica, histológica, lesiones asociadas y aplicación de la cromoendoscopia virtual
Chronic atrophic gastritis: endoscopic and histological concordances, associated injuries and application of virtual chromoendoscopy
* Humberto Liu Bejarano
* Gastroenterólogo Medico Asistente - INEN
RESUMEN
INTRODUCCIÓN: Debido a la pobre concordancia entre la endoscopía y la histología, la biopsia gástrica sigue siendo el patrón de oro para el diagnóstico de gastritis crónica. La atrofia es el marcador actual de progresión de gastritis crónica. El sistema de cromoendoscopía virtual, permite una mejor observación de la mucosa gástrica.
OBJETIVO: Evaluar la concordancia entre el sistema de clasificación endoscópica de Kimura-Takemoto y el sistema histológico OLGA (Operative Link for Gastritis Assessment), así como evaluar la aplicación de la cromoendoscopia virtual.
METODOLOGÍA: Se realizó un estudio prospectivo y longitudinal de cohorte, en 138 pacientes, usando el sistema endoscópico de Kimura y Takemoto (K-T) con y sin el uso de cromoendoscopia virtual, comparándolas con los hallazgos histológicos del sistema OLGA. Además se determinó las lesiones gástricas asociadas según estadio de atrofia histológica. RESULTADOS: La concordancia entre la endoscopia convencional y el sistema OLGA fue de 0.859 y con el sistema de la cromoendoscopia virtual fue de 0.822.Las lesiones preneoplásicas y neoplásicas estuvieron asociadas a estadios III y IV de OLGA
CONCLUSIONES: La correlación endoscópica e histológica de los dos sistemas, es muy buena, con o sin el uso de cromoendoscopía virtual.
PALABRAS CLAVE: gastritis crónica atrófica, cromoendoscopia virtual, sistema olga, sistema kimura – takemoto.
ABSTRACT
INTRODUCTION: Due to the poor agreement between endoscopy and histology, the gastric biopsy continues being the gold standard for the diagnosis of atrophic chronic gastritis. The Virtual chromoendoscopy system allows better observation of the gastric mucosa
OBJECTIVE: Evaluate the agreement between the Kimura-Takemoto ´s endoscopic system classification and the histological system of OLGA (Operative for Link Assessment Gastritis), as well as to evaluate the application of the virtual chromoendoscopy
METHODOLOGY: A prospective and longitudinal study of cohorts, 138 patients was include, using endoscopic system of atrophy by Kimura and Takemoto (K-T), with conventional optical and with the use of seventh filter of virtual chromoendoscopy ,then comparing with the histological findings of the OLGA pathology system, also were determinated injuries associated with respect to stage OLGA
RESULTS: The kappa index of agreement between conventional endoscopy and the system OLGA was 0.859 and with the system of virtual chromoendoscopy was 0.822, the preneoplasic and neoplastic gastric lesions were associate to stages III and IV of atrophy
CONCLUSIONS: The endoscopic and histological correlation with both systems isvery good, with or without the use of virtual chromoendoscopy.
KEYWORDS: chronic atrophic gastritis, virtual chromoendoscopy, olga system, kimuratakemoto system.
INTRODUCCIÓN
La correlación reportada en diversos estudios entre hallazgos endoscópicos e histológicos en pacientes con gastritiscrónica, es decepcionante, con resultados variables que informan desde una pobre capacidad de predicción para diagnosticar gastritis crónica (definida por estudio histológico) hasta una correlación aceptable (sensibilidad 75%, especificidad 71%) (1-3), aún usando el último consenso endoscópico e histológico, mostrado en Sydney (4-8).
La propuesta de un grupo internacional de gastroenterólogos y patólogos que, en 1994 (4), dividieron las gastritis crónicas en atróficas y no atróficas; fue seguida en el 2002, por un grupo liderado por Rugue y Correa quienes definieron a la atrofia gástrica como la pérdida de glándulas apropiadas de la mucosa gástrica , asumieron bajo este nuevo concepto la atrofia sin metaplasia y la atrofia con metaplasia(9,10).Posteriormente, un grupo internacional de patólogos, liderados por Rugue, basados en todos estos avances previos, formularon un nuevo sistema histológico de estadiaje, al cual denominaron OLGA, en donde se enfatiza a la atrofia gástrica, como la lesión histológica representativa de progresión de la gástritis crónica (11-14). Este sistema puede conferir una evaluación inmediata de la gravedad de la enfermedad crónica, en particular respecto al riesgo de cáncer.
En forma similar a la clasificación patológica, no existe un estándar definido para una clasificación endoscópica de gastritis, siendo muy variadas (2,4,7,8),Sin embargo, desde 1969,en Japón se ha usado una clasificación basada en la progresión del borde de atrofia gástrica, reportada por Kimura y Takemoto (EAB)(15-17) , la cual se basa en la transición entre gastritis atrófica y gastritis no atrófica. Este ha demostrado constituir el mejor índice de correlación endoscópica – histológica para atrofia gástrica, como se demostró en un estudio previo, al compararlos con una escala modificada del sistema histológico propuesto en la clasificación de Sydney, con un índice Kappa de 0.44-0.59,obteniéndose una concordancia aceptable (3).
La cromoendoscopia virtual, permite imágenes más claras sin el uso de tintes, como el sistema FICE ( Fuji Intelligent Chromo Endoscopy) desarrollado en 2005. Este sistema es útil para el diagnóstico de diversas enfermedades del tracto gastrointestinal(18-20), y ha sido usado en la determinación de atrofia gástrica con y sin metaplasia, con buenos resultados(21-24).
Basados en estas premisas, se evaluó la concordancia entre el sistema de clasificación endoscópica de Kimura- Takemoto y el sistema de clasifi cación anátomo-patológica OLGA,además de estudiar la utilidad de la cromoendoscopia en el diagnóstico de atrofia gástrica y determinar la incidencia de lesiones gástricas asociadas, según el estadio de gastritis atrófica histológica.
MATERIAL Y MÉTODOS
El presente trabajo de investigación constituyó un estudio longitudinal, prospectivo, de observación.
Población y muestra
La población estuvo constituida por los pacientes con síntomas de dispepsia y sospecha de gastritis,que acudieron a realizarse una gastroscopia en el centro de endoscopia digestiva del hospital Arzobispo Loayza durante el periodo Marzo – Mayo del año 2010. Para el cálculo del tamaño muestral, se usó la fórmula propuesta por Cicchetti , (2k²) , siendo K el número de categorías (25), En el presente estudio se incluyó 138 pacientes , los cuales fueron tomados de forma aleatoria y que cumplieron los criterios de inclusión y exclusión.
Criterios de inclusión
Pacientes adultos con sintomatología dispéptica, cumplir los requisitos generales para la realización de la exploración endoscópica del tramo digestivo superior, es decir: colaboración del paciente y ausencia de trastornos importantes de la conciencia, ausencia de trastornos de la coagulación, que hicieran peligrosa la toma de biopsia, firma del consentimiento informado.
Criterios de exclusión
Intervención quirúrgica previa del tracto digestivo superior, procedimiento endoscópico gástrico incompleto o toma inadecuada de muestras de biopsia , haber recibido tratamiento con inhibidores de la bomba de protones, antibióticos o derivados del bismuto, en los 30 días previos a la exploración, al momento del estudio recibieran corticoides, inmunosupresores, quimioterapia, radioterapia,pacientes con várices esofágicas y/o gástricas, pacientes con hemorragia aguda o reciente,pacientes en mal estado general.
Endoscopia y biopsia
Previo consentimiento informado y ayuno de por lo menos 6 horas , el estudio endoscópico fue realizado por médicos del Servicio. Luego de la aplicación de spray de xilocaina y en algunos casos de midazolam, se procedió a la introducción del gastroscopio,los hallazgos fueron inicialmente descritos globalmente respecto a la presencia de patrones de gastritissegún la clasifi cación endoscópica de Sydney, tanto en antro como cuerpo de estómago; luego, se procedió a ubicar el borde de atrofia gástrica ,en un primer momento sin aplicación de filtro FICE, y se determinó el estadio de atrofia gástrica basado en la clasificación de Kimura y Takemoto (ANEXO 01), posteriormente se retiró el endoscopio hasta la región cardial y se aplicó el set 7 de fi ltro FICE de cromoendoscopia virtual, y se realizó la exploración determinando nuevamente el borde de atrofia, reestadiandosepor el sistema descrito.Posterior a ello, se apagó el fi ltro FICE y se tomaron las biopsias de las áreas descritas en elA-NEXO 02consignando para cada lugar de toma de biopsia si endoscópicamente era mucosa atrófica o no atrófica(26-30), y se tomaron, además, biopsias de cualquier lesión focal hallada en la exploración endoscópica.
La presencia de atrofia gástrica sin metaplasia se defi nió como la presencia de una marcada proliferación de los vasos submucosos, y la disminución de la altura y extensión de los pliegues
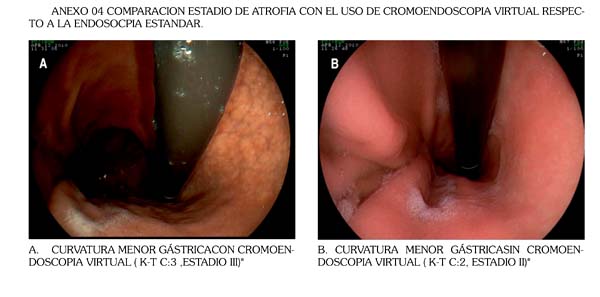
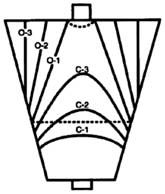
(ANEXO 04). La atrofia con metaplasia se definió como la presencia de placas ligeramente levantadas de color blanco-amarillento y de mucosa de aspecto levemente velloso .El borde atrófico ( línea B-boundary) fue el límite entre los territorios antral y fúndico(3), los cuales endoscópicamente fueron reconocidos como las diferencia de color y grosor de la mucosa antral y fúndica. (la cual se proyecta desde la incisura angular proximalmente ) El grado de atrofia gástrica endoscópica fue estimado con la clasifi cación de Kimura y Takemoto ( K-T) en 7 subtipos y reagrupándolos luego en 5 estadios : estadio 0 =(patrón C-0), estadio I = (patrón C-1), estadio II=( patrón C-2), estadio III= (patrones C-3,O-1,O-2), estadio IV= (patrón O3)(15-17).Histología
Las muestras de mucosa gástrica fueron procesados por la técnica habitual de parafina, empleando la tinción de hematoxilina-eosina. Todas las muestras fueron evaluadas por un solo patólogo. Para el estadio histológico de OLGA, en cada sitio de toma de biopsias, la gastritis fue clasifi cada como no atrófica y atrófica (26). La severidad de la atrofia gástrica se determinó independientemente para dos sectores topográficos gástricos distintos: la proveniente de antro/ángulo y la proveniente delfondo gástrico, mediante la escala visual analógica de severidad de atrofia del sistema OLGA en 4 grados: grado 0= no atrofia; grado 1= atrofia leve; grado 2 = atrofia moderada y grado 3= atrofia severa, considerando siempre el grado de severidad más alto por sector. Sobre la base de la ubicación topográfi ca (antral/angular, fúndica,) y de la severidad (4 grados) de cambios atrófi cos obtenidos, la gastritis atrófica fue evaluada de acuerdo con el sistema OLGA en 5 estadios (ANEXO 03).
Técnicas para el procesamiento de la información
La estadística descriptiva se presentó a través de tablas y gráficas ; para el análisis estadístico, se empleó la prueba de Kappa (K) ponderado(25), con un nivel de significancia estadística del 5% (p<0,05) con lo cual se determinó la concordancia entre el estadio de atrofia gástrica por endoscopia convencional y el estadio de atrofia histológico, así como también para el estadio de atrofia gástrica por endoscopia con el uso del set 7 de filtro FICE y el estadio de atrofia histológico, Se usó el programa StatXact de Cytel en su versión 9. Para su interpretación, se empleó la escala propuesta por Landis y Koch(30).
RESULTADOS
Respecto a la población estudiada 85 fueron mujeres y 53 varones; con un promedio de edad en conjunto de 47.43 +- 17.9 años, con una distribución homogénea por sexo y edad (Tabla 01).No hubo diferencia estadísticamente significativa respecto al sexo y el estadio de atrofia gástrica (Tabla 02).
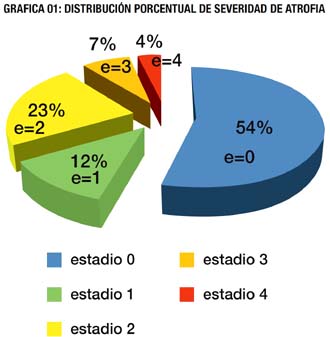
Respecto a la incidencia del severidad de atrofia gástrica evaluada según histología, en la población de estudio, Gráfica 01, 54.34 % no tuvieron atrofia (estadio 0) y 45.65% tuvieron algún grado de atrofia (estadios 1-4), siendo el estadio 2 el de mayor incidencia con 23% y el estadio 4 el de menor incidencia con 4%.
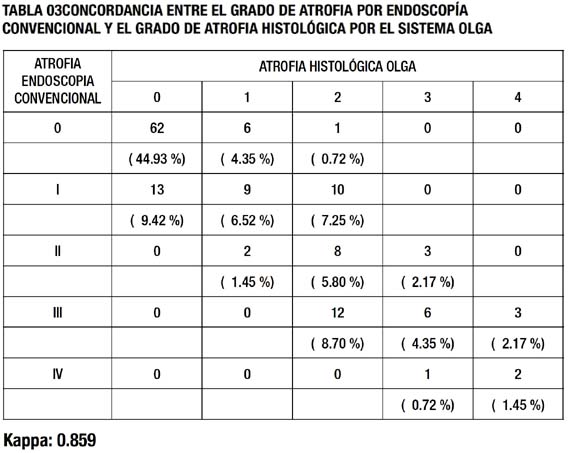
La concordancia entre el estadio de atrofia endoscópica (endoscopia convencional) y estadio de atrofia por el sistema OLGA,verificados en la tabla 03, es muy buena con un valor kappa de 0.8591 con un intervalo de confianza al 95% de 0.817-0.9013 y una p <0.0001, en donde se logró un 63.05% de acuerdo completo. Un desacuerdo en primer nivel 36.23, con una sobreestimación de la valoración endoscópica de atrofia del20.29% y desacuerdo en segundo nivel 0.72%.
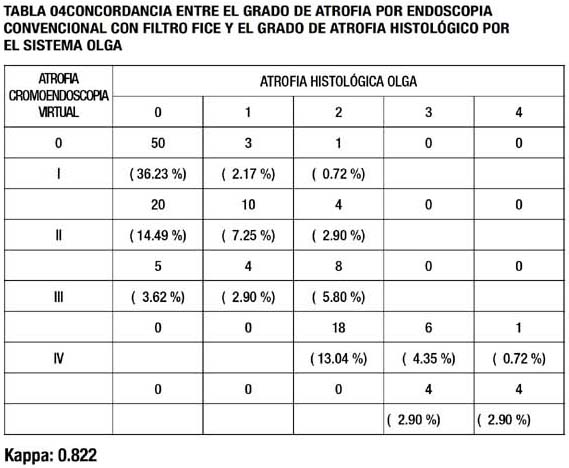
La concordancia entre el estadio de atrofia endoscópica con cromoendoscopia virtual (con set 7 de filtro Fice ) y estadio de atrofia por el sistema OLGA, tabla 04, es muy buena con un valor kappa de 0.8223 con un intervalo de confianza al 95% de 0.7662 -0.8783 y una p <0.0001, en donde se logró un 56.53% de acuerdo completo, un 39.12 de desacuerdo en primer nivel , con una sobreestimación de la valoración endoscópica de atrofia del 33.33% y 4.34 % de desacuerdo en segundo nivel.
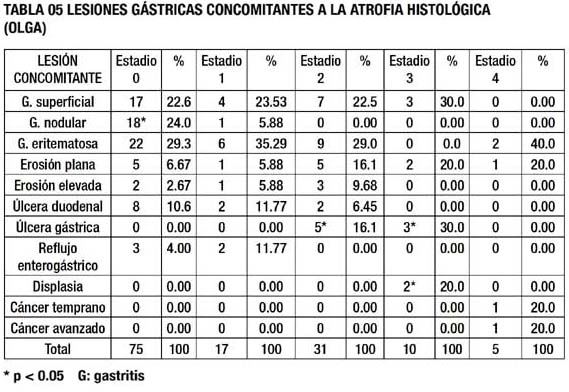
Al evaluar las lesiones gástricas concomitantes, tabla 05, se evidencia que existe una diferencia estadísticamente significativa asociadas al estadio de atrofia, siendo para el estadio 0, la gastritis nodular, para el estadio 2 la presencia de úlcera gástrica, para el estadio 3, la presencia de úlcera gástrica así como la presencia de lesiones displásicas, y para el estadio 4, la evidencia de lesiones neoplásicas.
DISCUSIÓN
El correcto diagnóstico de gastritis crónica tiene una gran importancia en la práctica clínica, debido a que su progresión, está asociada a un aumento del riesgo de cáncer gástrico (31- 33). Actualmente se considera a la atrofia gástrica como el factor básico de progresión de la enfermedad gástrica crónica. Los resultados del presente estudio demuestran una concordancia perfecta entre la clasifi cación histológica de atrofia gástrica, según el sistema OLGA, y la clasifi cación endoscópica, según el sistema de Kimura – Takemoto, ya sea con endoscopia convencional o con la cromoendoscopía virtual. La evidencia es que los valores del kappa ponderado encontrados fueron de 0.86 y 0.82, respectivamente, lo cual corresponde, según Landis y Koch, a una fuerza de concordancia perfecta.Pocos estudios han sido publicados respecto a la correlación endoscópica e histológica de atrofia gástrica, excepto en Japón, donde Kimura y Takemoto en 1969 (15), desarrollaron una clasificación endoscópica de atrofia gástrica, la cual ha sido usada en diferentes estudios, debido a su adecuado índice interobservador y a su regular concordancia con la histología (16,17). En 2005, Liu y col. (3), luego del consenso de atrofia gástrica del 2002 de Correa y Rugue , realizaron un primer estudio de concordancia , entre la clasificación endoscópica de K – T. y atrofia gástrica histológica, logrando una concordancia regular. Actualmente basados en los últimos estudios sobre progresión topográfica de atrofia gástrica (11-15), se ha desarrollado la nueva clasificación histológica de OLGA, con la misma base conceptual de progresión topográfica de atrofia que el sistema de endoscopia de atrofia gástrica, descrito por Kimura y Takemoto. En nuestro estudio se determinó por primera vez la concordancia entre estos dos sistemas, obteniéndose una concordancia mucho mejor a la descrita por Liu y col.(3)
Como se sabe, para el anterior sistema Sydney y el consenso de atrofia del 2002 (9,10), el valor de atrofia , es la representación global de la severidad máxima encontrada, pero, como se sabe,ésta tiene una progresión topográfi ca de antro al ángulo, curvatura menor y posteriormente curvatura mayor; por ello se entiende que los sistemas usados para describirla, sobreestiman su severidad, al usar sólo el valor más alto hallado, a diferencia del sistema OLGA, que es más preciso (12-14) debido a que hace una distinción clara, tanto topográfica y de severidad para la atrofia en antro/ángulo y cuerpo, la cual es muy similar y paralela al sistema endoscópico de Kimura y Takemoto, razón de ello es la excelente concordancia obtenida.
Respecto a la utilidad del sistema de cromoendoscopia virtual , se determinó que la concordancia endoscópicahistológica con el sistema de FICE y el sistema OLGA, se obtiene un valor de 0.8223, la cual determina una concordancia excelente, comparable a la endoscopia convencional. La explicación de esto se debe a que principalmente existe una mayor desacuerdo en el primer y segundo nivel de concordancia con una tendencia neta a sobreestimar la atrofia leve-moderada, lo que reduce el índice( ANEXO 04). La explicación sería técnica y se debería a la falta de estandarización para la elección de los 3 filtros que conforman cada uno de los 10 sets predefinidos, del FICE. En el presente estudio se debió idealmente usar para atrofia sin metaplasia, un set que tenga un filtro que se aproxime al 400nm, para evaluación de microestructura, y un filtro de contraste no mayor de 540nm. En el estudio la configuración más cercana , no la ideal, era el set 7 de FICE,que posee de fábrica los filtros 400nm , 450nm, y 520nm, aun así el fi ltro de 450nm prefijado puede ser el que esté dando información sobreestimada de mucosa atrófica sin metaplasia, debido a una mayor penetración en la mucosa y por ende dar falsos positivos de atrofia cuando esta es inexistente, actualmente es sabido que el uso de tres filtros en cada set no es necesario y que un sistema análogo al FICE, el NARROW BANDING IMAGE (NBI), solo usa la información de dos filtros con buenos resultados (37).
Con respecto a la atrofia con metaplasia,en estudios previos el uso del set 7 fue el que dio mayor contraste respecto a la mucosa normal, con una excelente precisión diagnóstica (21-24,34), en el estudio endoscópico se apreció una mejoría notable del contraste de las áreas de metaplasia, respecto a áreas sin metaplasia, por lo que el autor considera que si existe sobreestimación de la atrofia con la cromoendoscopia virtual , es respecto principalmente alos estadios leves de atrofia sin metaplasia.
El sistema OLGA tiene la ventaja de clasificar en grupos de riesgo para cáncer gástrico, según el estadio de atrofia encontrado (11,35).En el presente estudio, los grupos 3 y 4 se asociaron a displasia, cáncer gástrico temprano y avanzado; mientras los estadios 1 y 2, se asociaron a lesiones inflamatorias y benignas, los cuales son similares a los hallazgos de estudios previos con el sistema OLGA, lo que probablemente repercuta en un mayor control endoscópico y consideraciones respecto al tratamiento en estos grupos de riesgo(36).
CONCLUSIONES
-
La concordancia de la endoscopia convencional con el sistema de Kimura – Takemoto y el sistema de histo logía OLGA, es excelente.
-
El sistema de cromoendoscopia virtual (filtro 7 FICE) es útil en el diagnóstico de atrofia gástrica con y sin metaplasia, con una mejor precisión diagnóstica respecto a la endoscopia convencional y concordancia endoscópica e histológica excelente.
-
Los estadios 3 y 4 se asociaron a lesiones pre – malignas y malignas, mientras los estadios 1 y 2 se asociaron a lesiones inflamatorias y benignas.
REFERENCIAS
1. MEEK E., STIEFKEN P., JARAMILLO L.F. Concordancia en la clasificación de la metaplasia intestinal en biopsias gástricas usando coloraciones histológicas convencionales vs. coloraciones especiales en el Hospital Universitario San Ignacio. Revista Colombiana de Gastroenterología 1999; vol. XIV, nº 4:225-229.
2. GUARNER J., HERRERA-GOEPFERT R., et al. Interobserver variability in application of the revised Sydney system classification for gastritis. Hum Pathol 1999;30:1431-1434
3. YI LIU , NAOMI UEMURA, SHU-DONG XIAO Agreement between endoscopic and histological gastric atrophy scores J Gastroenterol 2005; 40:123–127
4. APPELMAN H.D., Gastritis: terminology, etiology, and clinicopathological correlations: another biased view. Hum Pathol 1994;25:1006-1019.
5. KHAKOO S.I., LOBO A.J., Shepherd, Wilkinson S.P. Histological assessment of the Sydney classification of endoscopic gastritis. Gut 1994;35:1172-1175.
6. GENTA R.M., DIXON M.F. The Sydney system revisited: the Houston international gastritis workshop. AJG 1995; vol. 90, nº 7: 1039-1041.
7. BOHROD M.G. What is a pathological diagnosis? A prelude to computer diagnosis. Path Annual 1971;7:197-208.
8. CORREA P. Chronic gastritis: a clinico-pathological classification. Am J Gastroenterol 1988;83:504-509.
9. RUGGE M, CORREA P, DIXON MF, Gastric mucosal atrophy: interobserver consistency using new criteria forclassification and grading. Aliment Pharmacol Ther. 2002 Jul;16(7):1249-59.
10. DIXON M.F., GENTA R.M., et al. Classification and grading of gastritis, the updated Sydney system. Am J Sur Pathol 1996;20(10):1161-1181.
11. RUGGE M, GENTA RM, OLGA-Group. Staging gastritis: an international proposal. Gastroenterology 2005;129:1807–8.
12. RUGGE M, GENTA RM. Staging and grading of chronic gastritis. Hum Pathol 2005;36:228–33
13. RUGGE M, MEGGIO A, PENNELLI G, PISCIOLI F, GIACOMELLI L, DE PRETIS G, et al. Gastritis staging in clinical practice: the OLGA staging system. Gut 2007;56:631–6.
14. HALA EL-ZIMAITY et al.
Gastritis and gastric atrophy Current Opinion in Gastroenterology 2008,24:682–68615. KIMURA K, TAKEMOTO T. An endoscopic recognition of the atrophic border and its significance in chronic gastritis. Endoscopy 1969;3:87–97.
16. TAKEMOTO T. Endoscopic diagnosis of chronic gastritis. Diagn Treat 1966;54:1274–85.
17. KIMURA K, SATOH K, IDO K, TANIGUCHI Y, TAKIMOTO T, TAKEMOTO T. Gastritis in the Japanese stomach. Scand J Gastroenterol 1996;31(Suppl 214): 17–20.
18. H OSAWA, M YOSHIZAWA, H YAMAMOTO, H KITA.
Optimal band imaging system can facilitate detection of changes in depressedtype early gastric cancer, Gastrointest Endosc 2008;67:226-34.19. R MOURI, S YOSHIDA, S TANAKA, S OKA.
Evaluation and validation of computed virtual chromoendoscopy in early gastric cancer, Gastrointest Endosc 2009;69:1052-820. M YOSHIZAWA, H OSAWA, H YAMAMOTO, H KITA.Diagnosis of elevated-type early gastric cancers by the optimal band imaging system, Gastrointest Endosc 2009;69:19-28
21. HERBERT BURGOS, MARCELA PORRAS, Use of Fujinon FICE and High Resolution Magnification Endoscopy to Identify Chemical Gastritis Vs. Helicobacter Pylori Related GastritisGastrointestinal Endoscopy Volume 65, Issue 5 , Page AB159, April 2007
22. HERBERT BURGOS, MARCELA PORRAS, FERNANDO BRENES, EDGAR IZQUIERDO, Fujinon FICE Electronic Chromovideoendoscopy Helps Differentiate the Type of Metaplasia in Patients with Chronic Atrophic Gastriti Gastrointestinal Endoscopy Vol. 65, Issue 5, Page AB353, April 2007
23. HERBERT BURGOS, MARCELA PORRAS, Use of the Fujinon FICE and High Resolution Magnification Endoscopy to Identify Portal Hypertensive Gastropathy Vs Chemical Gastritis Gastrointestinal Endoscopy Vol. 67, Issue 5, Page AB129 , April 2008
24. ARVED W. SCHNEIDER, HARTMUT VOGELL, MARC NAUMANN, PETRA R. UHLEN, Gabriele Grebe-Schultheis Computed Virtual Chromoendoscopy: Usefulnessfor Identification of Histologically Normal Mucosa in the Gastric Corpus-GastrointestinalEndoscopyVolume 67, Issue 5 , Page AB259, April 2008
25. D. CICCHETTI: "Testing the Normal Approximation and Minimal Sample Size Requirements of Weighted Kappa When the Number of Categories is Large". In Applied Psychological Measurement, 5(1):101-104, 1981.
26. M. RUGGEA, P. CORREA c OLGA staging for gastritis: A tutorial, Digestive and Liver Disease 40 (2008) 650–658
27. VAN IJZENDOORN MC, LAHEIJ RJF, DE BOER WA, JANSEN JBMJ.
The importance of corpus biopsies for the determination on Helicobacter pylori infection. Netherlands The Journal of Medicine 2005; 63(4): 141-14528. YA LI ZHANG1, ZHUO SHENG LAI, DIAN YUAN ZHOU ,Supra-angular biopsy is more reliable for atrophy recognization: analysis of 1598 cases for gastric mucosal histological examination World J Gastroentero, 2000; 6(6):893-897
29. SATOH K, KIMURA K, TANIGUCHI Y, KIHIVA K, TAKIMOTO T, et al. Biopsy sites for the diagnosis of Helicobacter pylori infection and the assesment of the extent of atrophic gastritis. Am J Gastroenterol 1998; 93(4): 569-73.
30. LANDIS J.R., KOCH G.G.: The Measurement of Observer Agreement for Categorical Data, Biometrics, 1977a, 33, 159-174
31. REDÉEN S, PETERSSON F, KECHAGIAS, Natural history of chronic gastritis in a populationbased cohort. Scand J Gastroenterol. 2010 May;45(5):540-9.
32. CORREA P, HOUGHTON J., Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007 Aug;133(2):659-72
33. KANG HY, KIM N, PARK YS, HWANG JH, Progression of atrophic gastritis and intestinal metaplasia drives Helicobacter pylori out of the gastric mucosa. Dig Dis Sci. 2006 Dec;51(12):2310-5.
34. COHEN J. Advanced Digestive Endoscopy: Comprehensive Atlas of High Resolution Endoscopy and Narrowband Imaging. Cap. 1. 1a edición. Blackwell publishing. 2007. p. 3- 8.
35. RUGGE M, DE BONI M, PENNELLI G, Gastritis OLGA-staging and gastric cancer risk: a twelveyear clinico-pathological follow-up study. Aliment Pharmacol Ther. 2010 May;31(10):1104-11
36. PELAYO CORREA, M. BLANCA PIAZUELO, AND KEITH T. WILSON, Pathology of Gastric Intestinal Metaplasia: Clinical Implications, Am J Gastroenterol 2010;105:493–498
37. COHEN J. Advanced Digestive Endoscopy: Comprehensive Atlas of High Resolution Endoscopy and Narrowband Imaging. Cap. 1. 1a edición. Blackwell publishing. 2007. p. 3- 8.
Anexos
ANEXO 01 Clasificación endoscopica de Kimura Takemoto para el borde de atrofia gastrica
ANEXO 02 Ubicación de la toma de biopsias gastricas, según la recomendación del sistema OLGA, para gastritis

ANEXO 03 Sistema de estadiaje OLGA
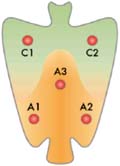
ANEXO 04 Comparación estadio de atrofia con el uso de cromoendoscopia virtual respecto a la endoscopia estandar