Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.2 Lima abr./jun. 2011
ARTÍCULO ORIGINAL
¿Contribuye la nutrición enteral precoz a disminuir las complicaciones de la gastrectomia radical por cáncer gastrico?
Does contribute early enteral nutrition to decrease the complications of radical gastrectomy for gastric cancer?
Ronald Christian Delgado Delgado1 ; Carlos E. Luque Vásquez V.2
1 Médico Asistente del Servicio de Cirugía General del Hospital IV "Alberto Sabogal Sologuren".
2 Médico Asistente del Departamento de Abdomen del Instituto Nacional de Enfermedades Neoplásicas.
RESUMEN
OBJETIVO: Evaluar si la administración de nutrición enteral precoz en el post operatorio de los pacientes gastrectomizados por cáncer gástrico contribuye a disminuir la frecuencia de complicaciones post operatorias.
MATERIALES Y MÉTODOS: Se realizó un estudio de casos y controles con 120 pacientes, 60 con complicaciones post-operatorias (casos) y 60 pacientes sin complicaciones postoperatorias (controles), pareados por edad y sexo.
RESULTADOS: El análisis univariado, encontró que albúmina (p=0.03), hematocrito (p=0.004), nutrición enteral precoz (p<0.01), estadío del cáncer gástrico (p=0.013) se comportaron como variables asociadas al desarrollo de complicaciones post-operatorias; sin embargo, en el análisis múltivariado, sólo la nutrición enteral precoz (p=0.014), nivel de hematocrito (0.019) y estadio anatomopatológico (0.013) mostraron asociación estadística significativa.
CONCLUSIONES: La nutrición enteral precoz administrada por sonda nasoenteral en el post-operatorio inmediato, junto con el nivel de hematocrito y estadio anátomo-patológico de la enfermedad, se asociaron estadísticamente a la disminución de las complicaciones postoperatorias, en pacientes sometidos a cirugía radical, por cáncer gástrico.
PALABRAS CLAVE: Nutrición enteral precoz, cáncer gástrico, cirugía, prevención, complicaciones.
ABSTRACT
OBJECTIVE: To evaluate whether the administration of early enteral nutrition in postoperative gastrectomized patients due gastric cancer helps to reduce the frequency of postoperative complications.
MATERIALS AND METHODS: A case-control study with 120 patients, 60 with postoperative complications (cases) and 60 patients without post operative complications (controls) matched for age and sex.
RESULTS: The uni-variable analysis found that albumin (p=0.03), hematocrit (p=0.004), early enteral nutrition (p<0.01), stage of gastric cancer (p=0.013), behaved as variables associated with the development of postoperative complications. However, in this multivariable analysis, only early enteral nutrition (p=0.014), hematocrit (0.019) and pathological stage (0.013), showed statistically significant association.
CONCLUSIONS: The early enteral nutrition administered by nasoenteral tube in the immediate postoperative period, with the hematocrit level and the anatomopathological disease stage is associated with statistically decreased postoperative complications in patients undergoing radical surgery for gastric cancer.
KEY WORDS: Early Enteral Nutrition, gastric cancer, surgery, prevention, conplications.
INTRODUCCIÓN
El cáncer gástrico tiene una incidencia, en el Perú, de 10 a 12 por cada 100,000 habitantes; ocupa el segundo lugar en frecuencia; es la segunda causa de muerte por cáncer, y, es el primero en frecuencia de origen gastrointestinal 1. Los tumores gástricos pueden producir obstrucción, náusea, vómito, digestión deficiente o mal absorción, ocasionando desnutrición que influye en la disminución de la calidad de vida y aumento de la morbilidad y mortalidad operatoria. La prevalencia de desnutrición es de 15 a 20% en el momento del diagnóstico, y, alcanza un 8090% en los casos de enfermedad avanzada 5,6. En varios estudios se ha demostrado que los pacientes desnutridos, que se sometieron a cirugía mayor, tienen mayor riesgo postoperatorio de desarrollar complicaciones, que aquellos pacientes que se encontraban en un adecuado estado nutricional 5-8. Independientemente del objetivo del tratamiento oncológico (curación o paliación), la detección temprana de problemas nutricionales y la intervención rápida, son esenciales.
Actualmente, existen datos que demuestran la superioridad de nutrición enteral precoz (primeras 24 horas después de cirugía) en pacientes con cirugía digestiva por cáncer, frente a la rutina tradicional postoperatoria de no dieta absoluta(NPO), fluido terapia intravenosa, con una lenta progresión a la tolerancia oral. La nutrición enteral precoz (NEP) ha demostrado reducir significativamente el riesgo de dehiscencia de la anastomosis, el riesgo de cualquier tipo de infección y, de manera no significativa, la infección de la herida quirúrgica, neumonía y el absceso intraabdominal, la estancia hospitalaria en 0,84 días, así como los costes totales del ingreso hospitalario15. Por otro lado, frente a la nutrición parenteral total (NPT), la nutrición enteral (NE) presenta menos complicaciones infecciosas y no infecciosas, menor estancia post-quirúrgica en la Unidad de Cuidados Intensivos y hospitalaria, con una mejor relación coste-eficiencia, hasta cuatro veces más económica16; sin embargo, los pacientes tratados con NEP, presentan mayor sensación subjetiva de incomodidad y desarrollan, con mayor frecuencia, efectos adversos digestivos que habitualmente son leves17. Los efectos adversos digestivos y los mecánicos (relacionados con la sonda) ocurren en 30% y en 6% de los casos, respectivamente18, pero generalmente se resuelven mediante reducción o interrupción temporal de la infusión nutricional, o bien, mediante la administración de fármacos adecuados.
Además, diversos estudios han demostrado que, NEP por sonda nasoyeyunal, en pacientes gastrectomizados por cáncer gástrico, está asociada a menor incidencia de complicaciones postoperatorias; así tenemos que Rugeles10 y col (2001), evaluaron el catabolismo postoperatorio, la morbilidad postoperatoria y la estancia hospitalaria, en un grupo de pacientes sometidos a resección gástrica electiva, y encontraron que, los pacientes que recibieron NEP, presentaron disminución significativa del catabolismo postoperatorio y mejoría de la fuerza muscular. Papietro y col (2002) 11, al evaluar la tolerancia digestiva a NEP pacientes con cáncer, sometidos a gastrectomía total, reportaron que la hiperglucemia post-operatoria fue menos frecuente, el costo del soporte nutricional y tiempo de hospitalización fueron menores en los pacientes con NEP. Rosales y col. (2009)14, evaluaron el efecto de la NEP y nutrición enteral tardía en el estado nutricional de pacientes con gastrectomia total por cáncer gástrico, y concluyeron que, NEP es un soporte seguro y efi caz, con ventajas nutricionales respecto a la nutrición enteral tardía. Kehr y col. (2005)12, valoraron el efecto de NE en 30 pacientes operados con cáncer gástrico, a través de una sonda nasoyeyunal, colocada en sala de operaciones, y concluyeron que, la sonda nasoyeyunal, usada en forma oportuna, permite mantener una adecuada nutrición en el paciente en el post-operatorio. Lin y col (2007)13, estudiaron la factibilidad y seguridad de NEP después de gastrectomía total por carcinoma de estomago en 100 casos, y concluyeron que, es útil para mantener la función gastrointestinal y la condición nutricional de los pacientes, además de ser efectiva, segura y económica.
Frente a la evidencia, en la mejora del estado nutricional de los pacientes post-operados de gastrectomía por cáncer gástrico, nos preguntamos si NEP por sonda nasoyeyunal también interviene o contribuye a la disminución de la frecuencia de complicaciones asociadas al procedimiento quirúrgico.
MATERIAL Y MÉTODOS
Con la finalidad de determinar si NEP por sonda nasoyeyunal disminuye la frecuencia de complicaciones en los pacientes gastrectomizados por cáncer gástrico, llevamos a cabo un estudio analítico de casos y controles, entre los pacientes que ingresaron al Servicio de Cirugía General del Hospital IV "Alberto Sabogal Sologuren" de EsSalud, con diagnóstico anátomo-patológico de Adenocarcinoma Gástrico y que fueron intervenidos quirúrgicamente de gastrectomía radical total o parcial, entre el 01 de Enero del 2005 al 31 de Diciembre del 2009.
Se incluyeron, en el presente estudio, 120 pacientes pareados por edad y sexo. Fueron definidos como casos (60 pacientes), los que desarrollan al menos una de las siguientes complicaciones en el postoperatorio: Absceso abdominal, neumonía nosocomial, dehiscencia de anastomosis, íleo prolongado, fístula enterocutánea, fístula pancreática, pancreatitis y/o hiperglicemia; y como controles (60 pacientes), los que no desarrollaron ninguna de éstas complicaciones.
Los pacientes con NEP, recibieron una fórmula enteral líquida, isotónica, isocalórica, isonitrogenada, completa y balanceada (Osmolite ®, Abbott Laboratorios S.A.), inicialmente a una velocidad de 15 mL/h, y se incrementó en 15 mL/h/día, hasta alcanzar el objetivo nutricional de 25 a 30 kcal/kg/d; éste continuó hasta que el paciente inicie vía oral y alcance, a través de la vía oral, el 50% de sus requerimientos energéticos basales. Desde el principio, se asoció nutrición parenteral parcial con lípidos, proteínas y carbohidratos, para cubrir el requerimiento calórico en al menos 50%.
El análisis estadístico incluyó análisis de frecuencias para variables categóricas y medias y desviaciones estándar o medianas. En el análisis univariado, para detectar diferencias entre variables categóricas, se usó la prueba Chi cuadrado o prueba exacta de Fisher; para detectar diferencias entre los valores de las variables continuas, se usó la prueba t de dos muestras independientes ó la prueba de la suma de los rangos de Wilcoxon, según sea lo apropiado. En el análisis multivariado, se utilizó la regresión logística, para ver la relación entre variable dependiente e independiente. Los datos obtenidos fueron procesados a través del programa estadístico SPSS (Statistical Product for Social Sciences) for Windows, statistics for reserch, software versión 15, 2006.
RESULTADOS
La edad promedio fue de 69.55 años, con una desviación estándar de 8.36 años para los casos, y de 68.41 años, con una desviación estándar de 11.11 años para los controles. El porcentaje de hombres fue de 66.7 % y de mujeres fue de 33.3 % en ambos casos.
Se realizó el análisis univariado de las variables índice de Charlson, albúmina, hematocrito, nutrición enteral precoz, localización del tumor, estadiaje y procedimiento quirúrgico. Aquellas variables, que fueron estadísticamente signifi cativas en el análisis univariable, ingresaron al análisis multivariado.
La media del índice de comorbilidad de Charlson de los casos, fue de 3.31 con una desviación estándar de 1.55, y el de los controles fue de 2.88, con una desviación estándar de 0.90 (Tabla 1). En el análisis univariado, la diferencia de medias, no fue estadísticamente significativa (p = 0.672).
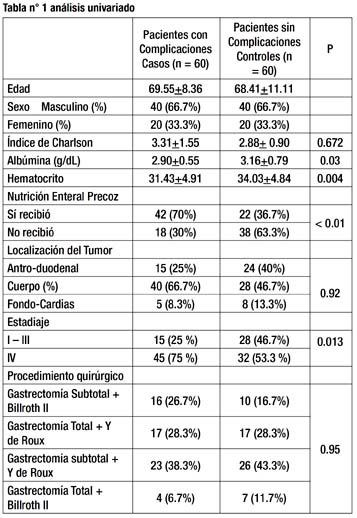
La media del nivel de albúmina de los casos, fue de 2.90 g/dL, con una desviación estándar de 0.55 g/dL, y el de los controles, fue de 3.16 g/dL, con una desviación estándar de 0.79 g/dL (Tabla 1). En el análisis univariado, la diferencia de medias, fue estadísticamente significativa (p = 0.03). En el análisis multivariado (Tabla 2) el nivel de albúmina, obtuvo un OR de 0.69, con un Intervalo de confianza al 95% de 0.36 a 1.32, y no fue estadísticamente significativo (p = 0.27).
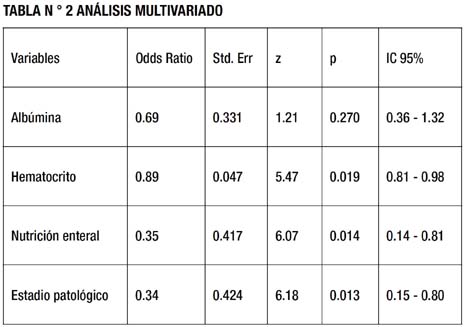
La media del nivel de hematocrito de los casos, fue de 31.43, con una desviación estándar de 4.91, y el de los controles fue de 34.03, con una desviación estándar, de 4.84 (Tabla 1). En el análisis univariado, la diferencia de medias, fue estadísticamente significativa (p = 0.004) y en el análisis multivariado (Tabla 2), el nivel de hematocrito, obtuvo un OR de 0.89, con un Intervalo de confianza al 95% de 0.81 a 0.98, y fue estadísticamente significativo (p = 0.019).
La proporción de pacientes con NEP, fue de 70% para los casos, y de 36.7 % para los controles (Tabla 1). En el análisis univariado, la diferencia de proporciones, fue estadísticamente significativa (p < 0.01), así como en el análisis multivariado (Tabla 2), cuya proporción de pacientes con nutrición enteral, obtuvo un OR de 0.35, con un Intervalo de confianza al 95% de 0.14 a 0.81, siendo estadísticamente significativo (p = 0.014).
La localización del cáncer de estómago para los casos, fue de 25 % en antro y en duodeno, 66.7 % en cuerpo y 8.3 % en fondo y cardias. La localización del cáncer de estómago, para los controles, fue de 40 % en antro y duodeno, 46. 7 % en cuerpo y 13.3 % en fondo y cardias (Tabla 1). En el análisis univariado, la diferencia de proporciones entre ambos grupos, no fue estadísticamente significativa (p = 0.92).
El estadio anatomopatológico del cáncer de estómago, para los casos fue de 25% en Estadio I – III y 75% en estadio IV. Para los controles, fue de 46.7 % en Estadio I – III y 53.3 % en estadio IV (Tabla 1). En el análisis univariado, la diferencia de proporciones entre ambos grupos, fue estadísticamente significativa (p = 0.013). En el análisis multivariado (Tabla 2), la proporción de pacientes con Estadiaje del I – III, obtuvo un OR de 0.34, con un Intervalo de confianza al 95% de 0.15 a 0.80, siendo estadísticamente significativo (p = 0.013).
Los procedimientos quirúrgicos, realizados en los pacientes del grupo de casos, fue de 26.7 % con gastrectomía subtotal más Billroth II, 28.3 % con gastrectomía total más Y de Roux, 38.3 % con gastrectomía subtotal más Y de Roux, y 6.7 % con Gastrectomía total más Billroth II. En los pacientes del grupo control fue de 16.7 % con gastrectomía subtotal más Billroth II, 28.3 % con gastrectomía total más Y de Roux, 43.3 % con gastrectomía subtotal más Y de Roux, y 11.7 % con Gastrectomía total más Billroth II (Tabla 1). En el análisis univariado, la diferencia de proporciones entre ambos grupos, no fue estadísticamente significativa (p = 0.95).
DISCUSIÓN
Los pacientes sometidos a cirugía gastrointestinal, con frecuencia, presentan algún grado de deterioro del estado nutricional, debido a múltiples factores: disminución de la ingesta en el período preoperatorio, ayuno postoperatorio, aumento de los requerimientos nutricionales, presencia de íleo postoperatorio, entre otras. Durante mucho tiempo, el manejo de estos pacientes consistió en ayuno postoperatorio hasta lograr la realimentación oral 20. Posteriormente, se consideró el aporte de NE, una vez que los ruidos intestinales estuvieran presentes. En el presente estudio, a diferencia de Lobo21 y a similitud de Rugeles10, Papietro11 y Kehr12, encontramos que, el inicio de la NEP, antes de las 24 horas del post-operatorio, en pacientes con cáncer gástrico, se asoció a menor desarrollo de complicaciones post-quirúrgicas (infecciosas y no infecciosas). A diferencia de los protocolos seguidos por los autores citados anteriormente, se administró concomitantemente nutrición parenteral, si la nutrición enteral no fue suficiente para cubrir el 50% de los requerimientos energéticos basales para el paciente. Debido a que el resultado del post-operatorio depende de otras variables, se investigó también variables no nutricionales disponibles en la base de datos. La diferencia encontrada en el análisis univariado, en el nivel de albúmina, hematocrito y estadiaje de enfermedad, no se mantuvieron en el análisis multivariado, sugiriendo que, pueden estar asociadas a menor desarrollo de complicaciones, en los pacientes postoperados de cáncer gástrico. En estudios previos, como el de Kudsk22 y Bozzetti23, el nivel de albúmina, ha sido un marcador de morbilidad y mortalidad. Debido a que, el tamaño de la muestra no fue calculado tomando en cuenta estas variables, sólo se puede sugerir un rol positivo en el no desarrollo de complicaciones postquirúrgicas de los pacientes que van a ser operados por cáncer gástrico.
Bozzetti, en el año 2007, estudió el rol de la nutrición enteral en las complicaciones postoperatorias, e incluyó, 1410 pacientes. De ellos, 149 sólo recibieron fluidos endovenosos estándar, 368 nutrición parenteral, 393 nutrición enteral y 500 nutrición enteral inmunoenriquecida. Las complicaciones fueron menores en el grupo de nutrición enteral (infecciosas 19.8% y no infecciosas 24.%) y nutrición enteral inmunoenriquecida (infecciosas 13.2% y no infecciosas 24.4%); concluyendo que, el soporte nutricional, disminuye la morbilidad, en los pacientes con cirugía gastrointestinal por cáncer, versus, aquellos que no la reciben.
Lewis, en su meta-análisis, compara la nutrición enteral precoz versus "nada por vía oral", durante el postoperatorio de cirugía gastrointestinal. Revisó 11 estudios, incluyendo 837 pacientes. La nutrición enteral precoz, redujo el riesgo de infección (RR: 0.72 IC 95% 0.54-0.98, p=0.001). Hubo reducción en riesgo de dehiscencia de anastomosis (RR: 0.53, IC 95% 0.26-1.08, p=0.080). Disminuye las complicaciones sépticas, y mejora la cicatrización tisular. Asimismo, reduce el tiempo de estancia hospitalaria, y no encontró beneficio en dejar al paciente en NPO, en el post-operatorio.
Akbarshahi en 2008, Rynn en 2006, Chin en 2004, Papapietro en 2002, Page en 2002, coinciden que la nutrición enteral temprana, en pacientes gastrectomizados por cáncer gástrico, es segura; además, disminuye la morbilidad y, en especial, las complicaciones infecciosas, lo que acorta la estancia hospitalaria.
CONCLUSIONES
Los resultados del presente estudio nos permiten afirmar que, en la población estudiada, la nutrición enteral precoz, administrada por sonda nasoenteral en el post-operatorio inmediato, el nivel de hematocrito y el estadío anatomo-patológico de la enfermedad, se asociaron, estadísticamente, a disminución de las complicaciones postoperatorias en pacientes sometidos a cirugía radical por cáncer gástrico.
DECLARATORIA
Los autores declaran expresamente que no existe ningún tipo de relación interés o vinculo con Abbott Laboratorios S.A. o su producto comercial Osmolite ®, el cual fue utilizado en el presente estudio, debido a la disponibilidad del producto en la farmacia del Hospital IV "Alberto Sabogal Sologuren".
REFERENCIAS BIBLIOGRÁFICAS
1. HTTP://WWW.INEN.SLD.PE/PORTAL/PRENSA/NOTAS-DE-PRENSA/118-NP-055.HTML.
Setiembre 2009.2. Gómez-Candela C, Luengo LM, Cos AI y cols. Valoración Global Subjetiva en el paciente neoplásico. Nutr Hosp 2003; 18(6):353-57.
3. Marure RA, Villalobos JL, Toval JA y cols. Valoración del estado nutricional en pacientes afectos de tumor digestivo resecable. Nutr Hosp 2000; 15(3):93-96.
4. Campos Herrero C, Iranzo González-Cruz V. El síndrome de anorexia-caquexia en el enfermo neoplásico.
Barcelona: Doyma; 2006.5. Schttner M, Shike M: Nutrition support of the patient with cancer. In Shils ME, Shike M, Ross C, et al: Modern Nutrition in Health and Disease, 10th ed. Lippincott Williams & Wilkins, 2006, p.p. 1290-1313.
6. Strasser F, Bruera E. Nutritional support of patients with gastrointestinal malignancies. In: Abbruzzese JL, Evans DB, Willett CG: Gastrointestinal Oncology. Oxford University Press, 2003, p.p. 841-865.
7. Cid L, Fernández T, Neira P. Prevalencia de desnutrición en pacientes con neoplasia digestiva previa cirugía. Nutr Hosp. 2008;23:46-53.
8. Cerezo L. Diagnóstico del estado nutricional y su impacto en el tratamiento del cáncer. Oncología 2005; 28(3):29-134.
9. Smith JS, Frankenfield D, Souba WW. Nutritional Support. En: De Vita VT Jr, Hellman S, Rosenberg SA (editores).
Cancer. Principles and Practice of Oncology. 7th Edition. Lippincott Williams & Wilkins. Philadelphia, 2005; pp 2649-2661.10. Rugeles S. Nutrición enteral temprana en el paciente gastrectomizado: experimento clínico controlado. Lect nutr. 2001; 8(2): 64 –72.
11. Papietro et al. Nutrición enteral precoz en pacientes con gastrectomía por cáncer. Rev. méd. Chile 2002; 130 (10).
12. Kehr, J; Morales Nutrición enteral en cáncer gástrico.
Lect. nutr. 2005; 8(2):64-72.13. LIN Wei,CHEN Jin-kun,TU Hai-jian. The Clinical Research of Early Enteral Nutrition after Gastrectomy. Journal of Putitian University. 2007; 2
14. Rosales B. Comparación entre nutrición enteral precoz y nutrición enteral tardía en el estado nutricional de pacientes gastrectomizados. Rev Chil Nutr 2009. 36 (1).
15. Lewis SJ, Egger M, Sylvester PA, Thomas S. Early enteral feeding versus "nil by mouth" after gastrointestinal surgery: systematic review and meta-analysis of controlled trials. BMJ 2001; 323: 773-7.
16. Peter JV, Moran JL, Phillips-Hughes J. A metaanalysis of treatment outcomes of early enteral versus early parenteral nutrition in hospitalized patients. Crit Care Med 2005; 33: 213-20.
17. Bozzetti F, Braga M, Gianotti L, Gavazzi C, Mariani L. Postoperative enteral versus parenteral nutrition in malnourished patients with gastrointestinal cancer: a randomised multicentre trial. Lancet 2001; 358:1487-92.
18. Fernández de Bustos A, Creus Costas G, Pujol Gebelli J, Virgili Casas N, Pita Merce AM. Per os early nutrition for colorectal pathology susceptible of laparoscopy-assisted surgery. Nutr Hosp 2006; 2: 173-8.
19. Koretz R. Enteral Nutrition: A Hard Look at Some Soft Evidence. Nutr Clin Pract.2009; 24:316-324.
20. Monti R, Cardonatti G; Soporte nutricional en pacientes gastrectomizados; Rev Asoc Méd Argentina 2007;120 (2):36-40.
21. Lobo DN, Williams RN, Wlch NT et al. Early postoperative jejunostomy feeding with an immune modulating diet in patients undergoing resectional surgery for upper gastrointestinal cancer: a prospective, randomized, controlled, double-blind study. Clin Nut 2006 Oct;25(5):716-26. Epub 2006 Jun 13.
22. Kudsk KA, Tolley EA, DeWitt RC, Janu PG, Blackwell AP, Yeary S, et al. Preoperative albumin and surgical site identify surgical risk for major postoperative complications. J Parenter Enteral Nutr 2003;27:1–9.
23. Bozzetti F, Braga M, Gianotti L, Gavazzi C, Mariani L. Postoperative enteral versus parenteral nutrition in malnourished patients with gastrointestinal cancer: a randomised multicentre trial. Lancet 2001;358:1487–92.
24. Charlson M.E., Pompei P.P., Ales K.L., MacKenzie C.R., A new method of classifying prognositic comorbidity in longitudinal studies; development and validation. J Chron Dis 1987; 5 : 373–383.













