Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.31 no.3 Lima July/Sep. 2011
ARTÍCULOS ORIGINALES
Determinación de la susceptibilidad de cepas de Helicobacter pylori a Levofloxacino en formato pequeño y método de difusión en disco usando Agar yema de huevo
Antimicrobial susceptibility of helicobacter pylori to levofloxacin determined in a miniwell format and disk diffusion tests using egg yolk agar
Humberto Mochizuki Tamayo1
; Adrián Pedro Noriega Aldave21, 2 Médico egresado de la Universidad Peruana Cayetano Heredia (UPCH). Lima, Perú. INSTITUCION: Laboratorio de Investigación y Desarrollo – UPCH
RESUMEN
OBJETIVOS: Determinar la concentración mínima inhibitoria (CMI) de Levofloxacino en cepas de HELICOBACTER PYLORI (HP). MATERIALES Y MÉTODOS: Se evaluaron 95 cepas peruanas de HP en métodos de agar dilución y difusión en disco, así como el coeficiente Pearson (r) y el efecto del inóculo. RESULTADOS: 36,9% (35 de 95) fueron resistentes a Levofloxacino (CMI>1μg/ml). CMI90 fue 16ug/ml (IC:90%). CMI de Levofloxacino no viró ante diferentes concentraciones del inóculo. r:-0,733 (p<0,001). CONCLUSIONES: La proporción de HP resistentes a Levofloxacino en Perú es mayor a la observada en países desarrollados. Se recomienda evaluar periódicamente la susceptibilidad antimicrobiana para elegir óptimas conductas terapéuticas.
PALABRAS CLAVES: Helicobacter Pylori, Levofloxacino, Susceptibilidad, Concentración mínima inhibitoria.
ABSTRACT
OBJECTIVES: To determine the Minimum inhibitory concentration (MIC) of Levofloxacin against HELICOBACTER PYLORI (HP). MATERIALS AND METHODS: 95 HP Peruvian strains were evaluated in Agar dilution and Disk diffusion tests, as well as the Pearson Coefficient (r) and the inoculums effect. RESULTS: 36.9% (35 of 95) were resistant (MIC>1μg/ml) to Levofloxacin. MIC90 was 16ug/ ml (CI:90%). MIC of Levofloxacin did not change at different inoculum concentrations. r: -0.733 (p<0.001). CONCLUSIONS: The proportion of HP Levofloxacin resistant strains in Peru is higher than in developed countries. Periodic testing of antibiotic susceptibility is warranted to select the most accurate therapies.
KEY WORDS: Helicobacter Pylori, Levofloxacin, Susceptibility, Minimum inhibitory concentration.
INTRODUCCIÓN
El Helicobacter pylori (HP) es el principal agente etiológico de gastritis crónica y úlcera péptica y un factor de riesgo importante de cáncer gástrico y linfoma tipo MALT (1, 2 ,3). Los estudios epidemiológicos han mostrado que la infección por HP ocurre en la población mundial. Sin embargo, la prevalencia de la infección en países desarrollados es alrededor de 10-50% (4) y en países en vías de desarrollo como Perú es de 59%. (5) La alta prevalencia de la infección en los países en vías de desarrollo se ha asociado con las pobres condiciones sanitarias, cloración del agua, preparación de los alimentos y hacinamiento (4).
Más de 25 años después de haber aislado por primera vez esta bacteria, aún no se ha encontrado en el mundo el tratamiento óptimo de erradicación del Helicobacter pylori; así, incluso las combinaciones más efectivas actualmente disponibles fracasan en aproximadamente un 20% de los casos(6,7). Estos fracasos en la erradicación están relacionados a la falta de adherencia al tratamiento, la resistencia bacteriana y los efectos adversos de estos esquemas. (8)
La amoxicilina es el antibiótico que no ha demostrado resistencia bacteriana primaria en la mayoría de los países del mundo, por lo cual se incluye en la mayoría de los esquemas de erradicación (8). Claritromicina y metronidazol han mostrado niveles superiores de resistencia. Un estudio realizado en Perú durante 1996 reportó un porcentaje de resistencia in vitro de 61% y 50% de resistencia para metronidazol y claritromicina respectivamente (8, 9).
En los últimos años varios antibióticos, un macrólido (Azitromicina) y fluoroquinolonas de 3ra. Generación (Levofloxacina, Gatifloxacina, Moxifloxacina) se han incorporado en estos nuevos esquemas de erradicación tanto en terapias de primera línea como en terapias de rescate (6,10).
Algunos estudios han demostrado que el Levofloxacino posee in vitro una elevada actividad frente a Helicobacter pylori y que las resistencias frente a dicho antibiótico son muy reducidas (1,9%) sin demostrarse diferencias estadísticamente significativas con la tasa de resistencia a la amoxicilina, pero notablemente inferiores a las encontradas para la claritromicina (7).
En Japón (11), Francia (12), Países Bajos (13), Portugal (14) y Alemania (15) se han hecho estudios sobre la actividad in vitro del Levofloxacino frente al HP, encontrándose niveles de resistencia menores al 10%.
Dado que en nuestro país aún no se han realizado estudios respecto a la actividad in vitro, el objetivo de este estudio es determinar la concentración mínima inhibitoria (CMI) de Levofloxacino necesario para inhibir el crecimiento de Helicobacter pylori, utilizando el Método de agar dilución – el cual es considerado la prueba de oro entre las pruebas de susceptibilidad antimicrobianas (16) -, utilizando el Agar yema de huevo, el cual ha demostrado ser idóneo en la determinación de CMI (17). Asimismo se evaluará la susceptibilidad in vitro de Helicobacter pylori a Levofloxacino mediante el Método de difusión en disco, el cual es un método técnicamente simple, ampliamente difundido y de fácil repetición (18). Se correlacionarán además los resultados de las CMI con la susceptibilidad in vitro hallada mediante el método de difusión en disco utilizando el coeficiente de correlación de Pearson, y se determinará el efecto del inóculo en la técnica utilizada.
MATERIALES Y MÉTODOS
Muestra: 95 Cepas de Helicobacter pylori proporcionadas por el Laboratorio de Investigaciones (LID) en Enfermedades Infecciosas de la Facultad de Ciencias de la UPCH. Las cepas de HP fueron aisladas de pacientes peruanos procedentes de Lima con gastritis, cuyas edades oscilan entre 18 y 63 años, a partir de muestras obtenidas en el Hospital Nacional Cayetano Heredia (HNCH) mediante biopsia endoscópica realizadas durante el 2006. Ninguno de los pacientes recibió antibioticoterapia la semana precedente a la endoscopía. Se utilizaron 95 cepas, las cuales fueron revividas de Agar Skirrow y crecidas en Agar BHI (Brain, Heart Infusion) suplementado con 5% de sangre de carnero desfi brinada. Las cepas fueron incubadas por 3 días en Agar sangre (placas 150-mm diametro) a 37°C en un ambiente microaerofílico (O2 al 5%, N2 al 85%, CO2 al 10%), y replicadas cada 48 horas durante 1 semana.
Múltiples colonias fueron escogidas de la placa y suspendidas en buffer fosfato salino (ph 7,4) en una concentración de 1,5 x 108 CFU/ml con un estándar de McFarland no 0,5. Esta suspensión fue utilizada como el inóculo de ambas pruebas.
Con la prueba de ureasa (1,9) se confirmó la presencia de colonias de Helicobacter pylori. Se utilizó solución Agar Base Urea 10X: Úrea: 200mg/ml, Rojo Fenol: 0,12mg/ ml, Cloruro de Sodio: 50mg/ml, Dextrosa: 10mg/ml (BBL, Becton, Dickinson and Co., Sparks, MD, USA), diluyendo 1ml de éste en 100ml de Agar. La lectura se realizó a los 5 minutos siendo positivo si el medio se torna de color violeta.
Se empleó el Muestreo Aleatorio Simple, en el banco de cepas del laboratorio de investigaciones en enfermedades infecciosas.
Dado que la prevalencia de infección por HP en Lima es de 59% (5), la cantidad de muestras necesarias con un nivel de confianza al 90%, es de 93 muestras (Epi Info Version 6.0).
El ensayo se realizó en dos formatos: placas petri de 150 mm y placas de microtitulación de 96 pozos. En las primeras se realizó el Método de difusión en disco y en las segundas la determinación de la CMI.
Método de agar dilución: Se utilizó Agar yema de huevo el cual fue preparado según lo descrito por Westblom (17), con las modificaciones siguientes. Los huevos primero se lavaron con jabón y agua y en seguida fueron sumergidos en etanol 95% por 2 hrs a temperatura ambiente. Se quebraron los huevos y las yemas fueron separadas e incorporadas luego en el Agar. El Agar yema de huevo contiene Agar Columbia, 5-10% de yema de huevo, 1% de IsoVitaleX, Anfotericin B (6μg/ml) y cloruro de 2,3,5 trifeniltetrazolium (TTC) 40μg/ml (17).
Las placas de microtitulación de 96 pozos fueron llenadas de 200 μl del Agar por cada pozo. Las diluciones antimicrobianas se agregaron al Agar en las concentraciones establecidas para Levofloxacino en un rango de 0,0312-16μg/ ml (Tabla Nº 1) Dos pozos estuvieron libres de diluciones de antibióticos ya que constituyeron los controles positivo y negativo. Al control positivo se le inoculó bacterias más no antibióticos, mientras que al control negativo no se le inoculan bacterias ni antibióticos. Las diluciones antimicrobianas y el IsoVitaleX fueron agregados cuando el huevo, el Anfotericin B, el Agar Columbia, y el cloruro de 2,3,5 trifeniltetrazolium, estuvieron mezclados y entonces se vertió la mezcla inmediatamente en los pozos. Posteriormente se inoculó 5ul de la suspensión de Helicobacter pylori en cada pozo, exceptuando los controles negativos. Todas las placas fueron incubadas por 5 días antes de ser leídas, a 37ºC en un ambiente microaerofílico (O2 al 5%, N2 al 85%, CO2 al 10%).
Método de difusión en disco: Se preparó el Agar yema de huevo según se describió previamente, y se vertió en placas petri de 150mm. Inmediatamente después las placas fueron puestas en una capilla laminar de flujo bajo de luces UV por 2 hrs para asegurar la esterilidad. Las placas fueron utilizadas dentro del plazo de 1 semana para mantener la humedad. Se sembraron 100μl del inóculo de prueba de cada cepa en las placas y luego se colocó un disco de Levofloxacino (5μg/ml) en el centro de éstas. Se incubaron luego las placas a 37ºC en un ambiente microaerofílico (O2 al 5%, N2 al 85%, CO2 al 10%) por 5 días luego de las cuales se procedió a su lectura.
Efecto del inóculo: Se evaluó la respuesta al antibiótico a concentraciones mayores del inóculo utilizando el método de agar dilución. Se utilizaron concentraciones de una de las cepas de acuerdo a las escalas Mc Farland Nº 4 y 10, y se compararon las CMIs resultantes con la CMI de la misma cepa correspondiente a la concentración Mc Farland Nº 0,5
La lectura se realizó a los 5 días (17), tanto para la determinación de la CMI como para el Método de difusión en disco. Las colonias de Helicobacter pylori se observan de color rojo pero el mismo color pueden tomar bacterias contaminantes por lo que el método de la ureasa es necesario para la distinción. Sin embargo, las bacterias contaminantes son identificables ya que no poseen el brillo dorado característico de las colonias de HP al ser observadas desde un ángulo ante una fuente de luz (19).
La CMI es definida como la concentración más baja de Levofloxacino que dé por resultado la inhibición completa del crecimiento. En el Método de difusión en disco se mide el diámetro del halo total de inhibición.
Análisis estadístico: Los valores de CMI y diámetro del halo de inhibición fueron expuestos en tablas de frecuencias y estadístico descriptivo los cuales grafican en una curva normal la distribución, los valores máximos, valores mínimos, la desviación estándar y las medias. Los métodos de difusión en disco y de Agar dilución fueron comparados con una curva de correlación por medio del coeficiente de correlación de Pearson. Todos los intervalos de confianza fueron calculados al 90%. Se utilizó para el análisis el programa SPSS 7,5 para Windows.
RESULTADOS
Método de Agar dilución: En la tabla Nº 2 se muestra la frecuencia de resistencia y sensibilidad, tomando como punto de corte de resistencia CMI > 1ug/ml.

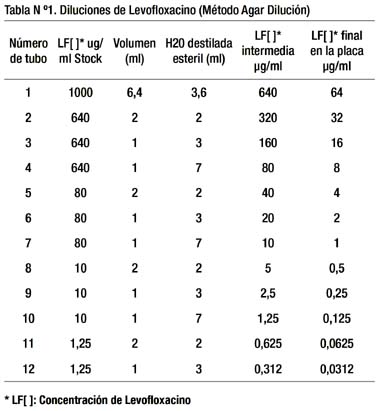
Para determinar el CMI90, se realizó la curva de sensibilidad (Gráfico Nº 1), demostrando que el valor que inhibe el crecimiento del 90% de las cepas es 16ug/ml. Asimismo, se calculó el CMI50 siendo éste 0,5μg/ml.
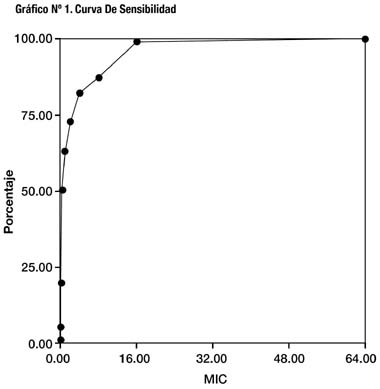
De los resultados se observa que la CMI de mayor frecuencia
(30,5%) es 0,5μg/ml (Gráfico Nº2).
La media de las CMI halladas se representa en la tabla Nº 3, estando la media muestral en 3,84 μg/ml (4,18-11,84 μg/ml; IC90%). Asimismo se representa la media de los valores CMI > 1: 9,54 μg/ml (Desviación típica: 11,14), y de los valores CMI < 1: 0,5μg/ml (Desviación típica: 0,27).
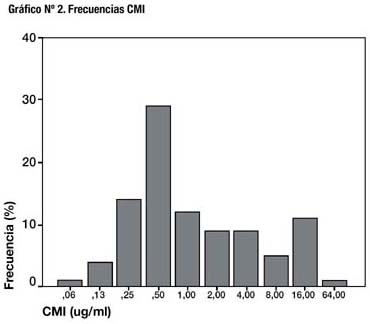
La curva de distribución de frecuencias de CMI se muestra en el gráfico Nº 3.
La CMI de la cepa evaluada para determinar el efecto del inóculo fue 0.25μg/ml en las diferentes microdilucionesde HP (McFarland 0,5; 4 y 10).
1. Método de difusión de disco
La media del diámetro del halo total de inhibición fue 40,68mm, y la desviación estándar 16,37mm, con un intervalo de confianza del 90%.
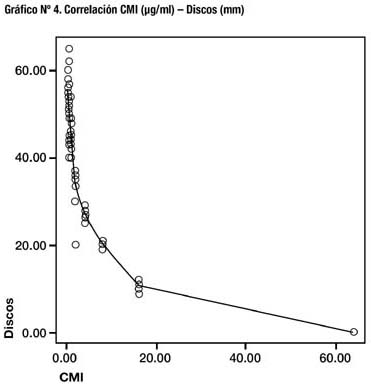
Comparando los valores obtenidos de CMI de micro-dilución con los valores del método de difusión en disco, se obtiene un coeficiente de correlación de Pearson de -0,733 (p = 0,01) (Gráfico Nº 4).

DISCUSIÓN
Dada la alta prevalencia de Helicobacter pylori en nuestro medio (59%)(5), y el incremento de resistencia a los esquemas terapéuticos estándar (4,6,7), nos vemos en la necesidad de implementar nuevas opciones terapéuticas para el tratamiento de esta infección.
Método de Agar dilución: El valor estándar de CMI tomado en cuenta para definir una cepa como resistente fue de >1μg/ml, mientras que un valor < 1μg/ml la define como sensible. Se consideró este punto de corte en relación a otros trabajos publicados, dado que la NCCLS (National Committee for Clinical Laboratory Standards) no ha establecido un punto de corte.
La CMI90 (16μg/ml) es similar a la de otros países europeos (CMI90 0.93 – 32) (11,13,14,20). Sin embargo, la CMI50 observada (0.5μg/ml) es mayor a las observadas en otros países europeos (CMI50 0,047 – 0,125 μg/ml), y la CMI media observada (3,84μg/ml) es mayor al valor estándar (1μg/ml). El 63,1% de las cepas de HP presentaron CMI de Levofloxacino < 1 μg/ml (Sensibles), y 36,9 % CMI >1μg/ml (resistentes) lo cual difiere de los resultados hallados en Europa donde la resistencia reportada es menor de 10% (12,13,14).
Esto podría explicarse por la resistencia cruzada e inducción observadas dentro del grupo de las fluoroquinolonas (11,13,20). En nuestro medio, la resistencia cruzada de Levofloxacino se vería favorecida por la alta prevalencia de infecciones gastrointestinales (21) y consecuente exposición a quinolonas.
Método de difusión en disco: El grado de correlación entre los diámetros del halo de inhibición y las CMI obtenidas, obtenido mediante el coeficiente de correlación de Pearson es de -0,733 (p=0,01) demostrándose un grado de correlación negativo importante, similar al observado en otros estudios (22,23). No se determinó el porcentaje de resistencia/ sensibilidad dado que la NCCLS no ha determinado un valor de corte estándar. Así, el método de difusión en disco resulta una alternativa eficiente para determinar patrones de susceptibilidad dados el buen grado de correlación con el método de Agar dilución y su facilidad de aplicación.
Efecto del inóculo: No se observaron cambios en la CMI ante las diferentes concentraciones del inóculo, a diferencia de lo que ocurre en cepas de Helicobacter pylori frente a Metronidazol donde la CMI puede aumentar hasta 16 veces(24) ante variaciones de la cantidad de inóculo.
Control de calidad: En la evaluación intralaboratorio, no se observó contaminación de esterilidad y en todos los controles de crecimiento se visualizó desarrollo de las cepas. Las cepas se comportaron en todas las pruebas dentro de lo esperado ante las diferentes concentraciones de Levofloxacino.
Dada la potencial variabilidad de los patrones de susceptibilidad bacteriana en el tiempo (8), resulta crucial la vigilancia epidemiológica periódica de dichos patrones para establecer óptimas conductas terapéuticas y líneas de investigación.
REFERENCIAS
1. VALDEZ Y, VELAPATIÑO B, GILMAN R, GUTIERREZ V, et al.
Antimicrobial susceptibility of Helicobacter pylori determined by the E test using tetrazolium egg yolk agar. Journal of Clinical Microbiology 1998; 36: 2784–2785.2. LEÓN-BARÚA R, RECAVARREN S, RAMÍREZ A. El aporte peruano a la investigación sobre Helicobacter pylori. Rev Med. Herediana. 1991; 2(4): 173-81.
3. RECAVARREN-ARCE S, LEÓN-BARÚA R,COK J, BERENDSON R, GILMAN RH, RAMÍREZ-RAMOS A, RODRÍGUEZ C, Spira WM .
Helicobacter pylori and progressive gastric pathology that predispones to gastric cancer. Scand J Gastroenterol 1991; 26 (Suppl 181): 51-7.4. RAMIREZ RAMOS A, SANCHEZ-SANCHEZ R. Helicobacter pylori 25 años después (1983 -2008): epidemiología, microbiología, patogenia, diagnóstico y tratamiento. Rev. gastroenterol. Perú. 2009: 29(2): 158-170.
5. RAMIREZ A, MENDOZA D, LEEY J, GUERRA J. Estudio del Helicobacter pylori en el Perú, Rev Peru Med Exp Salud Publica 2002; 19: 209-214.
6. GISBERT JP. Rescue therapy after Helicobacter pylori eradication failure. Gastroenterología y Hepatología. 2011; 34(2): 89-99
7. ASOCIACIÓN ESPAÑOLA DE GASTROENTEROLOGÍA. Terapia "De Rescate" con Levofloxacino tras múltiples fracasos erradicadores de H.pylori. http://www.aegastro.es/Areas/Estomago/Retto_con_Levofloxacino2004/protocolo.htm (Acceso 29 de Junio de 2011).
8. DE FRANCESCO V, GIORGIO F, HASSAN C, et.al. Worldwide H. pylori antibiotic resistance: a systematic review. Journal of Gastrointestinal and Liver Disease. 2010; 19(4): 409-414
9. VÁSQUEZ Y, VALDEZ, GILMAN RH et al.
Metronidazole and Clarithromycin Resistance in Helicobacter pylori Determined by Measuring MICs of Antimicrobial Agents in Color Indicator Egg Yolk Agar in a Miniwell Format. Journal of Clinical Microbiology 1996; 34: 1232.10. GONZÁLEZ C, GARCÍA C, APOLINARIA, DAROCH M, FABIOLA et al. Susceptibilidad in vitro de cepas de Helicobacter pylori: aislamiento de cepas resistentes a claritromicina.
Rev. méd. Chile 2001; 129: 6.11. FUJIMURA S, KATO S, LINUMA K et al. In vitro activity of fluoroquinolone and the gyrA gene mutatioin in Helicobacter pylori strains isolated from children. J Med Microbiol 2004; 53: 1019-22.
12. TANKOVIC J, LASCOLS C, SCULO Q et al.
Single and double mutations in gyrA but not in gyrB are associated with low-and high-level fl uoroquinolone resistance in Helicobacter pylori. Antimicrob Agents Chemoter 2003; 47: 3942-4.13. DEBETS–OSSENKOP YJ, HERSCHEID AJ, POT RG, et al. Prevalence of Helicobacter pylori resistance to metronidazole, clarithromycin, amoxicilin, tetracycline and trovafloxacin in The Netherlands. J Antimicrob Chemother 1999; 47: 511-5.
14. CABRITA J, OLEASTRO M, MATOS R, et al.
Features and trenes in Helicobacter pylori antibiotic resistance in Lisbon area, Portugal (1990-1999). J Antimicrob Chemother 2000; 46: 1029-31.15. HEEP M, KIST M, STROBEL S, et al. Secondary resistance among 554 isolates of Helicobacter pylori after failure of therapy. Eur J Clin Microbiol Infect Dis 2000; 19: 538-41.
16. WHITE D et.al. Antimicrobial resistance: Standardization and harmonization of laboratory methodologies for the detection and quantification of antimicrobial resistance. Rev sci .tech 2001; 20: 849-858
17. WESTBLOM U, MADAN E, BENTLEY R. Egg Yolk Emulsion Agar, a New Medium for the Cultivation of Helicobacter pylori. Journal of Clinical Microbiology. 1991; 29: 819-821.
18. OSATO M. Antimicrobial Susceptibility Testing for Helicobacter Pylori: Sensitivity Test Results and Their Clinical Relevance. Current Pharmaceutical Design 2000; 6: 1545-1555.
19. ALARCÓN T, BAQUERO M, DOMINGO D, LÓPEZBREA M, ROYO G. Procedimientos en Microbiología Clínica Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica Editores: Emilia Cercenado y Rafael Cantón 17. Diagnóstico microbiológico de la infección por Helicobacter pylori. 2004; p: 435.
20. MOGG J, SUNG J, CHAE H, NAYOUNG K, YOUNGJEON K, SUNG I. Distribution of fl uoroquinilone MICs in Helicobacter pylori strains from Korean Pacients. Antimicrob Agents Chemother. 2006; 56: 965-967.
21. MINISTERIO DE SALUD. Situación de salud 2008. Dirección de salud IV Lima Este. http://www.limaeste.gob.pe/limaeste/situacion/asis/asis_/ASIS_2008/asis2008.pdf. (Acceso el 12 de Noviembre del 2008).
22. DECROSS A, MARSHALL B, MCCALLUM R, et.al. Metronidazole Susceptibility Testing for Helicobacter pylori: Comparison of Disk, Broths and Agar Dilution Methods and Their Clinical Relevance. Journal of Clinical Microbiology. 1993; 31: 1971-74.
23. XIA H, KEANE C, BEATTIE S, OMORAIN, C. Standardization of Disk Diffusion Test and Its Clinical Significance for Susceptibility Testing of Metronidazole against Helicobacter pylori. Antimicrobial Agents and Chemotherapy.1994; 38: 2357-61.
24. BERGER S, A.GOREA, et.al. Effects of inoculum size in antimicrobial susceptibility of Helicobacter pylori. European Journal of Clinical Microbiology and Infectious diseases. 1993; 12: 782-783.













