Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.3 Lima jul./set. 2011
REPORTE DE CASOS
GIST Yeyunal con Sangrado Digestivo de Origen Oscuro
Jejunal GIST with obscure gastrointestinal bleeding
María Nelly Manrique
; Oscar Frisancho ; Luz Rivas Wong y Américo Palomino* Departamento del Aparato Digestivo, Hospital Nacional Edgardo Rebagliati Martins, EsSALUD, Lima, Perú.
RESUMEN
Reportamos el caso de una mujer de 84 años con antecedentes de arritmia cardiaca y hemorroides. Tenía múltiples hospitalizaciones y transfusiones por anemia ferropénica sintomática; los estudios endoscópicos solo demostraron divertículos y pequeños pòlipos de colon. Posteriormente fue hospitalizada por presentar heces sanguinolentas de color rojo vinoso; la endoscopia alta indicó gastritis y la colonoscopia mostró pequeñas úlceras colónicas, un pólipo colónico y múltiples divertículos. Meses después, reingresó con hemorragia de origen oscuro; en esa ocasión se demostraron: gastritis, erosiones antrales, pequeños pólipos colónicos y úlceras colónicas en vías de cicatrización; la cápsula endoscópica mostró probable angiodisplasia en yeyuno medio, la enteroscopia anterógrada detectó en yeyuno proximal algunas lesiones eritematosas sin evidencia de sangrado activo. Volvió a ser hospitalizada por melena y dolor abdominal, la endoscopia alta mostró angiodisplasias gástricas y duodenales que fueron tratadas. El último ingreso indicó un tiempo de enfermedad de dos años, el episodio se caracterizó por presentar deposiciones rojo vinosas y anemia. La endoscopia mostró angiodisplasia gástrica, que fue tratada con termocoagulación con argón plasma. En el examen no presentó signos de descompensación hipovolémica. Enfocado como un problema de hemorragia digestiva de origen oscuro se repitieron varios exámenes endoscópicos sin resultados. Resangró estando hospitalizada, se realizó cápsula endoscópica que demostró sangrado agudo en yeyuno, se complementó con nueva enteroscopia anterógrada que mostró lesiones ulceradas de yeyuno, se marcó el área con tinta china y se indicó laparotomía exploratoria. En la intervención quirúrgica se encontró en borde antimesentérico de yeyuno, una tumoración redondeada (6x6x4.5 cm) de crecimiento extraluminal, que comprometía la pared sin adherirse a otras estructuras; se realizó resección del tumor y anastomosis yeyuno-yeyunal. El estudio histológico -con inmunohistoquímica- del espécimen mostró que se trataba de un Tumor Estromal Intestinal (GIST), de riesgo intermedio, patrón histológico fusiforme, con escasas mitosis, dependiente de la capa muscular propia del intestino delgado. En conclusión el presente caso se trata de una mujer con un GIST yeyunal cuya presentación clínica fue una hemorragia de origen oscuro que constituyó un problema diagnóstico y que gracias al advenimiento de los nuevos procedimientos endoscópicos (enteroscopia y cápsula endoscópica) fue localizada y posteriormente extirpada quirúrgicamente.
PALABRAS CLAVE: Tumor estromal gastrointestinal, Hemorragia gastrointestinal de origen oscuro, Tumores de intestino delgado.
ABSTRACT
We report the case of a woman of 84 years with a history of cardiac arrhythmia and hemorrhoids. She had multiple hospitalizations and transfusions for symptomatic iron deficiency anemia, endoscopic studies showed only small diverticula and colon polyps. He was later hospitalized with bloody stools red wines, upper endoscopy and colonoscopy showed gastritis, small colonic ulcers, colonic polyp and multiple diverticula. Readmitted with bleeding of obscure origin, on that occasion showed gastritis, antral erosions, small ulcers, colon polyps and colon ulcers in the process of healing, capsule endoscopy showed angiodysplasia in jejunum, anterograde enteroscopy detected some erythematous lesions in proximal jejunum without evidence of bleeding. Again hospitalized for melena and abdominal pain, upper endoscopy revealed gastric and duodenal angiodysplasia were treated. The last entry indicated a time of two years disease, the current episode with wine-red colored stools, Hb: 8.4 g, for which he received two units of PG. Endoscopy showed gastric angiodysplasia, which was treated with thermocoagulation (argon plasma). In the entrance examination showed no signs of hypovolaemic decompensation. Approached as a problem of obscure gastrointestinal bleeding were repeated several endoscopic examinations without results. She re-bled being hospitalized, capsule endoscopy was performed showing acute bleeding in the jejunum, complemented by new anterograde enteroscopy that showed ulcerated lesions of the jejunum, the area was marked with indian ink. Exploratory laparotomy was indicated. In the surgical intervention it was in edge antimesentérico of yeyuno, a round tumor (6x6 cm) of extraluminal growth, which compromised the wall without sticking to other structure, Resection of the tumor and jejuno-jejunal anastomosis was realized. The histological study with immunohistochemistry showed an Intestinal Stromal Tumor (GIST), intermediate risk, histological pattern fusiform, with scarce mitosis; the lesion was dependent on the muscularis propria of the small intestine. In conclusion, this case involves a woman with a jejunal GIST whose clinical presentation was hemorrhage of unknown origin which was a diagnostic problem and thanks to the advent of new endoscopic procedures (enteroscopy and capsule endoscopy) could locate the place of injury and subsequent surgery.
KEY WORDS: gastrointestinal stromal tumor, gastrointestinal bleeding of obscure origin, small bowel tumours.
INTRODUCCIÓN
Los Tumores Estromales Gastrointestinales (GISTs) son los tumores mesenquimales más frecuentes que crecen en la pared del tracto gastrointestinal. La mayoría de GISTs han sido históricamente clasificados como tumores de células musculares lisas, de células nerviosas u otros tumores derivados del mesénquima y así han sido llamados leiomiomas, leiomiosarcomas, neurofi bromas, schwannomas, etc. (1).
Los descubrimientos en biología molecular sugieren que las células intersticiales de Cajal (CIC) o sus precursoras que expresan receptor tirosina kinasa (c-Kit) o Receptor Alfa del Factor de Crecimiento Derivado de Plaquetas (PDGFRA) son las células progenitoras de los GIST. Las CIC se encuentran intercaladas entre los nervios autonómicos y las células musculares lisas, su principal función es generar el ritmo autónomo de contracciones involucradas en la digestión y peristaltismo (2,3).
Los GISTs se caracterizan por la expresión de un receptor de membrana mutante con actividad tirosina kinasa anormal (la proteína c-Kit), debido a una mutación en la función del gen KIT ubicado en el cromosoma 4 (q11-12). Existe una fracción de estos tumores que no expresan el receptor c-Kit, de estos un 30% son positivos para una mutación del gen del Receptor Alfa del Factor de Crecimiento Derivado de Plaquetas (PDGFRA) que también tiene actividad tirosina kinasa asociada. Aproximadamente 60%-70% de los GIST c-Kit negativos también son PDGFRA negativos lo que sugiere la existencia de mecanismos adicionales aún desconocidos que definen una proliferación celular no regulada (4, 5, 6).
La exacta incidencia de GIST es difícil de determinar, estudios recientes reportan una incidencia de aproximadamente 10-15 casos/millón/año en Europa, sin embargo la prevalencia de GIST es más alta, debido a que muchos pacientes viven por años con la enfermedad (7).
La presentación clínica de los GISTs va de asintomáticos a sintomáticos, los GISTs asintomáticos son frecuentemente detectados incidentalmente durante screnning endoscópico de rutina. Aunque 10% a 30% de los GISTs son clínicamente malignos, se conoce que todos los GISTs tienen algún grado de potencial maligno. Sin embargo las pruebas histológicas o herramientas diagnósticas que realmente estimen el riesgo de malignidad de los GISTs preoperatoriamente no están disponibles (8,9).
Se presenta el caso de una mujer de 84 años que fue hospitalizada en varias oportunidades por hemorragia digestiva, que inicialmente la cápsula endoscópica mostró aparentes angiodisplasias en yeyuno medio, y que finalmente resultó ser un GIST yeyunal.
CASO CLÍNICO
Mujer de 84 años de edad, natural y procedente de Lima, con antecedentes de arritmia cardiaca y hemorroides; refería varias hospitalizaciones por anemia sintomática desde Junio del 2008.
Hospitalizada el 30/06/08 por anemia severa sintomática (Hb: 4.2g/dl), recibió transfusión de cuatro paquetes globulares (PG), la endoscopia digestiva alta (EDA) fue normal; la colonoscopia detectó divertículos y pólipos (dos); los estudios histológicos indicaron que se trataban de adenomas.
Hospitalizada el 14/01/09 por presentar hematoquezia, los análisis indicaron Hb: 8.3g/dl, VCM: 68.4, HCM: 20, entre otros; recibió un PG.
Hospitalizada el 27/10/09 por presentar hematoquezia y anemia aguda, el tacto rectal comprobó la presencia de heces de color rojo vinoso; la Hb disminuyó hasta 9.8g/ dl, se transfundió 2 PG. Se realizó EDA encontrando gastritis, se realizó colonoscopia encontrándose cuatro úlceras, un pólipo, divertículos y hemorroides internas grado I; se realizó inyectoterapia con adrenalina, termocoagulación con Argón plasma (úlceras colónicas) y polipectomía.
Hospitalizada el 23/11/09 por presentar dos días de sangrado (aparente "melena"). Se planteó el diagnóstico de Hemorragia Digestiva de Origen Oscuro. Los exámenes mas representativos indicaron: Hb 11.6g/dl, la EDA: gastritis y erosiones antrales, la colonoscopia: pólipos pequeños(4) y úlceras colónicas en vías de cicatrización. Los estudios anatomopatológicos indicaron adenoma tubular y colitis crónica moderada inespecífica con formación "granulomatoide", por lo que se realizó estudio histoquímico el cual fue negativo para BK. Fue dada de alta.
El 02/12/09 se realizó Cápsula Endoscópica encontrándose probable angiodisplasia en yeyuno medio, por lo que se complementó con enteroscopia (anterógrada) observándose en yeyuno proximal lesiones eritematosas circunscritas, escasas, dispersas, sin evidencia de sangrado activo.
La penúltima hospitalización fue el 29/05/2010 por melena y dolor abdominal. Se realizó EDA encontrándose angiodisplasias gástricas y duodenales las cuales recibieron termocoagulación con Argón plasma. Dada de alta el 06/06/10.
HOSPITALIZACIÓN ACTUAL: Paciente acudió a Emergencia un día después del alta de la penúltima hospitalización (07/06/10) refiriendo que había presentado dos episodios de deposiciones oscuras y luego sangrado rojo vinoso. La Hb llegó a 8.4g/dl y recibió 2 PG. Se realizó EDA encontrando una angiodisplasia gástrica que fue tratada con termocoagulación de Argón plasma.
EXAMEN FÍSICO: Funciones vitales normales, luce en REG, REH, REN. Piel: Tibia, pálida, hidratada, no ictericia. TCSC: No edema. Sistema Linfático: No adenopatías palpables, en tórax murmullo vesicular pasa bien en ACP, no ruidos agregados, ruidos cardiacos rítmicos, no soplos, abdomen con RHA normales, no doloroso a la palpación, no visceromegalia, tacto rectal: heces verdosas, génito-urinario: normal. Neurológico: LOTEP, no signos meníngeos ni de focalización.
EXÁMENES AUXILIARES: Leucocitos: 8520, Hb: 11g/ dl, Hto:33%, VCM:90.1, HCM:29.6, Plaquetas: 238000, TP: 10.99, TTPa:25, Fibrinógeno:453.8, Glu: 94mg/dl, U: 50mg/dl, Cr:0.67mg/dl, Proteínas totales: 6.81g/dl, Albumina:3.89g/dl, Bilirrubinas normales, TGO:21U/L, TGP:15U/L, Fosfatasa alcalina: 81U/L, Deshidrogenasa láctica: 309 U/L, Ca 19-9: <2 U/ml, CEA: 2.1ng/ml.
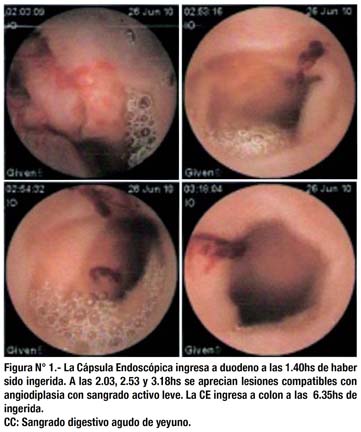
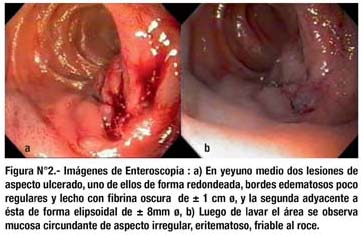
Se realizó proctoscopia encontrando hemorroides internas; la nueva colonoscopia mostró enfermedad diverticular de colon izquierdo; se realizó EDA sin encontrar evidencias de sangrado activo. Estando hospitalizada recurre el sangrado, el tacto rectal mostró heces rojo vinosas, por lo que inmediatamente se realizó cápsula endoscópica (Fig. 1) encontrándose signos de sangrado agudo yeyunal. La nueva enteroscopia anterógrada (Fig. 2) encontró lesiones ulceradas en yeyuno medio, se marcó el área adyacente con tinta china.
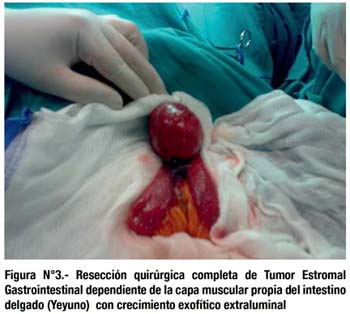
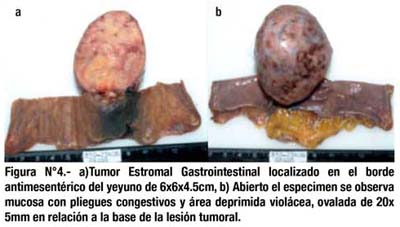
Fue sometida a laparotomía exploratoria (Fig. 3 y Fig. 4), encontrándose un tumor localizado en el borde antimesentérico del yeyuno a 2.8m de la válvula íleocecal, de crecimiento extraluminal, medía 6cm de diámetro, redondeado, liso, duro, de color violáceo, vascularizado que comprometía aparentemente toda la pared. La lesión no estaba adherida a otras estructuras, no se encontraron adenopatías, ni líquido libre. Se realizó resección del tumor y anastomosis yeyunal término-terminal.
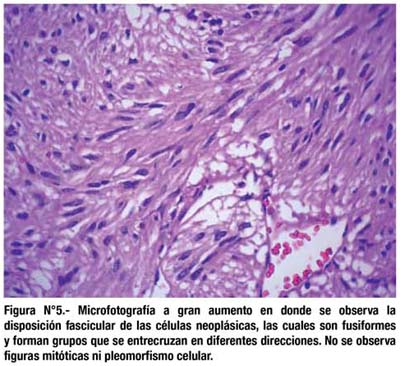
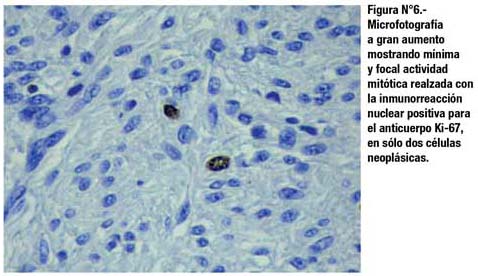
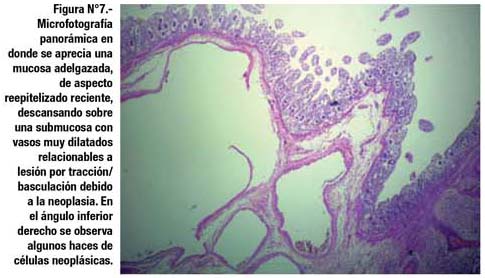
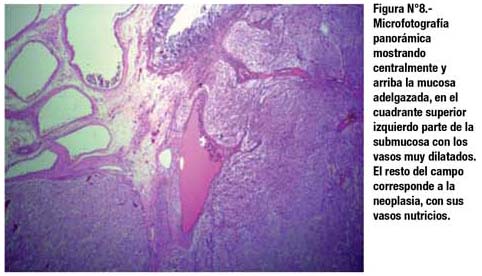
El estudio histológico mostró que se trataba de un Tumor Estromal Intestinal (GIST), de riesgo intermedio, patrón histológico fusiforme (Fig. 5), con escasa mitosis (Fig. 6), dependiente de la capa muscular propia del intestino delgado. La submucosa intestinal presenta estigmas de hemorragia antigua, adyacente a vasos distendidos en la base tumoral, relacionables a tracción (Fig. 7 y Fig. 8).
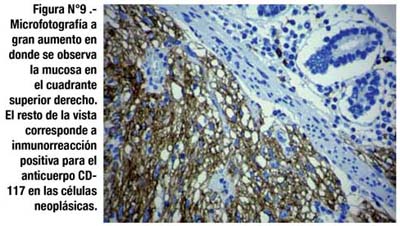
El estudio inmunohistoquímico mostró Vimentina y CD-117 positivos en células tumorales (Fig. 9), S-100 y Alfa Actina con positividad parcial y focal en células tumorales. NSE, CD-34, Actina, Sinaptofisina y Citoqueratina fueron negativos en células tumorales.
DISCUSIÓN
La incidencia de los Tumores Estromales Gastrointestinales (GIST) es ligeramente más alta en varones que en mujeres. Son usualmente afectados los adultos entre la quinta a séptima década, raros en niños y adultos jóvenes. La presentación clínica es variable. Frecuentemente el tumor es silente hasta que alcanza un tamaño grande momento en el cual puede producir malestar y dolor abdominal inespecífico, o ser reconocido como una masa palpable. Más del 25% de los pacientes se presentan con hemorragia digestiva dentro del tracto gastrointestinal o cavidad peritoneal debido a ruptura del tumor (10,11).
El presente caso se trata de una mujer de 84 años cuya edad está dentro del grupo atareo más afectado y que fue hospitalizada en varias oportunidades por anemia sintomática y hemorragia digestiva, estuvo en estudio durante aproximadamente 2 años y fue manejada como hemorragia digestiva de origen oscuro seis meses antes del diagnóstico.
El sangrado digestivo de origen oscuro (SDOO) es definido como el sangrado evidente de una fuente difícil de identificar, que persiste o recurre después de realizarse endoscopía alta y colonoscopia completa negativa, usualmente causado por sangrado del intestino delgado y representa aproximadamente el 5% de todos los casos de sangrado gastrointestinal (12).
Existen múltiples causas potenciales de SDOO; sin embargo, en pacientes menores de 40 años puede deberse a enfermedad inflamatoria intestinal, divertículo de Meckel, lesión de Dieulafoy o tumor del intestino delgado; en pacientes de más edad son más frecuentes las lesiones vasculares, erosiones o úlceras relacionadas a AINES (12,13).
Los tumores del intestino delgado son la causa del 5 -10% de SDOO, pero es la forma de presentación del 25 al 53% de estos tumores. Únicamente el 3% de los tumores del tracto gastrointestinal (TGI) se encuentran localizados en el intestino delgado. Los GIST y los leiomiomas son los más proclives a sangrar en esta localización y en general cursan con sangrado evidente.
Otros tumores como los carcinoides que en un 40% se ubican dentro de los 60cm proximales a la válvula ileocecal y los adenocarcinomas que se ubican principalmente a nivel duodenal (54%) y solo en un 18% a nivel ileal también pueden presentarse como SDOO pero la mayoría de veces no es severo, siendo la clínica más frecuente de los originados en el íleon la diarrea crónica y la pérdida de peso. Los linfomas primarios del TGI o en el contexto de enfermedad sistémica son el segundo tumor maligno del intestino delgado. Se localizan principalmente en el íleon terminal (53%), en segundo lugar en yeyuno (12%) y en tercer lugar en duodeno (14).
Entre los métodos diagnósticos de SDOO la Enteroscopia intraoperatoria tiene el más alto nivel de detección (70 100%) seguido por la Cápsula Endoscópica (50 -80%), la Enteroscopia doble balón (50-70%), la Enteroscopia balón simple (40-60%), la Enteroscopia espiral (40 – 50%), la Enteroscopia de pulsión (30-40%) y la Tomografía computarizada (TC) que incluye la TC enterografía y la TC angiografía (5 -50%) (15).
En el presente caso el diagnóstico de GIST yeyunal fue hecho mediante laparotomía exploratoria; la cápsula endoscópica (Fig. 1) reconoció el lugar de sangrado, la enteroscopia vía anterógrada confirmó la localización identifi cando lesiones ulcerosas de la mucosa producidas por el crecimiento tumoral (Fig. 2).
Los GISTs se presentan a lo largo del tracto gastrointestinal (TGI) con más alta frecuencia en el estómago (60%70%) y el intestino delgado (20%-30%), pero son raros en el colon y recto (5%-10%) y aún más raros en esófago, apéndice vermiforme o cualquier localización extraintestinal (<1%) (11).
El marcador inmunohistoquímico de los tumores GISTs es el C-Kit (CD-117), sin embargo, en algunos casos, especialmente en algunos GISTs mutantes del Receptor Alfa del Factor de Crecimiento Derivado de Plaquetas (PDGFRA) la positividad puede ser débil o estar ausente (2,3), en tales casos la alternativa de marcadores como la proteína kinasa C theta (PKC-) y CD34 pueden ser de utilidad; pero existen GISTs que son CD117 negativo y CD34 negativo, en cuyo caso es necesario el análisis molecular.
Los GISTs pueden mostrar una gran variedad de patrones histológicos. Los incidentales están generalmente compuestos de células fusiformes lisas en un estroma hialino y fi brótico (16). La actividad mitótica es mínima y son generalmente de bajo riesgo. Estos hallazgos sugieren que muchos GISTs incidentales involucionan y nunca progresan a crecimientos tumorales con significación clínica; sin embargo, hay indicios de que algunos factores genéticos son claves en la evolución de tumores más agresivos (17, 18).
Para los GISTs con significancia clínica los dos patrones histológicos más comunes son el fusocelular y el tipo epitelioide. Algunos GISTs muestran una mixtura de células epiteliodes y fusiformes. En algunos GISTs fusocelulares la semejanza al schwannoma es impresionante, e invariablemente resultó en este diagnóstico antes que la comprensión de la biología del GIST fuera común. Ahora se sabe que algunos GISTs pueden expresar el S-100, tal como lo hacen los schwannomas. De manera similar muchos de los GISTs fusocelulares de bajo grado aparentan ser leiomiomas y fueron probablemente diagnosticados como tales antes del advenimiento de la tinción KIT (CD117) y el análisis molecular.
Al igual que un verdadero tumor de músculo liso, los GISTs también pueden expresar marcadores musculares tales como actina específica muscular y actina de músculo liso (19). En adición patrones histológicos inusuales ocurren de tal manera que algunos GISTs semejan condrosarcomas, cordomas, hemangiomas y paragangliomas. La atipia celular pronunciada no es la característica de los GISTs, aunque algunos cambios degenerativos y células atípicas ocasionales pueden estar presentes. Además, algunos GISTs pueden presentar necrosis. Como regla general cualquier tumor con apariencia histológica de alto grado con extensa necrosis probablemente no sea un GISTs (20).
La mayoría de GISTs son fuertemente positivos cuando se tiñen con anticuerpos dirigidos contra la proteína KIT (CD117) sin embargo algunos muestran solamente una tinción CD117 débil o focal y otros son completamente negativos. Estos últimos tumores usualmente tienen mutaciones activadas en PDGFRA en lugar de c-KIT. La mayoría de GISTs (70%) son positivos cuando se tiñen para CD34, y aunque no es específico de GISTs, la positividad CD34 puede ser útil en evaluar aquellos tumores que son CD117 negativos o focalmente CD117 positivos.
Los GISTs también pueden mostrar expresión de marcador muscular así como la proteína S-100, pero estos no son específicos de GISTs y pueden ser vistos en tumores musculares y neurales. Una tinción útil para diferenciar GISTs de tumores musculares lisos es Desmina, que es raro en GISTs (19).
El análisis molecular en GISTs permite la identifi cación del exón activado que podría ayudar a los oncológos en la elección de la dosis adecuada de Imatinib, así largos estudios clínicos sugieren que 400mg de Imatinib es una apropiada dosis de inicio para GISTs positivos a la mutación c- KIT exón 11, pero para la mutación c-KIT exón 9 se sugiere la dosis de inicio de 800mg, lo cual parece proveer una mejor sobrevida libre de progresión (21,22).
Además, la identificación de una mutación activada en c-KIT o PDGFRA confirma el diagnóstico de GIST, independientemente de los resultados de la tinción inmunohistoquímica. Debido a que existe un espectro de la expresión de KIT en GISTs (23, 24), en la actualidad parece ser que las pruebas moleculares son la única manera de diagnosticar inequívocamente GISTs KIT negativo o GISTs con hallazgos inmunohistoquímicos inusuales (25,26).
Existen tumores que son CD117 positivo como: el carcinoma adenoideo quístico, el carcinoma de células Merkel y algunos carcinomas pulmonares de células pequeñas, tumores de mastocitos, y seminomas. Estos tumores usualmente no son considerados en el diagnóstico de un GIST y no deberían causar problema diagnóstico (20).
El diagnóstico de GIST está basado en la localización del tumor, la apariencia histológica, el inmunofenotipo y la alteración molecular. La mayoría de GISTs aparecen de la pared muscular del estómago y del intestino delgado y son inusuales en otros sitios.
En el caso de la paciente se trataba de un GIST de localización yeyunal dependiente de la capa muscular propia del intestino delgado, patrón histológico fusiforme, con escasas mitosis. La inmunohistoquímica resultó positiva para CD117, marcador más específico de los GISTs.
Adicionalmente existen los Tumores Estromales Extra-Gástricos (eGISTs) que comúnmente se encuentran en el omento y el mesenterio que hipotéticamente pueden representar GISTs exofíticos gástricos o intestinales que con el tiempo han perdido su conexión con el TGI (27). La explicación alternativa es que los eGISTs pueden ser derivados de una población pequeña de células que expresan KIT en estos lugares. En muchos casos los estudios de imágenes pueden ayudar con el diagnóstico.
Debido a que algunos GISTs muestran una apariencia histológica inusual, las tinciones inmunohistoquímicas juegan un rol importante en el diagnóstico. La mayoría de GISTs serán fuertemente CD117 y CD34 positivos. Por lo tanto un tumor que crece en la pared del TGI o en el mesenterio u omento, el cual es CD117 y CD34 positivo, puede ser diagnosticado como GIST sin pruebas adicionales (20).
Sin embargo, el diagnóstico de GIST no es siempre tan fácil. Algunos GISTs son CD117 negativos o focalmente CD117 positivo. En adición algunos tumores pueden ser CD117 positivo y no ser GISTs como por ejemplo el melanoma. Aunque en el futuro estarán disponibles tinciones inmunohistoquímicas para PDGFRA, PKC-
�, y DOG1 que tendrán un importante rol en el diagnóstico de GIST, aún no están ampliamente disponibles.El análisis molecular para mutaciones que activen c-KIT o PDGFRA es útil en caracterizar cualquier potencial GIST. Por lo tanto la detección de una mutación que active c-KIT o PDGFRA en un contexto clínico e histológico apropiado provee en la mayoría de los casos un diagnóstico inequívoco.
La identificación de los GISTS como tumores relacionados con CIC, y la demostración de la activación de mutaciones en c-Kit y PDGFRA, ha proporcionado unidad para un grupo de tumores estromales gastrointestinales antes supuesto heterogéneo. Además, la demostración de que estos tumores responde al inhibidor tirosina kinasa, el Imatinib, ha hecho de los GISTs uno de los tumores modelos para terapia blanco anti cáncer (28). No obstante se debe enfatizar que la cirugía es el principal modo de tratamiento para los GISTs y que la resección completa debe ser realizada cuando sea posible (29).
Los GISTs tienen un amplio espectro de comportamiento biológico rango de benigno a maligno. Los lugares más frecuentes de metástasis son el hígado y el peritoneo. Sin embargo, es difícil diferenciar entre lesión benigna y maligna basado solamente en los cambios histológicos.
Estudios previos han reportado la signifi cancia pronóstica del tamaño tumoral, el conteo mitótico, el índice del Ki-67, el subtipo de mutación KIT, la angiogénesis y la expresión aberrante del ciclo de células reguladoras(4). Predecir malignidad en GISTs es difícil y aparte del tamaño no existen características groseras que predigan el comportamiento biológico.
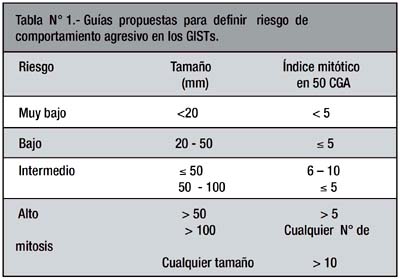
Para predecir el comportamiento de los GIST o al menos identificar aquellas lesiones más probables de metástasis, Fletcher et al. recomiendan el uso de la evaluación de riesgo (Tabla 1). Ellos categorizan los GISTs en 4 grupos: muy bajo, bajo, intermedio y alto riesgo, basados en la combinación del tamaño del tumor (punto de corte; 2, 5 ó 10cm) y conteo mitótico (punto de corte; 5/50 campos de gran aumento [CGA] y 10/50 CGA). Subsecuentes estudios han confirmado el valor pronóstico de esta clasificación de riesgo en una gran serie de GISTs (30).
Miettinen y col. recientemente propusieron el Sistema de Clasificación Modificado para evaluación pronóstica, basado en el análisis de un gran número de GISTs, que incluyeron más de 1700 casos gástricos y 900 casos de intestino delgado (5,11). Los autores indican que los GISTs gástricos muestran un comportamiento menos agresivo que los GISTs de intestino delgado (yeyunal e ileal) de similar tamaño y/o actividad mitótica.
Los GISTs gástricos con baja actividad mitótica tienen pronóstico relativamente favorable a pesar del tamaño tumoral grande. Sin embargo, aún el Sistema de Clasificación Modificado predice de forma incompleta el pronóstico del paciente individual con GIST. En particular en GIST de grado bajo a moderado aún es un reto predecir que individuos sufrirán un curso clínico adverso.
Los patólogos juegan un papel clave en el tratamiento y manejo de pacientes con GISTs. Ellos son responsables de proveer no sólo un exacto diagnóstico sino también de proporcionar las características claves del tumor, que permita al oncólogo planificar un protocolo de tratamiento apropiado (20).
Actualmente se considera al Imatinib como droga de primera línea para pacientes con GIST metastásico a dosis de 400mg/día y en pacientes con mutaciones que activen KIT exon -9 se sugiere aumentar la dosis a 800mg/día. Si se presenta progresión de enfermedad durante el tratamiento con Imatinib 400mg/día, se sugiere incrementar la dosis a 800mg/día. En el caso de mayor progresión o intolerancia al Imatinib, se recomienda Sunitinib a dosis de 50mg/día (31).
En los pacientes tratados quirúrgicamente de tumores localizados, como en el presente caso, la evaluación de riesgo basado en el conteo mitótico, tamaño tumoral y localización del tumor puede ayudar a elegir la política de seguimiento. Los pacientes con alto riesgo generalmente recaen dentro de los 2 a 3 años, mientras que los pacientes de bajo riesgo pueden recaer más tarde, aunque es poco probable.
Se sugiere seguimiento con Tomografía Espiral Multicorte (TEM) en los pacientes de alto riesgo y riesgo intermedio cada 3 4 meses durante los 3 primeros años, luego cada 6 meses hasta los 5 años y luego anualmente; para los pacientes con tumores de bajo riesgo el seguimiento es con TEM cada 6 meses por 5 años. Para los GIST con muy bajo riesgo probablemente no se requiera seguimiento de rutina, aunque se debe tener claro que el riesgo no es nulo (32, 33).
En conclusión el presente caso se trata de una mujer con un GIST yeyunal cuya presentación clínica poco frecuente fue de una hemorragia de origen oscuro que constituyó un problema diagnóstico y que gracias al advenimiento de nuevos procedimientos endoscópicos (enteroscopia y cápsula endoscópica) fue localizada y posteriormente extirpada quirúrgicamente.
En cuanto a las características anatomopatológicas de la tumoración, la localización de la lesión en intestino delgado le confiere un riesgo adicional comparativamente a un GIST gástrico y si tomamos en cuenta el tamaño del tumor (± 6x6x4.5cm) y el recuento mitótico (menor a 5 mitosis en 50 CGA) se cataloga como GIST de riesgo intermedio según la clasificación de Fletcher y col. que trata de determinar que pacientes van a tener un curso clínico agresivo.
Actualmente, un año después de la intervención quirúrgica (resección completa), la paciente permanece en control por consultorio externo y no se ha detectado ninguna evidencia de recurrencia de enfermedad, lo cual es esperable.
REFERENCIAS
1. KOH J, TRENT J, CHEN L, et al. Gastrointestinal stromal tumors: Overview of pathologic features, molecular biology, and therapy with imatinib mesylate. Histol Histopathol (2004) 19: 565-574.
2. RUBIN B, FLETCHER J, FLETCHER C. Molecular insights into the histogenesis and patogénesis of gastrointestinal stromal tumours. Int J Surg pathol 2000; 8:5-10.
3. CORLESS CL, SCHROEDER A, GRIFFITH D, et al; PDGFRA mutation in gastrointestinal stromal tumors: frequency, spectrum and in vitro sensitivity to imatinib. J Clin Oncol 2005; 23(23): 5357-64.
4. HASEGAWA T, MATSUNO Y, SHIMODA T, et al. Gastrointestinal stromal tumor: consistent CD117 immunostaining for diagnosis, and prognostic classifi cation based on tumor size and MIB-1 grade. Human Pathology2002; 33:669-76.
5. MIETTINEN M, SOBIN LH, LASOTA J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetics study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29:52- 68.
6. MUÑOZ C, SABAH S, NAVARRO A, et al. Tumores del estroma gastrointestinal (GIST): Revisión de la literatura. Gastr Latinoam 2006; 17 (1): 43-5.
7. PENNACCHIOLI et al. Update on management of GIST and postsurgical use of imatinib. Open Access Surgery 2010:3 63–71.
8. CHAK A, CANTO MI, RÖSCH T, et al. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997; 45:468-73.
9. KAMIYAMA Y, AIHARA R, NAKABAYASHI T, et al. 18F-fluorodeoxyglucose positron emission tomography: useful technique for predicting malignant potential of gastrointestinal stromal tumors. World J Surg 2005; 29:1429-35.
10. DEMATTEO R, HEINRICH M, EL-RIFAI W, et al. Clinical Management of Gastrointestinal Stromal Tumors: Before and After STI-571. Human pathology 2002; 33(5):466-477.
11. MIETTINEN M, LASOTA J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006; 23:70-83.
12. American Society for Gastrointestinal Endoscopy. The rol of endoscopy in the management of obscure GI bleeding.Gastrointest Endosc 2010; 72(3):471-479.
13. ESTEBAN SAPERA, Hemorragia digestiva baja : esa gran desconocida, Gastroenterology Hepatology 2007; 30(2):93-100.
14. MARULANDA V, PRIETO J. Hemorragia Digestiva de Origen Oscuro: Revisión de la literatura. www.gastrocol.com/aamaincs/homebwz.php.
15. ROCKEY D. Occult and obscure gastrointestinal bleeding: causes and clinical management. Nat. Rev. Gastroenterol. Hepatol 2010; 7: 265–279.
16. CHETTY R. Small and microscopically detected gastrointestinal stromal tumours: an overview. Pathology 2008; 40:9–12.
17. ROBSON ME, GLOGOWSKI E, SOMMER G, et al. Pleomorphic characteristics of a germ-line KIT mutation in a large kindred with gastrointestinal stromal tumors, hyperpigmentation, and dysphagia. Clin Cancer Res 2004; 10:1250–4.
18. KLEINBAUM EP, LAZAR AJ, TAMBORINI E, et al. Clinical, histopathologic, molecular and therapeutic findings in a large kindred with gastrointestinal stromal tumor. Int J Cancer 2008; 122:711–8.
19. MIETTINEN M, LASOTA J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006; 130:1466–78.
20. HOLDEN J, WILLMORE-PAYNE C, LAYFIELD L. Gastrointestinal stromal tumors:a guide to the diagnosis. Surgical Pathology 2010,3: 241–276.
21. DEBIEC-RYCHTER M, SCIOT R, LE CESNE A, et al. Kit mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 2006; 42:1093–103.
22. HEINRICH MC, MAKI RG, CORLESS CL, et al. Primary and secondary kinase genotypes correlate with the biological and clinical activity of sunitinib in imatinibresistant gastrointestinal stromal tumor. J Clin Oncol 2008; 26(33):5352–9.
23. HALLER F, HAPPEL N, SCHULTEN HJ, et al. Site-dependent differential KIT and PDGFRA expression in gastric and intestinal gastrointestinal stromal tumors. Mod Pathol 2007; 20:1103–11.
24. KIRKEGAARD T, EDWARDS J, TOVEY S. Observer variation in immunohistochemical analysis of protein expression, time for a change? Histopathology 2006; 48:787–94.
25. LIPPAI N, FU¨ LE T, NE´METH T, et al. Keratin-positive gastrointestinal stromal tumor of the stomach mimicking gastric carcinoma: diagnosis confi rmed by c-kit mutation analysis. Diagn Mol Pathol 2008; 17(4):2414.
26. ROSSI G, SARTORI G, VALLI R, et al. The value of c-kit mutational analysis in a cytokeratin positive gastrointestinal stromal tumour. J Clin Pathol 2005; 58:991–3.
27. AGAIMY A, WUNSCH PH. Gastrointestinal stromal tumours: a regular origin in the muscularis propria, but an extremely diverse gross presentation. A review of 200 cases to critically re-evaluate the concept of so-called extra-gastrointestinal stromal tumours. Langenbecks Arch Surg 2006; 391:322–9.
28. HIROTA S, ISOZAKI K. Pathology of gastrointestinal stromal tumors. Pathol Int 2006; 56(1): 1-9.
29. DE MATTEO R, LEWIS J, LEUNG D et al; Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Annals of surgery 2000, 231(1): 51-58.
30. FLETCHER CD, BERMAN JJ, CORLESS C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum pathol 2002; 33:459-65.
31. BLAY JY, REICHARDT P. Advanced gastrointestinal stromal tumor in Europe: a review of updated treatment recommendations.Expert Rev Anticancer Ther. 2009 Jun; 9(6):831-8.
32. CASALI P, JOST L, Reichardt P.Gastrointestinal stromal tumors: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Annals of Oncology 2008; 19 (Supplement 2): ii35–ii38.
33. KANG Y, KIM K, SOHN T, et al. Clinical Practice Guideline for Accurate Diagnosis and Effective Treatment of Gastrointestinal Stromal Tumor in Korea. J Korean Med Sci 2010; 25: 1543-1552.













