Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Gastroenterología del Perú
versão impressa ISSN 1022-5129
Rev. gastroenterol. Perú v.31 n.4 Lima out./dic. 2011
REPORTES DE CASOS
Tumor fibroso solitario hepático
Hepatic solitary fibrous tumor: report of a case
Lourdes Huanca1 ; Patricia Webb1 y Eloy Ruiz2
1. Médico Anatomopatóloga asistente del Departamento de Patología, Instituto Nacional de Enfermedades Neoplásicas, Lima - Perú
.2. Médico Cirujano Abdominal asistente del Departamento de Cirugía de Abdomen, Instituto Nacional de Enfermedades Neoplásicas, Lima - Perú.
RESUMEN
El Tumor Fibroso Solitario es una neoplasia mesenquimal muy infrecuente a nivel hepático. Reportamos un nuevo caso en una paciente de 52 años de edad. La imagen tomográfica revelaba una tumoración sólida bien delimitada, localizada en el lóbulo hepático derecho. Macroscópicamente era de bordes regulares, blanquecina, de carácter expansivo. La microscopia reveló una tumoración fusocelular, de vasculatura hemangiopericitoide, con extensas áreas de hialinización; positiva para marcadores de inmunohistoquímica para CD 34, CD 99 y Bcl-2. Pese a su rareza, el tumor fibroso solitario debe de ser considerado entre los diagnósticos diferenciales de las tumoraciones fusocelulares a nivel hepático.
PALABRAS CLAVE: Tumor Fibroso Solitario, CD34, neoplasia fusocelular.
ABSTRACT
Solitary fibrous tumor is a very uncommon mesenchymal neoplasia in the liver. We report a new case in 52 year old patient. The tomographic image revealed a solid, well delimitated tumor, localized at the right hepatic lobe. Macroscopically, it had rounded borders, was expansive and white. Microscopically it had a spindle cell pattern with extensive areas of hyalinization and hemangiopericytic vessels; it was positive with inmunohistochemestry markers for CD34, CD99 and Bcl-2. Despiteitsrarity, solitary fibrous tumor shouldbe considered among the differential diagnosis of the spindle cell tumors of the liver.
KEY WORDS: Solitary fibrous tumor, CD34, spindle cell neoplasia.
INTRODUCCIÓN
El tumor fibroso solitario (TFS) es una neoplasia mesenquimal poco común de probable tipo (mio)fibroblástico, que muestra un característico patrón vascular ramificado hemangiopericitoide y que usualmente se desarrollan en la pleura, mediastino o mesenterio. Desde su primera descripción (1), hasta un 30% de los casos han sido reportados en partes blandas y órganos parenquimales. Pocos son los casos descritos en hígado (2,3,4,5,6,7,8,9,10,1 1,12,13,14,15,16,17,18) siendo por lo tanto raros. Se reporta aquí un caso más de tumor fibroso solitario desarrollado en hígado.
REPORTE DE CASO
Paciente mujer de 52 años, con tiempo de enfermedad de 2 años, caracterizado por hiporexia, pérdida de peso y dolor a nivel torácico. Al examen físico se palpaba hígado aumentado de tamaño de superficie regular, a 8 cm por debajo del reborde costal, de consistencia firme y a 12 cm del apéndice xifoides. En la tomografía y resonancia magnética se encontró una tumoración sólida lobulada hipodensa, con captación heterogénea de contraste (mas intensa en la periferia), localizada en el lóbulo hepático derecho, comprometiendo los segmentos hepáticos VII, VIII, V y VI en íntimo contacto con la vena porta (figs. 1 y 2)
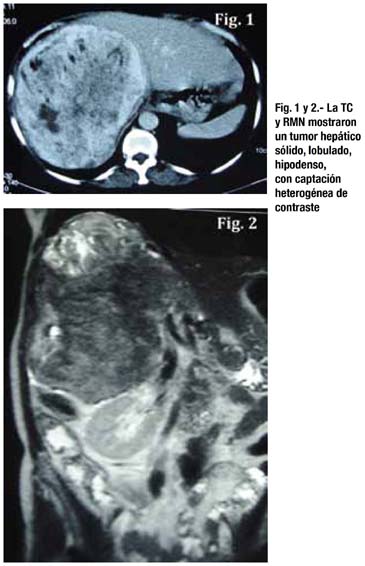
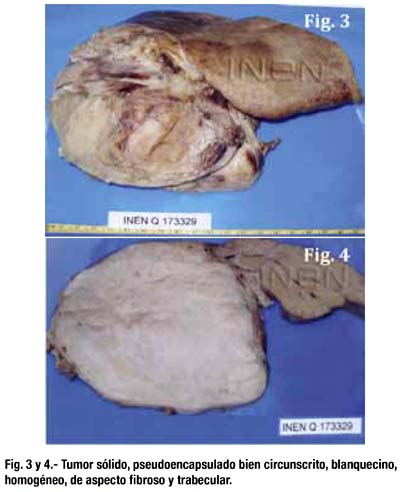
Se le realizó laparotomía exploratoria y trisegmentomía hepática derecha. Se resecó gran tumoración de 28x15x9 cm dependiente de segmentos IV, V, VIII y VII que desplazaba estructuras vasculares y comprimía la vena cava inferior.
Al corte la tumoración era sólida, pseudoencapsulada, de bordes expansivos, bien circunscrita, de consistencia firme, blanquecina, homogénea, de aspecto fibroso y trabecular en su superficie de corte (figs. 3 y 4).
En la microscopía se observó un patrón histológico fusocelular, de celularidad variada, con patrón de crecimiento desordenado a estoriforme, bandas densas de colágeno, vasos prominentes "hemangiopericitoides" de paredes hialinizadas. No se observó necrosis ni atípia nuclear, el índice mitótico era bajo, de hasta 2 mitosis en 10 campos de alto poder. (fig. 5 a-e)
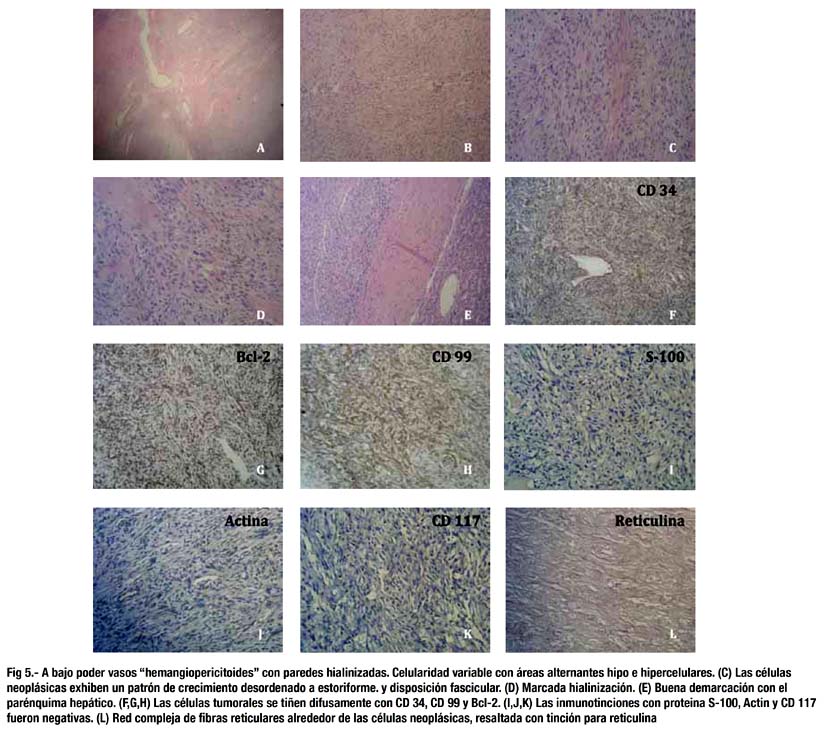
El perfil inmunohistoquímico fue CD34(+), Bcl-2(+), CD99(+), S-100(-), Actina(-), Panqueratina(-), EMA(-) y CD117(-) (fig. 5 f-K). La histoquímica para reticulina revelaba una red compleja de fibras reticulares alrededor de las células neoplásicas (fig. 5L).
Con todos estos hallazgos se hizo el diagnóstico de Tumor Fibroso Solitario. El resto del parénquima hepático no mostró alteraciones microscópicas significativas.
COMENTARIOS
El tumor fibroso solitario (TFS) es una neoplasia mesenquimal fusocelular reportada en partes blandas y diversos órganos (2-15,17-25). Es una neoplasia primitiva mesenquimal (mio) fibroblástica con características de diferenciación múltiple (8,15).
Se originan más frecuentemente en la pleura y ocasionalmente en el peritoneo, mediastino o mesenterio, siendo muy raros a nivel hepático. Se cree que en este órgano se originan a partir de la capa interna de la cápsula de Glisson, o que desde los tejidos conectivos fibrosos pueden crecer hacia el parénquima hepático (5).
Algunos autores sugieren que la irradiación hepática puede inducir la transformación fibrótica en un tumor fibroso solitario (8).
El rango de la edad de presentación es amplio, con predominancia del sexo femenino(5,8,9). Clínicamente se presentan con un amplio rango de síntomas dependiendo del tamaño tumoral y la compresión de las estructuras adyacentes, incluyendo fatiga, pérdida de peso, masa palpable al examen físico y manifestaciones de hipoglicemia, esta última puede ser causada por la sobreexpresión de IGF-II por las células tumorales (10,11).
Imagenológicamente, ante la presencia de una lesión única, grande, bien circunscrita de captación heterogénea hepática, se debe de considerar el diagnóstico de este tipo de tumores (17).
El diagnóstico definitivo es microscópico. Muestran a predominio un patrón fusocelular. La disposición de las células varía de área en área en el mismo tumor. En algunas zonas las células pueden formar pequeños fascículos mal definidos, mientras que en otras muestran una disposición desordenada. Otra característica sugestiva es la notoria hialinización estromal tipo queloidal, en estas áreas las células usualmente se disponen aisladas o en pequeños grupos paralelos y cercanos a los haces de colágeno denso. Presenta también vasos ramificantes hemangiopericitoides con hialinización perivascular (2,3,4,5,6,15).
El perfil inmunohistoquímico que presentan es positividad para CD34 (>90%) (4,13,15), CD99 (70%), Bcl-2 (30%), EMA (30%) y Actina (20%). Ocasionalmente pueden presentar positividad focal para la proteina S-100, citoqueratinas y/o desmina, pero por lo general son negativos para estas últimas (4).
Nuestro caso mostró positividad marcada difusa para CD 34, CD 99 y Bcl-2; siendo negativo para S-100, Actina, CD 117, EMA y Panqueratina.
En un estudio de TFS pleuro-pulmonares, Schirosi y col.(20) encontraron que la expresión de p53 puede representar una prueba valida y fácil como factor pronóstico con relación significativa a la superviviencia total y a la supervivencia libre de enfermedad.
No se han identificado aún alteraciones (cito) genéticas típicas; se sugiere que existe un amplio rango de cambios genéticos en los TFSs, no habiendo una aberración consistente o específica que pueda ser útil en el diagnóstico de esta enfermedad (15,16,25).
Aunque la mayoría de casos de TFS tienen un comportamiento benigno, este es impredecible pudiendo comportarse de forma agresiva caracterizada por recurrencia local y metástasis a distancia (15,18,19). Este comportamiento biológico puede no siempre correlacionarse con las características histomorfológicas atípicas. Las características mas importantes que sugieren un gran riesgo de recurrencia local y metástasis son celularidad aumentada, pleomorfismo celular, actividad mitótica aumentada (>4/10 campos de alto poder) y necrosis (4,15,18). El tamaño tumoral mayor a 10 cm también ha sido considerado como factor pronóstico de recurrencia local y metástasis (22,24). En nuestro caso, no hubo evidencia de diseminación metastásica.
El diagnóstico diferencial del tumor fibroso solitario es amplio, incluyendo lesiones benignas fusocelulares que pueden tener patrón hemangiopericitoide como fibroma, tumor miofibroblástico inflamatorio, angiolipoma, leiomioma, schwannoma y sarcomas metastáticos o primarios. Razón por la cual los estudios con inmunohistoquímica son imprescindibles para el diagnóstico definitivo.
El tratamiento es quirúrgico, se recomienda la escisión completa de estos tumores con margen adecuado (5,15). La resecabilidad es el factor determinante más importante de recurrencia (22). El rol de la terapia adyuvante no ha sido aun establecido. Ya que los tumores fibrosos solitarios se consideran como tumores de potencial maligno incierto, es recomendable hacer un cuidadoso seguimiento clínico a largo plazo en todos los casos.
La paciente tuvo una evolución buena ya a dos años de su tratamiento quirúrgico, sin evidencia de recurrencia ni de metástasis.
Correspondencia:
lulita1411@hotmail.com
REFERENCIAS
1. KLEMPERER P, RABIN CB. Primary neoplasms of the pleura: a report of five cases. Arch Pathol. 1931; 11:385–412.
2. GUILLOU L., FLETCHER JA et al. Extrapleural solitary fibrous tumour and haemangiopericytoma. En WHO Pathology and Genetics of Tumours of Soft tissue and bones 2002; pág.86.
3. WEISS S., GOLDBLUM J. Eizinger and Weisss Soft Tissue Tumors. 2008. 5th edition. Mosby Elservier
4. ISHAK K., P. ANTHONY. Mesenchymal tumours of the liver. En: Pathology and Genetics of Tumours of the Digestive System. Lyon. World Health Organization 2000; p. 191–198.
5. MORAN C., ISHAK K. Solitary Fibrous Tumor of the Liver: A Clinicopathologic and Immunohistochemical Study of Nine Cases. Annals of Diagnostic Pathology 1998; 2 (1): 19-24.
6. CRAIG JR, PETERS RL, Edmondson HA. Tumors of the liver and intrahepatic bile ducts. In: Atlas of tumor pathology. Washington D.C.: Armed Forces Institute of Pathology 1989; p. 92–94.
7. LEVINE TS, ROSE DS. Solitary fibrous tumour of the liver. Histopathology 1997; 30(4): 396–397.
8. PERINI MV., HERMAN P. Solitary fibrous tumor of the liver: Report of a rare case and review of the literature. International journal of surgery 2008; (6): 396–399
9. VENNARECCI G., ETTORRE GM. Solitary fibrous tumor of the liver. J Hepatobiliary Pancreat Surg 2005; (12): 341–344.
10. CHAN G., HORTON P. Malignant transformation of a solitary fibrous tumor of the liver and intractable hypoglycemia. J Hepatobiliary Pancreat Surg 2007; (14): 595–599.
11. FAMÀ F., LE BOUC Y. Solitary fibrous tumour of the liver with IGF-II-related hypoglycaemia. A case report. Langenbecks Arch Surg 2008; (393): 611–616.
12. CHITHRIKI M. JAIBAJI M. Solitary fibrous tumor of the liver presenting symptoms of hypoglycemic coma. Am surg 2004; 70(4): 291-293.
13. KWAK SY., GWAK GY. A case of solitary fibrous tumor of the liver. Korean J Hepatol 2007; 13(4): 560564.
14. KORKOLIS DP., APOSTOLAKI K. Solitary fibrous tumor expressing CD34 and vimentina: a case report. World J Grastroenterol 2008; 14(40): 6261-6264.
15. GRAADT VAN ROGGEN JF., Hogendoorn PCW. Solitary fibrous tumour: the emerging clinicopathologic spectrum of an entity and its differential diagnosis. Current Diagnostic Pathology 2004; (10): 229–235.
16. TORABI A., LELE S. Lack of a common or characteristic cytogenetic anomaly in solitary fibrous tumor. Cancer Genetics and Cytogenetics 2008; (181): 6064.
17. FUKSBRUMER M., KLIMSTRA D. Solitary Fibrous Tumor of the Liver: Imaging Findings. AJR 2000; (175):1683–1687.
18. DE CHIARA A., IZZO F. Two Well-Circumscribed Masses in the Liver. Arch Pathol Lab Med 2003; 127 (May): e255-e256.
19. HASEGAWA T., MATSUNO Y. Extrathoracic Solitary Fibrous Tumors: Their Histological Variability and Potentially Aggressive Behavior. HUMAN PATHOLOGY 1999; 30 (12): 1464-1473.
20. SCHIROSI L., LANTUEJOUL S. Pleuro-pulmonary Solitary Fibrous Tumors. A Clinicopathologic, Immunohistoche-mical and Molecular Study of 88 Cases Confirming the Prognostic Value of de Perrot Staging System and p53 Expression, and Evaluating the Role of c-kit, BRAF, PDGFRs (a/b), c-met, and EGFR. Am J Surg Pathol 2008; (32):1627–1642.
21. CHAN JKC. Solitary fibrous tumoreverywhere, and a diagnosis in vogue. Histopathology 1997; 31: 568–576.
22. KIM L., LAN PAIK A. et al. Extrapleural malignant solitary fibrous tumor. Basic and Applied Pathology. 2008; 1: 102–106.
23. MORIMITSU Y., NAKAJIMA M. et al.
Extrapleural solitary fibrous tumor: clinicopathologic study of 17 cases and molecular analysis of the p53 pathway. APMIS 2000; 108: 617–625.24. GOLD J., ANTONESCU C. et al.
Clinicopathologic correlates of solitary fibrous tumors. Cancer 2002; 94(4): 1057-1068.25. MIETTINEN M. Solitary Fibrous Tumor, Hemangiopericytoma, and Related Tumors. In: Markku Miettinen. Modern Soft Tissue Pathology: Tumors and Non-Neoplastic Conditions. Cambridge University Press; 2010. p. 335-347.













