Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Gastroenterología del Perú
versión impresa ISSN 1022-5129
Rev. gastroenterol. Perú v.32 n.1 Lima ene./mar. 2012
ARTÍCULOS ORIGINALES
Impacto de la esplenectomia y/o pancreatectomia distal en el pronóstico del cáncer gástrico proximal
Impact of splenectomy and/or distal pancreatectomy in the prognosis of the proximal gastric cancer
Edmundo Mori Gonzales1 ; Juan Celis2 ; Eloy Ruiz2 ; Eduardo Payet2 ; Francisco Berrospi2 ; Iván Chavez2 ; Frank Young2 ; Carlos Luque2 ; Jaime Montes3
1 Servicio de Cirugía General Especializada y Oncológica, Hospital IV Alberto Sabogal Sologuren, Lima, Perú.
2 Departamento de Abdomen, Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú.
3 Departamento de Anatomía Patológica, Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú.
RESUMEN
OBJETIVOS: Identificar factores pronósticos asociados a gastrectomías totales o proximales con o sin esplenectomía y/o pancreatectomía distal en pacientes con cáncer gástrico proximal. Evaluar la frecuencia de metástasis ganglionar en el hilio y arteria esplénica, la morbimortalidad postoperatoria y el impacto de la linfadenectomía del grupo 10 y 11 en la sobrevida del paciente.
MATERIALES Y METODOS: Es un estudio observacional, descriptivo, longitudinal y retrospectivo que analiza pacientes con diagnóstico de adenocarcinoma gástrico del tercio proximal sometidos a gastrectomía total y/o proximal asociada o no a esplenectomía y/o pancreatectomía distal, en el Departamento de Abdomen del Instituto Nacional de Enfermedades Neoplásicas entre 1990 y 2005. La sobrevida global para cada uno de los grupos fue calculada utilizando, el método de Kaplan-Meier, los factores pronósticos fueron evaluados utilizando el análisis univariado y multivariado de Cox.
RESULTADOS: Fueron estudiados 219 pacientes con adenocarcinoma gástrico del tercio proximal (cardias y fondo), de los cuales, según los criterios de inclusión, califican solo 129 (N= 129): 22 (17.1%) se trataron mediante gastrectomía sola, 79 (61.2%) gastrectomía asociada a esplenectomía y 28 (21.7%) gastrectomía con pancreatoesplenectomía distal, constituyendo tres grupos de tratamiento.
Se comparó la supervivencia de cada grupo y en cada factor analizado, determinando los siguientes factores pronósticos: compromiso ganglionar (N2 –N3), grado histológico indiferenciado y tumores Borrmann III y IV. Ni la esplenectomía ni la pancreatoesplenectomía distal mejoró la supervivencia con respecto a la gastrectomía sola. La morbimortalidad fue mayor en los pacientes con cirugía más agresiva pero sin valor significativo.
CONCLUSIONES: El número de ganglios extirpados en pacientes que tuvieron pancreatoesplenectomía y/o esplenectomía fue mayor, sin embargo, no tuvo impacto en la sobrevida a 5 años.
PALABRAS CLAVES: Cáncer gástrico proximal. Gastrectomía. Esplenectomía. Pancreatectomía distal. Factores pronósticos.
ABSTRACT
OBJECTIVES: Identify prognostic factors associated to total or proximal gastrectomy with or without splenectomy and / or distal pancreatectomy in patient with proximal gastric cancer. Evaluate the frequency of lymph node metastasis to the hilum and splenic artery, postoperative morbidity and mortality and the impact of lymphadenectomy of group 10 and 11 on long term survival.
MATERIALS AND METHODS: We performed an observational, descriptive, longitudinal and retrospective study analyzing patients with diagnostic of proximal third gastric adenocarcinoma subjected to total or proximal gastrectomy with or without splenectomy or distal pancreatectomy in the service of Abdomen of the Instituto Nacional de Enfermedades Neoplásicas between 1990 and 2005. Overall survival for each of the groups was calculated using the Kaplan-Meier method, prognostic factors were evaluated using univariate and multivariate analysis.
RESULTS: We studied 219 patients with proximal third gastric adenocarcinoma (cardias and bottom), of wich, according to inclusion criteria, only qualify 129 (N=129): 22 (17.1%) were treated by gastrectomy alone, 79 (61.2%) gastrectomy associated witch splenectomy and 28 (21.7%) gastrectomy with distal pancreatosplenectomy, constituting three treatment groups. We compared the survival of each group and each factor analyzed, determining the following prognostic factors: lymph node metastasis (N2-N3), degree of differentiation, undifferentiated tumors and Borrmann III and IV tumors. Neither splenectomy or distal pancreatectosplenectomy improved survival compared to the gastrectomy alone. The morbidity and mortality was higher in patients with more aggressive but more aggressive surgery without significant value.
CONCLUSIONS: The number of nodes removed in patients who had pancreatosplenectomy and /or splenectomy was higher, however, had no impact on survival at 5 years.
KEY WORDS: Proximal gastric cancer. Gastrectomy. Splenectomy. Distal pancreatectomy. Prognostic factors.
INTRODUCCIÓN
El cáncer gástrico es la cuarta neoplasia más frecuente del mundo1. En el registro de cáncer de Lima metropolitana, el cáncer gástrico es el más frecuente, ocupando el segundo lugar en el sexo masculino luego del cáncer de próstata, mientras que en el sexo femenino ocupa el tercer lugar después del cáncer de Mama y de Cérvix respectivamente2.
En el Japón las tasas de cáncer gástrico precoz llegan al 60% de sus casos y en el resto del mundo la mayoría de casos son estadíos clínicos avanzados, obteniendo bajas tasas de supervivencia3. Son muchos los trabajos japoneses que indican buenos resultados en el impacto de la linfadenectomía ampliada en el cáncer gástrico avanzado4-5. En algunos centros occidentales, la linfadenectomía extendida ha obtenido mejoras en la supervivencia, fundamentalmente en estadios no muy avanzados, como el estadio IB y II6-7. Aunque en cáncer gástrico de tercio proximal este tipo de linfadenectomía se puede realizar sin necesidad de extirpar páncreas distal y/o bazo8, lo cierto es que la mayoría de los cirujanos occidentales proceden a la extirpación para facilitar el vaciamiento de los ganglios del hilio esplénico9. En tumores gástricos avanzados las posibilidades que estos ganglios estén afectados son relativamente altas. No obstante, también ha quedado demostrado que la extirpación de estas estructuras conlleva un mayor número de complicaciones postoperatorias9-10. Ya se ha demostrado que las complicaciones postoperatorias más frecuentes se encuentran en los pacientes con gastrectomía más esplenectomía con intención curativa que sin esplenectomía11-12-13-14-15.
En contraposición, el grupo japonés menciona que la resección del órgano adyacente no es componente esencial de la resección D2, apoyado del método de Maruyama, en donde se preserva el páncreas, el cual disminuye las complicaciones asociadas con la resección, pero no la radicalidad de ésta16. Todos los estudios apuntan a realizar un estadiaje más preciso mediante resecciones D2, pudiendo no solo identificar pacientes de alto riesgo con ganglios positivos, sino aún mejorar la sobrevida. De ahí que la mayoría de grupos extranjeros están avocados a modificar el tratamiento quirúrgico estándar recomendado por la UICC y hacer énfasis en el exámen histológico en un número corregido de ganglios por nivel anatómico: para la estación N1 (15 ganglios) y para la estación N2 (25 ganglios). Así se mejoraría la probabilidad de detectar metástasis ganglionar17.
Muchos Autores como Okajima18 Roukos19 Wanebo20 Yoshizumi21 proveen en sus estudios la evidencia necesaria para la linfadenectomía D2, los cuales refieren que la gastrectomía con linfadenectomía del hilio esplénico sin esplenectomía podría disminuir la morbilidad postoperatoria, pudiéndose preservar el bazo para los estadios del I al III, o realizar esplenectomía selectivas en los estadios II y III con metástasis ganglionar palpable.
Los objetivos de este trabajo son identificar los factores pronósticos asociados a gastrectomías totales o proximales con o sin esplenectomía y/o pancreatectomía distal en pacientes con cáncer gástrico proximal. Evaluar la frecuencia de metástasis ganglionar en el hilio esplénico y arteria esplénica, la morbimortalidad postoperatoria asociada y el impacto de la linfadenectomía del grupo 10 y 11 en la sobrevida del paciente.
MATERIALES Y MÉTODOS
Es un estudio observacional, descriptivo, longitudinal y retrospectivo, que analiza los datos registrados de pacientes que fueron diagnosticados y operados por adenocarcinoma gástrico del tercio proximal en el Departamento de Abdomen del Instituto Nacional de Enfermedades Neoplásicas (INEN) entre enero de 1990 hasta diciembre del 2005.
Criterios de Inclusión
-
Diagnóstico de adenocarcinoma gástrico del tercio proximal. Gastrectomía total y/o proximal asociada o no a esplenectomía y/o pancreatectomía distal. Resección R0 (Sin tumor residual microscópico o macroscópico).
Criterios de exclusión
-
Antecedentes de otras neoplasias malignas intraabdominales de presentación sincrónica
-
Sometidos a cirugía paliativa.
-
Enfermedad residual
-
Pacientes con metástasis a distancia.
-
Operados en otras instituciones y que llevan un seguimiento en el INEN.
Los datos clínicos, el reporte operatorio y el resultado patológico se obtuvieron de la historia clínica. El estudio histológico estuvo a cargo de patólogos especializados en el área, el cual se basó en los hallazgos macroscópicos y microscópicos del tumor y en el informe anatomopatológico se consignó el tipo histológico, la profundidad de invasión, el compromiso de bordes de sección, el número de ganglios resecados y comprometidos en cada grupo ganglionar y el total de ganglios resecados.
Los pacientes fueron intervenidos por diferentes miembros del servicio de abdomen, pero siguiendo siempre los mismos tiempos quirúrgicos estándar en la cirugía oncológica gástrica.
Análisis estadístico
Recolectada la información fue codificada y procesada utilizando el paquete estadístico SPSS 12. Se analizó la existencia de algún tipo de relación significativa entre las diferentes variables clínico histológicas para cada una de las cirugías con el test o prueba de Chi cuadrado y la "t" de student. Posteriormente se evaluó la influencia en la supervivencia para cada una de las variables utilizando el método de Ka-plan Meier y log rank test para determinar las diferencias entre los grupos. Para el análisis de los factores pronósticos se recurrió al modelo de riesgos proporcionales de Cox, que es una técnica multivariada.
Definición de variables
Gastrectomía con esplenectomía y preservación pancreática (Método de Maruyama)16: Resección del estomago y bazo. Se realiza una disección ganglionar D2 incluyendo los ganglios alrededor d e la arteria esplénica, para lo cual se secciona dicha arteria posterior al nacimiento de la arteria pancreática dorsal, y la vena se secciona en la parte más caudal del páncreas con preservación del mismo.
Morbilidad y mortalidad postoperatoria: se definió como la ocurrida durante los 30 días del periodo post-operatorio.
La estadificación se realizó con la clasificación de la Sociedad Japonesa de Investigación del Cáncer Gástrico (JRSGC)(38), para el presente trabajo se re estadificó según la sexta edición de la UICC22.
Los registros de seguimiento por consulta externa fueron revisados, se contactó a algunos de los pacientes o a sus familiares por vía telefónica para verificar su condición actual y seguimiento o visita de asistenta social o búsqueda en la RENIEC.
Se realizó una revisión y descripción bibliográfica actualizada de las opciones terapéuticas de manejo quirúrgico y opciones intra operatorias variadas del manejo del adenocarcinoma gástrico del tercio proximal.
Este estudio es viable porque el INEN representa un centro referencial de enfermedades oncológicas en el Perú.
RESULTADOS
Se encontró 219 pacientes que fueron diagnosticados y operados por adenocarcinoma gástrico del tercio proximal, de los cuales, según los criterios de inclusión, califican solo 129 pacientes (N= 129).
Características clínico patológicas
Los 129 pacientes fueron intervenidos quirúrgicamente mediante tres tipos de procedimientos: 22 (17.1%) se trataron mediante gastrectomía sola, 79 (61.2%) mediante gastrectomía asociada a esplenectomía y 28 (21.7%) mediante gastrectomía con pancreatoesplenectomía distal, constituyendo los tres grupos de tratamiento, de los cuales se analizan las características clínico patológicas para cada una de ellas, detalladas en la tabla Nº 1.
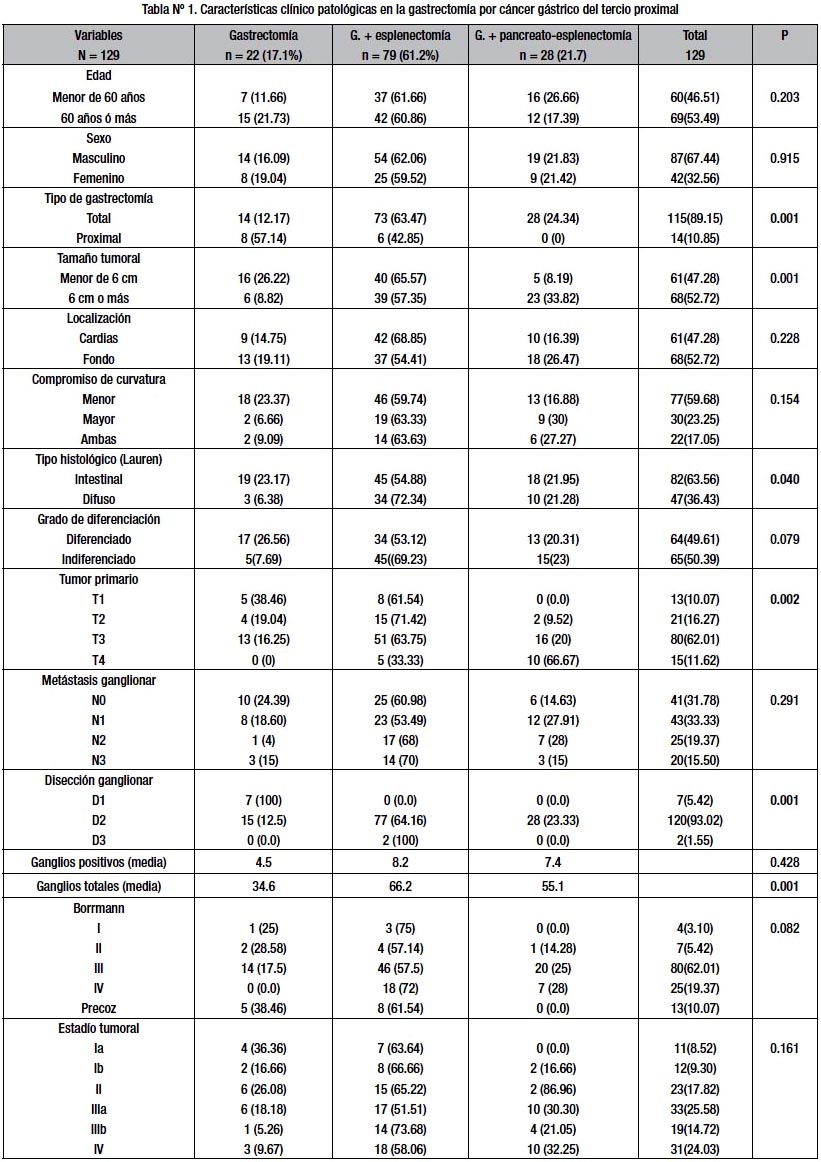
Con relación a la edad, se toma punto de corte 60 años para tener grupos comparables, encontrando 69 pacientes mayores de 60 años que constituye el 53.49% del total y 60 pacientes menores de 60 años que constituye el 46.51 % del total. La edad media para cada unos de los grupos fue 67, 65 y 64 años para gastrectomía sola, gastrectomía con esplenectomía y para gastrectomía con pancreatoesplenectomía respectivamente; siendo el paciente de menor edad de 28 años y el de mayor edad de 94 años. Predominó el sexo masculino sobre femenino en una relación 2:1 (87 varones por 42 mujeres). Al utilizar el método estadístico Chi cuadrado, no se encontró diferencia significativa en edad y sexo al comparar los tres grupos de tratamiento.
En cuanto al tamaño tumoral, se toma como punto de corte 6 cm para tener grupos comparables, encontrando tumores mayores de 6 cm en 68 pacientes y menores de 6cm en 61 pacientes. Observamos que de los pacientes que tuvieron tumores mayores de 6cm, el 57.35% fue sometido a gastrectomía más esplenectomía, seguida de gastrectomía con pancreatoesplenectomía en 33.82% y gastrectomía sola en 8,82%. Al comparar el tamaño tumoral para cada uno de los grupos se encontró diferencia significativa (p=0.01).
La localización más frecuente fue el fondo gástrico (52.72%), seguida del cardias (47.28%). La curvatura menor fue la más afectada (59.68%), seguida de la curvatura mayor (23.25%) y ambas curvaturas (17.05%), sin diferencia significativa en los tres grupos de tratamiento.
Al analizar el tipo histológico, el tipo intestinal fue 63.56% y el difuso fue 36.43%, siendo estadísticamente significativa al comparar el tipo histológico en los tres grupos (p=0.040). Según el grado de diferenciación, el tipo indiferenciado fue 50.39%, el diferenciado 49.61%, sin diferencia significativa en los tres grupos de tratamiento (p=0.079).
Aplicando los criterios de TNM22 revisamos el grado de infiltración tumoral (T) encontrando: T1 (10%), T2 (16.27%), T3 (62.01%) y T4 (11.62%). En los tres grupos de tratamiento, el tipo de tumor más frecuente fue el que infiltraba las tres capas de la pared gástrica (T3), con diferenciación significativa al comparar los tres grupos de tratamiento (p=0.002). En cuanto al grado de compromiso ganglionar (N): N0 (31.78%), N1 (33.33%), N2 (19.37%) y N3 (15.50%), no existieron diferencias significativas en los tres grupos de tratamiento. Además, cuando examinamos el números de ganglios aislados para cada una de las técnicas quirúrgicas, hallamos que la media de ganglios aislados era mayor cuando se resecó el bazo (66.2 ganglios), seguida de la resección de bazo y páncreas distal (55.1 ganglios) y con gastrectomía sola se aisló una media de ganglios inferior (34.6 ganglios); siendo estadísticamente significativa al comparar los tres grupos (p<0.01). Sin embargo, cuando estudiamos la media de ganglios afectados no hubo diferencia entre los grupos.
Al comparar el nivel de disección ganglionar encontramos: D1 (5.42%), D2 (93.02%) y D3 (1.55%). En la mayoría de pacientes se realizó disección D2 siendo significativa al comparar los tres grupos. En relación a la clasificación de Borrmann, el más frecuente fue el tipo III; siendo el tipo I (3.1%), II (5.42%), III (62.01%) y IV (19.37%). Cáncer precoz se encontró en 10% de los casos, sin diferencia significativa al comparar los tres grupos de tratamiento. Cuando analizamos el estadio tumoral según la UICC, el estadio más frecuente fue el IIIa; siendo el Ia (8.52%), Ib (9.3%), II (17,82%), IIIa (25,58%) IIIb (14,72%) y IV (24.03%), sin diferencia significativa en los tres grupos de tratamiento.
Características clínico patológicas de pacientes esplenectomizados
De los 129 pacientes se excluyó 22 pacientes a los cuales no se realizó esplenectomía, quedando 107 pacientes, de los cuales se describen las caraterísticas clínico patológicas detalladas en la tabla Nº 2.
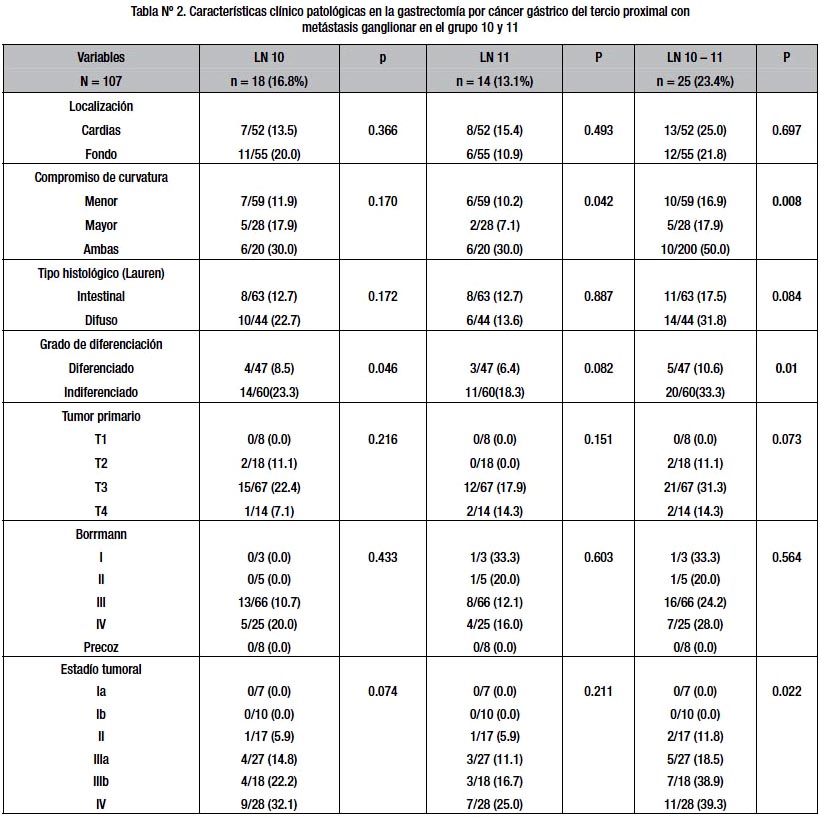
La frecuencia de metástasis a nivel del hilio esplénico (grupo ganglionar Nº 10) fue 16.8 % (n =18 pct). Una media de tres ganglios linfáticos fueron aislados (rango: 0 – 8 ganglios). Macroscópicamente los tumores metastáticos en hilio esplénico fueron Borrmann III (13 pacientes) y Borrmann IV (5 pacientes) e histológicamente fueron indiferenciados (14 pacientes) y diferenciados (4 pacientes), siendo según el grado de diferenciación estadísticamente significativo (p<0.046); el tipo histológico difuso (10 pacientes), intestinal (8 pacientes) siendo no significativo (p<0.172). Con relación al estadio tumoral, ningún paciente en estadio I presentó metástasis ganglionar en el grupo 10, pero si en los demás estadios, siendo no significativo (p<0.74) (tabla Nº 3). En cuanto al compromiso de las curvaturas, la menor estuvo comprometida en 7 pacientes y la curvatura mayor en 5 pacientes (p< 0.70). La localización de la tumoración gástrica correspondió a cardias (7 pacientes) y fondo (11 pacientes) estadísticamente no significativa (p<0.366). Al analizar la infiltración de la pared gástrica (T), la que tuvo compromiso de la serosa (15 pacientes) presentó mayor metástasis en el grupo 10. De todas las variables analizadas solo resultó significativo el grado de diferenciación.
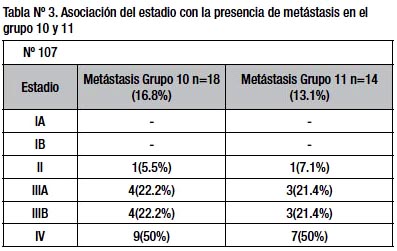
La frecuencia de metástasis en la arteria esplénica (grupo ganglionar Nº 11) fue 13.1% (n =14 pacientes). Una media de tres ganglios linfáticos fueron aislados (rango: 0 – 6 ganglios). Macroscópicamente los tumores metastáticos en arteria esplénica fueron predominantemente Borrmann III (8 pacientes) y Borrmann IV (4 pacientes) e histológicamente fueron indiferenciados (11 pacientes) y diferenciados (3 pacientes), siendo no significativo (p<0.082); el tipo histológico difuso (6 pacientes), intestinal (8 pacientes) siendo no significativo ( p<0.887). Con relación al estadio tumoral ningún paciente en estadio I presentó metástasis ganglionar en el grupo 11, pero si en los demás estadios, siendo no significativo (p<0.211) (tabla Nº 3).
En cuanto al compromiso de las curvaturas, la menor estuvo comprometida en 6 pacientes, y la curvatura mayor en 2 pacientes. (p< 0.042). La localización de la tumoración gástrica, correspondió a cardias (8 pacientes) y fondo (6 pacientes) estadísticamente no significativa (p<0.493). Al analizar la infiltración de la pared gástrica (T), la que tuvo compromiso con la serosa (12 pacientes) presentó mayor metástasis en el grupo 11. De todas las variables analizadas solo resulto significativa el compromiso de la curvatura.
Morbilidad y Mortalidad
Las complicaciones post operatorias están detalladas en la tabla Nº 4. Las complicaciones quirúrgicas alcanzaron el 15.5% presentándose con mayor frecuencia la fístula pancreática y absceso intraabdominal. La morbilidad no quirúrgica fue de 12.4% con predominio de las complicaciones respiratorias, siendo mayores en pacientes con gastrectomía ampliada a bazo. Las fístulas pancreáticas y la infección de heridas operatorias no existieron en los casos de gastrectomía sola. Solo 7 pacientes fueron reintervenidos (5.4% del total); 1 para gastrectomía sola, 4 para el grupo de pacientes con esplenectomía y 2 para el grupo de pancreatoesplenectomía distal, tampoco existió diferencia significativa entre los grupos (p<0.898), siendo la morbilidad global 21.6%.
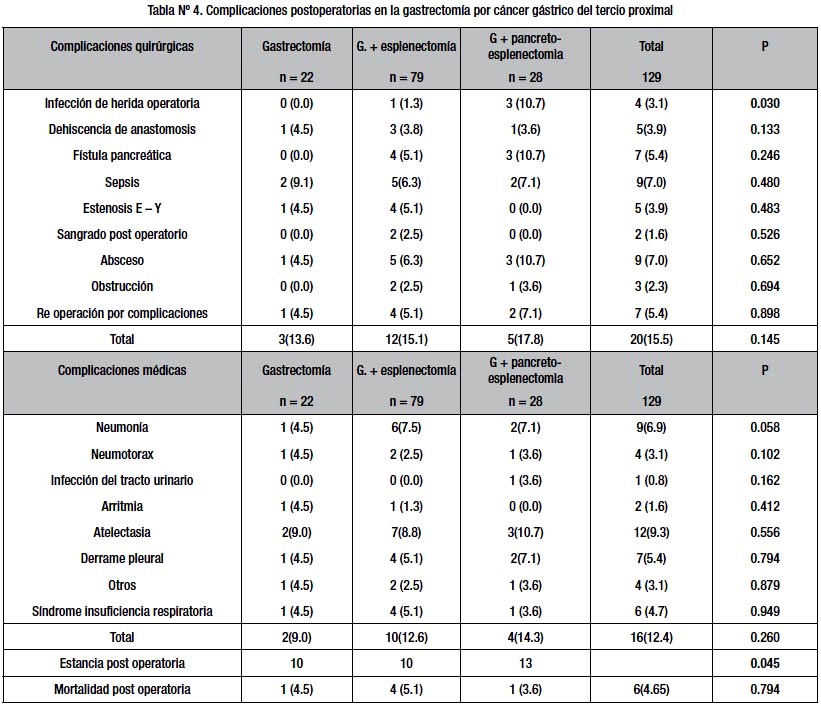
La mortalidad post operatoria a 30 días fue de 4.65% (6 casos). La primera causa de muerte post operatoria inherente a la cirugía fue la dehiscencia de anastomosis esofagoyeyunal (4 casos)(3.1%) seguida de complicaciones pulmonares (2 casos), no hubo diferencia significativa en los tres grupos.
La estancia post operatoria fue de 13 días para el grupo de pancreatoesplenectomía e iguales en el grupo de esplenectomía y gastrectomía sola (10 días), siendo estadísticamente significativa al comparar los tres grupos (p<0.045).
Análisis de la supervivencia
Realizamos un análisis univariado para cada uno de los factores e intentamos valorar si existía algún tipo de relación con la supervivencia de los pacientes en cada uno de las tres modalidades de tratamiento quirúrgico, los cuales se detallan en la tabla Nº 5.
La edad, el sexo, tipo de gastrectomía (total y proximal), la localización (cardias y fondo), tipo histológico (intestinal y difuso), y finalmente, según el tipo de gastrectomía extendida (gastrectomía sola, con esplenectomía y con pancreatoesplenectomía) (p<0,6830), no tuvieron ningún tipo de influencia en la supervivencia de los pacientes. Como era de esperar, los tumores que infiltraban la serosa tuvieron peores tasas de supervivencia comparada con las que infiltraban la muscular y la mucosa /submucosa, siendo la supervivencia a los 5 años para los T3 (41.64%), T2 (70.51%) y T1 (86.37%) (p<0.0038). La afectación ganglionar también afectó la supervivencia de los pacientes a los 5 años, siendo menor en los que tenia compromiso N2 (37.02%), seguido de los N1 (46.15%) y N0 (80.31%), siendo estadísticamente significativo (p<0.0003).
Con relación al nivel de disección ganglionar, la supervivencia a los 5 años fue para D1 (56.88%), D2 (47%) y D3 (0%), con un p significativo (p<0.0004). En cáncer precoz, el 84.61% de pacientes estuvo vivo a los 5 años. En cuanto al Borrmann, la tasa de sobrevida fue para el Tipo I (-), el tipo II (74.32%), tipo III (48.68 %) y tipo IV (32.47%). Cuando analizamos el estadio tumoral, la tasa de sobreviva a 5 años fue para el estadio IA (90.15), IB (84.56), II (58.21%), IIIa (47.20%), IIIb (34.21%) y IV (13.80).
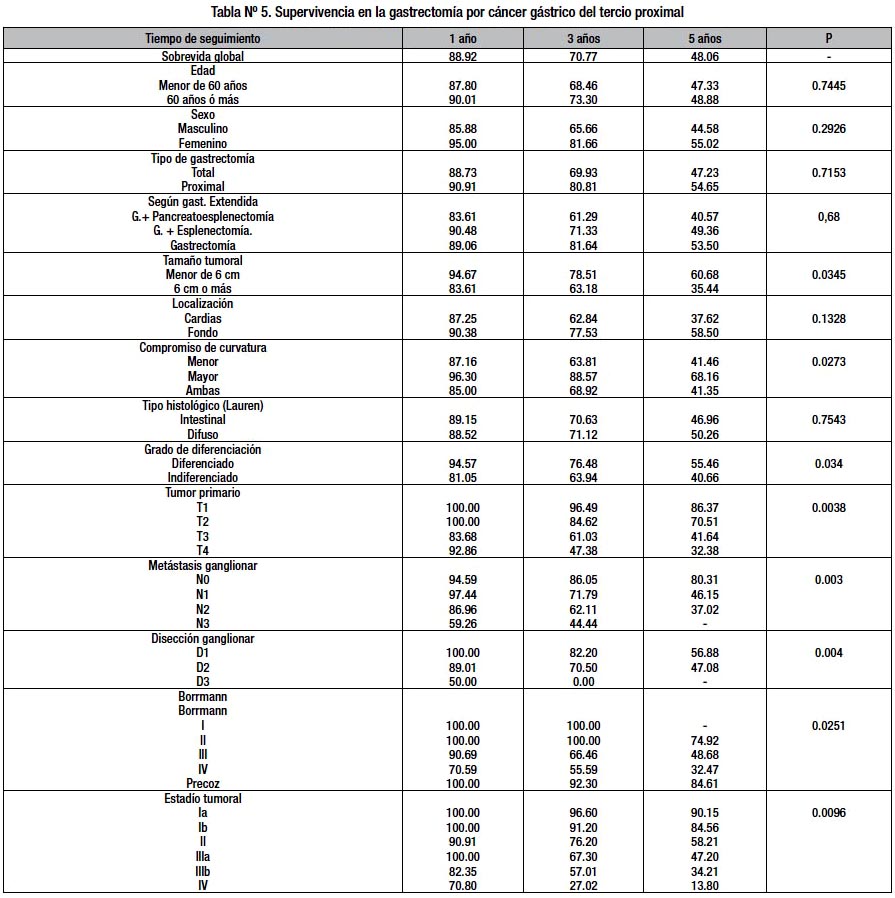
La supervivencia global a los 5 años para adenocarcinomas del tercio proximal operados con intención curativa fue 48.06 (Fig. Nº 1)
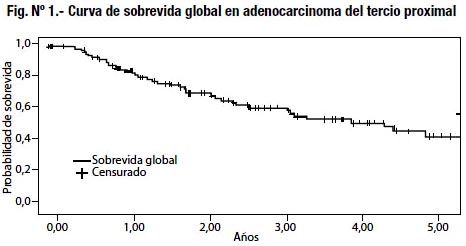
Comparamos la supervivencia global para cada uno de los tres grupos de tratamiento quirúrgico (Fig. Nº 2), pero no obtuvimos diferencias significativas entre los grupos (p<0.8023).
Al comparar las curvas de sobrevida según los estadios clínicos, para cada uno de los tres grupos de tratamiento quirúrgico, no encontramos diferencias significativas entre la gastrectomía sola, la asociada a pancreatectomía distal y esplenectomía, excepto en el estadio IIIB (p<0.001).
En cuanto a los ganglios resecados de los grupos 10 y 11, se comparó los ganglios no metastáticos frente a los metastásicos, encontrando diferencia significativa en la supervivencia a 5 años, cuando había metástasis ganglionares solo en el grupo 11(p<0.0385) y grupos 10 y 11 juntos (p<0.0240), obteniendo menores tasas de sobrevida; excepto cuando había metástasis solo en el grupo 10 (p<0.0519).
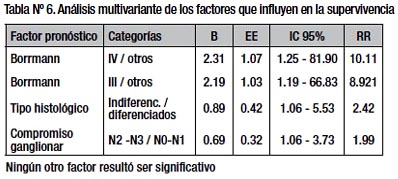
Posteriormente, con las variables que habíamos obtenido significación pronóstica para la supervivencia aplicamos un análisis de covariables usando el método de Cox, los que se detallan en la tabla Nº 6. Ni la esplenectomía ni la pancreatoesplenectomía constituyen factores pronósticos independientes (p< 0,6830). Por el contrario, el Borrmann III y IV, el tipo histológico indiferenciado y el compromiso ganglionar N2- N3; resultaron factores pronósticos independientes.
DISCUSIÓN
Desde las publicaciones de Brunschin y Mc Near(16), quienes aceptaban que las resecciones ganglionares extendidas y en "block" sólo eran posibles resecando la totalidad del estómago y efectuando pancreatoesplenectomía. No obstante, no todos los autores están a favor de la extirpación sistemática y rutinaria de ambas estructuras17-23. Fue mérito de los cirujanos japoneses revertir este concepto, ellos demostraron que es factible realizar resecciones ganglionares a nivel D2 sin necesidad de eliminar el páncreas y/o bazo. Nosotros hemos demostrado que el número de ganglios resecados tampoco varía significativamente con la esplenopancreatectomía y además este procedimiento no está exento de complicaciones postoperatorias. La fístula pancreática, el absceso intraabdominal y el sangrado del lecho pancreaticoesplénico son complicaciones severas que no debemos olvidar, son difíciles de manejar, prolonga la estancia hospitalaria post operatoria, requiere el uso de nutrición parenteral total, análogos de la somatostatina, algunas veces re operación y pueden conllevar un aumento en la mortalidad9. Por otro lado, esta técnica quirúrgica es uno de los pasos más delicados de la gastrectomía oncológica con lo que el tiempo quirúrgico se alarga y esto tiene su importancia sobre todo en pacientes de edad avanzada con factores de coomorbilidad asociada. En relación a los aspectos inmunológicos de la esplenectomía para cáncer gástrico, los informes de investigación básica, así como los estudios clínicos, sugieren que el bazo puede jugar un papel como supresor y en otras ocasiones como regulador de la actividad tumoral de acuerdo con el número de células cancerosas, la esplenectomía conlleva a una reducción en la resistencia frente a la infección por neumococos12 y un mayor riesgo de sepsis fulminante. Dos estudios japoneses han comparado la sobrevida a 5 años, con y sin esplenectomía24 llegando a la conclusión que en pacientes con cáncer avanzado con compromiso de serosa la sobrevida fue similar, con o sin esplenectomía; pero en etapas precoces, la sobrevida fue mayor en pacientes sin esplenectomía. A todo esto se suma el hecho de que algunos trabajos como Kasakura23, Kitamura25 y Otsuji26 no han demostrado que la pancreatoesplenectomía mejore las tasas de supervivencia y lo mismo es lo que hemos confirmado también en nuestro estudio.
Si ponemos en una balanza el riesgo con el beneficio tendríamos que inclinarnos por la preservación del bazo, excepto en las siguientes circunstancias: Infiltración directa del órgano, invasión ganglionar del hilio, con imposibilidad de realizar su disección, necesidad de sacrificar los vasos esplénicos por infiltración o trauma quirúrgico.
Nuestro estudio retrospectivo trata de analizar si la gastrectomía que se asoció a una pancreatectomía distal y/o esplenectomía para el cáncer gástrico del tercio proximal, se acompañó de una mayor supervivencia, y con ello, un beneficio para el paciente. El análisis univariante nos mostró que el estadiaje tumoral resultó ser un factor pronóstico independiente en la supervivencia de los pacientes. Sin embargo, al estratificar los tres tipos de cirugía, para cada uno de los estadios, no existieron diferencias significativas entre la gastrectomía sola, la asociada a pancreatectomía distal y la asociada a esplenectomía en ningún estadio, excepto en el estadio IIIB (p<0,001). El cirujano realizó un tipo determinado de linfadenectomía, y en el estudio anatomopatológico se encontró que el promedio de ganglios resecados fue 54,3 y 40,6 para gastrectomía total y proximal respectivamente asociado a disección ganglionar D2, y de 25 y 18 ganglios cuando se realizó disección ganglionar D1 en gastrectomía total y proximal respectivamente, superando el número de ganglios mínimo que se atribuyen a cada nivel de linfadenectomía (mínimo de 15 para D1 y mínimo de 25 para D2) según Siewert27, Cushieri9. En la actualidad se ha adoptado como estándar la disección ganglionar D2 en el manejo del cáncer gástrico en el INEN, al igual que en el Japón, ya que permite un mejor estadiaje y por ende mejora en la sobrevida. Al analizar el número de ganglios aislados y afectados así como la extensión de las metástasis linfáticas (N), no obtuvimos diferencias de supervivencia entre las tres técnicas quirúrgicas; a pesar de que el número de ganglios aislados, si se realizó esplenectomía y/o pancreatectomía distal, fue significativamente mayor que en la gastrectomía sola. Este hecho pone en duda si realmente son útiles las linfadenectomías ampliadas en este tipo de tumores gástricos, como también demuestran otros autores como Maehara28, quien concluye que realizar linfadenectomías extendidas asociadas a esplenectomías conlleva mayor morbilidad. Según la clasificación del estado ganglionar basada en el sistema TNM (5ª ed; 1997)22 el cual se basa en el número de ganglios linfáticos comprometidos, en nuestro estudio al comparar las N encontramos diferencias significativas en la sobrevida (p< 0.003), teniendo resultados similares a otros grupos como el publicado por Spanknebel y Brennan(37) en el 2002 que compara los estudios Alemán, Japonés y Americano en cuanto al pronóstico y supervivencia de los pacientes según el compromiso ganglionar encontrando mejor índice pronóstico con esta clasificación29-30.
Con las variables que habíamos obtenido significación pronóstica para la supervivencia aplicamos un análisis de covariables usando el método de Cox, los que se detallan en la tabla Nº 6. Ni la esplenectomía ni la pancreatoesplenectomía tuvieron significación en la supervivencia de los enfermos como variable pronóstica independiente (p< 0,6830) (Fig. 2). Por el contrario, el Borrmann III y IV, el tipo histológico in-diferenciado y el compromiso ganglionar N2- N3; resultaron factores pronósticos independientes. Kasakura23, Kitamura25 y Otsuji26 en sus estudios retrospectivos obtuvieron similares resultados, por lo que no recomiendan su realización de forma sistemática. En los estudios prospectivos de Attila Csendes31, quien analiza y compara la gastrectomía total D2 versus la gastrectomía asociada a esplenectomía en 187 pacientes con adenocarcinoma, concluye que la gastrectomía asociada a esplenectomía no tiene efecto en la supervivencia en fases tempranas (estadios I y II) y con una tendencia a mejorar la sobrevida a 5 años en etapas avanzadas (estadio III y IV) pero sin diferencia significativa. Igualmente el estudio prospectivo de W. Yu33, quien analiza la esplenectomía versus la preservación esplénica en 207 pacientes con cáncer gástrico proximal, concluye que los resultados no apoyan el uso de esplenectomía profiláctica al remover ganglios negativos del hilio esplénico y que al mismo tiempo se puede resecar ganglios del grupo 10 y 11 sin sacrificar el bazo y páncreas.
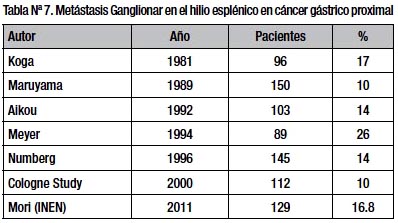
La frecuencia de metástasis ganglionar en el grupo 10 es 16.8% comparable a otros estudios (Tabla Nº 7)
En tumores que se extienden a órganos adyacentes se recomienda la resección en bloque de los órganos invadidos(36). En cuanto al compromiso pancreático, Okajima y Isozaki(18) estudiaron las gastrectomías extendidas al páncreas distal por sospecha de invasión tumoral directa encontrando que sólo el 65.7% de casos tenían infiltración pancreática tras el estudio patológico. En nuestro estudio el 11.62% fueron T4 con una sobrevida a los 5 años de 32.38%, de éstos el 66.67% y el 33.33% infiltraban el páncreas y el bazo respectivamente. se realizó pancreatectomía distal solo cuando había infiltración tumoral de la cola del páncreas o metástasis ganglionar macroscópica que ha penetrado o roto la cápsula pancreática, y cuando se realizó esplenectomía se preservó el páncreas según el método de Maruyama.
En nuestro estudio se encontró mayor porcentaje de complicaciones en cirugías ampliadas pero sin relación significativa, esto lo hemos atribuido a que en el grupo de la gastrectomía sola, la edad media fue superior, con mayor número de antecedentes patológicos y por tanto mayor factor de riesgo quirúrgico, que los otros dos grupos (p <0,029). La fístula pancreática y el absceso intraabdominal fueron las complicaciones más frecuentes relacionadas directamente con la cirugía en los grupos de resección pancreática y/o esplénica pero sin valor significativo en nuestro estudio, al contrario que en otros estudios de Cushiert9, Kasakura23, Otsuji E26 , Volpe31 y Attila Csendes32, en donde la morbilidad post operatoria es mayor en pacientes con esplenectomía asociada, resultando un valor significativo, siendo su manejo complejo, prolongado y usualmente implica el uso de nutrición parenteral.
La mortalidad postoperatoria global fue de 4.65%, pero si solo incluimos las muertes por causas inherentes a la cirugía la mortalidad queda reducida al 3.1%. La mortalidad postoperatoria no reveló diferencias significativas entre los grupos (p<0.794), sin embargo, sólo un paciente falleció en el postoperatorio tras gastrectomía sola, por cinco que lo hicieron cuando se realizó una cirugía ampliada a bazo y/o páncreas, con mortalidad postoperatoria promedio de 4,54% para gastrectomía sola y 4,67% para gastrectomía asociada a esplenectomía y/o pancreatoesplenectomía, sin diferencia significativa en ambos grupos, con resultados similares a los estudios de Attila Csendes32. La re operación es el factor de riesgo para mortalidad intra hospitalaria, no obstante, pese a su elevada mortalidad, la re operación no tiene una contraindicación absoluta ya que es la única posibilidad de recuperar al paciente complicado en quienes las medidas médicas no han dado resultado35.
El síndrome postesplenectomía asociado a sepsis por neumococo se presentó en 1 paciente (0,8%), al cual se le realizó una cirugía ampliada al bazo y páncreas. Según Attila Csendes32, Cushier9, Brennan34 la incidencia de este síndrome va desde 0% hasta 3,2%
CONCLUSIONES
-
La esplenectomía y la esplenopancreatectomía distal no influyeron en la supervivencia.
-
La esplenectomía y esplenopancreatectomía distal aumentaron la morbimortalidad postoperatoria en forma no significativa.
-
Factores pronósticos independientes negativos en la supervivencia: compromiso ganglionar (N2 –N3), grado histológico indiferenciado y tumores Borrmann III y IV.
-
En adenocarcinomas gástricos del tercio proximal, la frecuencia de metástasis ganglionares en los grupos 10 y 11 fueron 16.8% y 13.1% respectivamente. Se observó generalmente en cánceres avanzados estadios III / IV según la clasificación UICC, lesiones Borrmann III / IV y tumores de curvatura mayor.
RECOMENDACIONES
* Se debe realizar un estudio prospectivo con grupos comparables para poder determinar con mayor precisión la verdadera influencia del beneficio o no de la esplenectomía y/o pancreatoesplenectomía asociada a gastrectomía en adenocarcinoma del tercio proximal en nuestro país.
REFERENCIAS BIBLIOGRAFICAS
1. PARKIN, PISAN, FERLAY. Estimates of worlwide inicidence of 25 major cancers in 1990. Int Journal Cancer 1999; 1580 (6):827 -41.
2. REGISTRO DE CÁNCER DE LIMA METROPOLITANA 1994-1997: Centro de Investigación en Cáncer "Maes Heller" Vol III Diciembre 2004
3. BONENKAMP J, VELD C, KAMPSCHPER G. Comparison of factors influencig the prognosis oj Japanese, German and Dutch gastric cancer patients. World J Surg 1993; 17:410-5.
4. BABA H, MAEHARA Y, INUTSUKA S,et al. Effectivenessof extended lynphadenectomy in non curative gastrectomy. Amer J Surg 1995; 169:261-4
5. HANAZAKI K, SODEYAMA H, MOCHIZUKI Y. Efficacy of extended lyphadenectomy in the non curative gastrectomy for advanced gastric cancer. Hepatol Gastroenterol 1999; 46: 2677-82.
6. MANZONI G, VERLATO, GUGLIELMI A, LATERZA E. Prognostic significance of lymph node dissection in gastric cancer. Br J Surg 1996; 83:1604-7.
7. SIEWERT J, BOTCHER K, STEIN H, et al. Relevant prognostic factors in gastric cancer. Ten-years results of the German Gastric Cancer Study. Ann Surg 1998;228(4):449-61
8. UYAMA I, OGIWARA H, TAKAHARA T, et al. Spleen and pancreas preserving total gastrectomy with superextended lymphadenectomy including dissection of para-aortic lymph nodes for gastric cancer. J Surg Oncol 1996; 63: 268-70.
9. CUSHIERI A, FAYERS P, FIELDING J, et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. Lancet 1996; 347: 995-9.
10. YOSHINO K, HARUYAMA K, NAKAMURA S, et al. Evaluation of splenectomy for cancer gastrinoma. Jpn. J Gastroenterol Surg 1979; 12:944 (in Japanese)
11. BRADY, ROGATKO, DENT, SHIU. Effect of splenectomy on mormidity and survival following curative gastrectomy for carcinoma. Archieves Surgery 1991; 126: 359 – 364.
12. ELLISON E, FABRI P. Complications of splenectomy. Sur Clin North Am 1983; 63: 1313-30.
13. OTSUJI, YAMAGUCHI, SAWAI, et al. End results of simultaneous splenectomy and survival in patients undergoing total gastrectomy for gastric carcinoma. Surgery 1996; 120:40 – 44.
14. SÖREIDE, HEERDEN, BURGART, et al. Surgical aspects of patients with adenocarcinoma of the stomach operated on for cure. Archieves Surgery 1996; 131: 481- 486.
15. VISTE, EIEDE, SOREIDO. Postoperative complications and mortality after surgery for gastric cancer . Annals Surgery 1988; 207: 7 – 12
16. MARUYAMA, SASAKO, KINOSHITA, et al. Pancreas preserving total gastrectomy for proximal gastric cancer. World Journal of Surgery 1995;19: 532 – 536.
17. GRIFFITH J, SUE-LING H, MARTIN I, et al. Preservation of the spleen improves survival after radical surgery for gastric cancer. Gut 1995; 36: 684-90.
18. OKAJIMA, ISOZAKI. Splenectomy for treatmentof gastric cancer: Japanese experience. World Journal of Surgery 1995; 19: 537 -540.
19. ROUKOS, PARASCHOU, LORENZ. Distal gastric cancer and extensive surgery: a new evaluation method based on study of the status of residual lymph nodes after limited surgery. Annals of Surgical Oncology 2000;7: 719 – 726.
20. WANEBO, KENNEDY, WINCHESTER,STEWART. Role of splenectomy in gastric cancer surgery of elective splenectomy on longterm survival. Journal American College Surgeons 1997; 185: 177 – 184.
21. YOSHIZUMI, KOIKE, SHIBATA, MORISAKI. Simultaneus resection of gastric carcinoma and splenectomyina a patient with polycithemia vera: Report of a case. Surgery Today 1998; 28: 197 – 200.
22. SOBIN L, WITTEKIND CH. International Union Against Cancer (UICC): TNM Classification of Malignant Tumours. 5th ed. New York: John Wiley, 1997.
23. KASAKURA Y, FUJII M, MOCHIZUKI F, et al. Is there a benefit of pancreaticosplenectomy with gastrectomy in advanced gastric cancer. Amer J Surg 2000; 179(3): 237-42.
24. SUEHIRO S, NAGASUE N, OJAMA Y: The negative effect of splenectomy on the prognosis of gastric cancer. Am J. Surg 1984; 148: 648-8.
25. KITAMURA K, NISHIDA S, ICHIKAWA D, et al. No survival benefit from combined pancreaticosplenectomy and total gastrectomy for gastric cancer. Br J Surg 1999; 86: 119-22.
26. OTSUJI E, YAMAGUCHI T, SAWAI K, et al. Total gastrectomy with simultaneous pancreaticosplenectomy or splenectomy in patients with advanced gastric carcinoma. Br J Cancer 1999; 79 (11/12): 1789-93.
27. SAJI S, SAKAMOTO J, TERAMUKAI S, et al. Impact of splenectomy and inmunochemotherapy on survival following gastrectoomy for carcinoma: covariate interaction of inmunossupresive acidic protein, a serum marker for the inmune system. Tumor Marker Committee for The Study Group Immunochemotherapy with PSK for Gastric Cancer. Surg Today 1999; 29 (6): 5 0 4 - 10.
28. MAEHARA Y, MORIGUCHI S, YOSHIDA M, et al. Splenectomy does not correlate with length of survival in patients undergoing curative total gastrectomy for gastric carcinoma. Cancer 1991; 67 (12): 3006-9.
29. FUJII K, ISOZAKI H, OKAJIMA K, et al. Clinical evaluation of lymph node metastasis in gastric cancer defined by the fifth edition of the TNM classification in comparison with tha Japanese system. Br J Surg 1999; 86: 685-9.
30. KATAI H, YOSHIMURA K, MARUYAMA K, et al. Evaluation of the New International Union Against Cancer TNM Staging for Gastric Carcinoma. Cancer 2000; 88 (8): 1796-800.
31. VOLPE, DEBORAH, DRISCOLL, DOUGLAS. Out-come of Patients with proximal gastric cancer depends on extent of resection and nimber of resected lymph nodes. Annals of Surgical Oncology 2000; 7 (2): 139 – 144.
32. ATTILA CSENDES, PATRICIO BURDILES. A prospective randomized study comparing D2 total gastrectomy versus D2 total gastrectomy plus splenectomy in 187 patients with gastric carcinoma. Surgery April 2002.
33. W. YU, G. CHOID . Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer. British Journal of Surgery 2006; 93: 559-563.
34. BRENNAN, KARPEH. Surgery for gastric cancer: The American View. Seminars oncology 1996; 23: 352 – 359.
35. SIEWERT JR, STEIN HJ. Classifi cation of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998; 85: 1457-1459.
36. DAmico D, Ranzato R, DAmico C, et al. The treatment of advanced gastric cancer: total gastrectomy "extended" as needed. Ann Ital Chir 1992; 63: 783-9; discussion 789-90.
37. Spanknebel K, Brennan M. Is D2 lymphadenectomy for gastric cancer a staging tool or a therapeutic intervention? Surg Oncol Clin North Am 2001; 11: 415-30.
38. Japanese Research Society for Gastric Cancer: The General Rules for Gastric Cancer.Study in surgery and pathology. Jpn J Surg 1981; 11: 127-131.
Correspondencia:
Dr. Edmundo Mori Gonzales
e-mail: edmorig1@hotmail.com
Hospital IV Alberto Sabogal Sologuren
Jr. Colina Nª1081 Bellavista Callao – Perú
Teléf.: 429-7744 anexo 5081













