Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Gastroenterología del Perú
Print version ISSN 1022-5129
Rev. gastroenterol. Perú vol.32 no.1 Lima Jan./Mar. 2012
ARTÍCULOS ORIGINALES
Factores de riesgo asociados a metaplasia intestinal gástrica en pacientes sin enfermedad gastroduodenal significativa. ¿Está siempre asociada la infección por Helicobacter pylori?
Associated risk factors in patients with gastric intestinal metaplasia with mild gastroduodenal disease. Is always related to Hellcobacter pyloriinfection?
Alfonso Chacaltana Mendoza(1) ; César Soriano Álvarez(1) ; Oscar Frisancho Velarde(1)
1 Médico Asistente del Departamento del Aparato Digestivo, Hospital Edgardo Rebagliati Martins ESSALUD, Lima Perú.
RESUMEN
INTRODUCCIÓN.- El objetivo principal del estudio fue estudiar la presencia o no de asociación de la infección por Helicobacter pylori (HP) como factor de riesgo para la metaplasia intestinal gástrica (MIG), y determinar la existencia de cofactores concomitantes.
MATERIAL Y MÉTODOS.- Se desarrolló un estudio de casos y controles en pacientes sin lesiones gastroduodenales significativas que acudieron al Hospital Uldarico Rocca, desde octubre del 2010 a mayo del 2011. Se definió casos a aquellos pacientes con diagnóstico histológico de MIG y controles a aquellos sin MIG. Las variables estudiadas fueron: infección por HP, edad, sexo, consumo de tabaco y alcohol, antecedente familiar de cáncer gástrico y reflujo biliar. Se realizó análisis bivariado y multivariado mediante regresión logística múltiple para determinar la presencia de factores de riesgo asociados.
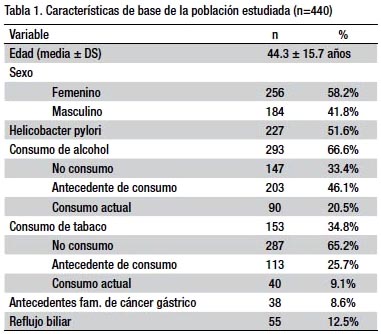
RESULTADOS.- Se estudiaron 440 pacientes (88 casos y 352 controles). La edad media de la población fue 44.3 ± 15.7 año y el 58.2% fueron mujeres. La prevalencia de la infección por HP fue de 51.6% en la población y de 46.6% en los pacientes con MIG. La mediana de la edad fue significativamente mayor en los casos (56.5 años vs. 39 años, p=0.0005), mientras que no hubo diferencias en las demás variables estudiadas entre ambos grupos. En el análisis bivariado solamente la edad ≥ 50 años se comportó como factor de riesgo (OR=4.47, IC95% 2.66-7.57), mientras que en el análisis multivariado las variables que se comportaron como factores de riesgo fueron: edad ≥ 50 años (OR= 4.67; IC 95% 2.79-7.81), reflujo biliar (OR= 3.66; IC 95% 1.71-7.83) y el antecedente de consumo de alcohol (OR= 2.31; IC 95% 1.33-4.03). La infección por HP presentó un OR menor a la unidad (OR=0.85; IC 95% 0.51-1.41).
CONCLUSIONES.- Los factores de riesgo asociados a la presencia de MIG en pacientes sin lesiones gastroduodenales significativas fueron la edad igual o mayor a 50 años, la presencia de reflujo biliar y el antecedente de consumo de alcohol en la población estudiada. La infección por HP no se comportó como un factor de riesgo asociado a la MIG.
PALABRAS CLAVE: metaplasia intestinal gástrica, Helicobacter pylori, factores de riesgo.
ABSTRACT
OBJETIVE: This study aimed to assess the presence or absence of association of Helicobacter pylori infection (HP) as risk factor for gastric intestinal metaplasia (IM), and to determine concomitant cofactors.
METHODS: A prospective, case-control study was performed from October 2010 to May 2011, in outpatients without significant gastroduodenal disease. The presence or absence of IM was diagnosed by gastric biopsies (case or control, respectively). H. Pylori infection, age, sex, smoking, alcohol drinking, family history of gastric cancer and bile reflux were evaluated. Odds ratios (ORs) and their 95% CIs were estimated by logistic regression.
RESULTS: A total of 440 patients (88 cases and 352 controls) were studied, with a mean age ± SD of 44.3 ± 15.7 years; 58.2% were women. Prevalence of HP infection was 51.6% in the population and 46.6% in patients with IM. The mean age was significantly higher in cases (56.5 years vs. 39, p = 0.0005), whereas no differences in other variables studied. In bivariate analysis, only age ≥ 50 years was a risk factor (OR = 4.47, 95% CI 2.66-7.57), whereas in multivariate analysis the risk factors were age ≥ 50 years (OR = 4.67, 95% CI 2.79-7.81), bile reflux (OR = 3.66, 95% CI 1.71-7.83) and history of alcohol drinking (OR = 2.31, 95% CI 1.33-4.03). HP infection showed an OR less < 1 (OR = 0.85, 95% CI 0.51-1.41).
CONCLUSIONS: Risk factors associated with the presence of IM in outpatients without significant gastroduodenal disease were age ≥ 50 years, bile reflux and a history of alcohol drinking in the population studied. H. Pylori infection was not associated as risk factor for IM.
KEYS WORDS: gastric intestinal metaplasia, Helicobacter pylori, risk factors.
INTRODUCCIÓN
La importancia y trascendencia del cáncer gástrico en la salud pública mundial permanece invariable desde hace varias décadas como consecuencia de su elevada mortalidad. Si bien se considera que el cáncer gástrico es el cuarto cáncer más común en el mundo con aproximadamente 1 millón de personas diagnosticadas anualmente, se constituye como la segunda causa de muerte asociada a cáncer en todo el mundo, con más de 700,000 muertes por año (1), siendo al menos, las dos terceras partes de estas muertes procedentes de los países en desarrollo como el nuestro. En nuestro país, los datos obtenidos del Registro de Cáncer de Lima Metropolitana del Centro de Investigación en Cáncer "Maes Heller" del Instituto Nacional de Enfermedades Neoplásicas (2) sitúan al cáncer gástrico como la primera causa de muerte por cáncer en hombres y la segunda en mujeres, consolidándose como la primera causa de muerte asociada a cáncer considerando ambos sexos. Esta alta mortalidad es explicada por los altos porcentajes de pacientes diagnosticados en estadios avanzados de la enfermedad, con frecuencias que llegan hasta el 94% (3), las mismas que otorgan una sobrevida reducida. En contraparte, es conocido que las fases tempranas de ésta neoplasia son asintomáticas y clínicamente no patentes, haciendo difícil su detección precoz.
Ante este problema, la detección de esta enfermedad en estadios iniciales o precoces que lo haga susceptible de un tratamiento curativo integral, se impone como una necesidad y obligación. Si bien en el campo clínico, continuos esfuerzos vienen siendo realizados para poder incrementar el porcentaje de diagnóstico del cáncer gástrico precoz con herramientas que ayudan a diagnosticar lesiones neoplásicas cada vez más pequeñas (implementación de mejoras en la visualización e imagen de los equipos endoscópicos), en el campo epidemiológico, el enfoque de este problema se orienta hacia el estudio de las fases iniciales de su génesis para determinar y caracterizar a la población con mayor riesgo para el desarrollo de esta neoplasia. Como resultado de estos estudios, se considera que el adenocarcinoma gástrico tipo intestinal usualmente es precedido por una secuencia de eventos histológicos que comienzan con la gastritis crónica difusa y que eventualmente llevan a atrofia gástrica, metaplasia intestinal gástrica (MIG) y displasia (4), secuencia en la que además estaría implicado la infección por el Helicobacter pylori (HP) tanto en la inducción de la inflamación gástrica como con la progresión del desarrollo de los cambios neoplásicos (5).
Sin embargo, actualmente se acepta que esta secuencia carcinogenética es un proceso progresivo en el que intervienen múltiples factores tanto ambientales, epidemiológicos y genéticos, y de cuya interacción parece influir no sólo en el desarrollo sino también en la progresión de la enfermedad (6). Las diferencias geográficas existentes en cuanto a la incidencia, evolución y pronóstico del adenocarcinoma gástrico parecen estar relacionadas con los diferentes factores ambientales a los que está expuesta la población, de lo que se desprende la importancia de la realización de estudios epidemiológicos locales.
Entre las lesiones que forman parte de esta secuencia carcinogénica, la metaplasia intestinal gástrica (MIG) proporciona una interesante área de investigación, dado que es considerado además como un factor de riesgo predictor independiente de subsecuente desarrollo de malignidad gástrica, en especial en sujetos infectados por HP (7). Por otro lado, si bien se ha estudiado la relación entre la infección por HP y la MIG, estableciéndose asociaciones y considerando a esta infección como un importante factor de riesgo para la presencia de la MIG (4,7-9), esto no ocurre en todos los contextos, por lo que se presume que existiría otros factores aislados y/o que interactúan con la infección por el HP en la aparición de la MIG: interacción de factores genéticos y del medio ambiente. Un ejemplo de ello, es que existen algunos países de Asia (10) y de África con altas prevalencias de HP que tienen una baja prevalencia de cáncer gástrico y de lesiones preneoplásicas (11).
En nuestro país, a pesar de ser el cáncer gástrico una de las neoplasias malignas con mayor repercusión en la salud pública, es poco lo que ha investigado con relación a las lesiones gástricas preneoplásicas incluida la MIG, desconociéndose además los factores de riesgo implicados a la presentación de esta condición histológica. Por último, en los últimos 20 años se ha observado una disminución sostenida (de 80% a 58.7%) de la tasa de prevalencia de la infección por HP en los estratos socioeconómicos medio y alto (12,13). Esta variación ha ido acompañada de una reducción significativa de las enfermedades asociadas como la úlcera gastroduodenal y el adenocarcinoma gástrico (14,15). Ante esto se podría esperar también una disminución en la frecuencia de la presentación de las lesiones preneoplásicas, entre ellas la MIG, sin embargo, en la práctica diaria observamos que ésta continúa presentándose, por lo que consideramos que otros factores pudieran estar implicados.
Por tanto, y dada la necesidad de incrementar los conocimientos en esta línea de investigación, es que nos planteamos el objetivo de estudiar la presencia o no de asociación de la infección por HP como factor de riesgo para la MIG, en especial en pacientes sin enfermedad gastroduodenal significativa, además de establecer la existencia o no de cofactores concomitantes en la presentación de la MIG.
MATERIALES Y MÉTODOS
Se realizó un estudio analítico de casos y controles. Se definió como casos a aquellos pacientes con diagnóstico histológico de metaplasia intestinal gástrica (MIG) y controles a aquellos sin diagnóstico histológico de MIG.
Población: Se tomó como población accesible a los pacientes ambulatorios que acudieron al consultorio externo del Servicio de Gastroenterología del Hospital I Uldarico Rocca ESSALUD del distrito de Villa El Salvador en la provincia de Lima, entre los meses de octubre del 2010 a mayo del 2011.
Criterios de inclusión: pacientes ≥ 18 años de edad, ambulatorios, con estudio endoscópico electivo sin lesiones gastroduodenales significativas (enfermedad ulcero-péptica, pólipos, neoplasias, esofagitis por reflujo) con estudio anatomopatológico, historia clínica y con el respectivo consentimiento informado.
Criterios de exclusión: pacientes con antecedente personal de infección por HP que hayan recibido tratamiento erradicador, diagnóstico histológico previo de MIG, consumo reciente o actual de inhibidores de la bomba de protones o antibióticos, diagnóstico histológico de adenocarcinoma gástrico o displasia gástrica, antecedente personal de cáncer del tracto gastrointestinal, gastrectomía o cirugía gástrica previa, embarazo, enfermedades crónicas descompensadas: cirrosis hepática, ICC, IRC, EPOC.
Muestra: El tamaño muestral fue determinado mediante el programa Stata v10.0 con un nivel de confianza al 95% y potencia del 80%, con una proporción casos/controles de 1/4. El tamaño estimado fue 84 (casos) y 336 (controles). Se realizó un muestreo no probabilístico consecutivo.
Variables: variable dependiente: metaplasia intestinal gástrica, variable independiente: infección por HP y covariables: edad, sexo, consumo de tabaco, consumo de alcohol, antecedente familiar de cáncer gástrico y reflujo biliar.
Definición operacional
Metaplasia intestinal gástrica: variable cualitativa dicotómica, definida por estudio histológico mediante la presencia de células caliciformes o globlet cells en mucosa gástrica y confi rmada por la evaluación de 02 anatomo-patológos diferentes. No se consideraron los resultados discordantes.
A su vez se categorizarán en metaplasia completa, si presentan disposición similar al intestino delgado con células absortivas con bordes en cepillo; o en metaplasia incompleta, si presentan disposición similar al intestino grueso con pocas células absortivas.
Infección por Helicobacter pylori: variable cualitativa dicotómica, definida por estudio histológico de las muestras de biopsia obtenida durante el respectivo estudio endoscópico mediante la identificación del Helicobacter pylori.
Consumo de tabaco: Para el análisis se considera como variable cualitativa categórica, definidas como:
-
No consumo: No consumo de cigarrillos en su vida.
-
Antecedente de consumo: aquellos individuos que fumaban, pero que no habían consumido cigarrillos en el último año antes de ingresar al estudio.
-
Consumo actual: aquellos individuos que fuman al menos 1 cigarrillo por día en el último año antes de ingresar al estudio.
Consumo de alcohol: Para el análisis se considera como variable cualitativa categórica, definidas como:
-
No consumo: No consumo de alguna bebida alcohólica a lo largo de su vida.
-
Antecedente de consumo: aquellos individuos que bebían al menos 1 bebida alcohólica de cualquier clase pero que no han consumido en el último año antes de ingresar al estudio.
-
Consumo actual: aquellos individuos que toman al menos 1 bebida alcohólica en el último año antes de ingresar al estudio.
Antecedente familiar de cáncer gástrico: variable cualitativa dicotómica, definida por la presencia de antecedente de cáncer gástrico en familiares consanguíneos de primer grado.
Reflujo biliar: variable cualitativa dicotómica, definida por la presencia de contenido biliar (líquido biliar) en el estómago evidenciando durante la endoscopia.
Procedimiento
A todos los pacientes ambulatorios que acudieron al consultorio externo de Gastroenterología del Hospital I Uldarico Rocca ESSALUD, entre los meses de octubre del 2010 a mayo del 2011, con indicación de estudio endoscópico y después de aplicar los criterios de selección descritos, se les invitó a participar en el estudio mediante la firma del consentimiento informado respectivo. Previo a la realización de la endoscopia, todos los participantes fueron entrevistados en base a un cuestionario de preguntas detalladas en una ficha de datos previamente establecida que contenían las variables de estudio.
Realizado el estudio endoscópico, y definidas las lesiones endoscópicas presentes, se prosiguió el estudio sólo con aquellos sin lesiones gastroduodenales signifi cativas (enfermedad ulcero-péptica, pólipos, neoplasias, esofagitis por refl ujo). A todos los pacientes incluidos en forma sistemática se les tomó tres muestras de biopsia de mucosa gástrica (1 de antro tercio medio curvatura menor, 1 de incisura angularis curvatura menor y 1 de cuerpo tercio distal curvatura menor) para el respectivo examen histológico e independientemente de otras muestras de biopsias extraídas según la presencia de otros hallazgos endoscópicos.
El estudio endoscópico fue realizado por el personal del Servicio de Gastroenterología del Hospital I Uldarico Rocca ESSALUD, conformado por cuatro médicos gastroenterólogos y que cuenta con equipo de videoendoscopio Olympus EVIS CV-140.
El estudio histológico fue realizado en el Departamento de Anatomía Patológica del Hospital Nacional Edgardo Rebagliati Martins perteneciente a la Red Asistencial de la institución (ESSALUD). Las muestras fueron procesadas con tinción de hematoxilina-eosina y evaluadas por un médico patólogo con experiencia en patología gástrica. Posteriormente las mismas muestras fueron reevaluadas por otro médico patólogo cegado al diagnóstico dado por el anterior colega. Se consideró el diagnóstico de metaplasia intestinal gástrica sólo cuando ambas evaluaciones coincidían, no considerándose los resultados "discordantes".
Todos los datos fueron recolectados en la ficha de recolección de datos ya confeccionada, para después realizar el respectivo análisis estadístico.
Análisis estadístico.- Se realizó estadística descriptiva reportándose las variables categóricas como porcentajes y la variable continua (edad) como media ± desviación estándar o mediana según tenga ésta distribución normal o no.
Se realizó un análisis bivariado previa confección de tablas de contingencia de 2 x 2, para obtener los respectivos odds ratio (OR) y determinar la presencia o no de asociación entre la variable dependiente e independiente, así como la prueba de chi cuadrado (X2) para determinar la significancia estadística, considerándose una diferencia estadísticamente significativa con un valor de p de 0.05 o menos. Se usará el Test exacto de Fisher si hay un valor esperado menor de 5. Por último, todas las variables con un valor de p <0.20 fueron sometidas a análisis multivariado mediante regresión logística múltiple para establecer la existencia o no de cofactores concomitantes en la presentación de la MIG. El análisis estadístico la realizamos con el paquete estadístico STATA v.10.
RESULTADOS
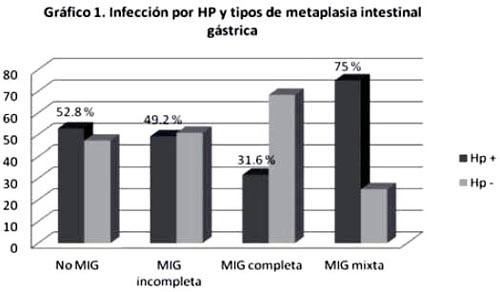
Un total de 440 pacientes (88 casos y 352 controles) fueron reclutados en nuestro estudio. La edad media de los pacientes incluidos fue de 44.3 ± 15.7 años (rango 18-86) con una mediana de 41.5 años. El 58.2% fueron mujeres y el 41.8% hombres. De los 88 pacientes con metaplasia intestinal gástrica (MIG), el 73.8% (65/88) se presentó como MIG incompleta, el 21.6% (19/88) como MIG completa y el 4.5% (4/88) como MIG completa e incompleta. La frecuencia de la infección por HP fue de 51.6% (227/440) en la población estudiada y de 46.6% (41/88) entre los pacientes con metaplasia intestinal. Entre los tipos de metaplasia intestinal la infección por HP estuvo presente en el 49.2% (32/65) de MIG incompleta, 31.6% (6/19) de MIG completa y 75% (3/4) de MIG mixta (gráfico 1).
El consumo de alcohol fue reportado en el 66% de la población (antecedente de consumo en 46.1% y consumo actual en 20.5%), mientras que el consumo de tabaco se presentó en el 34.8% (antecedente de consumo en 25.7% y consumo actual en 9.1%). El resto de características de la población estudiada se describen en la tabla 1.
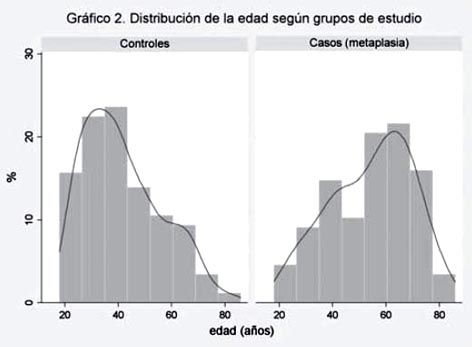
La distribución de los casos y controles son descritos en la tabla 2, de acuerdo a las variables estudiadas. La edad media de los pacientes con MIG (54.3 ± 15.5 años) fue mayor que la de los controles sin MIG (41.7 ± 14.7 años), al igual que las medianas con diferencia estadística significativa (56.5 vs. 39 años, p=0.005). Al categorizar le edad en décadas se aprecia un incremento progresivo en la frecuencia de la MIG desde 8.5% a los 30-39 años hasta llegar 55.6% en los mayores de 70 años, a diferencia del grupo control que presenta una curva decreciente en frecuencia con respecto al incremento de la edad (ver tabla 2 y grafico 2). En cuanto al género no hubo diferencias estadísticas entre ambos grupos de estudio (p=0.85).
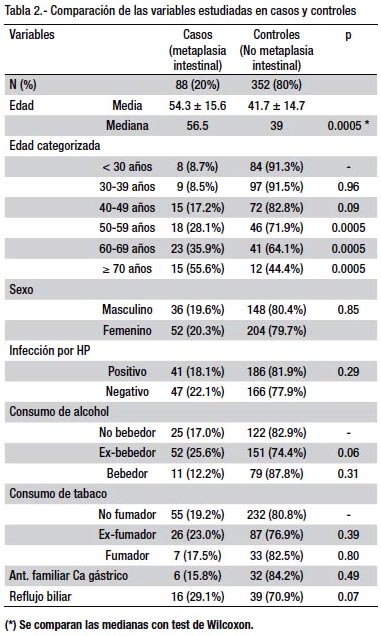
Entre los pacientes con infección por HP el 18.1% (41/227) tenía diagnóstico concomitante de MIG y el restante 81.9% no presentó MIG, sin diferencia estadística entre ambos grupos (p=0.29). En relación al consumo de alcohol y tabaco, el antecedente de consumo anterior fue el predominante en ambos grupos pero sin lograr diferencia estadística (p=0.06 y p=0.39, respectivamente). Tampoco se encontró diferencias entre ambos grupos en relación al antecedente familiar de cáncer gástrico (p=0.49) y la presencia del reflujo biliar (p=0.07).
En el análisis bivariado solamente la edad se presentó como factor de riesgo al ser categorizada en ≥ 50 años, con un OR=4.47 (IC 95%, 2.66-7.57) comparados con aquellos menores de 50 años. La infección por HP no se presentó como factor de riesgo (OR= 0.78; IC95% 0.4-1.3) en nuestro estudio, al igual que las demás covariables estudiadas (ver tabla 3).
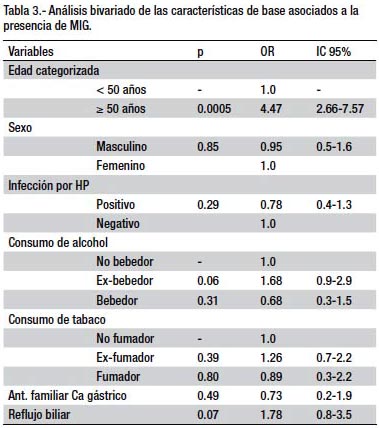
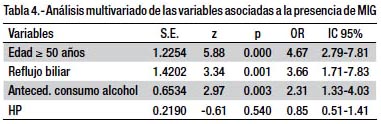
En el análisis multivariado las variables que se comportaron como factores de riesgo para la presencia de metaplasia intestinal gástrica fueron: edad ≥ 50 años (OR= 4.67; IC 95% 2.79-7.81), reflujo biliar (OR= 3.66; IC 95% 1.71-7.83) y el antecedente de consumo de alcohol (OR= 2.31; IC 95% 1.33-4.03). La infección por HP presentó un OR menor a la unidad (OR=0.85; IC 95% 0.51-1.41).
DISCUSIÓN
Considerando que en nuestro país el cáncer gástrico es una de las neoplasias malignas con mayor repercusión en la salud de la población, es poco lo investigado acerca de las lesiones consideradas preneoplásicas incluida la metaplasia intestinal gástrica. La mayoría de estudios revisados solo mencionan datos de frecuencias reportadas en trabajos de investigación realizados bajo otros objetivos de estudio (14,16,17) y que varían desde 11.2% a 35%. Por ejemplo, Ramírez Ramos y col (16), en un estudio retrospectivo de 10 años (1987-1998), reporta una frecuencia de MIG de 11.2% en 1406 pacientes sin enfermedad ulcero péptica ni neoplasias y una prevalencia de infección por HP de 74.7% en los pacientes con MIG.
Nuestro trabajo analiza 88 casos con MIG, equivalente a una frecuencia de 20% en 440 pacientes sin lesiones gastrointestinales significativas, con una prevalencia de la infección por HP de 46.6% en los casos con MIG y de 51.6% en la población estudiada. Si bien es cierto que nuestro estudio no fue diseñado para investigar la prevalencia de la infección por HP, llama la atención la baja frecuencia de la misma en la población estudiada, lo que evidenciaría una disminución de prevalencia de la infección por HP en nuestro medio, ya evidenciado en los estratos socioeconómicos medio y alto: de 83.3% en 1985 a 58.7% en 2002 (12,13), y de 38.5% reportada en el 2008 en una clínica privada (18).
En nuestro estudio la infección por HP no es un factor de riesgo asociado a la presencia de la MIG en pacientes sin lesiones gastrointestinales no significativas, ni en el análisis bivariado (OR=0.78; IC95% 0.4-1.3) ni en el multivariado (OR=0.85; IC95% 0.51-1.41). Si bien estos resultados pueden deberse a la baja frecuencia de la infección por HP encontrado en los pacientes con MIG secundario a la ya mencionada disminución de la prevalencia de la infección por HP en nuestro medio, no podemos descartar que sean influenciados por el número de la muestra incluida, dada la falta de significancia estadística expresada en los intervalos de confianza que contienen a la unidad. Sin embargo, existen evidencias de que la infección por HP puede ir disminuyendo conforme se incremente el grado y severidad de la inflamación gástrica, siendo menos frecuente en las lesiones premalignas más avanzadas, lo cual ha sido observado en varios estudios (7,19), incluyendo un estudio realizado en nuestro medio en una población que acudió a un programa de despistaje de cáncer gástrico (20). Hsu et al (7) siguió a 1225 taiwaneses dispépticos con infección por HP para evaluar el impacto del HP en el desarrollo de malignidades gástricas y encontró que esta infección se presentó en el 63%, 27% y 1.1% de la gastritis atrófica, metaplasia intestinal y adenocarcinoma gástrico, respectivamente. Con estos datos los autores sugieren que la infección por HP es una causa necesaria pero no suficiente para el desarrollo de adenocarcinoma gástrico, dado que el HP puede espontáneamente desaparecer durante el curso del desarrollo del adenocarcinoma gástrico en los pacientes infectados. Otros autores consideran que esta disminución gradual en la concentración de la bacteria se debería a que las lesiones más severas de la secuencia carcinogénica serían un medio desfavorable y poco hospitalario para el crecimiento del HP, llegando hasta desaparecer en el adenocarcinoma gástrico (19,21,22). Por tanto, se considera que el HP en particular tiene un rol importante como iniciador y promotor de la cascada carcinogénica, pero, debido a que la densidad de la colonización de la bacteria disminuye en las subsecuentes lesiones, la posterior progresión de lesiones premalignas es menos dependiente del HP y más relacionado a otros factores ambientales y genéticos del huésped (23,24).
Nuestros resultados se posicionan en contra de la literatura revisada que sostiene una consistente asociación entre la infección por HP y el desarrollo de la MIG (9,25,26), considerándolo además como un factor de riesgo independientemente para la progresión de la MIG a lesiones histológicas más severas (27). No obstante, existen algunos trabajos en los que encuentran resultados similares al nuestro (28,29). Muller et al (28) estudió la prevalencia y asociación de la infección por HP en las lesiones gástricas preeoplásicas en 2019 pacientes dispépticos en Brasil, reportando que la infección por HP tenía un OR de 0.6 (IC 95%, 0.5-0.8) para el diagnóstico de MIG a pesar de que la población estudiada presentó una prevalencia de 76% para HP, sugiriendo que otros factores de riesgo además del HP deben estar involucrados en el proceso de la carcinogénesis gástrica. Asimismo algunos reportes describen regiones con alta frecuencia de infección por HP y una baja prevalencia de cáncer gástrico y de lesiones gástricas preneoplásicas (10,11,30) lo que explicaría que otros factores medioambientales y respuestas inmunes del huésped jugarían un rol en explicar la variación geográfica en la prevalencia del cáncer gástrico y sus precursores como la metaplasia intestinal.
En nuestro estudio el factor de riesgo más asociado a la presencia de MIG fue la edad. Así se logró determinar que los pacientes de igual o mayor de 50 años de edad presentaron 4 veces más riesgo de presentar MIG (OR= 4.67) en comparación con aquellos pacientes menores de 50 años, similar a los reportado en otros estudios (9,25,26). Kim et al al evaluar a 389 pacientes coreanos sin enfermedad gastroduodenal significativa encontró que los pacientes con una edad mayor de 60 años tiene 3 veces más riesgo de presentar MIG en el antro (OR= 3.02) en comparación con aquellos con menos de 47 años de edad. Asimismo otro estudio demostró que la edad avanzada (edad mayor a 60 años vs 40 años) fue un fuerte predictor para todas las lesiones preneoplásicas con una fuerte asociación para las lesiones más avanzadas (OR= 3.43 IC95% 2.43-4.83 para MIG; OR=6.86 IC95% 3.75 12.55 para displasia) (26).
Otro de los factores de riesgo asociados a la MIG fue la presencia de reflujo biliar en la endoscopia con un OR= 3.66 según los resultados del análisis multivariado. Varios estudios han encontrado asociación entre el reflujo biliar y la MIG, considerándola como un importante factor de riesgo. Sobala et al (31) encontró que el reflujo biliar se comporta como predictor de desarrollo de MIG (OR=1.81, IC95% 1.14-2.88), determinando además que los tipos más avanzados de MIG ocurren con mayor frecuencia en los pacientes con concentraciones de ácidos biliares mayores de 1.00 mmol/l que en aquellos con concentraciones menores (MIG tipo I: OR=3.2, IC95% 1.4-7.0; MIG tipo II: OR=3.3, IC95% 1.5-7.2; MIG tipo III: OR=11.4, IC95% 1.3-13.9). Otros estudios han encontrado asociación entre el reflujo biliar y la metaplasia intestinal a nivel cardial (32). Chen et al (33) demostró que en pacientes con dispepsia y reflujo biliar las lesiones mucosas como inflamación activa, inflamación crónica, atrofia, metaplasia intestinal o infección por HP, fueron significativamente más severos a nivel de cuerpo e in-cisura que en aquellos pacientes dispépticos sin reflujo biliar. Asimismo, algunos estudios sugieren que los ácidos biliares intragástricos pueden implicar cambios histológicos premalignos, jugando algún papel en la carcinogénesis gástrica (34), actuando además como un cofactor importante en pacientes con infección por HP, acortando la edad de presentación de la MIG. Vdovychenko et al (35) encontró que la edad media de presentación de MIG fue significativamente menor (42.8 ±3.0 vs. 58.7±2.2 años, p<0.05) en pacientes con reflujo biliar e infección por HP que en aquellos sin el reflujo biliar.
El antecedente de consumo de alcohol resultó también un factor de riesgo luego del análisis multivariado en nuestro estudio (OR= 2.3, IC 95% 1.3-4.0). La asociación de la MIG con el consumo de alcohol ha tenido resultados más variables, con algunos estudios a favor (27) y otros en contra en los que no se encontró asociación con el consumo de alcohol (25,26).
Es importante remarcar algunas limitaciones de nuestro estudio. En primer lugar, puede existir clasifi cación errónea en los diagnósticos histológicos, en especial con la MIG, dado que ésta puede presentarse de manera focal y las muestras de biopsia estandarizadas para el estudio pueden no haberlos incluido, por lo que puede ser inevitable la existencia de falsos negativos que pueden influir en los resultados fi nales. De la misma forma, los falsos negativos para el diagnóstico de la infección por HP no fueron previstos con una corroboración serológica, ideal en aquellos pacientes con infecciones de larga data. Otra critica relacionada a la detección de ésta bacteria puede establecerse dado el empleo de la tinción de hematoxilina-eosina (HE) en nuestro estudio, que si bien es la más comúnmente empleada en nuestra práctica clínica diaria, puede tener una especificidad menor a la de otras tinciones como Giemsa y Genta, en especial cuando la densidad de la bacteria es baja (especificidad de 90% en HE vs. 98% en Giemsa y Genta) (36). Sin embargo, los resultados de las asociaciones encontradas en nuestro estudio no variaron en función de la significancia estadística luego de corregir los valores de las tablas de 2 x 2 en base a la especificidad de la tinción (datos no mostrados).
En segundo lugar, los pacientes incluidos fueron aquellos con síntomas que acudieron a un hospital, por lo que tuvieron más oportunidad de ser diagnosticados en comparación con aquellos asintomáticos. Esto es relevante ya que muchos de los pacientes con MIG al igual que las demás lesiones preneoplásicas son usualmente asintomáticos. Por lo tanto, puede haber una sub-representación de la población estudiada lo que complica la validez externa de nuestros resultados. En tercer lugar, la evaluación del consumo de alcohol de forma cualitativa y no cuantitativa puede haber sobrevalorado su frecuencia de presentación en especial cuando se evaluó el antecedente del consumo. Además no se evaluaron otros factores que pueden influir en el desarrollo de la MIG como la dieta. Por último, debemos remarcar que las asociaciones observadas en nuestro estudio no infieren causalidad, debido a que en los estudios de casos y controles las relaciones temporales entre las exposiciones y los resultados no son claras. Por tanto, creemos que las conclusiones deben ser tenidas en cuenta con las limitaciones referidas y en base a la coherencia con otros datos epidemiológicos.
A pesar de las limitaciones descritas, creemos que los resultados de nuestro trabajo deben servir como punto de partida para otros estudios, enfocados en la necesidad de contar con datos e información que se ajusten a nuestra realidad y a nuestra población. Dado que el cáncer gástrico es una de las principales causas de muerte por neoplasia maligna en nuestro país, el conocimiento de la historia natural de la enfermedad es de vital importancia, en especial del conocimiento de las lesiones consideradas como premalignas como la metaplasia intestinal gástrica.
En conclusión, la presencia de MIG se asoció de manera significativa con la edad igual o mayor a 50 años, la presencia de reflujo biliar y el antecedente de consumo de alcohol en la población estudiada. La infección por HP no se comportó como un factor de riesgo asociado a la MIG.
REFERENCIAS BIBLIOGRÁFICAS
1. PARKIN DM, BRAY F, FERLAY J, PISANI P. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55: 74–108.
2. Centro de Investigación en Cáncer "Maes Heller". Instituto Nacional de Enfermedades Neoplásicas. Registro de Cáncer de Lima Metropolitana 1994-1997 Vol III, Dic. 2004.
3. PAYET E. Cáncer Gástrico Precoz. Tesis de Magíster en Medicina. Universidad Peruana Cayetano Heredia. 2004.
4. CORREA P. HUMAN gastric carcinogenesis: a multistep and multifactorial process. First American Cancer Society Award Lecture on Cáncer Epidemiology and Prevention. Cancer Res 1992; 52:6735–40.
5. ASAKA M, TAKEDA H, SUGIYAMA T, et al. What role does Helicobacter pylori play in gastric cancer? Gastroenterology 1997;113(6 Suppl):S56–60.
6. DE LA RIVA S, MUÑOZ-NAVAS M, SOLA J. Carcinogénesis gástrica. Rev Esp Enferm Dig 2004; 96(4): 265-276.
7. HSU P, LAI K, HSU P, LO G, YU H, CHEN W et al. Helicobacter pylori Infection and the risk of gastric malignancy. Am J Gastroenterol 2007; 102:725-730.
8. UEMURA N, OKAMOTO S, YAMAMOTO S, MATSUMURA N, YAMAGUCHI S, YAMAKIDO M, et al. Helicobacter pylori and the development of gastric cancer. N Engl J Med 2001;345:784-789.
9. KIM N, PARK Y, CHO S, LEE H, CHOE G, KIM I, et al. Prevalence and risk factors of atrophic gastritis and intestinal metaplasia in a korean population without significant gastroduodenal disease. Helicobacter 2008;13:245-255.
10. GOH KL, CHEAH PL, MD N, QUEK KF, PARASAKTHI N. Ethnicity and H. pylori as Risk Factors for Gastric Cancer in Malaysia: A Prospective Case Control Study. Am J Gastroenterol 2007;102:40–45.
11. HOLCOMBE C. Helicobacter pylori: The African enigma. Gut 1992;33:429–31.
12. RAMÍREZ RAMOS A. Helicobacter pylori. Libro Tópicos selectos en Medicina Interna. Gastroenterología. 2006. Primera edición. Editorial Santa Ana, págs. 177-195.
13. RAMÍREZ A, MENDOZA D, CHINGA E, LEEY J, SEGOVIA M, OTOYA C. Variación de la prevalencia del H. pylori en el Perú período 1985-2002, en una población de nivel socioeconómico medio y alto. Rev. Gastroenterol. Peru 2003; 23: 92-98
14. SALAS W, BENITES M, SALINAS C. Asociación de Helicobacter pylori y patología gástrica no neoplásica en una clínica privada de Lima Norte. Rev Med Hered 2005;16(2):89-96.
15. RAMÍREZ-RAMOS A, WATANABE J, TAKANO J, GILMAN RG, RECAVARREN S, ARIAS J, et al.. Decrease in prevalence of peptic ulcer and gastric adenocarcinoma at the Policlínico Peruano Japonés, Lima, Peru, between the years 1985 and 2002. Analysis of 31,446 patients. Acta Gastroenterol Latinoam 2006; 36: 66-73.
16. RAMIREZ-RAMOS A, RECAVARREN S, ARIAS J, GILMAN RH y col. Helicobacter pylori, gastritis crónica, úlcera gástrica y úlcera duodenal: Estudio de 1638 pacientes. Rev Gastroenterol Perú 1999;19: 196-201.
17. CASTILLO T, NAVARRETE J Y CELESTINO A. Gastritis crónica y metaplasia intestinal. Rev Gastroenterol Perú 1989;9: 123-130.
18. PROCHAZKA R, SALAZAR FA, BARRIGA E, SALAZAR F. Prevalencia de Helicobacter pylori en una Clínica Privada de Lima. Sensibilidad de las Biopsias del Antro y el Cuerpo, y la Prueba Rápida de la Ureasa. Rev Gastroenterol Perú; 2010; 30-1: 33-39.
19. ZHANG CH, YAMADA N, WU YL, WEN M, MATSUHISA T, MATSUKURA N. Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric erosion, erosive gastritis, gastric ulcer and early gastric cáncer. World J Gastroenterol 2005;11(6):791-796.
20. CHACALTANA A, RODRÍGUEZ C, URDAY C, RAMON W, ESPINOZA J, VELARDE H et al. Lesiones gástricas preneoplásicas y Helicobacter pylori en despistaje endoscópico para cáncer gástrico en población de nivel socioeconómico medio y alto. Rev Gastroenterol Perú 2009;29(3):218-225.
21. RUGGE M, CORREA P, DIXON MF, FIOCCA R, HATTORI T, LECHAGO J, et al. Gastric mucosal atrophy: Interobserver consistency using new criteria for classification and grading. Aliment Pharmacol Ther 2002; 16: 1249-1259.
22. KAPADIA CR. Gastric atrophy, metaplasia, and dysplasia: A clinical perspective. J Clin Gastroenterol 2003; 36(5 Suppl):S29-S36.
23. DE VRIES A, KUIPERS EJ. Epidemiology of premalignant gastic lesions: Implications for the development of screening and surveillance strategies. Helicobacter 2007;12(Suppl 2):22-31.
24. WU MS, CHEN CJ, LIN JT. Host–environment interactions: their impact on progression from gastric inflammation to carcinogenesis and on development of new approaches to prevent and treat gastric cancer. Cancer Epidemiol Biomarkers Prev 2005;14:1878–82.
25. RUSSO A, MACONI G, SPINELLI P, et al. Effect of lifestyle, smoking, and diet on development of intestinal Metaplasia in H. pylori-positive subjects. Am J Gastroenterol 2001;96:1402–8.
26. KATO I, VIVAS J, PLUMMER M. LOPEZ G, PERAZA S, CASTRO D, et al. Enviromental factors in Helicobacter pylori-related gastric precancerous lesions in Venezuela. Cancer Epidemiol Biomarkers Preven 2004;13(3):468-476.
27. LEUNG WK, LIN SR, CHING JY, TO KF, NG EK, CHAN FK, et al. Factors predicting progression of gastric intestinal metaplasia: results of a randomized trial on Helicobacter pylori eradication. Gut 2004;53:12441249.
28. MULLER LB, FAGUNDES RB, DE MORAES CC, RAMPAZZO A. Prevalência da infecção por Helicobacter pylori e das lesões precursoras do câncer gástrico em pacientes dispépticos. Arq Gastroenterol 2007;44(2):93-98.
29. HIATT T, ALMOURADI T, ATTAR B, STROGER JH. Gastric Intestinal Metaplasia: A Demographic Study. En: 2011 DDW Abstract Supplement: Gastroenterology 2011;140(Suppl 1): p S44.
30. MIWA H, GO MF, SATO N. Helicobacter pylori and gastric cancer: the Asian enigma. Am J Gastroenterol 2002;97:1106–12.
31. SOBALA GM, OCONNOR HJ, DEWAR EP, et al. Bile reflux and intestinal metaplasia in gastric mucosa. J Clin Pathol 1993; 46:235–40.
32. DIXON MF, MAPSTONE NP, NEVILLE PM, MOAYYEDI P, AXON AT. Bile reflux gastritis and intestinal metaplasia at the cardia. Gut 2002;51:351–355.
33. CHEN SL, MO JZ, CAO ZJ, CHEN XY, XIAO SD. Effects of bile reflux on gastric mucosal lesions in patients with dyspepsia or chronic gastritis. World J Gastroenterol 2005;11(18):2834-2837.
34. HOUGHTON PW, MORTENSEN NJ, THOMAS WE, COOPER MJ, MORGAN AP, BURTON P. Intragastric bile acids and histological changes in gastric mucosa. Br J Surg 1986; 73(5): 354-6.
35. VDOVYCHENKO A. Is a bile reflux an additional cancerogenic factor in peptic ulcer, associated with Helicobacter pylori infection?. Annales Academiae Medicae Bialostocensis 2004;49:72-74.
36. LAINE L, LEWIN D, NARITOKU W, COHEN H. Prospective comparison of H&E, Giemsa and Genta stains for the diagnosis of Helicobacter pylori. Gastrointestinal endoscopy 1997; 45(6): 463-7.
Correspondencia
Dr. Alfonso Chacaltana Mendoza
e-mail: dralfonso_al@yahoo.com













